重组人促红细胞生成素抑制细胞自噬减轻心肌微血管内皮细胞氧化损伤
2016-09-08连晓鹏山西医科大学山西太原03000山西医科大学第二医院山西太原03000
连晓鹏 马 捷.山西医科大学,山西太原 03000;.山西医科大学第二医院,山西太原 03000
重组人促红细胞生成素抑制细胞自噬减轻心肌微血管内皮细胞氧化损伤
连晓鹏1马捷2
1.山西医科大学,山西太原030001;2.山西医科大学第二医院,山西太原030001
目的 探讨重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)对大鼠心肌微血管内皮细胞(cardica microvascular endothelial cells,CMECs)氧化损伤的保护作用和可能机制。方法 组织块贴壁法培养CMECs,倒置显微镜形态学观察,免疫荧光法鉴定。H2O2建立氧化损伤模型,取2~3代CMECs,随机分为对照组、200 μmol/L H2O2组、200 μmol/L H2O2+5 U/mL rhEPO组、200 μmol/L H2O2+10 U/mL rhEPO组、200 μmol/L H2O2+ 20 U/mL rhEPO组。应用MTT法测定细胞存活率,化学比色法测定上清液中乳酸脱氢酶(LDH)含量,Western-blot检测LC3、Beclin1和p-mTOR含量。结果 大鼠CMECs呈梭形、多角形等不规则形态,形成单层紧密鹅卵石样排列,抗体阳性90%以上;与对照组比较,H2O2处理组存活率降低(P<0.05),LDH释放量增加(P<0.05),rhEPO预处理后,与单纯H2O2组比较,上述指标可逆转(P<0.05);与对照组比较,H2O2处理组LC3Ⅱ和Beclin1表达水平增高(P<0.05),rhEPO预处理后,LC3Ⅱ和Beclin1含量减低,与单纯H2O2组比较差异有统计学意义(P<0.05);与对照组比较,单纯H2O2组p-mTOR表达减少(P<0.05),余H2O2组p-mTOR表达增多(P<0.05),rhEPO预处理后,与单纯H2O2组比较,诱导p-mTOR表达增高(P<0.05)。结论 rhEPO抑制氧化损伤CEMCs的过度自噬,提高细胞存活率,这种保护作用可能与rhEPO激活PI3K/AKT/mTOR通路有关。
重组人促红细胞生成素;心肌微血管内皮细胞;氧化损伤;自噬
[Abstract]Objective To explore the protective effect and mechanism of recombinant human erythropoietin on cardiac microvascular endothelial cells against oxidative damage.Methods The tissue block method was applied for CMECs. The cells were observed under inverted microscope and identified by immunofluorescence.To establish oxidative injury modle was by H2O2and CMECs at passage 2 to 3 were divided randomly into control group,200 μmol/L H2O2group, 200 μmol/L H2O2+5 U/mL rhEPOgroup,200 μmol/L H2O2+10 U/mL rhEPOgroup,200 μmol/L H2O2+20 U/mL rhEPO group.MTT assay was used to determine Cell viabilily.Chemical colorimetry were used to measure LDH of supernatant. Western-blot was used to evaluate protein expression of LC3,Beclin1 and p-mTOR.Results The cultured CMECs of rat showed fusiform shape or polygon,and the monolayer cultures displayed a typical cobblestone or paving-stone morphology and the positive rate was 90%or more.Compared with control group,the cell viabilily rate was reduced and LDH release quantity was increased(P<0.05)and after pretreated by rhEPO,compared with pure H2O2group,the above indexes were reversed(P<0.05);Compared with control group,protein expression of LC3Ⅱand Beclin1 were increased (P<0.05);after pretreated by rhEPO,compared with pure H2O2group,the protein expression were lowered(P<0.05);Compared with control group,p-mTOR of the pure H2O2group was reduced(P<0.05),but the other of H2O2group were increased(P<0.05),after pretreated by rhEPO compared with pure H2O2group,the protein expression were increased(P< 0.05).Conclusion RhEPO inhibits excessive autophagy of CMECs in oxidative damage and improves the cell viabilily rate.The protective effect may be related to activation of PI3K/AKT/mTOR signal away.
[Key words]Recombinant human erythropoietin;Cardiac microvascular endothelial cells;Oxidative damage;Autophagy
先天性心脏病是小儿时期最常见的心脏病,目前外科治疗是最有效的矫正手段。体外循环是手术中重要辅助手段,但这个过程伴有心脏的缺血再灌注损伤。其主要机制是氧自由基产生的氧化损伤[1]。氧化损伤不仅引起细胞凋亡、坏死,还能引起过度自噬[2]。自噬(autophagy)是利用细胞溶酶体降解回收利用受损、变性、衰老的蛋白质,实现蛋白和能量更新代谢,对细胞维持稳态具有非常重要意义[3]。有研究表明,氧自由基刺激不同信号转导的炎性因子诱导细胞自噬,损伤内皮细胞等[4],CMECs是氧自由基等最早作用的靶细胞[5],其损伤也是心肌细胞损伤的始动环节。因而研究CMECs在氧化损伤中的自噬水平有着重要意义。促红细胞生成素(erythropoietin,EPO)是一种刺激红细胞生成的糖蛋白细胞因子,主要由肾脏产生,现在广泛用于临床治疗贫血,有研究表明,EPO有抗炎、抗氧化、抗凋亡等作用,被认为是一种细胞保护因子[6]。rhEPO是基于重组DNA技术生产的 EPO,其氨基酸序列和生物活件均与内源性EPO相同。本实验采用体外建立CMECs氧化损伤模型,以模拟在体心脏损伤,研究rhEPO对CMECs自噬的影响及可能机制。
1 材料与方法
1.1材料与试剂
内皮细胞特制培养体系(500 mL基础培养基,25 mL FBS,5 mL内皮细胞生长添加剂,5 mL青霉素/链霉素)购于Sciencell公司;兔抗鼠Ⅷ相关抗原、兔抗鼠β-actin、辣根酶标记羊抗兔二抗购于北京中杉金桥;FITC标记羊抗兔IgG购于北京博奥森;rhEPO购于上海克隆生物高技术有限公司;乳酸脱氢酶(LDH)测定试剂盒购于海碧云天生物技术有限公司;兔抗大鼠LC3B、Beclin1、p-mTOR一抗购于Cell Signaling Technology公司。
1.2方法
1.2.1心肌微血管内皮细胞培养和鉴定取100~150 g雄性SD大鼠,用0.1%戊巴比妥钠(2 mL/100 g)腹腔注射麻醉。待大鼠完全麻醉后,放置于75%的乙醇缸中浸泡3~5 min后,移动至超净台。无菌操作开胸,剪下心脏,置于无菌D-hanks溶液中,洗净血污。小心剪除心肌瓣膜、结缔组织,心脏的心房和右心室等,保留左心室,到达灭活心脏内外膜组织,用PBS液彻底清洗心室组织3次,吸去多余的PBS液,转移至干燥平皿,并加入少量的FBS,用消毒后的眼科剪,仔细把心室肌剪成1 mm3大小的组织块。将剪好的组织块接种于的无菌培养瓶中,倒置放入37℃、5%CO2,饱和湿度的培养箱中,静置培养4 h,使组织块贴壁牢固。轻轻翻转培养瓶,加入3 mL含20%FBS的完全培养基,培养12 h,小心换液,去除血细胞。继续培养48 h,取出组织块并换液,再继续培养2~3 d,待细胞融合成单层时传代。取出3~4代培养的细胞进行实验。用免疫荧光法鉴定。抗体为兔抗鼠Ⅷ因子一抗和FITC羊抗兔二抗对细胞鉴定。
1.2.2大鼠微血管内皮细胞氧化损伤模型的建立和实验分组将培养的大鼠胸主动脉内皮细胞均匀接种于96孔板中,加入终浓度为200 μmol/L的H2O2,刺激细胞2 h。选用第2~3代培养的心肌微血管内皮细胞,随机分5组:(1)正常对照组;(2)200 μmol/L H2O2组;(3)200 μmol/L H2O2+5 U/mL rhEPO组;(4)200 μmol/L H2O2+10 U/mL rhEPO组;(5)200 μmol/L H2O2+20 U/mL rhEPO组。
1.2.3细胞存活率的检测将各组细胞孵育4 h后,弃去上清液,每孔加入20 μL MTT(5 mg/mL),培养4 h后,吸去上清液,加入100μL的DMSO,摇床振荡10min,用酶标仪于490 nm波长处测定吸光值(OD)。存活率=(实验组OD490 nm值/对照组OD490 nm值)×100%表示。实验重复3次,每组6个复孔。
1.2.4细胞LDH漏出量的检测上述实验完成后,取各组细胞的上清液,按照乳酸脱氢酶测试盒的方法,测定培养液中LDH漏出量。
1.2.5Western blot法检测 LC3、Beclin1、pmTOR蛋白表达各组细胞弃去上清液,加入ripa充分裂解。高速离心30 min,取上清液。加入用5%浓缩胶和12%分离胶电泳,转膜,封闭。分别加入兔抗鼠LC3B、Beclin1、p-mTOR抗体和兔抗鼠β-actin,4℃,慢摇过夜。二抗孵育90 min。ECL显色,图像分析系统测定结果。
1.3统计学分析
采用 SPSS17.0统计学软件进行分析处理,数据以均数±标准差(x±s)表示,两个均数间比较用t检验,多组间比较用单因素方差分析,多重比较用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1大鼠心肌微血管内皮细胞的形态学观察
在倒置相差显微镜下观察可见细胞贴壁牢固融合形成单层,立体感明显,折光性强,密集处呈梭形鹅卵石镶嵌状排列,铺路石样外观,见图1A。细胞传代后继续培养3 d可见有血管腔样结构形成,见图1B。
2.2大鼠心肌微血管内皮细胞的免疫荧光鉴定
Ⅷ因子相关抗原免疫荧光染色后可见细胞成梭形、多角形,绿色荧光阳性表达的细胞达95%以上,非内皮细胞无阳性表达,证实为内皮细胞,可用于后续试验。见图2。

图1 A大鼠心肌微血管内皮细胞形态学(×100)

图1 B大鼠心肌微血管内皮细胞形态学(×100)

图2 大鼠心肌微血管内皮细胞的免疫荧光鉴定(×100)
2.3rhEPO可以明显逆转H2O2引起的内皮细胞存活率下降
MTT测定各浓度rhEPO对细胞存活率的影响(n=3),各浓度rhEPO组细胞生长抑制率较200 μmol/L H2O2组明显降低(P<0.05),见表1、图3。
表1 心肌微血管内皮细胞存活率比较

表1 心肌微血管内皮细胞存活率比较
注:与200 μmol/L H2O2组比较,*P<0.05
组别存活率(%)200 μmol/L H2O2组200 μmol/L H2O2+5 U/mL rhEPO组200 μmol/L H2O2+10 U/mL rhEPO组200 μmol/L H2O2+20 U/mL rhEPO组55.92±3.34 65.80±2.49*71.47±2.66*79.41±3.39*
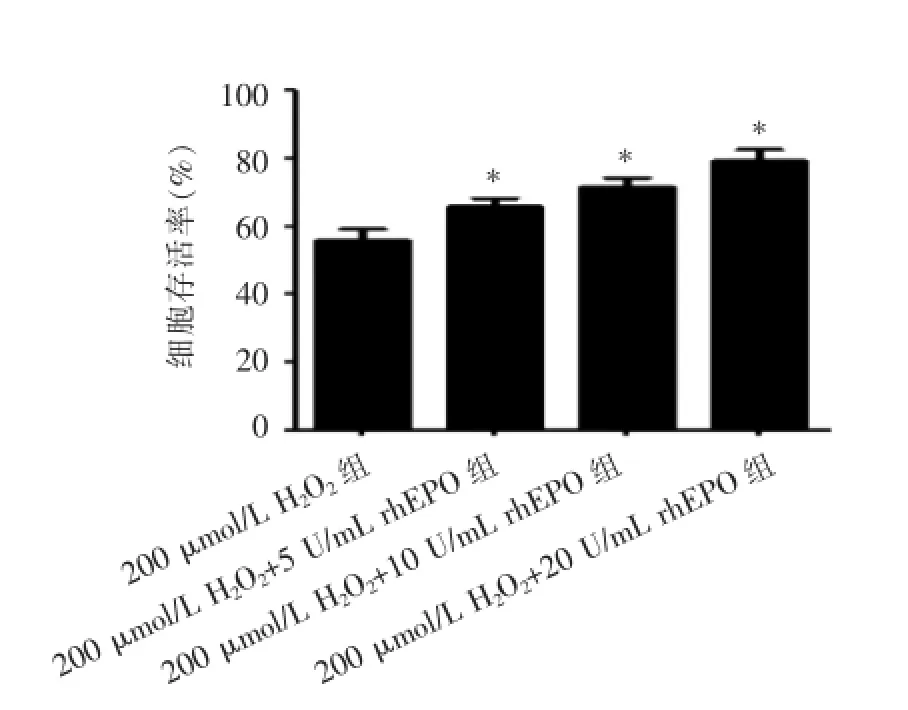
(*P<0.05 vs 200 μmol/L H2O2组)图3 MTT法测定各组细胞存活率的结果
2.4各组内皮细胞LDH比较
rhEPO能明显抑制细胞LDH的漏出量,对心肌微血管内皮细胞的氧化损伤有保护作用。见表2、图4。
表2 各组内皮细胞LDH比较

表2 各组内皮细胞LDH比较
注:与对照组比较,t=36.597,*P<0.05;与200 μmol/LH2O2组比较,F= 47.275,△P<0.05
组别LDH对照组200 μmol/L H2O2组200 μmol/L H2O2+5 U/mL rhEPO组200 μmol/L H2O2+10 U/mL rhEPO组200 μmol/L H2O2+20 U/mL rhEPO组70.86±10.56 514.16±18.41*446.25±26.94△362.51±27.18△307.69±17.33△
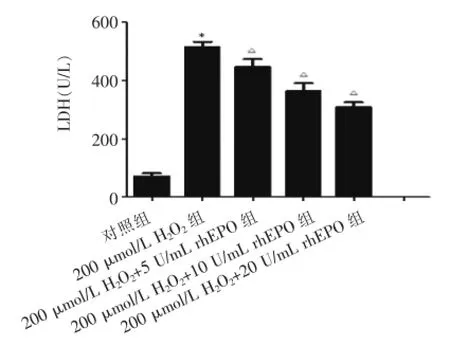
(与对照组比较,*P<0.05;与200 μmol/L H2O2组比较,△P<0.05)图4 化学比色法测定各组内皮细胞LDH的释放量的结果
2.5rhEPO能明显抑制自噬蛋白LC3Ⅱ的表达。
与对照组(0.701±0.022)比较,单纯H2O2组(1.225± 0.054)LC3Ⅱ的表达量明显上升(P<0.05);H2O2+rhEPO组用不同浓度rhEPO(5 U/mL、10 U/mL、20 U/mL)预处理,CMECs氧化损伤后,与单纯H2O2组比较,LC3Ⅱ含量均显著降低至(1.021±0.015)、(0.808±0.036)、(0.810±0.064),差异有统计学意义(P<0.05);但20 U/mL rhEPO组与10 U/mL rhEPO组比较,差异无统计学意义(P>0.05)。见图5。
2.6rhEPO能显著抑制自噬蛋白Beclin1表达量,且有一定的浓度依赖性
与对照组(0.642±0.011)比较,单纯H2O2组(1.491± 0.049)Beclin1的表达量显著上升(P<0.05);H2O2+ rhEPO组用不同浓度rhEPO(5 U/mL、10 U/mL、20 U/mL)预处理后,与单纯H2O2组比较,Beclin1表达量均明显降低至(1.163±0.040)、(0.862±0.027)、(0.775±0.023)(P<0.05),并且存在一定的浓度依赖性。见图6。
2.7western-blot检测各组细胞p-mTOR表达量
不同浓度rhEPO明显能诱导mTOR蛋白磷酸化水平的提高,并且p-mTOR的表达量的升高与浓度有剂量依赖性与对照组(0.240±0.015)比较,单纯H2O2组(0.110±0.004)p-mTOR的表达量显著上升(P<0.05);H2O2+rhEPO组用不同浓度rhEPO(5 U/mL、10 U/mL、20 U/mL)预处理后,与单纯H2O2组比较,p-mTOR表达量均明显降低,分别为(0.430±0.040)、(0.620±0.038)(0.790±0.073)(P<0.05),并且存在一定的浓度依赖性。见图7。
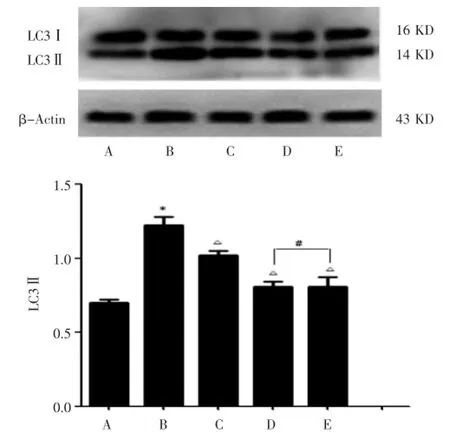
图5 Western-blot检测各组细胞LC3Ⅱ的蛋白的表达量

图6 Western-blot检测各组细胞Beclin1的蛋白的表达量

图7 Western-blot检测各组细胞p-mTOR表达量
3 讨论
在先心病体外循环中,造成缺血再灌注损伤还会丢失部分红细胞。EPO除了参与造血功能,本试验结果显示,rhEPO抗氧化损伤并且提高CMECs存活率,并且这种保护作用与rhEPO浓度正相关。EPO的保护作用与PI3K/AKT通路有关[7]。生理状况下,细胞保持着低水平自噬,是内环境的稳态和存活的机制,但自噬水平提高会破坏这种平衡使细胞死亡,出现一种新的死亡机制[8]。微管相关蛋白1轻链3(microtubuleassociated protein 1 light chain 3,LC3/Atg8)是自噬膜上的标志蛋白,细胞中存在两种形式的LC3蛋白:LC3Ⅰ和LC3Ⅱ。其中LC3Ⅰ仅参与自噬过程的某个阶段,而LC3Ⅱ始终稳定的保持在细胞中,并且LC3Ⅱ的表达水平一定程度上能反应自噬体的数量[9]所以经常作为标记自噬体。Beclin1是Atg6/Vps30同源的自噬基因,在肿瘤治疗中发挥重要作用[10],同时也是自噬的一个标志分子,作用是介导自噬蛋白定位,促进调节自噬体的形成和成熟,在这个过程中表达会升高。因此本实验把LC3Ⅱ和Beclin1作为评价自噬水平的检测指标。本试验中,用H2O2处理后,LC3Ⅱ和Beclin1表达量与对照组比,明显上升,表明H2O2造成的氧化损伤引起了细胞过度自噬,rhEPO预处理后LC3Ⅱ和Beclin1表达量显著降低,提示rhEPO有抑制自噬的作用。哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)属于磷脂酞肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)蛋白激酶类家族,因其活性可被雷帕霉素抑制而得名,有研究证实[11]极低浓度的H2O2可以通过激活mTOR诱导细胞自噬水平提高,清除多余的氧自由基,维持细胞的正常生理功能;氧自由基过量聚集可诱导细胞过度自噬直接导致细胞死亡[12]。2011年,Kang等[13]首次提出自噬与mTOR之间存在着反馈调控。PI3K/AKT/mTOR通路在细胞自噬中起到非常关键的调节作用,mTOR作为该通路关键效应因子,激活的p-mTOR可以抑制和破坏自噬体的形成[14],从而调节细胞自噬水平。本试验结果显示,单纯H2O2组与对照组比,p-mTOR明显降低,提示H2O2诱导的CMECs产生了过度自噬,用rhEPO预处理后,与单纯H2O2处理组比较,p-mTOR表达则明显上升,调节细胞自噬水平下降,初步考虑可能与PI3K/ AKT/mTOR通路相关,并且可能有mTOR有负反馈调节的参与。mTOR有雷帕霉素敏感的mTOR复合体(mTORC1)和雷帕霉素不敏感的mTOR复合体2 (mTORC2)两种多聚体的活性形式存在。两种复合体对细胞自噬的调节机制不一样,mTORC1的激活可抑制细胞自噬,而mTORC2的激活却可以诱导细胞自噬[15]。本试验初步考虑rhEPO主要诱导mTORC1的表达。
综上所述,本研究显示rhEPO可以减轻心肌微血管内皮细胞氧化损伤,提高心肌微血管内皮细胞存活率。0~10 U/mL rhEPO能明显抑制H2O2诱导氧化损伤的心肌微血管内皮细胞过度自噬,这种机制可能是rhEPO通过激活PI3K/AKT/mTOR通路,使得mTOR磷酸化,诱导p-mTOR表达上升,并且可能主要诱导mTORC1的形成,从而抑制细胞自噬,实现对自噬负反馈调节。
[1]Szentágothai János Kutatók觟zpont.The role of free radicals in the myocardial reperfusion injuries and in the development of endogenous adaptation[J].Orv Hetil,2015,156 (47):1908-1911.
[2]Duan P,Hu C.4-Nonylphenol induces apoptosis,autophagy and necrosis in Sertoli cells:Involvement of ROS-mediated AMPK/AKT-mTOR and JNK pathways[J].Toxicology,2016,341(3):28-40.
[3]Thapalia BA,Zhou Z,Lin X.Autophagy,a process within reperfusion injury:An update[J].Int J Clin Exp Pathol, 2014,7(12):8322-8341.
[4]Perrotta I,Aquila S.The role of oxidative stress and autophagy in atherosclerosis[J].Oxidative Medicine and Cellular Longevity,2015,15(2):523-540.
[5]Vinten-Johansen J,Jiang R,Reeves JG,et al.Inflammation,proinflammatory mediators and myocardial ischemiareperfusion injury[J].Hematol/Oncol Clin North Am,2007,21(1):123-145.
[6]Maiese K.Erythropoietin and diabetes mellitus[J].World J Diabetes,2015,6(14):1259-1273
[7]Yuanyuan Zhang.Erythropoietin action in stress response,tissue maintenance and metabolism[J].Int J Mol Sci,2014,15(6):10296-10333.
[8]Dash S.Autophagy in hepatocellular carcinomas:From pathophysiology to therapeutic response[J].Hepat Med,2016,8(1):9-20.
[9]Kimura S,Fujita N,Noda T,et al.Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol,2009,452(1):1-12.
[10]Jin S,WhiteE.Role of autophagy in cancer:Manygement of metaholic stress[J].Autophagy,2007,3(1):28-31.
[11]Morimoto N,Nagai M,Ohta Y,et al.Increased autophagy in transgenic mice with a G93A mutant SOD1 gene[J].Brain Res,2007,11679:112-117.
[12]Turkseven S,Kruger A,Mingone C J,et al.Antioxidant mechanism of heme oxygenase-1 involves an increase in superoxide dismutase and catalase in experirnental diabetes[J].Am J Physiol Heart Cire Physiol,2005,289(2):701-707.
[13]Kang R,Zeh HJ,Lotze MT,et al.The Beclin1 network regulates autophagy and apoptosis[J].Cell Death Differ,2011,18(4):571-580.
[14]Alfred J.Regulation of autophagy by amino acids and MTOR-dependent signal transduction[J].Amino Acids,2015,47(10):2037-2063.
[15]Hosokawa N,Hara,KaizukaT,et al.Nutrient dependent mTORC1 association with the ULK1-Atg13-FIP200 comolex required for autophgy[J].Mol Biol Cell,2009,20(7):1981-1991.
Recombinant human erythropoietin relieves oxidative stress damage of cardiac microvascular endothelial cells by inhibiting autophagy
LIAN Xiaopeng1MA Jie2
1.Shanxi Medical University,Taiyuan 030001,China;2.The Second Hospital of Shanxi Medical University,Taiyuan 030001,China
R965
A
1673-9701(2016)12-0022-05
2016-02-05)
