微型实验之氯水性质的科学探究教学设计
2016-09-07康晓丹衷明华
康晓丹 衷明华
【摘 要】 利用微型实验具有的实验装置简单便捷、试剂用量少、安全性高、成本低等特点,从而实现对氯水性质的科学探究设计。
【关键词】 氯水;性质;科学探究;微型实验
【中图分类号】G642.20 【文献标识码】A 【文章编号】2095-3089(2016)18-0-01
一、教材分析
本节课选自高中化学必修一第四章第二节《富集在海水中的元素—氯》第二课时。
这是学生在中学阶段第一次接触到氯气,通过之前的学习,学生知道氯气具有强氧化性,这些知识都为本节课的教学提供了知识基础。教材对氯气的性质、氯及其化合物在生产生活中的应用、检验等介绍较为全面。这对学生掌握正确学习方法,巩固学生的实验技
能,培养学生的探究能力大有裨益。同时,也培养了学生全面认识物质、辩证认识物质的能力。高中化学课程标准强调,通过实验加深对氯水性质的认识。出于对学生安全的考虑,我将引领学生进行氯水性质的微型实验探究,学生进行操作实验少而简便,学生着重体验科学探究的一般过程。在学习氯水性质之前,学生已具有了怎样的基础呢?
二、学情分析
1、(1)知识层面:学生已掌握了化学实验的基本方法,了解了氯气的部分性质,对本节课教学有较为充足的知识储备。
(2)能力层面:学生具备一定的实验操作能力和观察分析问题的能力,但严密的逻辑推理和科学的探究能力还有待进一步提高和加强。
(3)心理层面:学生对化学实验,化学现象兴趣浓厚,有较强的探求欲,求知欲。教师在教学过程中要对学生的好奇心做好有利的引导,使学生感到能力的提升。
根据我对教材的理解,以及我对学生情况的分析,我确立以下教学目标。
2、教学目标
(1)知识与能力:
掌握氯气与水的反应,次氯酸的主要性质以及应用。
巩固Cl-离子的检验方法,以及氧化还原反应知识的应用。
(2)过程与方法:
通过实验设计,领略科学探究的一般过程和基本方法,培养设计实验、动手实验并由现象得出结论的能力。
(3)情感、态度与价值观:
通过化学知识在生活中的应用,引发学习化学的兴趣。
通过讨论交流,培养观察、分析实验及总结归纳的能力。
3、教学重点、难点
重点:氯气和水的反应原理以及新制氯水成分的探究。
难点:氯气和水反应产物的确定。
三、教法学法分析
本节课我采用“问题——探究”的教学方法,即:创设问题情境→提出问题→构想假设→设计方案→实验验证→得出结论。学生主要通过阅读观察法、实验探究法、分组讨论法、归纳总结法学习本节内容。
四、教学过程
环节一:情境创设,激情导入
[情景创设]多媒体展示氯气泄漏事件的新闻报道及图片。
[引入]消防员为什么可以用水进行处理和稀释泄漏空气中的氯气呢?
(从生活材料入手,使学生认识化学与生活的联系,从生活中的经验得出氯气的用途,继而引出了今天的课题——氯水性质的科学探究。)
环节二:实验探究,合作交流
师:“知道接下来我们要研究什么吗?”让学生知道自己要研究的问题,学生经过思考知道要研究氯水的性质。
师:“你如何研究氯水的性质呢?”学生思考交流。
在这一环节中,学生的方法多数是目的性不强的尝试,如何让学生全面掌握氯水的性质呢。我将引导学生借助“结构决定性质”的学习方法,最终让学生得出应先预测氯水的成分,然后分组讨论,合作交流,猜想氯水中含有的粒子,并对其粒子设计实验验证方案。
汇报交流阶段,该阶段首先丰富了猜测结果,改进了实验验证方案,让实验验证环节中目的性更强,实验操作更加有效。
学生能够预测氯水中含有氯气分子,水分子,可能含有Cl-、H+。
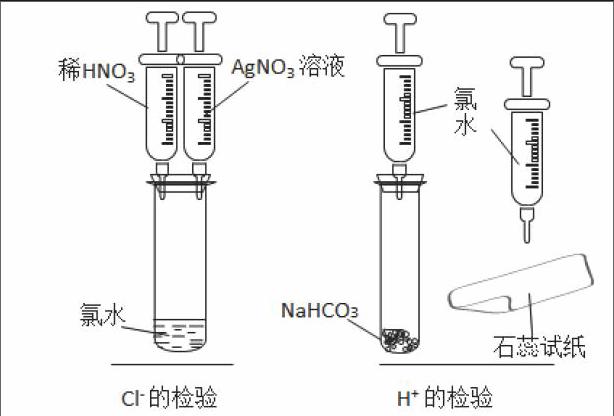
[引导实验设计1]——推测氯水中是否有盐酸存在。学生根据提供的药品和仪器设计实验方案。
(1)Cl-的检验方法:AgNO3溶液、稀HNO3
(2)H+的检验方法:①蓝色石蕊试纸;②NaHCO3或Na2CO3溶液;③镁条等。
(对学生的实验验证方案,我将给予正确评价,让学生掌握如何选取实验方案。选择实验现象明显,操作简便,科学合理的实验方案。在学生对其想法有强烈的探究欲的时候,顺利进入实验验证阶段。)
[学生分组实验]
(1)在氯水中滴加AgNO3溶液,再滴放数滴稀HNO3。
(2)分别向装有Mg或NaHCO3试管中滴加氯水;在蓝色石蕊试纸中部滴一滴氯水。
(在实验验证阶段,要充分发挥小组的合作精神。在这一阶段,由于学生急于知道预测的结果,在实验操作上可能出错,我将予以及时的纠正和引导。)
利用针管,并且用量少,装置封闭,确保了学生安全进行实验。微型实验装置如图:
[引导学生观察记录现象](1)试管中有不溶于稀硝酸的白色沉淀产生;(2)NaHCO3溶解,试管中有气泡冒出;滴上氯水的蓝色石蕊试纸中间变白,外围变红。
[学生分析推测结论]氯水呈酸性,有盐酸生成。
氯气与水会反应,成分有:Cl2、H2O、HCl(Cl-、H+)
总结:氯水中含有Cl2、H2O、Cl-、H+,氯水具有漂白性。
发现问题:接触氯水后蓝色石蕊试纸,为什么会褪色?
师:“你现在想研究什么呢?”学生能够说出要研究氯水的漂白性,继而引出“氯水的漂白性是由哪些粒子引起的?”由此开始新一轮的探究模式。
经分析,Cl-、H+都不具有漂白性,学生猜想:Cl2具有漂白性,或Cl2与H2O反应生成的某种物质具有漂白性。
学生以小组为单位设计实验方案,由于学生能力有限,我将对其进行一定的指导,体现了教师作为指导者的作用。最终学生得出用一干一湿的有色纸条放入氯气中观察现象。考虑学生安全,此时我将事先录制的视频播放给学生观看。
现象:湿润有色纸条褪色,干燥有色纸条不褪色。
结论:氯气没有漂白性,氯气与水反应有漂白性物质生成。
在学生体验最深刻的时候,我直接告诉学生这种漂白性物质就是次氯酸。
(这主要是由于学生的知识和能力水平有限,不能够清楚所有的内容,这充分体现了教师主导,学生主体的作用。)
环节三:归纳总结及其巩固
学生结合对氯水的认识,完成氯气与水反应的化学方程式。师:“次氯酸有怎样的性质呢?”
学生结合课本知识,总结归纳其性质,从中提升学生归纳总结的学习能力。
五、教学特色
化学是一门以实验为基础的学科,实验是最重要的教学方式之一。在课堂上,我突破传统教学方法,采用探究性学习方法。探究性学习是新课程标准所倡导的,学生亲自动手实验,体验实验学习的乐趣,提高动手实践的能力。
