基于人CD105分子的酵母展示系统的构建
2016-09-05高海霞刘红芹石琳屈浩
高海霞,刘红芹,石琳,屈浩
·论著·
基于人CD105分子的酵母展示系统的构建
高海霞,刘红芹,石琳,屈浩
目的构建基于人 CD105 分子的酵母表面展示系统。
方法以人 CD105 cDNA 为模板,扩增 CD105 基因片段,转化到酵母表面展示载体 pYDs,构建 pYDs-CD105 重组质粒;将重组质粒转化酵母细胞,测序鉴定,并通过流式细胞仪分析 CD105 的表达。
结果测序表明 CD105 基因片段转入 pYDs 质粒,流式细胞仪检测到酵母细胞表面有 CD105 分子的表达。
结论成功构建了基于人 CD105 分子的酵母表面展示系统,为本实验室获得 CD105 单克隆抗体杂交瘤细胞株提供了新的筛选平台。
聚合酶链反应;膜糖蛋白类;CD105;诱导;酵母表面展示
www.cmbp.net.cn中国医药生物技术, 2016, 11(4):329-332
表面展示技术(surface display techniques,SDT)是一种基因表达产物和亲和选择相结合的技术,不仅可以展示小肽,还可以展示较大的蛋白[1]。展示文库常用于确定单克隆抗体的抗原表位,其中大肠杆菌表达系统的噬菌体展示系统应用最为广泛,但受其自身加工能力的限制,缺乏对表达产物的翻译后修饰功能,从而降低了获得高亲和力单克隆抗体的可能性。酵母表面展示系统是继噬菌体展示技术创立后发展起来的真核展示系统,酵母的蛋白质折叠和分泌机制与哺乳动物细胞非常相似,对人的蛋白质表达和展示更具优越性[2]。
CD105 是一种分子量为 180 kD 的存在于细胞表面的同源二聚体跨膜糖蛋白,其胞膜外部分含有 561 个氨基酸残基,跨膜区域含有 25 个氨基酸残基,胞膜内部分含有 47 个氨基酸残基。CD105 主要表达在血管内皮细胞及相关组织上,在造血细胞、基质细胞、成纤维细胞、血管平滑肌细胞弱表达。CD105 参与血管生成,与肿瘤的转移及预后相关,在恶性肿瘤的诊断、预后、治疗中发挥重要作用[3]。将 CD105 分子展示在酵母表面,是利用流式细胞仪快速、准确筛选 CD105 单克隆抗体的有效方法。
1 材料与方法
1.1材料
1.1.1菌株酿酒酵母 EBY100 和大肠杆菌DH5α 由本实验室保存。
1.1.2主要试剂pYDs-CD105-ring 引物和 pYDs引物由美国 Invitrogen 公司合成;M-MLV 逆转录酶购自美国 Invitrogen 公司;DNA 纯化试剂盒、高保真 Pyrobest DNA 聚合酶购自大连 Takara 公司;酵母转化及诱导试剂盒购自北京伟仑欣创生物公司;酵母质粒提取试剂盒和 anti-V5 抗体购自天根生物公司;anti-CD105-PE 单克隆抗体购自美国Beckman Coulter 公司;goat anti-mouse-IgG-FITC购自美国 Biotech 公司。
1.2方法
1.2.1引物根据已知 human CD105 cDNA 序列,设计并合成一对引物,上游引物:pYDs-CD105-ring-1:5' CCAGGATCCAGTGTGGT GGAATTCGAAACAGTCCATTGTGACCTTCAGC CT 3',下游引物:pYDs-CD105-ring-2:5' GCCCTC TAGACTCGAGGGCGGCCGCATCGAGATCCCCG GGTGCGCA 3';此外,合成另一对酵母转化同源区引物,上游引物:pYDs01:5' GATCTGTACGACG ATGACGATAAGGTACCAGGATCCAGTGTGGTG GAATTC 3',下游引物:pYDs02:5' GTTAGGGAT AGGCTTACCTTCGAAGGGCCCTCTAGACTCGA GGGCGGCCGC 3'。
1.2.2总 RNA 提取和 RT-PCR从 U937 细胞系中提取总 RNA,以总 RNA 为模板进行逆转录合成第一链。从合成的 human CD105 cDNA 中取1 μl 为模板,以 pYDs-CD105-ring-1,pYDs-CD105-ring-2 为上下游引物,高保真聚合酶 Pyrobest 扩增CD105 片段。反应条件为:94 ℃ 预变性 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,共 30 个循环;之后 72 ℃ 延伸 5 min。
1.2.3在 CD105 两端加上酵母转化同源区序列以上面 PCR 扩增的 CD105 片段为模板,以pYDs01、pYDs02 酵母转化同源区为上下游引物,PCR 扩增带同源区序列的 CD105 片段。反应条件为:94 ℃ 预变性 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,共 30 个循环;之后 72 ℃ 延伸 5 min。1.2.4酵母转化根据胶回收试剂盒说明书步骤纯化回收用酵母同源区引物扩增的 CD105 片段,与 EcoR I 和 Not I 双酶切的 pYDs 质粒转化EBY100 酵母。
转化前 2 天从 -80 ℃ 冰箱取出 EBY100,划线接种到 YPD 平板上,30 ℃ 培养至长出单克隆菌落。将 EBY100 接种于 5 ml YPD 培养基,30 ℃200 r/min 过夜。次日测 A600= 0.935,用 50 ml YPD培养液稀释菌液至 A 值为 0.05,30 ℃ 200 r/min培养至 A 为 0.5,在 3000 × g 条件下,离心 5 min收集菌体,用 20 ml 双蒸水洗菌体,离心同上,弃上清。用 1 ml 100 mmol/L LiAc 悬浮菌体,30 ℃ 温浴 10 min,最高速度离心 10 s,弃上清,用 500 μl 100 mmol/L LiAc 重悬菌体。取 50 μl 细胞悬液于新的离心管,15 s 高速离心,移去上清,加入下列成分:240 μl PEG,36 μl LiAc(100 mmol/L),50 μl SS-DNA(carrier),1 μl Plasmic DNA Vector,20 μl PCR 产物,4 μl ddH2O。混匀细胞悬液,30 ℃ 温浴 30 min,然后加入 40 μl DMSO,混匀。热击转化液,42 ℃ 25 min,高速离心 30 s 收集细胞,去除上清,用 1 ml ddH2O 重悬,细胞悬液涂布 SD板,30 ℃ 培养 2 ~ 4 d,获得转化子。
1.2.5测序转化后从 SD 平板上挑取单克隆菌落接种到 SD 培养基中,30 ℃ 培养 24 h,按照酵母质粒提取试剂盒说明书步骤提取酵母质粒,热击法转化 DH5α,涂在 LB Amp+平板上,37 ℃ 培养箱培养过夜,挑单克隆测序。
1.2.6酵母诱导得到正确的展示 CD105 酵母克隆后,SG 培养基诱导。从 SD 平板上挑单克隆接种到 2 ml SD 培养基(加 2% 葡萄糖)中,30 ℃ 摇床培养到 OD 值至 2.0 时,取 1 ml 菌液,5000 r/min 离心 5 min,弃上清。用 1 ml SG 培养基(加 2% 半乳糖)悬浮菌体,5000 r/min 离心5 min,弃上清,然后用 2 ml SG 培养基悬浮菌体,转入试管,20 ℃ 摇床诱导 36 ~ 48 h。
1.2.7流式细胞仪检测取 SG 诱导的酵母 1 × 106个,用 1 ml FACS buffer(PBS + 1% BSA)洗1 次,5000 r/min 离心 5 min,弃上清,按 1:1000加入 anti-V5 抗体,4 ℃ 避光孵育 1 h,1 ml FACS buffer 洗 3 次,按 1∶100 加入二抗 goat anti-mouse-IgG-FITC,流式细胞仪 FACS Calibur检测 V5 信号。同时,用 20 μl anti-CD105-PE 单克隆抗体标记酵母 1 × 106个,4 ℃ 避光孵育 1 h,随后流式细胞仪检测 CD105 信号。
2 结果
2.1PCR 扩增产物的鉴定
以 CD105 cDNA 为模板,以两侧引物扩增CD105 分子的一个蛋白结构域。经琼脂糖凝胶电泳分析,结果显示成功地扩增出 717 bp 的目的 DNA条带(图 1)。以此为模板,在 CD105 两端加上酵母(pYDs)转化同源区序列,成功地扩增出 767 bp 的 pYDs-CD105 DNA 目的条带(图 2)。
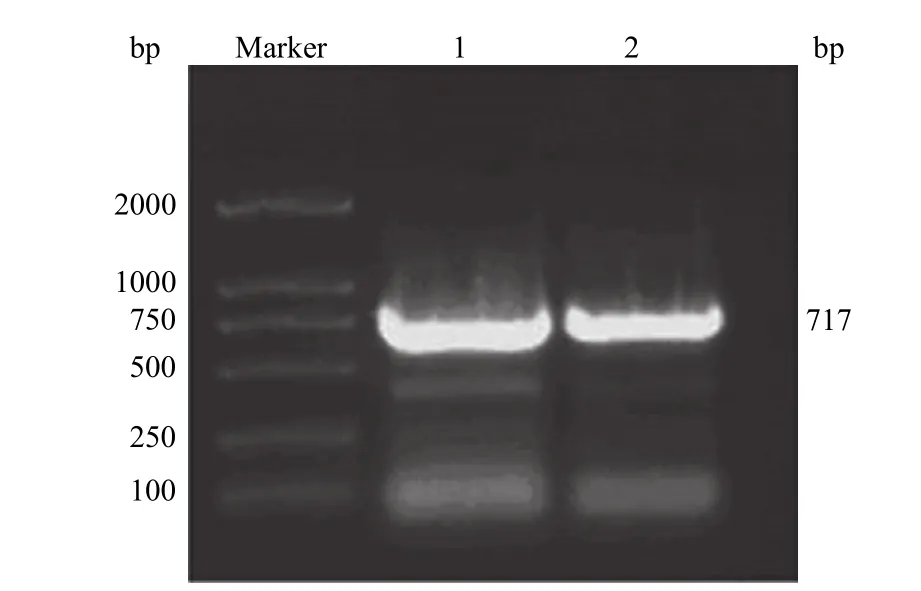
图1 CD105 基因片段扩增的琼脂糖电泳分析Figure 1 Analysis of CD105 gene by agarose gel electrophoresis
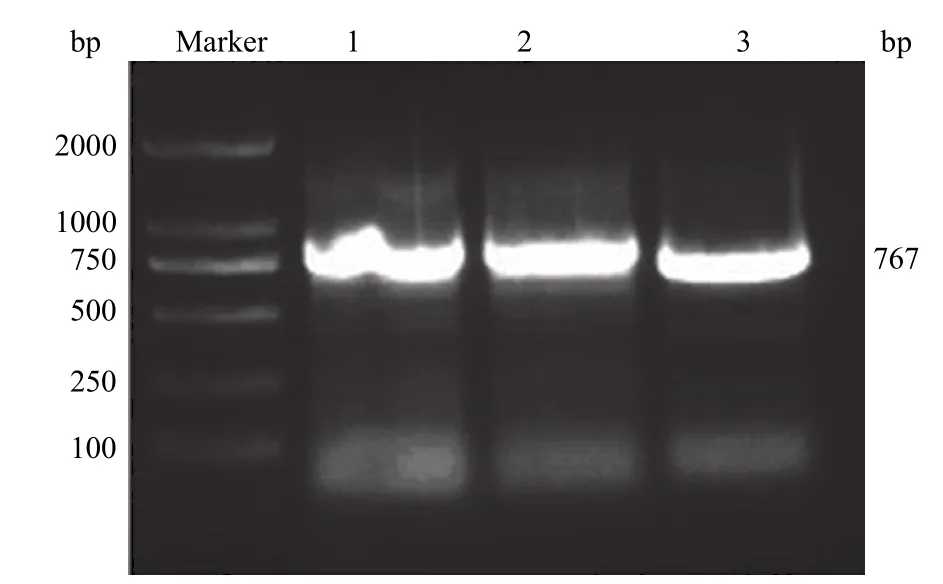
图2 pYDs-CD105 基因扩增的琼脂糖电泳分析Figure 2 Analysis of pYDs-CD105 gene by agarose gel electrophoresis
2.2酵母转化及测序
根据胶回收试剂盒说明书步骤纯化回收用酵母同源区引物扩增的 CD105 片段,与 EcoR I 和Not I 双酶切的 pYDs 质粒转化 EBY100 酵母,30 ℃ 培养 2 d 后 SD 平板长出数十个单菌落。
从 SD 平板上挑取单克隆菌落提取酵母质粒,热击法转化 DH5α,涂在 LB Amp+平板上,37 ℃培养箱培养过夜,挑单克隆 pYDs-CD105-ring-1 和pYDs-CD105-ring-2 去测序,最终获得了序列完全正确的 pYDs-CD105 质粒。
2.3流式细胞仪检测酵母表面 CD105 的表达
PCR 扩增 CD105 一个蛋白结构域的片段,表达在酵母表面后,先用 anti-V5-FITC 标记,检测酵母展示的效率。结果显示 V5 信号阳性(图 3),然后用 anti-CD105 抗体标记,流式细胞仪检测抗体结合。结果表明,CD105 片段与 anti-CD105 抗体结合(图 4)。
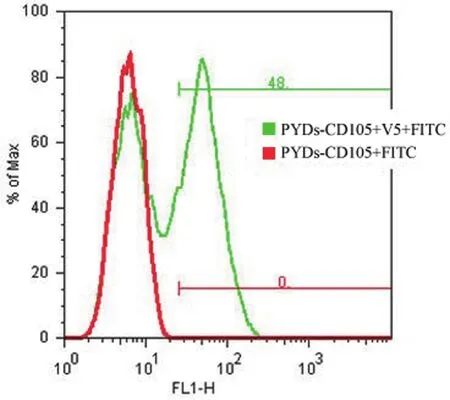
图3 FACS 检测 V5 表达Figure 3 The expression of V5 was determined by FACS
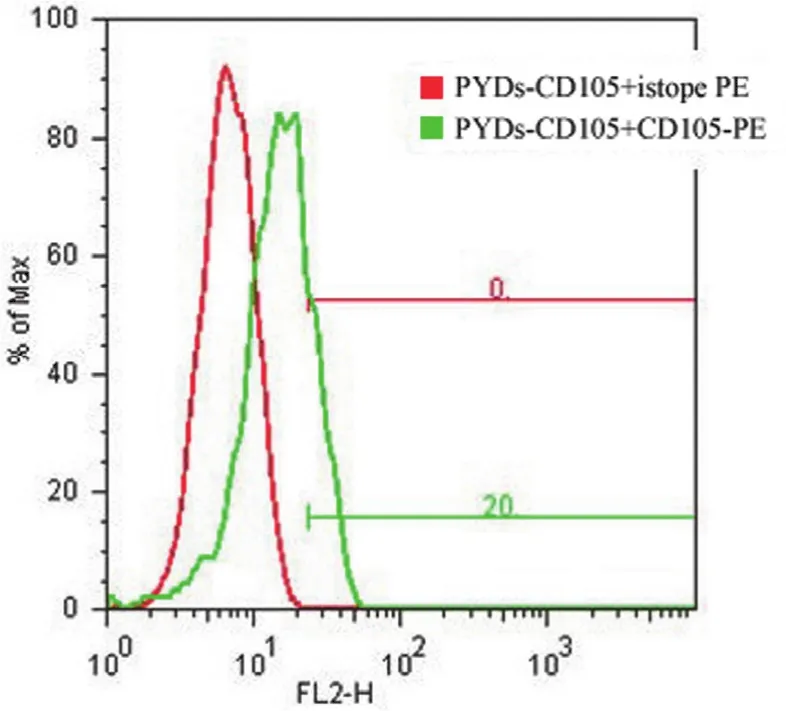
图4 FACS 检测 CD105 表达Figure 4 The expression of CD105 was determined by FACS
3 讨论
酵母展示系统是研究可溶性蛋白间相互作用的有效系统,利用此系统可以简单快速地研究抗原与抗体的相互作用,确定与抗体相对应的空间构象性的抗原决定簇。
自丝状噬菌体表面展示技术创立以来,短短几年,又分别发展了 λ 噬菌体、T4 噬菌体、T7 噬菌体、大肠杆菌、杆状病毒以及酵母等多种表面展示系统。酵母表面展示系统是一种真核展示系统,含有与哺乳动物相似的蛋白折叠机制,这样酵母比原核细胞更有可能正确地表达和展示人的蛋白[4]。另外,在回收稀有克隆,区分亲和力微弱差别的克隆方面也优于噬菌体、大肠杆菌等原核展示系统。更具优势的是将目的片段连入载体,经过诱导,目的蛋白就展示在酵母表面,不需要进行蛋白纯化,且酵母细胞颗粒大,可用流式细胞仪进行筛选和分离,比 Western blot 和 ELISA 方法要方便、快速[5-6]。
本实验室应用酵母展示技术成功将人 CD105分子片段展示在细胞表面,建立了筛选 CD105 单克隆抗体的新技术平台。但是,CD105 全长基因较大(2000 bp 左右),将全长基因转化至酵母载体不易形成正确的空间构象,故计划将其拆分为几个结构域进行克隆,构建不同抗原决定簇的酵母展示载体,相关实验还在进行中。
本次构建的酵母表面展示 CD105 片段与anti-CD105 抗体结合,但是信号较 V5 弱。可能是测试所用的 anti-CD105 抗体对应的抗原结合位点与本实验构建的抗原部分交叉,而不是完全一致,导致信号不强。另一个原因,anti-CD105 抗体不是与 CD105 抗原的某一段线性片段结合,而是与 CD105 抗原空间构象位点结合,抗体结合需要CD105 的正确折叠。
[1] Reich LL, Dutta S, Keating AE. Generating high-accuracy peptide-binding data in high throughput with yeast surface display and SORTCERY. Methods Mol Biol, 2016, 1414:233-247.
[2] SunPN,ZhangXC,ChenYS.Applicationofthe yeast-surface-display system for orally administered salmon calcitonin and safety assessment. Biotechnol Prog, 2010, 26(4):968-974.
[3] Barbara NP, Wrana JL, Letarte M. Endoglin is an accessory protein that interacts with the signaling receptor complex of multiple members of the transforming growth factor-beta superfamily. J Biol Chem, 1999, 274(2):584-594.
[4] Choi HJ, Kim YJ, Choi DK, et al. Engineering of immunoglobulin Fc heterodimers using yeast surface-displayed combinatorial Fc libraryscreening. PLoS One, 2015, 10(12):e0145349.
[5] Bidlingmaier S, Su Y, Liu B. Combining phage and yeast cell surface antibody display to identify novel cell type-selective internalizing human monoclonal antibodies. Methods Mol Biol, 2015, 1319:51-63.
[6] Ye B, Lin Y, Han SY. Development and application yeast cell surface display system. Ind Microbiol, 2007, 37(6):53-58. (in Chinese)
叶波, 林影, 韩双艳. 酵母细胞表面展示系统的研究进展及其应用.工业微生物, 2007, 37(6):53-58.
【Abstract】
ObjectiveConstruction of the yeast display system on human CD105.
MethodsIn the present study, the cDNA of human CD105 was used as a template, and human CD105 gene was amplified by PCR with primer we designed. The PCR products were cloned into yeast surface display vector pYDs, and the recombinant vector CD105-pYDs was thus constructed. This recombinant vector was then transfected into yeast cells. The expression of CD105 on the surface of yeast cells was determined by flow cytometery.
ResultsThe CD105 gene was successfully transfected into pYDs, and CD105 was detected on the surface of yeast cells by flow cytometery.
ConclusionThe yeast display system on human CD105 is successfully constructed in the present study, and this might provide a favorable basis of further study.
Author Affiliations: Tianjin AllianStemcell Biotech Co., Ltd., Tianjin 300304, China (GAO Hai-xia); Union Stem Cell & Gene Engineering Co., Ltd., Tianjin 300384, China (LIU Hong-qin, SHI Lin, QU Hao)
www.cmbp.net.cnChin Med Biotechnol, 2016, 11(4):329-332
Construction and identification of human CD105 based yeast display system
GAO Hai-xia, LIU Hong-qin, SHI Lin, QU Hao
Polymerase chain reaction;Membrane glycoproteins;CD105;Introduce;Yeast display
GAO Hai-xia, Email: gaohaixia2005@aliyun.com
10.3969/j.issn.1673-713X.2016.04.008
天津市科技创新专项资金(08FDZDSH03000)
300304 天津和泽干细胞科技有限公司(高海霞);300384 天津,协和干细胞基因工程有限公司(刘红芹、石琳、屈浩)
高海霞,Email:gaohaixia2005@aliyun.com
2016-04-08
