钙调蛋白镁结合位点突变体载体的构建、表达纯化及鉴定
2016-09-05赵美眯邵冬雪梁洪玥孙雪菲郝丽英
赵美眯,李 卓,邵冬雪,梁洪玥,晏 珊,封 瑞,孙雪菲,郭 凤,郝丽英
(中国医科大学药学院药物毒理学教研室,沈阳110122)
钙调蛋白镁结合位点突变体载体的构建、表达纯化及鉴定
赵美眯,李卓,邵冬雪,梁洪玥,晏珊,封瑞,孙雪菲,郭凤,郝丽英
(中国医科大学药学院药物毒理学教研室,沈阳110122)
目的构建钙调蛋白3种镁离子结合位点突变体的质粒载体,并进行表达纯化及鉴定,为深入研究钙调蛋白的生物学功能奠定基础。方法利用钙调蛋白cDNA进行点突变,制备3种镁离子结合位点突变的cDNA。将突变后的cDNA分别插入pGEX-6P-3载体,制备钙调蛋白突变体载体质粒。质粒转化大肠杆菌BL21感受态细胞,培养大肠杆菌,并诱导GST融合蛋白表达。利用Glutathione-Sepharose 4B珠子和PreScission蛋白酶分离纯化蛋白。结果酶切鉴定和DNA测序证实成功构建钙调蛋白突变体质粒;表达纯化得到的钙调蛋白突变体经电泳图鉴定纯度较高,浓度约1.0 mg/mL。结论本研究成功构建了钙调蛋白镁结合位点突变体融合蛋白原核表达质粒,分离纯化可获得较高浓度较高纯度的钙调蛋白突变体。
钙调蛋白;突变体;融合蛋白;pGEX-6P-3
网络出版地址
钙调蛋白(calmodulin,CaM)是一种广泛存在于生物体的钙结合蛋白。它与体内多种蛋白相互作用产生各种生物学效应,是生命活动过程中不可缺少的细胞因子[1-2]。研究发现CaM不仅可与经典的钙离子通道蛋白相互作用,而且可与钾离子通道[3]、钠离子通道[4],以及非选择性阳离子通道[5]直接作用,但其作用机制有待深入研究。本研究拟构建新的CaM突变体,以便进一步研究其生物学功能及其对各种离子通道的调节作用。
CaM由148个氨基酸组成,空间结构呈哑铃型,两端(N-lobe,C-lobe)各有2个EF-hand结构域,4个EF-hand都可以结合Ca2+。目前国内外文献中涉及的CaM突变体就是指CaM钙结合位点突变体,即CaM的4个EF-hand上某些关键氨基酸残基发生了突变,使得不能与Ca2+结合,导致其功能部分或全部丧失[6-7]。一般认为Ca2+/CaM复合物具有重要的生理学功能,CaM钙结合位点突变体被广泛应用于CaM作为Ca2+伴侣蛋白参与各种生物信息调节的机制研究中。
CaM也能结合Mg2+。CaM上4个EF-hand与Mg2+的解离常数约为1×10-2~1×10-4/mol,其中N-lobe上第1个EF-hand与Mg2+亲和力最高,C-lobe上第2个EF-hand为其次,其余2个位点亲和力很弱[8]。目前研究认为,Mg2+/CaM复合物可引起CaM局部构象改变,但其功能变化鲜见报道。为此,本研究设计了3个CaM镁结合位点突变体:CaMN(D24N),即点突变CaM的N-lobe上镁结合位点;CaMC(D133N),即点突变CaM的C-lobe上镁结合位点;以及双突变体CaMNC(D24N+D133N),即同时突变CaM的N-lobe和C-lobe上镁结合位点。本实验拟构建钙调蛋白3种Mg2+结合位点突变体的质粒载体并进行表达纯化及鉴定,为进一步揭示Mg2+/CaM复合物的功能及体内生物学意义奠定基础。
1 材料与方法
1.1材料
pGEX-6P-3/CaMN、pGEX-6P-3/CaMC和pGEX-6P -3/CaMNC钙调蛋白镁结合位点突变体的重组质粒由武汉金开瑞生物工程有限公司合成提供。Escherichia coli BL21由北京全式金生物技术有限公司提供;胰化蛋白胨,酵母提取物由Oxoid公司提供;异丙基硫代-β-D半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),氨苄青霉素(ampicillin,AMP),溶菌酶,二硫苏糖醇(DL-Dithiothreitol,DTT),月桂酰肌氨酸(N-lauroylsarcosine sodium salt)由Sigma公司提供;Triton X-100,十二烷基硫酸钠(sodium dodecyl sulfate,SDS)由BIOSHARP公司提供;Glutathione-Sepharose 4B珠子(GS-4B珠子),PreScission蛋白酶由GE Healthcare公司提供;Bradford蛋白浓度测定试剂盒由碧云天公司提供。
1.2质粒构建
应用点突变试剂盒制备钙调蛋白镁结合位点突变体(CaMN、CaMC和CaMNC)编码序列并克隆至载体pGEX-6P-3。
1.3质粒转化
采用42℃精确热击法将上述3种重组质粒转化至Escherichia coli BL21感受态细胞,得到基因重组BL21大肠杆菌,具体操作参考文献[9]。
1.4质粒提取
第二,突出教学重点,确保幼儿一日活动的高效性。幼儿园一日活动的内容非常丰富,细节较多,因此,幼儿园应在每一学期设置不同的重点,扎实地展开幼儿的教学活动。在教学过程中要注重理论与实践之间的结合,通过案例的示范、研究讨论、实践与反思等来提高教学活动的时效性。
采用碱裂解法和硅基质膜材料特异性吸附DNA的方法从大肠杆菌中小量提取质粒DNA。按照高纯度质粒小提试剂盒(DP107,北京天根生物工程有限公司)说明书进行提取。
1.4.1提取质粒的酶切鉴定:该重组质粒具有SalⅠ和NotⅠ酶切位点,选用这2个限制性内切酶(NEB公司)进行酶切鉴定。反应体系:1 μL RE缓冲液,0.25 μL SalⅠ,0.25 μL NotⅠ,1 μL质粒DNA,7.5 μL DEPC水,反应总体系10μL。37℃培养箱孵育1 h后,1%琼脂糖凝胶电泳,紫外成像。
1.4.2提取质粒的DNA测序:应用双脱氧终止法进行DNA测序,由武汉金开瑞生物工程有限公司完成。
1.5融合蛋白表达
重组质粒转化BL21大肠杆菌后保留菌种,取适量相对应的菌种加入装有400 mL LB(含AMP 50 μg/mL)培养液的锥形瓶中,利用振荡水浴锅在37℃、100 r/min条件下培养13~16 h。当A600值达到0.6~1.0时,加入IPTG至1 mmol/L,继续在37℃、110 r/min的条件下振摇培养4 h,诱导CaM突变体的融合蛋白表达。
1.6蛋白纯化
将上述菌液离心后弃上清,用PBS重悬沉淀菌体,加入溶菌酶至0.2 mg/mL,DTT至10 mol/L,冰浴30 min后低温超声波破碎细菌。超声破碎后菌液低温高速离心取上清,加入相应量的GS-4B珠子,4℃缓慢旋转孵育过夜。次日清晨,用Tris缓冲液(pH 8.0)清洗后,加入1% PreScission蛋白酶,室温最大速度旋转酶切蛋白5 h,使得融合蛋白GST与目的蛋白分离。600 r/min离心3 min,上清即为提纯的CaM突变体蛋白。部分纯化蛋白用于纯度鉴定和浓度测定,其余-80℃保存备用。
1.6.1纯化蛋白的纯度鉴定:利用15% SDS-PAGE电泳检测纯化蛋白的相对分子量和纯度。
2 结果
2.1重组质粒的酶切鉴定
用1%琼脂糖电泳鉴定插入CaM突变体的pGEX-6P-3载体的质粒。质粒pGEX-6P-3经SalⅠ和NotⅠ双酶切分别插入3种钙调蛋白镁结合位点突变体,即pGEX-6P-3/CaMN、pGEX-6P-3/CaMC和pGEX-6P-3/CaMNC。质粒pGEX-6P-3约为4 900 bp,SalⅠ和NotⅠ之间的碱基全长为18 bp,CaM突变体约为467 bp,所以CaM突变体重组质粒的长度约5 349 bp。重组质粒用SalⅠ和NotⅠ双酶切后应该得到1个大分子量DNA片段(约4 882 bp,pGEX-6P-3载体)和1个小分子量DNA片段(约467 bp,CaM突变体)。电泳结果显示,3种CaM突变体重组质粒酶切后,在分子量约5 000 bp和500 bp处均有一明显的条带(图1),与预期结果相符,表明CaM突变体重组质粒构建成功。
2.2CaM突变体的DNA测序
为鉴定CaM突变体,测序结果用GeneTool软件与野生型CaM[homo sapiens calmodulin 2(phosphorylase kinase,delta),CALM2]比对。CaMN测序结果显示:基因序列的第70位碱基由G突变成了A;CaMC测序结果显示:基因序列的第397位碱基由G突变成了A;CaMNC测序结果显示:基因序列的第70位和第397位碱基同时由G突变成了A,见图2A。根据测得的CaM碱基序列及3个碱基决定1个氨基酸的原则,获得CaM氨基酸顺序。CaMN突变体氨基酸序列与野生型相比,第24个氨基酸残基由D突变成了N;CaMC突变体氨基酸序列与野生型相比,第133个氨基酸残基由D突变成了N;CaMNC突变体氨基酸序列与野生型相比,第24和第133位氨基酸残基均由D突变成了N,见图2B。该结果与设计的突变位点一致,进一步表明CaM突变体重组质粒构建成功。
2.3纯化后CaM突变体的纯度鉴定
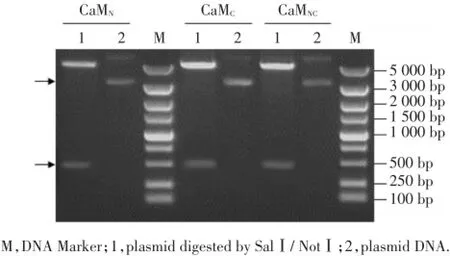
图1 CaM突变体重组质粒的酶切鉴定图Fig.1 Enzyme digestion analysis of CaM mutants recombinant plasmids
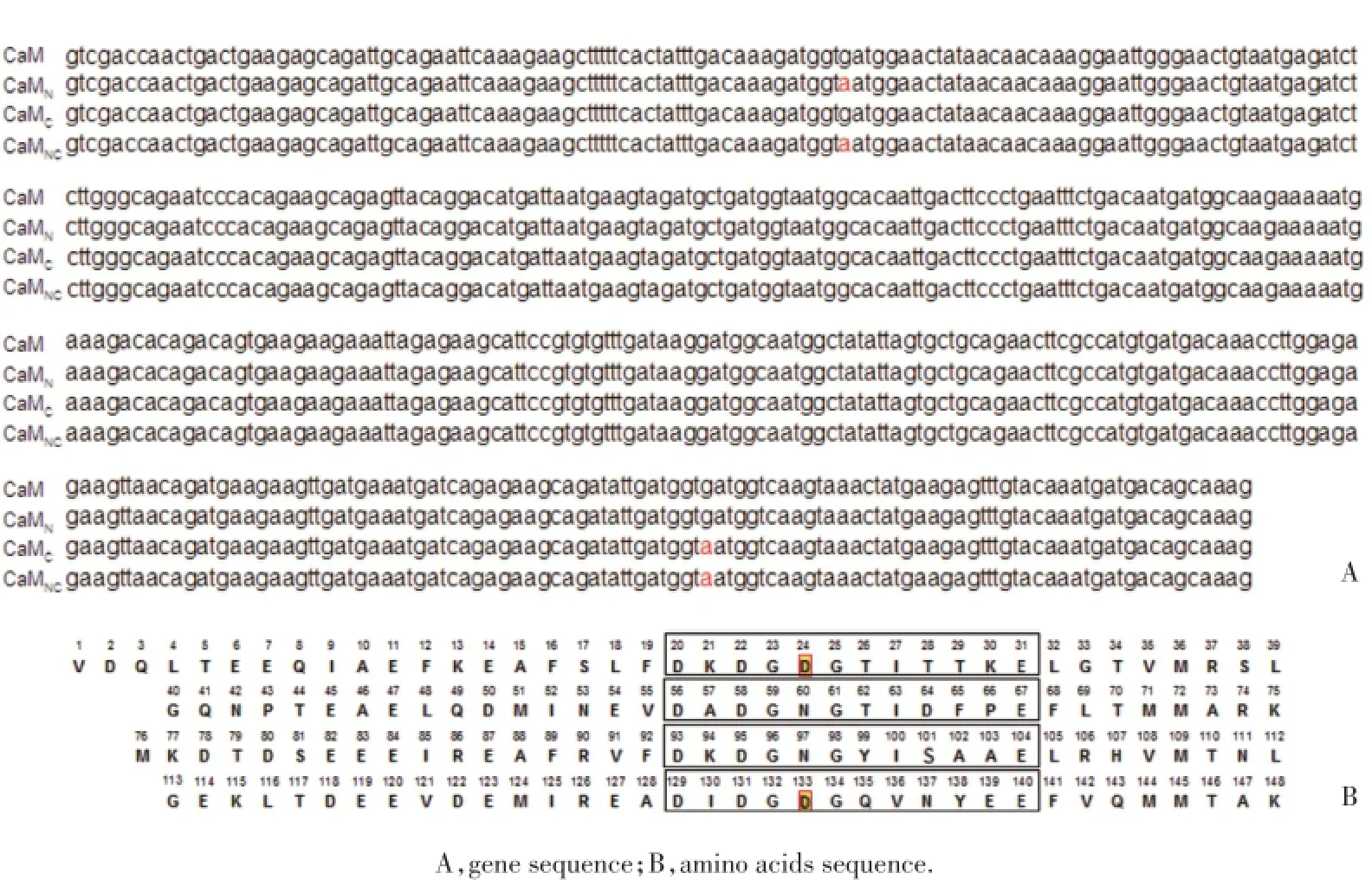
图2 CaM突变体测序结果及相对应氨基酸序列图Fig.2 DNA sequence identification of CaM mutants and their amino acids
CaM由148个氨基酸组成,表观分子量约为16.7×103。点突变后的3种CaM突变体表观分子量仍为16.7×103。SDS-PAGE蛋白电泳结果显示(图3),在Marker 15×103条带的稍微偏上处CaM、CaMN、CaMC和CaMNC4个泳道分别出现1条粗蛋白条带,即分别为CaM及其突变体蛋白,与预期结果一致。电泳结果显示附近基本无杂带,提示纯化后CaM突变体的蛋白纯度较高。
2.4纯化后CaM突变体的浓度测定
采用Bradford蛋白浓度测定试剂盒测定蛋白浓度,将各样品稀释4倍后用酶标仪在波长595 nm处测得OD595值。根据标准曲线公式,计算所得纯化后CaM突变体(CaMN、CaMC和CaMNC)的蛋白浓度依次为1.0、0.9、1.2 mg/mL。与同一方法提纯的野生型CaM的浓度(1.0 mg/mL)无明显区别。
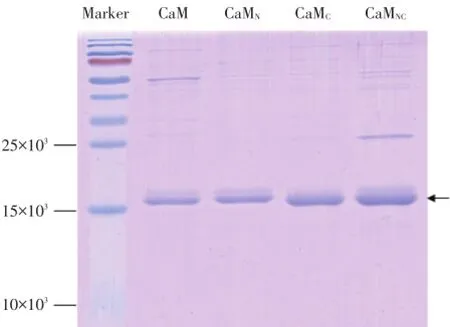
图3 纯化后CaM突变体变性凝胶电泳图Fig.3 SDS-PAGE of purified CaM and its mutants
3 讨论
为深入研究CaM的生物学功能,了解与其他蛋白的相互作用,本实验应用了蛋白重组技术;首次设计了CaM镁结合位点突变体;应用大肠杆菌原核表达系统表达GST融合蛋白;采用GS-4B珠子和PreScission蛋白酶分离纯化突变体蛋白,为后续开展体外蛋白结合实验等工作提供保障。本实验选用表达重组蛋白的首选表达系统——大肠杆菌表达系统,具有遗传背景清楚、培养操作简单、转化和转导效率高、生长繁殖快、成本低廉,可以快速大量地生产目的蛋白等优点。本实验表达载体选用融合表达载体中的GST(谷胱甘肽-S-转移酶)系统。因为CaM分子量较小,以融合蛋白形式表达,可增强mRNA及表达产物稳定性,并生产出可溶性蛋白;同时采用该表达载体简化了蛋白分离纯化步骤。
本实验用pGEX-6P-3/CaMN、pGEX-6P-3/CaMC和pGEX-6P-3/CaMNC重组质粒分别转化大肠杆菌BL21感受态细胞,可稳定地表达GST-CaM镁结合位点突变体融合蛋白,且表达突变体的基因性状稳定。GS -4B珠子可稳定结合GST-CaM镁结合位点突变体融合蛋白,经PreScission蛋白酶特异性酶切,可获得较纯CaM镁结合位点突变体蛋白。本实验提取的重组质粒,用双酶切鉴定转化成功,测序CaM镁结合位点突变体基因正确。分离纯化所得蛋白,经SDSPAGE电泳鉴定为目的蛋白(CaMN、CaMC和CaMNC),且纯度较高;Bradford法测定蛋白浓度较高。以上结果提示,采用本实验方法可稳定可靠获得较高纯度较高浓度的CaM镁结合位点突变体,从而为深入研究CaM突变体的生物学特性及其功能奠定了基础。
[1]Ainscough JS,Gerberick GF,Kimber I,et al.Interleukin-1β processing is dependent on a calcium-mediated interaction with calmodulin[J].J Biol Chem,2015,290(52):31151-31161.
[2]Adams PJ,Ben-Johny M,Dick IE,et al.Apocalmodulin itself promotes ion channel opening and Ca2+regulation[J].Cell,2014,159(3):608-622.
[3]Wong R,Schlichter LC.PKA reduces the rat and human KCa3.1 current,CaM binding,and Ca2+signaling,which requires Ser332/ 334 in the CaM-binding C terminus[J].J Neurosci,2014,34(40):13371-13383.
[4]Alli AA,Bao HF,Liu BC,et al.Calmodulin and CaMK Ⅱ modulate ENaC activity by regulating the association of MARCKS and the cytoskeleton with the apical membrane[J].Am J Physiol Renal Physiol,2015,309(5):F456-F463.
[5]Loukin SH,Teng J,Kung C.A channelopathy mechanism revealed by direct calmodulin activation of TrpV4[J].Proc Natl Acad Sci USA,2015,112(30):9400-9405.
[6]Shao D,Zhao M,Xu J,et al.The individual N-and C-lobes of calmodulin tether to the Cav1.2 channel and rescue the channel activity from run-down in ventricular myocytes of guinea-pig heart[J].FEBS Lett,2014,588(21):3855-3861.
[7]Brunet S,Scheuer T,Catterall WA.Cooperative regulation of Ca(v)1.2 channels by intracellular Mg2+,the proximal C-terminal EF-hand,and the distal C-terminal domain[J].J Gen Physiol,2009,134(2):81-94.
[8]Tikunova SB,Black DJ,Johnson JD,et al.Modifying Mg2+binding and exchange with the N-terminal of calmodulin[J].Biochemistry,2001,40(11):3348-3353.
[9]孙威,封瑞,郭凤,等.PreIQ及其突变体载体构建表达纯化和活性鉴定[J].中国医科大学学报,2014,43(4):293-296.
(编辑武玉欣)
Vector Construction,protein Expression,purification and Identification of Calmodulin Mg2+Binding Site Mutants
ZHAO Meimi,LI Zhuo,SHAO Dongxue,LIANG Hongyue,YAN Shan,FENG Rui,SUN Xuefei,GUO Feng,HAO Liying
(Department of Pharmaceutical Toxicology,School of Pharmacy,China Medical University,Shenyang 110122,China)
Objective To construct plasmid vectors of calmodulin(CaM)Mg2+binding site mutants,and to express,purify and identify the mutant proteins.Methods Three kinds of cDNAs coding for the mutated CaM were cloned into pGEX-6P-3 plasmid vectors.These recombinant plasmids were transfected into Escherichia coli BL21 to express GST fusion proteins of CaM mutants.The fusion proteins were purified with Glutathione-Sepharose 4B beads and PreScission protease.Results Both enzyme digestion analysis and DNA sequence identification proved the successful construction of the CaM mutant plasmids.SDS-PAGE results showed the high purity of each CaM mutant protein.The concentrations of three CaM mutants were around 1.0 mg/mL.Conclusion Prokayotic expression vectors of CaMMg2+binding site mutants were successfully developed,and the eligible CaM mutant proteins were obtained.This study provided an important basis for further study on CaM's biological function.
calmodulin;mutant;fusion protein;pGEX-6P-3
R96
B
0258-4646(2016)05-0394-04
10.12007/j.issn.0258-4646.2016.05.003
国家自然科学基金(31471091,31500930);医学电生理学重点实验室开放基金(KeyME-2014-03)
赵美眯(1978-),女,讲师,博士.
郝丽英,E-mail:lyhao@mail.cmu.edu.cn
2015-09-02
网络出版时间:
