阿霉素性慢性心衰大鼠模型不同方案的比较
2016-09-02叶婷,张梦,张宇,陈晶
叶 婷,张 梦,张 宇,陈 晶
(1.黑龙江中医药大学基础医学院,哈尔滨150040;2.黑龙江中医药大学附属第二医院内分泌科,哈尔滨150001)
阿霉素性慢性心衰大鼠模型不同方案的比较
叶婷1,2,张梦1,张宇1,陈晶1
(1.黑龙江中医药大学基础医学院,哈尔滨150040;2.黑龙江中医药大学附属第二医院内分泌科,哈尔滨150001)
比较利用不同方案尾静脉注射阿霉素建立Wistar大鼠慢性心力衰竭模型,评价出较优方案.成年雄性Wistar大鼠50只,随机分为3组:正常对照组(n=10)、模型A组(n=20)、模型B组(n= 20).模型A组按2 mg/kg体重剂量尾静脉注射阿霉素,每周1次,共6周;模型B组按3 mg/kg体重和1 mg/kg体重交替给予尾静脉注射盐酸阿霉素,每周1次,共6周;对照组注射相同体积的氯化钠注射液.末次注射停药后2周,测量体重(BW)、心室质量(VW)、左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室射血分数(LVEF)、左室短轴缩短率(FS)的变化.结果表明,与对照组相比,模型A组和模型B组VW/BW、LVESD、LVEF显著大于对照组;模型A组和模型B组比较,模型A 组LVEF与对照组及模型B组比较有统计学意义.尾静脉交替注射一定剂量的阿霉素是建立大鼠慢性心力衰竭模型的一种简便可靠的方法.
阿霉素;慢性心力衰竭;大鼠;动物模型
慢性心力衰竭(chronic heart failure,CHF)是各种心血管疾病的严重和终末阶段,发病率高,是当今最重要的心血管病之一[1].为进一步通过动物实验研究其发病机制,寻求有效的治疗方法,建立合适的动物模型是其首要条件.阿霉素(Doxorubicin Hydrochloride,ADR)诱导大鼠慢性心力衰竭模型广泛应用于慢性心力衰竭发病机制及药物治疗的研究中[2],但目前对于阿霉素致CHF动物模型的给药量及给药方按说法不一.本实验通过两种不同剂量的给药方案造模的比较,优选出合理的阿霉素造模给药方案.
1 材料和方法
1.1实验动物
成年雄性Wistar大鼠50只(黑龙江中医药大学动物实验中心提供),体重(200±20)g.适应性喂养1周后,将其随机分成对照组10只,模型A组10只,模型B组10只.
1.2主要药品试剂与仪器
注射用盐酸阿霉素(北京华奉联博科技有限公司,批号:0405E1);0.9%氯化钠注射液(中国大冢制药有限公司,批号:国药准字H12020025),梅特勒AL204电子体重天平(上海速展计量仪器有限公司),彩色多普勒超声诊断仪(SIEMENS公司).
1.3方法
1.3.1动物模型制备
将盐酸阿霉素用氯化钠注射液配制成2 mg/ mL溶液,模型A组(n=20)按2 mg/kg体重,即2 mL/kg的体重剂量尾静脉注射注射,每周1次,共6周,累积总药量12 mg/kg体重;模型B组(n= 20)按3 mg/kg体重和1 mg/kg体重交替给予尾静脉注射盐酸阿霉素,每周1次,共6周,累计总药量12mg/kg体重;对照组(n=10)尾静脉注射相同体积的氯化钠注射液.于末次注射给药后2周,观察动物的一般行为、体征及死亡率.
1.3.2超声心动图
将各组8周后存活的大鼠,行超声心动图检测.用10%水合氯醛溶液按3×10-3mL/g体重给予大鼠腹腔注射,进行全身麻醉,麻醉完成后仰卧位固定大鼠,固定后左前胸备皮,并用体积分数为0.7的乙醇消毒.选用超声仪12 L探头,频率14 MHz,于胸骨旁平乳头肌水平采集大鼠心脏超声图像,连续记录10个心动周期以上,获得超声心动图,测量左心室舒张末期内径(LVEDD),左心室收缩末期内径(LVESD)、左室射血分数(LVEF)和左心室短轴缩短率(LVFS).
1.4统计学处理
各组数值变量资料数据以均数±标准差表示,用SPSS19.0统计学软件对实验所得数据进行分析处理.各组间差异显著性检验采用t检验进行比较,P<0.05为差异有统计学意义.
2 结果
2.1一般情况与存活率
模型A组和模型B组大鼠在造模过程中均陆续出现精神状态萎靡,食量少,体重增长缓慢或者下降,反应迟钝,活动量下降,口唇及足趾发绀等慢性心力衰竭的症状.模型A组在造模期间共死亡大鼠5只,解剖发现大鼠肝大,腹水严重,存活率为75%;模型B组在造模期间共死亡大鼠6只,存活率为70%;对照组无大鼠死亡情况发生.模型A组和模型B组二者存活率比较差异无统计学意义.
2.2体重变化及心脏质量、心脏质量指数的比较
模型A组、模型B组与对照组相比,用药前后体重、心室质量差异无显著统计性差异(P>0.05).而用药后模型A组和模型B组与对照组VW/BW显著大于对照组,具有统计学意义(P<0.05).模型A组与模型B组VW/BW比较无统计学意义(P>0.05)(表1).
表1 造模8周末体重、心室质量比较(±S)

表1 造模8周末体重、心室质量比较(±S)
注:与对照组及模型B组相比较,*P<0.05.
组别 动物数 体重/g 心室质量/mg心室质量/体重(mg/g)10 299±18 768.28±22 2.57±0.06模型A组 20 243±20 736.46±20 3.03±0.07*模型B组对照组20 237±17 732.72±23 3.09±0.08
2.3超声心动图的比较
造模8周末利用超声心动图测定各组大鼠心功能.模型A组和模型B组大鼠心室腔扩大,心室室壁厚度增加,LVEDD和LVESD增加,且模型A 组LVESD与对照组及模型B组比较差异有统计学意义(P<0.05);模型A组和模型B组LVEF和LVFS明显降低,显示有左室收缩功能障碍,且模型A组LVEF与对照组及模型B组比较差异有统计学意义(P<0.05);对照组大鼠超声心动图未见明显心功能异常(见表2).
表2 造模8周末超声心动图检查结果比较(±S)
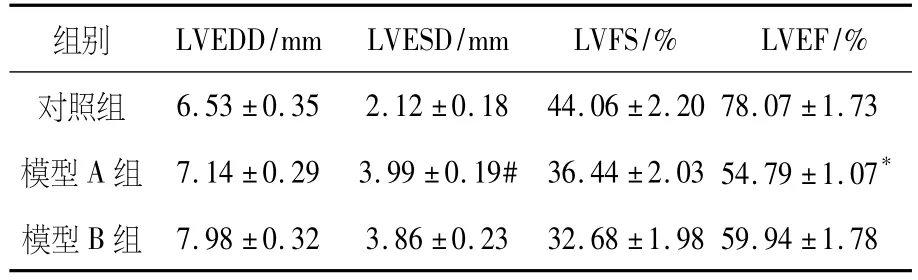
表2 造模8周末超声心动图检查结果比较(±S)
注:与对照组及模型B组比较,*P<0.05.
6.53±0.35 2.12±0.18 44.06±2.20 78.07±1.73模型A组 7.14±0.29 3.99±0.19# 36.44±2.03 54.79±1.07*模型B组LVEDD/mm LVESD/mm LVFS/% LVEF/%对照组组别7.98±0.32 3.86±0.23 32.68±1.98 59.94±1.78
3 讨论
阿霉素是一种有效的蒽环类广谱抗肿瘤化疗药物,是目前最常用的抗癌药物之一,可损害机体各脏器组织,其中以心脏损害在临床上最常见,其对心脏的损害特点为慢性、蓄积性,是建立CHF模型的理想药物.大鼠多次[3]给药后长期观察,可建立阿霉素CHF动物模型;阿霉素致CHF具有时间累积效应.盐酸阿霉素诱导CHF模型沿用已久,建立动物模型方式也较为公认,国内外研究阿霉素致CHF动物模型的方法有很多,但给药剂量、给药方式、给药时间各不相同[4-6].在前期的预实验中,给予大鼠腹腔注射阿霉素,模型死亡率高,可重复性差.分析原因可能为药物效价不同或者动物种属的差异;且腹腔注射致腹部皮肤局部坏死,大量药物直接局部刺激腹腔,胃肠道毒性更明显;实验最终选定尾静脉给药为给药方式.查阅文献发现尾静脉注射阿霉素造模的方法亦不尽一致,最终拟对比2 mg/kg体重剂量尾静脉注射阿霉素和3 mg/kg体重与1 mg/kg体重交替给予尾静脉注射盐酸阿霉素,每周1次,共6周,累计用量12 mg/kg,比较并评价二者建立的CHF动物模型.
目前,动物实验研究中常用于判断心力衰竭模型的方法有:心重/体重,有创的心功能的测定[7],观察心肌组织形态学的改变,均为有创方式;本实验拟通过超声心动图测定尾静脉注射阿霉素建立CHF大鼠模型的心脏功能,即为无创方式评价大鼠心力衰竭情况.研究结果表明,模型A组和模型B组大鼠出现慢性心力衰竭的症状和体征,彩超结果为左室收缩功能障碍,心室腔扩大,心室室壁厚度增加,模型A组和模型B组LVEF和LVFS明显降低,且模型A组LVEF与对照组及模型B组比较差异有统计学意义,因此本实验中3 mg/kg体重与1 mg/kg体重交替给予尾静脉注射盐酸阿霉素建立大鼠CHF动物模型为可靠方法,为课题组下一步进行CHF的机制研究提供可靠的模型.课题组分析交替给药组模型造模效果更佳,主要原因是交替给药组首先3 mg/kg体重的负荷量対大鼠心肌造成损伤,之后给1 mg/kg体重的维持量保证大鼠心肌持续处于损伤状态,交替组造成心肌损伤的程度更为严重,同时选择3 mg/kg体重与1 mg/kg体重交替给药并不造成大鼠的致死率增加,因此,在给药剂量相同的前提下,交替给药组建立的慢性心力衰竭模型更为可靠.
综上所述,多次尾静脉注射阿霉素可以建立CHF模型,并且可以通过超声心动图无创判定心脏功能,操作简单方便.因此,本实验提供了建立阿霉素大鼠CHF模型的方案,可为研究CHF的发病机制和新的治疗措施提供一种简单、可靠、易于操作的造模方法.本实验的不足之处在于未进行大鼠心肌组织形态学观察,更有力的评价大鼠CHF模型情况,今后将完善相关方面的内容.
[1]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2014[J].中华心血管病杂志,2014,42(2):98-122.
[2]薛一涛,李秋实,焦华琛,等.复心合剂对心衰大鼠信号通路Raf-MEK-ERK的影响[J].中华中医药学刊,2015 (04):791-794.
[3]陈晶,匡海学,代晓光.强心胶囊对阿霉素诱导大鼠心衰模型神经内分泌功能的影响[J].中医药学报,2009,37 (5):38-40.
[4]WU S,ZHU L,YANG J,et al.Hydrogen-containing saline attenuates doxorubicin-induced heart failure in rats[J]. Pharmazie,2014,69(8):633-636.
[5]成忠煌,胡雪峰,彭敏,等.阿霉素诱导大鼠慢性心力衰竭模型给药剂量和频率的优化[J].湖北中医杂志,2011,33(4):9-11.
[6]周岩,孙兰军,徐强.慢性心力衰竭大鼠模型研究进展[J].辽宁中医杂志,2014,41(8):1782-1784.
[7]王楚盈,李玉梅,刘畅,等.附子人参有效组分配伍对阿霉素致慢性心衰大鼠血流动力学的影响及其机制研究[J].中药新药与临床药理,2015,26(1):39-43.
Comparison of different rat chronic heart failuremodels induced by adriamycin
YE Ting1,2,ZHANG Meng1,ZHANG Yu1,CHEN Jing1
(1.School of Basic Medical Science,Heilongjiang University of Chinese Medicine,Harbin 150040,China;2.Endocrinology Department,The Second Affiliated Hospital,Heilongjiang University of Chinese Medicine,Harbin 150001,China)
The optimal scheme was evaluated by comparing the different schemes of intravenous injection of doxorubicin to establish themodel of chronic heart failure in Wistar rats.A total of 50 maleWistar ratswere randomly divided into 3 groups:normal control group(n= 10),Model A group(n=20),model B group(n=20).Model A group ratswere injected doxorubicin one times aweek and 2mg/kgweight dose in 6 weeks.Model B group ratswere given by 3 mg/kgweight and 1 mg/kg weight alternately.The control group ratswere injected saline.Twoweeks after the last injection,measured the body weight(BW),left ventricularmass(VW),left ventricular end diastolic diameter(LVEDD),left ventricular end systolic diameter(LVESD),left ventricular ejection fraction(LVEF),left ventricular fractional shortening(FS).Thr results showed that the VW/BW,LVESD,and LVEF of control group were significantly higher than group model A and group model B.The LVEF of A group was statistically significant lower than Model B group and control group.Themethod of intravenous alternating injection of a certain dose of doxorubicin was a simple and reliable method to establish a ratmodel of chronic heart failure.
doxorubicin;chronic heart failure;rat;animalmodel
R332
A
1672-0946(2016)02-0154-03
2015-05-05.
黑龙江省自然科学基金(H201485)
叶婷(1986-),女,博士,主治医师,研究方向:中医治则与治法机理研究.
陈晶(1964-),女,博士,教授,研究方向:中医治则与治法机理研究.
