乳腺癌Jab1蛋白调控Nov基因的表达受甲基化水平影响
2016-09-02王顺妮陈红岩叶晓娟闵太善卢大儒陈浩明
王顺妮,陈红岩,叶晓娟,闵太善,卢大儒,陈浩明
(1. 复旦大学 生命科学学院,上海 200438; 2. 复旦大学 遗传工程国家重点实验室,上海 200438;3. 复旦大学 现代人类学教育部重点实验室,上海 200438)
乳腺癌Jab1蛋白调控Nov基因的表达受甲基化水平影响
王顺妮1,2,3,陈红岩1,2,3,叶晓娟1,2,3,闵太善1,2,3,卢大儒1,2,3,陈浩明1,2,3
(1. 复旦大学 生命科学学院,上海 200438; 2. 复旦大学 遗传工程国家重点实验室,上海 200438;3. 复旦大学 现代人类学教育部重点实验室,上海 200438)
为探讨癌基因Jab1在乳腺癌发生发展中的功能,首先在乳腺癌细胞MDA231中建立了慢病毒介导的Jab1基因的表达干扰系统,并通过人基因表达谱芯片分析结果以及实时定量PCR实验筛选出受Jab1调控的下游基因;此外,通过实时定量PCR以及Western blot实验证实Jab1干扰表达能降低Nov基因在转录和翻译水平表达,而且Nov启动子区域存在4个高甲基化CpG位点.进一步使用甲基转移酶抑制剂处理Jab1干扰表达细胞,发现与未使用抑制剂处理细胞相比,Nov基因的mRNA和蛋白质表达水平发生明显上调,说明Jab1基因调控Nov表达受甲基化水平的影响,提示Jab1可能是通过表观遗传学水平调控Nov基因的表达.
乳腺癌; Jab1; 甲基化;Nov
乳腺癌高居女性恶性肿瘤的首位,全世界范围内每年约有120万新发乳腺癌病例,严重威胁着女性健康.Jab1也称为c-Jun激活结构域结合蛋白-1(c-Jun activation domain binding protein 1),同时也是COP9信号复合体的第5个亚单位(CSN5)[1].COP9信号复合体(CSN)是一个复杂保守的蛋白质,包含8个亚基,即CSN1~CSN8[2].CSN在多种真核动物和植物中都表达,并参与多种生物学过程[3-4].Jab1是一种重要的原癌蛋白,只存在于真核生物中,能够从复合体中脱离开单独进行作用并行使其功能[5-6],很多研究表明Jab1在多种癌症病人样本中都有过表达的现象,包括乳腺癌、脑垂体瘤、胰腺癌和肺癌[7-12]等,因此进一步深入揭示Jab1在肿瘤细胞中的分子机制显得尤为重要.
Nov(Nephroblastoma overexpressed),又称CCN3,是CCN家族中的成员之一,其在多个器官的发育和分化中起重要作用[13].Nov的异常表达常见于肿瘤中,并与多种恶性肿瘤的发生、发展、转移及浸润有关.在多数肿瘤中,Nov起负调节作用,能够促进肿瘤细胞的分化,抑制肿瘤细胞的增殖;但在个别肿瘤,例如前列腺癌、肾细胞癌等癌症中,Nov反而能够促进肿瘤细胞的增殖和转移[14].以上结果提示我们Nov在肿瘤中具有重要作用.
在肿瘤形成过程中,表观遗传学机制的作用越来越受到重视.其中一个重要机制就是DNA甲基化.研究表明,异常的DNA甲基化可以出现在肿瘤发生和发展的各个阶段[15-17].
在本次研究中,通过携带相应shRNA片段的慢病毒感染乳腺癌细胞系MDA231后筛选到Jab1调控的下游基因Nov,并从表观遗传学的水平初步探索了Jab1调控Nov基因的可能分子机制.
1 材料和方法
1.1材料
人源胚胎肾细胞(Human Embryonic Kidney, HEK)293T、人乳腺癌细胞MDA231、慢病毒包装相关质粒均为本实验室保存;DMSO试剂购自上海试剂厂;Lipofetamin 2000转染试剂、TRIzol试剂购自Invitrogen公司;反转录以及定量PCR试剂购自Toyobo公司;RIPA裂解液、一抗稀释液以及HRP标记的Western blot二抗购自碧云天生物研究所;人表达谱芯片购自上海博奥生物有限公司;Jab1一抗购自Thermo公司;β-actin、Nov一抗购自Cell Signaling公司;Polybrene粉末试剂购自Sigma公司;PVDF膜购自Millipore公司;细胞培养相关培养基、血清以及双抗均购自Gibco公司;5-氮杂-2′-脱氧胞苷(5′-aza-dC)购自上海研域生物科技有限公司,DNA甲基化检测试剂盒购自上海锐赛生物技术有限公司.
1.2细胞培养
293T、MDA231细胞培养使用DMEM高糖培养基,完全培养基中含有10% 胎牛血清以及青霉素(100U/mL)-链霉素(100μg/mL)双抗;培养于37℃、含5% CO2的恒温培养箱中培养.
1.3慢病毒包装
Jab1对应的干扰慢病毒shRNA序列为: Jab1sh2: 5′-GCACTGAAACCCGAGTAAATG-3′,Jab1sh5: 5′-GCTTGAGCTGTTGTGGAATAA-3′;对照组慢病毒shRNA序列: shLuc: 5′-CGTACG CGGAATACTTCGA-3′,分别克隆到pCDH-copGFP慢病毒表达载体中.
慢病毒包装时将各种慢病毒主质粒分别和3种辅助质粒PLP1、PLP2以及VSVG按质量比3∶1∶1∶1 混合后转染至293T细胞中,8h后换液,48h后收集病毒上清,2000r/min离心10min后用0.45μm 滤器过滤并分装后冻存于-80℃冰箱;感染时,取1mL慢病毒加入到含有10%细胞的六孔板中,加入1mL DMEM高糖完全培养基,并加入终浓度为3μg/mL的Polybrene溶液.
1.4抽提细胞总RNA
经过慢病毒感染的细胞弃去培养基后使用PBS将培养基洗干净,加入TRIzol裂解液后将细胞置于冰上裂解10min,加入三氯甲烷震荡静置,分层后冷冻离心取上层,加入等量异丙醇充分混匀后冷冻离心去上清,加入75%乙醇洗涤沉淀后加入适量DEPC水,冻于-80℃冰箱.
1.5实时定量PCR
定量PCR在ABI公司7900HT定量PCR仪上进行,结果由配套的SDS2.4软件进行分析,GAPDH基因作为内参基因,实验进行3组重复;GAPDH上游引物: 5′-ACAACTTTGGTATCGTGGAAGG-3′,GAPDH下游引物: 5′-GCCATCACGCCACAGTTTC-3′;Jab1上游引物: 5′-GCAATCGGGTGGTAT CATAGC-3′,Jab1下游引物5′-GCAATCGGGTGGTATCATAGC-3′;Nov上游引物: 5′-TGCGGATA TTGTTCTTGTTGGA-3′,Nov下游引物: 5′-ATTGACGGTTCCTATTGGTGAC-3′.
1.6Western blot
经过慢病毒感染的细胞弃去培养基后使用PBS将培养基洗干净,加入RIPA裂解液将细胞置于冰上裂解30min,冷冻离心取上清,BCA定量后将各蛋白质裂解液用RIPA裂解液调整至统一浓度,加入适量上样缓冲液,煮沸10min后,取20μL进行SDS-PAGE电泳,电泳结束后200mA恒流转膜2h至孔径0.22μm 的PVDF膜,使用5%脱脂奶粉封闭1h,一抗(各抗体按照1∶103稀释)室温摇床孵育2h,相应二抗(1∶103稀释)室温摇床孵育1h,基因科技(上海)有限公司G-BOX显影仪显影拍照.
1.7荧光显微镜观察
Leica公司倒置荧光显微镜观察细胞,使用蓝色激发光观察绿色荧光,在200倍放大条件下选取适当视野、适当曝光时间进行拍照,保存照片.
1.85′-aza-dC处理细胞
消化对数生长期细胞铺于细胞培养皿中,按照1∶103的比例加入5′-aza-dC于细胞中,根据细胞生长情况进行换液,生长至合适密度后抽提总RNA及总蛋白质.
1.9甲基化检测和甲基化程度计算
使用shLuc、Jab1sh2和Jab1sh5慢病毒感染细胞,根据DNA甲基化检测试剂盒步骤处理细胞后进行PCR扩增反应,并回收PCR产物进行测序.在基因组DNA中,由于非甲基化的胞嘧啶(C)经过亚硫酸氢盐处理与PCR扩增后会转变为胸腺嘧啶(T);全部发生甲基化的“C”经过亚硫酸氢盐处理与 PCR 扩增后仍然为“C”;而部分发生甲基化的“C”碱基经过处理后会呈现出“C”和“T”叠加的情况(图1).前期的研究发现通过计算测序峰图中的“C”的峰高与“C”及“T”峰高之和的比值可以得出每个 CpG 位点的甲基化比例,公式如下所示:
甲基化程度=甲基化峰高/(甲基化峰高+非甲基化峰高)×100%
1.10数据处理
2 结 果
2.1慢病毒介导的Jab1基因的shRNA干扰
用制备的对照慢病毒(shLuc)和Jab1基因的shRNA干扰慢病毒(Jab1sh2和Jab1sh5)分别感染MDA231细胞,120h后使用荧光显微镜观察慢病毒干扰表达情况,并抽提相应细胞总蛋白质,进行Western blot实验,检测细胞内Jab1基因的表达水平(图2).可见光视野和荧光视野的对比结果表明(图2(a)),高于80%的细胞具有不同程度的GFP荧光强度,说明shLuc、Jab1sh2和Jab1sh5慢病毒对MDA231细胞的感染率高.Western blot检测结果表明,在蛋白质水平上Jab1基因的shRNA慢病毒干扰细胞组中的Jab1表达量显著低于对照组(图2(b)).以上结果表明,慢病毒介导的shRNA干扰使得MDA231细胞中Jab1基因的表达显著下调,乳腺癌细胞MDA231中Jab1表达干扰系统构建成功.
2.2Jab1表达干扰后人表达谱芯片筛选
使用shLuc、Jab1sh2和Jab1sh5慢病毒感染MDA231细胞后,抽提RNA反转录成cDNA后使用Illumina Bead Chip Human HF12-V4型芯片检测,总共测定1600个基因,之后根据表达差异显著程度以及基因功能筛选出了表达差异显著并且与细胞增殖迁移等相关的候选基因,包括Nov、CSF2以及DEK等,筛选结果如表1所示.
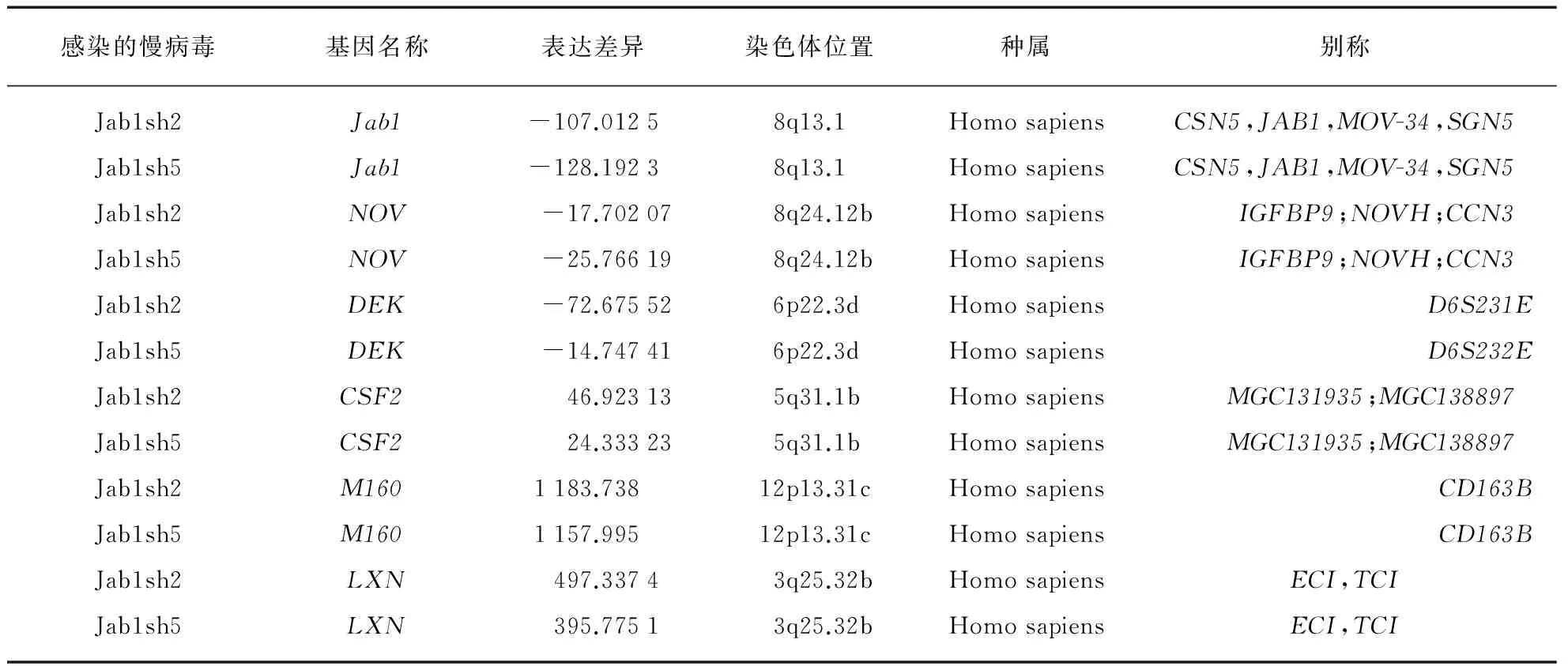
表1 MDA231细胞感染慢病毒后表达谱筛选结果
根据表达谱芯片筛选结果,进一步使用实时定量PCR验证了上述候选基因转录水平表达变化情况,结果如图3所示,在Jab1低表达(P<0.001)时Nov基因的mRNA水平发生了明显下调,并具有统计学差异(P<0.001). 根据已有的Nov基因研究报道[18-19],本研究选择了Nov基因作为Jab1调控的下游基因进一步研究.
2.3Jab1干扰表达能够下调Nov基因表达
本研究进一步对Jab1干扰表达后Nov的转录和翻译水平进行了检测.实时定量PCR结果表明,(图4(a)),Jab1表达干扰组相较于对照组细胞Jab1基因mRNA水平显著下调,同时,Nov基因mRNA表达水平也相应下调,统计结果表明Jab1表达干扰组和对照组相比,Nov的mRNA表达水平均具有极显著性差异(P<0.01).如图4(b)所示,随着MDA231细胞中Jab1蛋白表达量下降,Nov蛋白表达水平也显著下调(以β-actin作为内参),表明Jab1可在转录和翻译水平调控Nov基因的表达.
2.4Nov启动子CpG位点分析
DNA甲基化是常见的表观遗传修饰,一般多发生于CpG双核苷酸部位或CpG岛区域.已有研究表明肿瘤中许多重要功能基因的DNA甲基化水平存在明显的异常[20],进而影响基因的表达.
为进一步研究Jab1是通过何种机制调控Nov的表达,本研究对于Nov启动子3000bp 区域进行了在线CpG位点分析(www.urogene.org),结果如图5所示,启动子区域存在多个CpG位点和一个CpG岛,说明Jab1有可能会通过调控Nov基因启动子甲基化程度进而调节Nov的转录翻译表达.
于是使用DNA甲基化检测试剂盒检测了Nov基因可能转录起始位点区域(-120~+150)序列(通过网站http: ∥promotor.biosino.org/预测)有4个CpG位点的甲基化程度显著高于对照组,表示这四个CpG位点的高甲基化可能与Nov在乳腺癌细胞中受Jab1蛋白调控有关.
2.55′-aza-dC对Nov基因表达的影响
为进一步研究Jab1是否会影响Nov基因的DNA甲基化,本研究使用甲基化转移酶抑制剂5′-aza-dC分别处理Jab1干扰表达实验组和shLuc对照组,生长至合适密度后抽取总RNA和总蛋白质进行了实时定量PCR以及Western blot实验.5′-aza-dC可以直接作用于DNA上,抑制DNA甲基转移酶,使DNA甲基化水平降低.5′-aza-dC处理细胞后,Nov的转录水平增加(以DMSO为对照),并且具有统计学上的显著性差异(P<0.05),结果如图6(a)所示.Western blot检测结果(图6(b))显示,5′-aza-dC处理Jab1干扰表达实验组和shLuc对照组后,Nov的表达水平相对于未加5′-aza-dC(DMSO组)发生了上调,表明甲基化转移酶抑制剂能增加Nov的表达,使用5′-aza-dC处理后Nov的表达从显著下调变为了组间表达基本无差异,说明Jab1基因调控Nov的表达受甲基化水平的影响.
3 讨 论
已有研究表明,原癌蛋白Jab1对于多种肿瘤的发生发展具有重要作用,并且因Jab1对肿瘤抑制子的降解能力使得其也参与了其他细胞进程,例如细胞增殖、凋亡、血管增生等[21-23].而这些作用也正是将它和肿瘤的发生发展、不良预后和化疗抵抗等联系起来的重要原因.Jab1位于人染色体8q13.1,这个区域已有研究发现在乳腺癌、前列腺癌、大肠癌和子宫癌中具有过度扩增的现象,而且Jab1与具有侵染性和迁移性的癌症发生都有相关性[24-28].Nov作为CCN家族中的重要成员参与多种生理过程和病理过程,先前有研究报道Nov的异常表达常见于肿瘤中并且受到多种因素的调控,存在时间和空间特异性[19],例如在鸟视网膜神经细胞中BMP信号通路激活后可诱导Nov基因的表达,而Notch信号通路则能够降低Nov的转录和翻译水平.以上结果提示Nov在癌症中的作用和相关生物学功能也越来越受到人们的重视.
然而此前还没有研究揭示Jab1与Nov的调控关系和分子机制,因此在本次研究中,首先利用shRNA介导的慢病毒感染转移性乳腺癌细胞系MDA231,实现了Jab1基因表达的干扰.再通过人表达谱芯片筛选出一系列可能被Jab1调控的基因,并通过实时定量PCR发现Jab1基因的干扰表达能够使得与细胞增殖相关基因Nov在转录和翻译水平上都发生显著下调.
进一步,本研究探讨了使用shRNA介导的慢病毒干扰Jab1表达后引起Nov表达变化的机制,通过对Nov基因启动子分析推测Jab1低表达有可能会引起Nov基因甲基化的异常发生.使用甲基转移酶抑制剂5′-aza-dC处理Jab1干扰表达的乳腺癌细胞系,发现Jab1基因表达干扰实验组中Nov基因的转录和翻译水平表达从原来的下调变为与对照组间无明显表达差异,此结果提示我们Jab1可能是通过表观遗传学中的甲基化修饰方式来调控Nov基因的表达.下一步研究可聚焦在Jab1基因是具体通过调控Nov启动子哪个甲基化位点使得Nov基因的mRNA和蛋白质表达水平改变,并进一步通过过表达Nov基因的方法研究Nov对于乳腺癌MDA231细胞生长增殖的影响.
[1] ZHOU J, WAN B, LI R,etal. Jab1 interacts with brain-specific kinase 2(BRSK2) and promotes its degradation in the ubiquitin-proteasome pathway [J].BiochemBiophysResCommun, 2012,422(4): 647-652.
[2]YOSHIDA A, YONEDA-KATO N, PANATTONI M.etal. CSN5/Jab1 controls multiple events in the mammalian cell cycle [J].FEBSLett, 2010,584(22): 4545-4552.
[3]STRATMANN J W, GUSMAROLI G. Many jobs for one good cop-the COP9 signalosome guards development and defense [J].PlantSci, 2012,185(4): 50-64.
[4]HUA Z, VIERSTRA R D. The cullin-RING ubiquitin-protein ligases [J].AnnuRevPlantBiol, 2010,62: 299-334.
[5]KOTIGUDA G G, WEINBERG D, DESSAU M,etal. The organization of a CSN5-containing subcomplex of the COP9 signalosome [J].JBiolChem, 2012,287(50): 42031-42041.
[6]SHARON M, MAO H, STEPHENS E,etal. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality [J].Structure, 2009,17(1): 31-40.
[7]CAYLI S, EYIBILEN A, GURBUZLER L,etal. Jab1 expression is associated with TGF-beta1 signaling in chronic rhinosinusitis and nasal polyposis [J].ActaHistochem, 2012,114(1): 12-17.
[8]KOUVARAKI M A, RASSIDAKIS G Z, TIAN L,etal. Jun activation domain-binding protein 1 expression in breast cancer inversely correlates with the cell cycle inhibitor p27(Kip1) [J].CancerRes, 2003,63(11): 2977-2981.
[9]NIE W, SONG W, ZHANG W,etal. miR-1470 mediates lapatinib induced p27 upregulation by targeting c-jun [J].JCellPhysiol, 2015,230(7): 1630-1639.
[10]PORRELLO E, RIVELLINI C, DINA G,etal. Jab1 regulates Schwann cell proliferation and axonal sorting through p27 [J].JExpMed, 2014,211(1): 29-43.
[11]FUKUMOTO A, IKEDA N, SHO M,etal. Prognostic significance of localized p27(Kip1) and potential role of Jab1/CSN5 in pancreatic cancer [J].OncolRep, 2004,11(2): 277-284.
[12]FEI M, HANG Q, HOU S,etal. Adhesion to fibronectin induces p27(Kip1) nuclear accumulation through down-regulation of Jab1 and contributes to cell adhesion-mediated drug resistance (CAM-DR) in RPMI 8,226 cells [J].MolCellBiochem, 2014,386(1-2): 177-187.
[13]REN Z, HOU Y, MA S,etal. Effects of CCN3 on fibroblast proliferation, apoptosis and extracellular matrix production [J].IntJMolMed, 2014,33(6): 1607-1612.
[14]WU L, RUNKLE C, JIN H J,etal. CCN3/NOV gene expression in human prostate cancer is directly suppressed by the androgen receptor [J].Oncogene, 2014,33(4): 504-513.
[15]XING E P, NIE Y, WANG L D,etal. Aberrant methylation of p16INK4a and deletion of p15INK4b are frequent events in human esophageal cancer in Linxian, China [J].Carcinogenesis, 2009,20(1): 77-84.
[16]WANG Y, FANG M Z, LIAO J,etal. Hypermethylation-associated inactivation of retinoic acid receptor beta in human esophageal squamous cell carcinoma [J].ClinCancerRes, 2003,9(14): 5257-5263.
[17]CLEMENT G, BRAUNSCHWEIG R, PASQUIER N,etal. Alterations of the Wnt signaling pathway during the neoplastic progression of Barrett’s esophagus [J].Oncogene, 2003,25(21): 3084-3092.
[18]PARK M, BAEK I J, KIM H,etal. CCN3 overexpression inhibits growth of callosal projections via upregulation of RAB25 [J].BiochemBiophysResCommun, 2015,461(3): 456-462.
[19]RODDY K A, BOULTER C A. Targeted mutation of NOV/CCN3 in mice disrupts joint homeostasis and causes osteoarthritis-like disease [J].OsteoarthritisCartilage, 2015,23(4): 607-615.
[20]JONES P A, BAYLIN S B. The epigenomics of cancer [J].Cell, 2007,128(4): 683-692.
[21]Shackleford T J, Claret F X. Jab1/CSN5: A new player in cell cycle control and cancer [J].CellDiv, 2012,5: 26.
[22]PAN Y, YANG H, CLARET F X. Emerging roles of Jab1/CSN5 in DNA damage response, DNA repair, and cancer [J].CancerBiolTher, 2014,15(3): 256-262.
[23]WANG H, SONG W, HU T,etal. Fank1 interacts with Jab1 and regulates cell apoptosis via the AP-1 pathway [J].CellMolLifeSci, 2011,68(12): 2129-2139.
[24]OKOH V O, GARBA N A, PENNEY R B,etal. Redox signalling to nuclear regulatory proteins by reactive oxygen species contributes to oestrogen-induced growth of breast cancer cells [J].BrJCancer, 2015,112(10): 1687-1702.
[25]UDALI S, GUARINI P, RUZZENENTE A,etal. DNA methylation and gene expression profiles show novel regulatory pathways in hepatocellular carcinoma [J].ClinEpigenetics, 2015,7(1): 43.
[26]DIMOVA I, ORSETTI B, NEGRE V,etal. Genomic markers for ovarian cancer at chromosomes 1, 8 and 17 revealed by array CGH analysis [J].Tumori, 2009,95(3): 357-366.
[27]HALLSTROM T C, NEVINS J R. Jab1 is a specificity factor for E2F1-induced apoptosis [J].GenesDev, 2006,20(5): 613-623.
[28]ZHANG Y, BAYSAC K C, YEE L F,etal. Elevated DDX21 regulates c-Jun activity and rRNA processing in human breast cancers [J].BreastCancerRes, 2014,16(5): 449.
Jab1 Regulating Nov Affected by DNA Methylation in Breast Cancer Cell Line
WANG Shunni1,2,3, CHEN Hongyan1,2,3, YE Xiaojuan1,2,3, MIN Taishan1,2,3,LU Daru1,2,3, CHEN Haoming1,2,3
(1. School of Life Science, Fudan University, Shanghai 200438, China; 2. State Key LaboratoryofGeneticsEngineering,FudanUniversity,Shanghai200438,China; 3.MOEKeyLaboratoryofContemporaryAnthropology,FudanUniversity,Shanghai200438,China)
In order to study the effects of Jab1 in breast cancer, a Jab1 gene knockdown system in breast cancer cell line MDA231 was established with lentivirus mediated RNA interference. Then our study confirmed thatNovgene was regulated by Jab1 through human expression microarray and Real-Time PCR. Moreover, the knockdown of Jab1 decreased the expression level of mRNA and protein ofNovgene. Moreover, 4 CpG sites ofNovpromotor have high methylation rates. The expression level ofNovgene had no significant difference after adding methyltransferase inhibitor 5′-aza-dC in Jab1 knockdown cell lines comparing to the expression ofNovdown regulated in Jab1 knockdown cell lines without inhibitor which indicats that Jab1 may regulateNovgene through epigenetics.
breast cancer; Jab1; methylation;Nov
0427-7104(2016)01-0112-07
2015-05-05
国家自然科学基金(81071739,81272385)
王顺妮(1989—),女,硕士研究生;陈浩明,男,副教授,E-mail: hmchen@fudan.edu.cn.
R 737.9
A
