微囊藻胶鞘多糖和水溶性胞外多糖的化学特性*
2016-09-01陈毛珍谢梅娟喻富根李朋富
陈毛珍,谢梅娟,巫 伟,喻富根,李朋富
(南京大学生命科学学院,南京 210093)
微囊藻胶鞘多糖和水溶性胞外多糖的化学特性*
陈毛珍,谢梅娟,巫伟,喻富根,李朋富**
(南京大学生命科学学院,南京 210093)
微囊藻(Microcystis)产生大量胞外多糖(EPS),包括包裹在细胞外的胶鞘多糖(CPS)和释放到周围环境中的水溶性多糖(RPS).为探究EPS在蓝藻水华发生中的生理生态学意义,迫切需要了解微囊藻EPS的化学特性.本文从太湖分离群体微囊藻,经过大约18个月实验室培养后,其中一些藻株转变为单细胞形态.选择5株群体藻和4株单细胞藻,比较分析这些藻株EPS的化学特性发现:(1)所有9株藻的EPS均为含有脱氧己糖的酸性杂多糖;(2)所有9株藻的CPS的糖醛酸含量(1.2%~2.1%)均低于RPS的糖醛酸含量(2.4%~6.2%);(3)所有9株藻的EPS均含有乙酰基和硫酸基,其中,每一株藻CPS的乙酰基含量均高于RPS的乙酰基含量,所有群体藻CPS的乙酰基含量(4.1%~6.6%)高于所有单细胞藻CPS的乙酰基含量(2.0%~3.2%).本文进而讨论了EPS化学特性对EPS水溶性和微囊藻群体形成的影响,以及对其生态学作用的影响.在这些化学特性中,乙酰取代基团被认为可能是影响微囊藻EPS生理生态学作用的重要因素.
微囊藻;胞外多糖;乙酰基;疏水性;群体形成
蓝藻水华是危害公共健康和环境安全的全球性问题.微囊藻(Microcystis)是在湖泊和水库中形成蓝藻水华的最常见藻类.与其他蓝藻一样,微囊藻产生大量胞外多糖(EPS),其中包括粘附在细胞外的胶鞘多糖(capsular polysaccharide,CPS)和释放到周围环境中的水溶性多糖(water-soluble released polysaccharide,RPS)[1].据报道,英国Cheshire郡一个富营养化淡水湖泊中,其变温层(epilimnion)中的微囊藻胞外多糖粘液层占湖水总体积的0.0001%~0.007%,在水华暴发高峰期,细胞多糖粘液层达到湖水总体积的0.06%[2].大量存在的微囊藻EPS影响水环境中的微生物丰度和多样性、有机颗粒(organic aggregates)形成、碳循环和金属元素循环[3-4].
众所周知,在自然界中微囊藻主要以群体形态存在,细胞因多糖粘液层包裹而成为群体[5].然而,在实验室中长期培养后,微囊藻丧失群体特性,主要以单细胞形态存在[6].群体的形成有利于微囊藻垂直迁移和抵御浮游动物的摄食[7].此外,群体微囊藻比单细胞微囊藻拥有更高效的光合电子传递系统,有更高的低磷水平亲和力和较高的防御溶藻细菌的能力[8-10].研究表明浮游动物摄食和藻菌相互作用可能是影响群体形成的重要因素[11-12].此外,微囊藻细胞表面疏水性可能在细胞间粘附和群体形成中发挥重要作用,而细胞疏水性与细胞表面多糖相关[13].
到目前为止,对微囊藻EPS化学特性的了解较少.已有报道显示,微囊藻EPS的单糖组成具有藻株特异性,并且多为酸性杂多糖[4,14-17].为了探究微囊藻EPS在蓝藻水华发生过程中的作用,迫切需要对EPS的化学特性进行更多更深入的研究.本文对群体微囊藻和单细胞微囊藻CPS和RPS的化学特性进行比较研究,并讨论EPS化学特性与其生理生态作用的相关性.
1 材料与方法
1.1蓝藻分离与培养
2011年8月从太湖采集微囊藻水华样品,在显微镜下观察并进行形态学分类鉴定[18],用微量进样器枪头挑取单个微囊藻群体,经过无菌水洗涤后用BG11培养基在试管中进行培养[19],随后转入50 ml三角瓶中继续培养.实验室培养约18个月后,有些藻株保持群体形态,而一些藻株失去群体特性以单细胞形态存在.本文选择5株群体藻和4株单细胞藻用于实验.5株群体藻为惠氏微囊藻(M.wesenbergii)H4和H16、坚实微囊藻(M.firma)H54、铜绿微囊藻(M.aeruginosa)H169和水华微囊藻(M.flos-aquae)H183,4株单细胞藻为惠氏微囊藻H50和H2、坚实微囊藻H43和铜绿微囊藻H177.所选藻株在3 L三角瓶中培养,培养时连续通入过滤空气.培养温度为25℃,光照强度为2500 lx,光暗周期比为12 h∶12 h.
1.2多糖的提取
微囊藻培养30 d后进入稳定期,7000 转/min离心收集含RPS的上清液,并依次用0.45和0.22 μm的微孔滤膜过滤.将滤液转移到截留分子量为7000 Dalton的透析袋中,在蒸馏水中4℃透析72 h,随后45℃减压蒸馏浓缩.CPS从沉淀的藻细胞中提取,用0.05% NaCl溶液重悬藻细胞,60℃水浴30 min[20].随后离心收集含CPS的上清液,过滤、透析和浓缩的方法同上.由于冷冻干燥的多糖在水中不能完全溶解,因此直接将一部分浓缩后的多糖用于测定蛋白质、糖醛酸和取代基团含量.另一部分浓缩后的多糖溶液在测定体积后,冷冻干燥、称重,并计算浓缩多糖溶液中RPS或CPS含量.
1.3单糖组成分析
1.3.1中性单糖组成分析冷冻干燥的多糖用2 M三氟乙酸在120℃下水解3 h,水解产物用过滤空气吹干后,按照李铁林等的方法进行糖腈衍生化[21],加入10 mg盐酸羟胺和0.5ml吡啶,90℃水浴30 min并振荡,取出后冷却至室温,加入0.5ml醋酸酐,在90℃下继续反应30 min进行乙酰化,反应完成后进行气相色谱分析.单糖标准品处理同上.然后用气相液相色谱法定性和定量分析,仪器为HP-6890气相色谱仪,色谱柱为HP-55%苯甲基硅烷(30 m×0.25 mm×0.25 μm);流量为1.2ml/min;进样温度为260℃;程序升温:146℃保留2 min,从146℃以2℃/min升温到210℃,从210℃以30℃/min升温到280℃;FID检测器,检测温度300℃,载气为氮气;进样量为1 μl.
1.3.2酸性单糖定性分析干燥后的多糖水解产物加入1-苯基-3-甲基-5-吡唑啉酮进行衍生化反应[22],衍生产物使用氯仿萃取2次,最终得到的水相产物用高效液相色谱(HPLC)法分析,HPLC色谱柱:ZORBAX SB-C18(150 mm×4.6mm);流动相:0.1mol/L磷酸盐缓冲液-乙腈(V∶V=83∶17);流速:0.7ml/min;柱温:30℃;检测波长:245 nm.
1.4蛋白质、糖醛酸和取代基团含量的测定
蛋白质含量用Bradford方法测定,标样采用牛血清白蛋白[23].糖醛酸含量的分析按照Blumenkrantz等[24]的方法,多糖溶液与四硼酸钠硫酸溶液反应后,进一步与间羟联苯反应,反应产物在520 nm处测定光吸收值,以葡萄糖醛酸为标样.乙酰基含量利用多糖中的乙酰基与碱性羟胺反应生成乙酰氧肟酸(acetohydroxamic acid)进行测定,以葡萄糖五乙酸酯为标样[25].丙酮酸含量分析通过多糖酸水解(1 N HCl,6 h,100℃)释放的丙酮酸转化为2,4-二硝基苯肼衍生物后进行测定,以丙酮酸为标样[26].硫酸基团含量通过多糖酸水解后释放的硫酸基团与氯化钡反应生成硫酸钡进行测定,以硫酸钾为标样[27].
1.5蓝藻细胞疏水性分析
蓝藻细胞表面疏水性采用细菌粘附于碳氢化合物(BATH)方法进行测定[28].测定细胞疏水性前,先用超声波处理微囊藻群体(80 W,20 Hz,1 min)[13].离心收集藻细胞,用磷酸盐缓冲液(PBS,10 mmol/L,pH 7.2)洗涤两次并重悬于PBS中至OD560≈0.9.取5 ml洗涤后的细胞悬浮液加2 ml二甲苯于试管中涡旋混合1 min.静置10 min,测定下层水相OD560.蓝藻的疏水性表示为:(ODi-ODf)/ODi×100,其中ODi和ODf分别是最初和最终的细胞悬浮液OD560.
2 实验结果.
2.1单糖组成、糖醛酸和蛋白质含量
从太湖分离到的群体微囊藻经过大约18个月的实验室培养后出现3类不同的形态:有的藻株完全转变为单细胞形态,一些藻株转变为单细胞和群体共存的状态,有的藻株仍以群体形态存在.为了提取多糖而进行通气培养后发现,群体微囊藻在通气搅拌培养后出现了2类形态:有的变成了单细胞和群体共存的状态,而有的仍以群体形态存在.这说明在实验室培养过程中微囊藻群体的稳定性有差异,本文试图通过CPS化学特性的比较分析来探讨导致群体稳定性差异的原因.微囊藻H4、H16、H54、H169和H183都是在通气培养后仍然全部以群体形态存在的藻株,是群体稳定性较高的藻株.微囊藻H50、H2、H43和H177是在培养过程中全部以单细胞形态存在的藻株,是由群体很不稳定的微囊藻藻株转变而来的.
群体微囊藻的CPS和RPS中含有7~9种单糖,单细胞微囊藻的CPS和RPS中含有7~8种单糖(表1、2).所有微囊藻的CPS和RPS中都含有蛋白质、脱氧己糖(岩藻糖和/或鼠李糖)和酸性己糖(葡萄糖醛酸和/或半乳糖醛酸),都含有鼠李糖、甘露糖、葡萄糖、半乳糖和葡萄糖醛酸(表1、2和3).对于CPS和RPS,不同的微囊藻藻株间单糖组成存在差异.其中,脱氧己糖岩藻糖在微囊藻H16中缺乏,戊糖阿拉伯糖在微囊藻H50中缺乏,戊糖木糖在微囊藻H2、H43和H177中缺乏,半乳糖醛酸在4个藻株(H16、H183、H169和H50)中缺乏,另外,阿拉伯糖也在藻株H183的CPS中缺乏.比较同一株藻的CPS和RPS发现,除了藻株H183以外,同一株藻CPS和RPS含有的单糖种类是相同的,但是,从单糖摩尔比看,它们的组成都不同.对于每个微囊藻藻株,CPS的蛋白质含量比RPS的高,而CPS中糖醛酸含量(1.2%~2.1%)低于RPS的糖醛酸含量(2.4%~6.2%)(表3).比较群体藻(5株)和单细胞藻(4株)的单糖组成、糖醛酸和蛋白质含量,不管是RPS还是CPS,都没有发现规律性的差异.
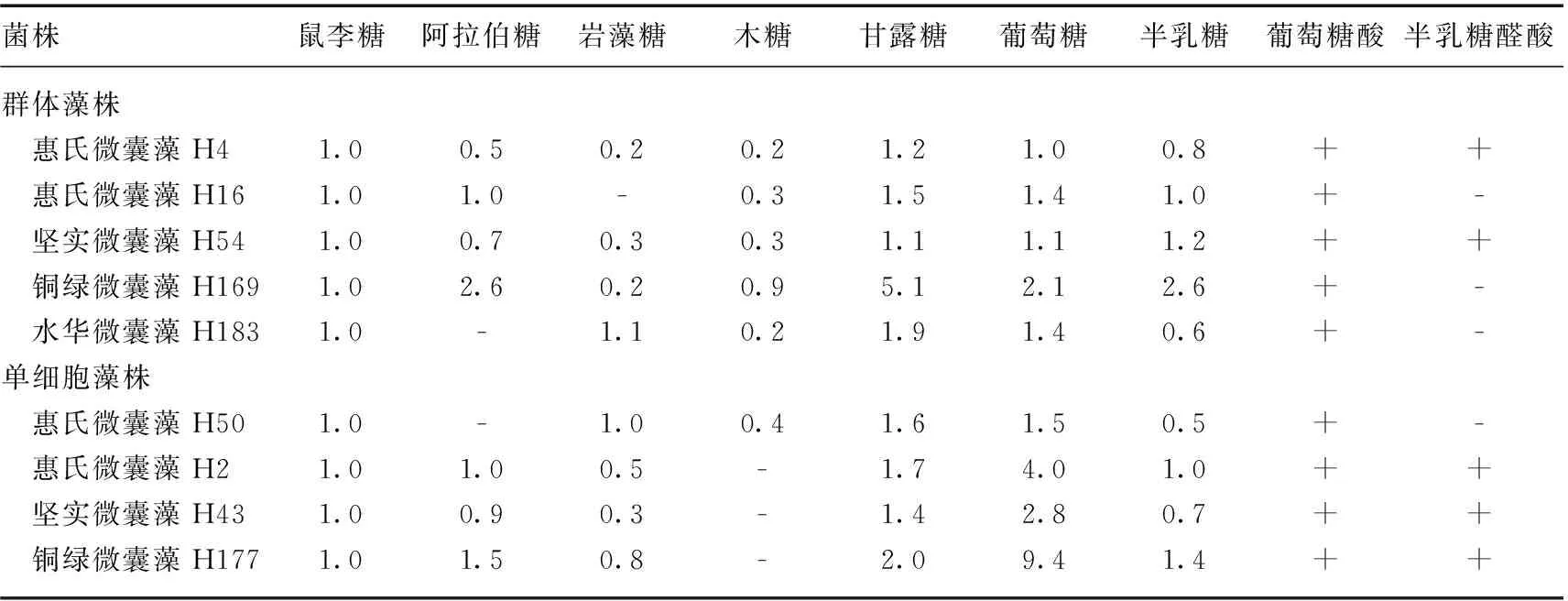
表1 群体和单细胞微囊藻CPS单糖组成*
*数据为摩尔比率;+表示存在,-表示不存在,下同.
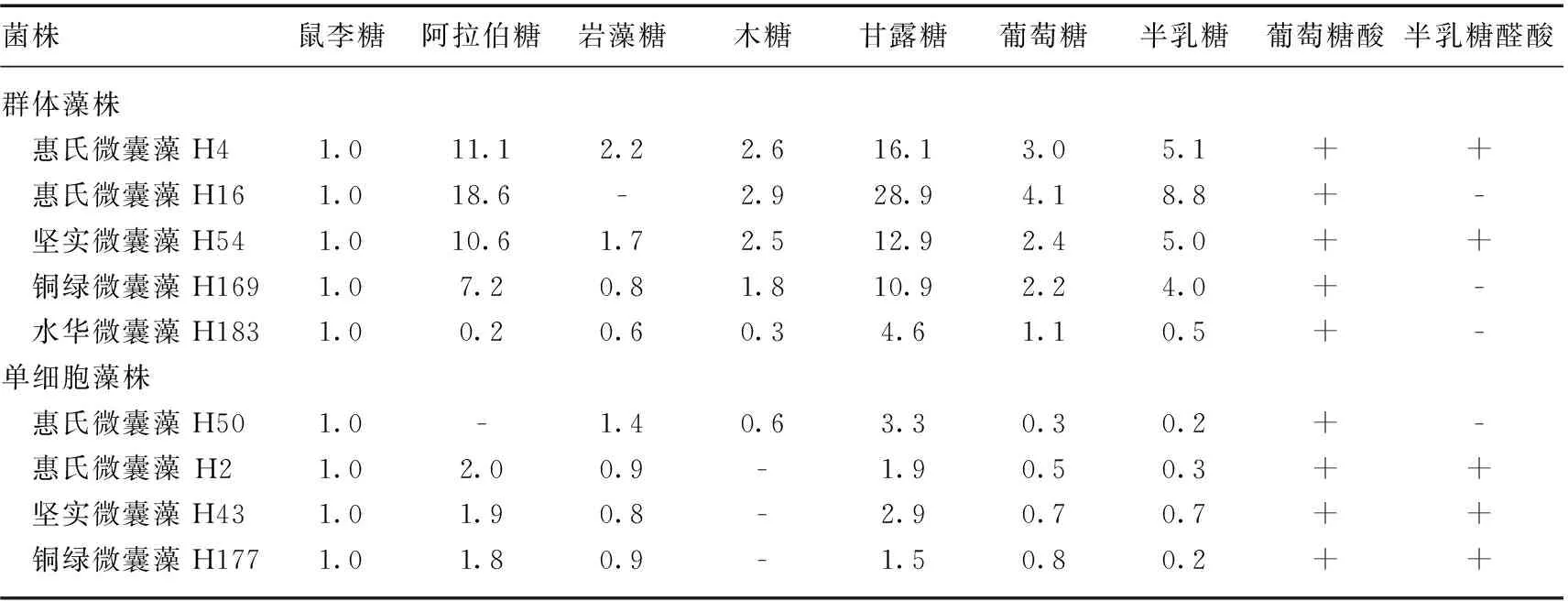
表2 群体和单细胞微囊藻RPS单糖组成

表3 群体和单细胞微囊藻CPS和RPS中蛋白质、糖醛酸和取代基团含量*
*数据为Wt/CPS干重,Wt/RPS干重(%)(mean±SE,n=3);-表示不存在.
2.2取代基团含量和疏水性
所有微囊藻CPS和RPS都含有乙酰基和硫酸基.除4个藻株(H4、H16、H50和H2)的CPS和藻株H50的RPS外,其它多糖中都含有丙酮酸(表3).群体藻CPS的乙酰基含量(4.1%~6.6%)均高于其RPS的乙酰基含量(1.1%~2.4%),单细胞藻CPS的乙酰基含量(2.0%~3.2%)也均高于其RPS的乙酰基含量(0.5%~1.1%).除水华微囊藻H183、惠氏微囊藻H50和铜绿微囊藻H177外,其余微囊藻CPS的丙酮酸含量均比RPS低.除惠氏微囊藻H16外,各微囊藻CPS的硫酸基团含量均比RPS的高.群体微囊藻CPS的乙酰基含量(4.1%~6.6%)总体高于单细胞藻CPS的乙酰基含量(2.0%~3.2%).群体微囊藻表现出较高的疏水性(惠氏微囊藻H4、惠氏微囊藻H16、坚实微囊藻H54、铜绿微囊藻H169和水华微囊藻H183的疏水性分别为66.4%±2.0%、81.6%±1.6%、59.9%±2.0%、63.1%±3.3%和68.7%±1.5%),而实验中发现单细胞微囊藻均保留在水相中,疏水性数值都为0,表现出亲水性.这说明群体微囊藻细胞表面是疏水的,而单细胞藻的细胞表面是亲水的.
3 讨论
3.1微囊藻EPS的化学特性
本研究中所有的CPS和RPS均为酸性杂多糖,这与以前的报道一致.Nakagawa等[14]报道群体铜绿微囊藻(M.aeruginosaK-3A)的CPS含有12.8%的蛋白质和8种单糖(半乳糖醛酸、鼠李糖、木糖、葡萄糖、阿拉伯糖、岩藻糖、甘露糖和半乳糖).Plude等[15]的研究表明群体水华微囊藻(M.flos-aquaeC3-40)的CPS包含6种单糖(半乳糖、葡萄糖、木糖、甘露糖、鼠李糖和半乳糖醛酸).Forni等[16]发现6个单细胞微囊藻株的CPS和RPS均为酸性杂多糖.Li等[3]发现微囊藻水华样品中的CPS含有5.4%的蛋白质和7种单糖(葡糖醛酸、半乳糖醛酸、鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖).还有研究表明实验室培养和野外生长的微囊藻的CPS冷冻干燥后,在水中的溶解度都很低[3,14-15].本研究也显示冻干的EPS在水中溶解度很低.此外,本研究中EPS含有脱氧己糖、蛋白质、乙酰基、丙酮酸和硫酸基,与其他一些蓝藻的EPS一致[1].已有报道显示,一株铜绿微囊藻的RPS含有硫酸基[17],本文结果显示在惠氏微囊藻、水华微囊藻、坚实微囊藻的EPS中也存在硫酸基.
3.2EPS化学特性对其水溶性的影响及对群体形成的作用
群体微囊藻细胞有较高的疏水性,而单细胞微囊藻表现为亲水性,这与之前的报道一致[13].细胞疏水性被认为与表面多糖相关,群体微囊藻细胞表现出疏水性表明包裹在细胞表面的CPS应该是具有较强的疏水性.由于EPS中乙酰基团、蛋白质和脱氧己糖(如岩藻糖和鼠李糖)的存在,使一些蓝藻的EPS具有显著的疏水性[1].本文的结果显示每个微囊藻株CPS的蛋白质含量均比RPS高(表1、2),然而,Yang等的报道显示蛋白水解酶处理对细胞疏水性并没有影响[13],这表明蛋白质可能不是影响微囊藻CPS疏水性和细胞疏水性的因素.脱氧己糖岩藻糖和鼠李糖的存在有可能是微囊藻EPS具备疏水性的一个因素(表1、2),而Vieira等研究表明对于形成聚集体的硅藻颗粒直链藻(Aulacoseiragranulate),其EPS中56.1%的末端单糖是岩藻糖和鼠李糖,表明末端脱氧己糖可能对增加EPS疏水性和粘附性有重要作用[29],为了了解脱氧己糖对微囊藻EPS疏水性的影响,需要进一步分析其化学结构来确定脱氧糖是否处在多糖分子的末端.
已有研究证实乙酰取代基团能够改变多糖的物理化学性质.乙酰化程度低的木聚糖能完全溶于水,而高度乙酰化的木聚糖则不能溶于水,脱乙酰基的木聚糖能与更多的水分子通过氢键结合,因而能更好地溶于水[30].不溶性的壳多糖(chitin)经脱乙酰后生成了水溶性的几丁聚糖(chitosan)[31].在本研究中,RPS乙酰基含量较低,可能是导致其相对较高的水溶性并溶解在培养基中的一个重要因素.相反,CPS的乙酰基含量较高,可能是导致其相对较高的疏水性以及粘附在细胞表面的一个重要因素.
已有研究也显示微生物EPS的乙酰基对细胞聚集似乎是必不可少的.在形成微生物膜(biofilm)的早期阶段,能产生乙酰化海藻酸的野生型铜绿假单胞菌(Pseudomonasaeruginosa)形成小的群体,而乙酰化缺陷型细菌不形成小群体[32].荧光假单胞菌(PseudomonasfluorescensSBW25)细胞表层粘液中纤维素的乙酰化也是其形成微生物膜的必要条件[33],可以推测微生物EPS的乙酰取代基决定了EPS的粘附性和凝结特性,并决定微生物膜的结构[32].本文结果显示,群体微囊藻CPS乙酰基含量高于单细胞微囊藻CPS乙酰基含量,表明群体微囊藻CPS疏水性和粘附性可能会更高.另外,据报道,群体微囊藻CPS层也比单细胞微囊藻CPS层厚[34].因此,群体微囊藻通过CPS介导的细胞间联结可能是牢固的,从而导致细胞被固定于群体内.单细胞藻可能不能建立牢固的细胞间联结,从而无法形成群体.综合本文的结果以及文献报道可以推测,微囊藻CPS中乙酰基含量可能是影响其疏水性和粘附性的一个重要因素,CPS中的乙酰基可能影响微囊藻群体的形成和稳定性.
乙酰取代基团能阻碍糖苷水解酶水解多糖,抑制植物细胞壁多糖的酶解[35],并增强植物细胞壁对入侵微生物的防御能力[36].铜绿假单胞菌胞外多糖海藻酸(alginate)脱乙酰后,海藻酸裂解酶的水解作用提高了15倍[37].群体微囊藻CPS含有较高含量的乙酰基,有可能会阻碍糖苷水解酶将其解聚.虽然群体微囊藻有许多附生的异养细菌[12],但是细菌对CPS的利用有可能是缓慢的.
多糖侧链存在糖醛酸或丙酮酸有利于多糖溶于水[38].RPS的糖醛酸含量比CPS的高(表3),较高的糖醛酸含量有可能会促进RPS在培养基中溶解.但是,RPS和CPS的化学结构是未知的,不清楚糖醛酸和丙酮酸是否位于多糖侧链,因此关于糖醛酸和丙酮酸含量对RPS和CPS溶解度的影响还需要进一步研究.
3.3EPS在水环境中的生态学作用
水体中细菌群落能够降解微囊藻的EPS[39].由于乙酰取代基能抑制多糖的酶降解[33],微囊藻EPS中乙酰基的存在有可能会抑制细菌的降解作用,而微囊藻CPS和RPS的乙酰基含量不同,有可能导致二者对微生物降解的敏感性不同.糖醛酸、硫酸基和丙酮酸的存在赋予EPS阴离子特性,使EPS对金属离子具有亲和力[1].由于糖醛酸、硫酸基和丙酮酸在微囊藻CPS和RPS中的含量不同,也有可能导致CPS和RPS螯合金属离子能力有差异.另外,微囊藻EPS化学特性影响其物化特性,比如乙酰基含量影响其疏水特性,从而也有可能影响其形成有机颗粒的能力.EPS化学特性对其生态学作用的影响有待进一步深入具体地研究.
4 结论
本文对群体和单细胞微囊藻CPS和RPS的化学特性进行比较研究,这是关于微囊藻EPS的乙酰基和丙酮酸的首次报道.研究表明,所有的EPS均为含有脱氧己糖的酸性杂多糖.对于每个微囊藻株,其CPS的糖醛酸含量均比RPS低,而CPS的乙酰基含量均比RPS高.此外,群体微囊藻CPS的乙酰基含量比单细胞微囊藻CPS高.EPS中还含有蛋白质和硫酸基团.这些数据将有助于理解微囊藻EPS在蓝藻水华形成中的生理生态学作用.基于本文的研究可以推测,乙酰取代基可能是影响EPS水溶性的重要因素,也是影响EPS在群体形成中的作用以及其生态学作用的重要因素.
[1]Pereira S, Zille A, Micheletti Eetal. Complexity of cyanobacterial exopolysaccharides: composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly.FEMSMicrobiologyReviews, 2009, 33(5): 917-941.
[2]Tien CJ, Krivtsov V, Levado Eetal. Occurrence of cell-associated mucilage and soluble extracellular polysaccharides in Rostherne Mere and their possible significance.Hydrobiologia, 2002, 485(1/2/3): 245-252.
[3]Li PF, Cai YF, Shi LMetal. Microbial degradation and preliminary chemical characterization ofMicrocystisexopolysaccharides from a cyanobacterial water bloom of Lake Taihu.InternationalReviewofHydrobiology, 2009, 94(6): 645-655.
[4]蔡元峰, 施丽梅, 李朋富等. 与微囊藻胞外多糖降解相关的微生物菌群分析. 湖泊科学, 2009, 21(3): 369-374. DOI 10.18307/2009.0309.
[5]Otsuka S, Suda S, Li Retal. Morphological variability of colonies ofMicrocystismorphospecies in culture.JournalofGeneralandAppliedMicrobiology, 2000, 46(1): 39-50.
[6]Zhang M, Kong FX, Tan Xetal. Biochemical, morphological and genetic variations inMicrocystisaeruginosadue to colony disaggregation.WorldJournalofMicrobiologyandBiotechnology, 2007, 23(5): 663-670.
[7]Fulton RSIII, Paerl HW. Effects of colonial morphology on zooplankton utilization of algal resources during blue-green algal (Microcystisaeruginosa) blooms.LimnologyandOceanography, 1987, 32(3): 634-644.
[8]Shen H, Song LR. Comparative studies on physiological responses to phosphorus in two phenotypes of bloom-formingMicrocystis.Hydrobiologia, 2007, 592(1): 475-486.
[9]Wu ZX, Song LR. Physiological comparison between colonial and unicellular forms ofMicrocystisaeruginosaKÜTZ (Cyanobacteria).Phycologia, 2008, 47(1): 98-104.
[10]Wang XY, Xie MJ, Wu Wetal. Differential sensitivity of colonial and unicellularMicrocystisstrains to an algicidal bacteriumPseudomonasaeruginosa.JournalofPlanktonResearch, 2013, 35(5): 1172-1176.
[11]Yang Z, Kong, FX, Shi XLetal. Changes in the morphology and polysaccharide content ofMicrocystisaeruginosa(cyanobacteria) during flagellate grazing.JournalofPhycology, 2008, 44(3): 716-720.
[12]Shen H, Niu Y, Xie Petal. Morphological and physiological changes inMicrocystisaeruginosaas a result of interactions with heterotrophic bacteria.FreshwaterBiology, 2011, 56(6): 1065-1080.
[13]Yang HL, Cai YF, Xia Metal. Role of cell hydrophobicity on colony formation inMicrocystis(Cyanobacteria).InternationalReviewofHydrobiology, 2011, 96(2): 141-148.
[14]Nakagawa M, Takamura Y, Yagi O. Isolation and characterization of the slime from a cyanobacterium,MicrocystisaeruginosaK-3A.AgriculturalandBiologicalChemistry, 1987, 51(2): 329-337.
[15]Plude JL, Parker DL, Schommer OJetal. Chemical characterization of polysaccharide from the slime layer of the cyanobacteriumMicrocystisflos-aquaeC3-40.AppliedandEnvironmentalMicrobiology, 1991, 57(6): 1696-1700.
[16]Forni, C, Telo FR, Caiola G. Comparative analysis of the polysaccharides produced by different species ofMicrocystis(Chroococcales, Cyanophyta).Phycologia, 1997, 36(3): 181-185.
[17]梅秋红, 缪月秋, 张成武等. 铜绿微囊藻(Microcystisaeruginosavarmajor)胞外酸性多糖的分离、纯化及其理化特性. 湖泊科学, 2005, 17(4): 322-326. DOI 10.18307/2005.0407.
[18]虞功高, 宋立荣, 李仁辉. 中国淡水微囊藻属常见种类的分类学讨论——以滇池为例. 植物分类学报, 2007, 45(5): 727-741.
[19]Rippka R. Isolation and purification of cyanobacteria.MethodsinEnzymology, 1988, 167: 3-27.
[20]Xu HC, Cai HY, Yu GHetal. Insights into extracellular polymeric substances of cyanobacteriumMicrocystisaeruginosausing fractionation procedure and parallel factor analysis.WaterResearch, 2013, 47(6): 2005-2014.
[21]李铁林, 吴昌贤, 张燕霞. 糖和糖醇的气相色谱分析研究Ⅱ糖腈乙酰酯衍生物气相色谱分析的改进. 分析化学, 1982, 10(5): 272-276.
[22]Strydom DJ. Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone-derivatized neutral, acidic and basic aldoses.JournalofChromatographyA, 1994, 678(1): 17-23.
[23]Bradford MM. Rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.AnalyticalBiochemistry, 1976, 72(1/2): 248-254.
[24]Blumenkrantz N, Asboe-Hansen G. New method for quantitative determination of uronic acids.AnalyticalBiochemistry, 1973, 54(2): 484-489.
[25]McComb EA, McCready RM. Determination of acetyl in pectin and in acetylated carbohydrate polymers hydroxamic acid reaction.AnalyticalBiochemistry, 1957, 29(5): 819-821.
[26]Sloneker JH, Orentas DG. Pyruvic acid, a unique component of an exocellular bacterial polysaccharide.Nature, 1962, 194(4827): 478-479.
[27]Dodgson KS, Price RG. A note on the determination of the ester sulphate content of sulphated polysaccharides.BiochemicalJournal, 1962, 84(1): 106-110.
[28]Fattom A, Shilo M. Hydrophobicity as an adhesion mechanism of benthic cyanobacteria.AppliedandEnvironmentalMicrobiology, 1984, 47(1): 135-143.
[29]Vieira AAH, Ortolano PIC, Giroldo Detal. Role of hydrophobic extracellular polysaccharide ofAulacoseiragranulata(Bacillariophyceae) on aggregate formation in a turbulent and hypereutrophic reservoir.LimnologyandOceanography, 2008, 53(5): 1887-1899.
[30]Pawar PMA, Koutaniemi S, Tenkanen Metal. Acetylation of woody lignocellulose: significance and regulation.FrontersinPlantScience, 2013, 4: 118.
[31]Rinaudo M. Role of substituents on the properties of some polysaccharides.Biomacromolecules, 2004, 5(4): 1155-1165.
[32]Tielen P, Strathmann M, Jaeger KEetal. Alginate acetylation influences initial surface colonization by mucoidPseudomonasaeruginosa.MicrobiologicalResearch, 2005, 160(2): 165-176.
[33]Spiers AJ, Bohannon J, Gehrig SMetal. Biofilm formation at the air-liquid interface by thePseudomonasfluorescensSBW25 wrinkly spreader requires an acetylated form of cellulose.MolecularMicrobiology, 2003, 50(1): 15-27.
[34]Zhang M, Shi XL, Yu Yetal. The acclimative changes in photochemistry after colony formation of the cyanobacteriaMicrocystisaeruginosa.JournalofPhycology, 2011, 47(3): 524-532.
[35]Gille S, Pauly M. O-acetylation of plant cell wall polysaccharides.FrontersinPlantScience, 2012, 3: 12.
[36]Biely P. Microbial carbohydrate esterases deacetylating plant polysaccharides.BiotechnologyAdvances, 2012, 30(6): 1575-1588.
[37]Sutherland IW. Polysaccharide lyases.FEMSMicrobiologyReviews, 1995, 16(4): 323-347.
[38]Sutherland IW. Structure-function relationships in microbial exopolysaccharides.BiotechnologyAdvances, 1994, 12(2): 393-448.
[39]Yang Z, Kong FX, Zhang Metal. Effect of filtered cultures of flagellateOchromonassp. on colony formation inMicrocystisaeruginosa.InternationalReviewofHydrobiology, 2009, 94(2): 143-152.
Chemical characteristics of capsular polysaccharide and water-soluble released exopolysaccharide from Microcystis
CHEN Maozhen, XIE Meijuan, WU Wei, YU Fugen & LI Pengfu**
(SchoolofLifeSciences,NanjingUniversity,Nanjing210093,P.R.China)
Microcystisspp. produces large amounts of exopolysaccharides (EPSs) including capsular polysaccharides (CPSs) which form mucilaginous matrix around the cells, and water-soluble released polysaccharides (RPSs). To understand their ecophysiological roles in cyanobacterial bloom, we urgently need more information on chemical characters of EPS. In this paper, colonialMicrocystisstrains were isolated from Lake Taihu. After incubation for about 18 months in the lab, some strains turned to be unicellular form. The comparative study of chemical characteristics of EPSs from five colonial strains and four unicellular strains showed that (1) all the EPSs were acidic heteropolysaccharides containing the deoxyhexoses; (2) the uronic acid content was lower in CPS (1.2%-2.1%) than in RPS (2.4%-6.2%) for allMicrocystisstrains; (3) acetate and sulfate groups were present in all EPSs, of which the acetate content was higher in CPS than in RPS for each strain, and higher in CPSs (4.1%-6.6%) of all colonial strains than in CPSs (2.0%-3.2%) of all unicellular strains. The chemical characteristics of EPS were discussed with respects in the solubility of EPS in water, the roles in colony formation and the ecological roles in the aquatic environments. It was thought that among these chemical characteristics, acetyl substitution might be an important factor affecting the ecophysiological roles of EPS in cyanobacterial bloom.
Microcystis; exopolysaccharide; acetyl group; hydrophobicity; colony formation
J.LakeSci.(湖泊科学), 2016, 28(3): 609-615
10.18307/2016.0317
©2016 byJournalofLakeSciences
*国家自然科学基金项目(31270447)和国家重点基础研究发展计划“973”项目(2008CB418004)联合资助. 2015-07-28收稿;2015-08-14收修改稿. 陈毛珍(1989~), 女, 硕士研究生; E-mail: cmz0370@163.com.
**通信作者;E-mail: pengfuli@nju.edu.cn.
