鄱阳湖河湖转换期间鱼腥藻(Anabaena)的变化*
2016-09-01钱奎梅齐凌艳陈宇炜
钱奎梅,刘 霞,齐凌艳,陈宇炜**
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)(2:徐州工程学院环境工程学院,徐州 221111)
鄱阳湖河湖转换期间鱼腥藻(Anabaena)的变化*
钱奎梅1,2,刘霞1,齐凌艳1,陈宇炜1**
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)(2:徐州工程学院环境工程学院,徐州 221111)
鄱阳湖作为我国长江目前仅存的两个通江湖泊之一,年内水位变幅巨大. 通过在鄱阳湖2013年河湖转换期间(5-11月)对鄱阳湖主航道都昌段进行每月3~4次的高频监测,以考察鄱阳湖水体中鱼腥藻(Anabaena)的动态变化,分析鄱阳湖中鱼腥藻生长并占优势的影响因素. 结果表明,蓝藻为鄱阳湖浮游植物的次级优势种,8月蓝藻生物量平均占浮游植物生物量的57%,蓝藻取代硅藻成为暂时的优势种. 夏、秋季水华蓝藻以固氮鱼腥藻为主,主要与夏、秋季水温较高以及适宜的营养盐条件等有关. 研究期间鄱阳湖水体氮磷比平均在15左右,鱼腥藻能够产生有固氮能力的异形胞,并在水华蓝藻中成为优势种,也反映了鄱阳湖某些湖区存在氮相对缺乏的阶段.
鄱阳湖;鱼腥藻;河湖转换
蓝藻是最简单、最原始的单细胞生物. 固氮蓝藻是蓝藻中具有明显固氮能力的种类,当水体中氮浓度较低时,可通过其细胞中固氮酶的作用将大气中游离态的分子氮还原成可供植物利用的氮素化合物,从而增加水体中的初级生产力. 鱼腥藻是一种丝状体固氮蓝藻,在氮源缺乏的情况下,大约每隔10 个营养细胞形成1个异形胞[1]. 异形胞可以直接固定大气中的N2(分子态),形成藻细胞可以利用的氮素化合物. 当水体氮浓度降低而磷浓度不按比例降低时会导致水体的氮磷比降低,最终导致可以适应氮缺乏条件的初级生产者即固氮蓝藻的出现[2]. Liao[3]的研究认为随着氮的添加,不具有固氮作用的种类会占优势,但是当没有外源氮(比如硝态氮)输入时,具有固氮作用的种类会占优势. 低的氮磷比促使浮游植物优势种类朝固氮蓝藻方向转变[4-5],但是固氮藻类只在强光照条件下才出现优势,而非固氮蓝藻的密度与氮磷比没有关系[3]. Smith[6]通过对分布于世界各处的17个湖泊中正值生长季节的藻类和营养盐的分析,认为水体中固氮蓝藻的比例与水体中总氮、总磷质量比(TN/TP)有关,当TN/TP超过29时往往会出现蓝藻很少的情况.
2007-2011年发现鄱阳湖部分湖区出现大群体的蓝藻聚集,2013年和2014年鄱阳湖蓝藻水华分布区域较前几年有大范围增加,夏、秋季是鄱阳湖蓝藻水华发生的主要季节. 在对鄱阳湖浮游植物样品分析中发现,硅藻为鄱阳湖浮游植物的优势种,水华蓝藻生物量及相对生物量呈增加的趋势,水华蓝藻优势种主要包括鱼腥藻(Anabaena)、微囊藻(Microcystis)等[7],鱼腥藻在2009-2014年鄱阳湖湖区中全年可见. 由于鱼腥藻能够产生有固氮能力的异形胞,其在水华蓝藻中成为优势种也反映了鄱阳湖湖区营养盐相对来说氮缺乏. 氮磷比可以较好地预测淡水生态系统浮游植物群落结构. 当水体中氮磷摩尔比低于约60(质量浓度比为27),无论是贫营养[8]还是富营养水体[9]中的优势种通常均为固氮蓝藻,它们能够以大气中的氮气为氮源. 由于淡水浮游植物群落特别是固氮蓝藻对氮磷比很敏感,因此水体中的氮磷比变化会导致浮游植物群落结构的转变.
本文通过对鄱阳湖河湖转换期间鱼腥藻生物量及其异形胞的现场定位监测,阐明鄱阳湖水情波动较大时期鱼腥藻及其异形胞的变化,分析鱼腥藻种群生物量及异形胞形成的影响因素,探索氮磷比变化与鄱阳湖鱼腥藻及异形胞的关系,对于科学预测鄱阳湖浮游植物特别是蓝藻对水文条件变化的响应具有重要的生态和环境意义. 研究成果有助于进一步补充湖泊蓝藻水华发生的生态效应与机理.
1 材料与方法
1.1研究区域概况
鄱阳湖为过水型湖泊,汇集赣江、修河、鄱江(饶河)、信江、抚河等水,最终由湖口进入长江. 入湖水量一般集中在4-6月,湖泊水位变幅巨大,最大年变幅为9.59~15.36 m,最小年变幅为3.80~9.79 m,湖水换水速度快,平均换水周期约为21 d. 鄱阳湖湖体通常以都昌和吴城间的松门山为界,分为南北两湖. 松门山以北为北湖,湖面狭窄,实为一狭长通江港道,长40 km,宽3~5 km,最窄处约2.8km. 松门山以南为南湖,湖面辽阔,是湖区主体,长133 km,最宽处达74 km.
1.2研究方案及分析方法

本研究各种统计学检验均采用SPSS 17.0统计软件完成,绘图使用SigmaPlot 10.0软件完成.
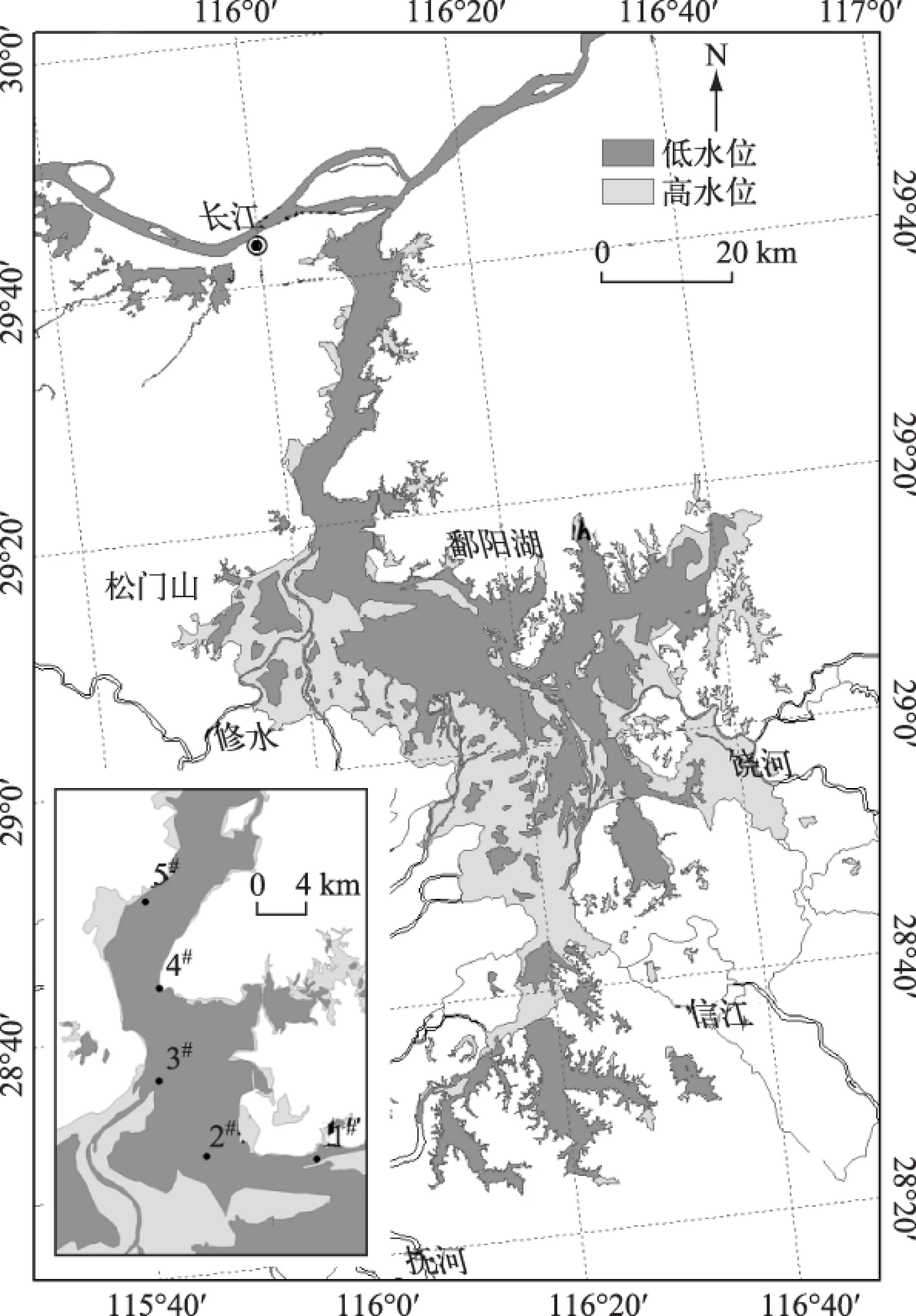
图1 鄱阳湖采样点位Fig.1 The sampling sites in Lake Poyang
2 结果
2.1鄱阳湖夏、秋季浮游植物群落结构
鄱阳湖水体为中营养状态,水质状况良好,达到Ⅲ类水水质标准,湖区水体富营养化程度为中营养状态. 鄱阳湖浮游植物隶属于7门67属132种,其中绿藻门34属64种,占总藻类数百分比为48.5%;硅藻门17属30种,占总藻类数的22.7%;蓝藻门6属22种,占总藻类数的16.7%;裸藻门4属7种,占5.3%;甲藻门和隐藻门分别为3属4种和2属4种,均占鄱阳湖浮游植物总藻类数的3.0%;金藻门种类数最少,仅见1属1种.
2013年5-11月鄱阳湖各采样点浮游植物总生物量为1.5~11.1mg/L,变幅较大,平均值约为3.3mg/L. 蓝藻生物量变化范围为0.2~10.5mg/L,平均生物量为1.3mg/L. 浮游植物总生物量达到最高值11.1mg/L时,蓝藻生物量达到10.5mg/L,当浮游植物总生物量升高时,蓝藻的相对生物量也相应上升,即蓝藻在总生物量中的相对生物量与浮游植物总生物量有着高度一致性(图2).
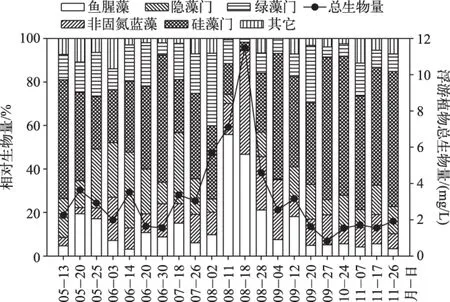
图2 研究期间鄱阳湖浮游植物群落组成Fig.2 The community composition of phytoplankton in Lake Poyang in the study period
总体而言,鄱阳湖浮游植物的优势门类为硅藻,生物量百分比为40%,其主要优势种为Aulacoseiragranulata、Fragilariapinnata和Surirellarobusta;蓝藻为次级优势门类,生物量百分比为26%;其次为绿藻和隐藻,生物量百分比分别为14%和12%. 比较特殊的是,8月蓝藻生物量平均占浮游植物总生物量的57%以上,成为暂时的优势门类. 鄱阳湖水华蓝藻的主要优势属为鱼腥藻、微囊藻和浮游蓝丝藻(Planktothrix),其主要优势种为Anabaenaaffinis、A.smithii、Microcystisaeruginosa、M.smithii、Planktothrixagardhii和P.cryptovaginata. 其中,鱼腥藻的生物量百分比相对较高,夏、秋季的平均生物量占浮游植物总生物量的13%,最高达55%.
研究期间,鄱阳湖鱼腥藻丰度在5-8月较高,到8月达到最高值. 到9-11月退水期鱼腥藻丰度相对较低. 鱼腥藻丝体长度在不同时间的变化相对不大,而不同样点之间有一定的变化. 鱼腥藻异形胞出现频率在8和10月相对较高(图3).
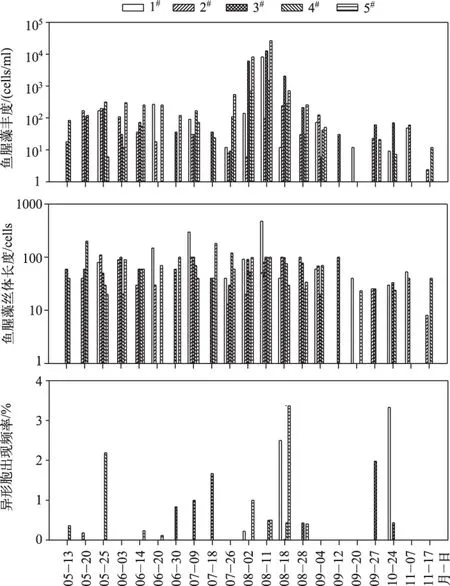
图3 研究期间鄱阳湖的鱼腥藻丰度、鱼腥藻丝体长度及异形胞出现频率Fig.3 Abundance, mean filament length and heterocyst frequency of Anabaena in Lake Poyang in the study period
2.2鄱阳湖水体理化性质
研究期间鄱阳湖水体理化性质在不同采样时期发生变化. 总体而言,总氮浓度在0.5~2.4mg/L之间波动,平均值为1.6mg/L;铵态氮浓度变化不大;硝态氮与总氮浓度具有相同的变化趋势;亚硝态氮浓度呈波浪形变化;总磷浓度在0.05~0.28 mg/L之间波动,5-8月正磷酸盐磷与总磷浓度变化一致,8月以后,正磷酸盐磷浓度变化不大,而总磷浓度变化较大;透明度在5-6月相对较高,之后透明度降低,悬浮物浓度刚好相反;溶解氧浓度高于5 mg/L,只有8月鱼腥藻生物量急增时,其溶解氧浓度迅速下降到1.5mg/L以下. 水位与水温的变化趋势相对一致(图4).
3 讨论
3.1鄱阳湖优势种群的变化
水体富营养化问题是近几十年来世界各国面临的主要环境问题. 在中国,自1980s起的水体富营养化随着社会经济的高速发展而日趋严重. 目前,水体污染导致的富营养化已经严重影响了饮用水水质,蓝藻水华频发使得湖泊周围城市的供水困难,已成为制约经济发展的主要因素之一[11]. 1960s太湖水体的营养状态大致在贫营养状态到中营养状态之间,并偏向贫营养状态. 进入1980s后,水体逐渐由中营养状态向富营养状态过渡,1980s末已达到富营养化状态,1990s后富营养化日趋加剧,且速度越来越快[12-13]. 对以往其它水体富营养化过程植物演替的研究[14-15]表明,早期水生高等植物为优势种,之后中营养时期浮游植物硅藻占优势,最后富营养时期蓝藻为优势种. 多瑙河长期资料显示1987年整个水体上面覆盖沉水植物,水生植物为优势种,浮游植物生物量低,水体清澈. 1993年水下植被生物量已经下降约95%,而浮游植物年平均生物量增加了10倍以上. 1994年这种趋势进一步继续,水生植物几乎消失,浮游植物生物量显著增加,最大值达81 mg/L[12]. 分析鄱阳湖中浮游植物的演替过程,鄱阳湖目前处在中营养向富营养转变的特殊阶段. 鄱阳湖是一个河流型的湖泊,以往关于鄱阳湖浮游植物的研究都表明,其优势种是适合流水生长的硅藻门[16-17]. 而本研究结果表明,8月蓝藻生物量占浮游植物生物量的57%,蓝藻取代硅藻成为暂时的优势种.
3.2鱼腥藻对水环境变化的响应
水体中浮游植物群落的种类组成和数量结构的变化主要受相关的物理、化学和生物等环境因子的影响[18]. 鄱阳湖水体中硝态氮、亚硝态氮、铵态氮、总氮、高锰酸盐指数、透明度、水温、pH值、氧化还原电位(ORP)和TN/TP与水位均呈显著相关,表明这些指标变化受到水位波动的影响显著(表1). 水生生态系统中固氮蓝藻生长是由多种因素引起的,如水温、光照、营养盐浓度及形态、氮磷比等[19-20]. 一般来说,在营养物质充足、水体较为稳定等条件具备时,适宜的高水温是蓝藻生长旺盛的外界诱发因子. 同样地,鱼腥藻的生长发展与水体的温度密切相关. 已有培养实验结果表明水温对鱼腥藻生长具有直接作用,当培养温度为7~10℃时,水华鱼腥藻的生长速率很低,当水温达到16~22℃时,达到最大生长速率[21]. 野外监测数据显示,当水温高于17℃时,出现水华鱼腥藻大范围繁殖[22]. 本研究中鱼腥藻在鄱阳湖中全年可见,通常在夏季达到全年的最大值. 鱼腥藻丰度与水温没有显著相关性,是由于研究期间的水温高于15℃(表1). 一般,夏季水华鱼腥藻会形成异形胞,而冬季一般不产生异形胞[19]. 鄱阳湖夏、秋季鱼腥藻异形胞频率相对较高,主要是由于此时氮浓度相对较低、温度较高. 当水温较高、氮浓度相对较低时,固氮蓝藻在pH值高的水体中生长得更好[23]. 鄱阳湖pH值随时间变化很大,其值一般约为8,接近蓝藻生长的最佳pH值[24].
** 表示在置信度(双侧)为 0.01 时,相关性是显著的;*表示在置信度(双侧)为 0.05 时,相关性是显著的.
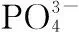
3.3不同湖泊的氮磷比
很多关于氮磷比变化导致浮游植物群落组成改变的研究,包括湖泊[34-35]、围隔实验[36]和实验室实验[37]. 在氮添加处理中,随着氮的增加,虽然总生物量减少,但固氮蓝藻生物量增加. 李伟等[38]通过改变藻类生长发育所需的氮磷比,持续跟踪藻类群落的结构特征及各微藻组分的种群动态变化,研究发现水体氮、磷的供给比例直接影响了具有不同耐低氮或耐低磷能力的微藻种群数量分布. 当TN/TP>30时,蓝藻门的生物量较低,但随总磷增长呈明显的指数增长趋势,当30>TN/TP>12时,指数性增长变得十分平缓,当TN/TP<12时,蓝藻的增长趋势变为对数性增长[39]. 本研究中,鄱阳湖TN/TP平均值为15,DIN/DIP平均值为18 (图5).
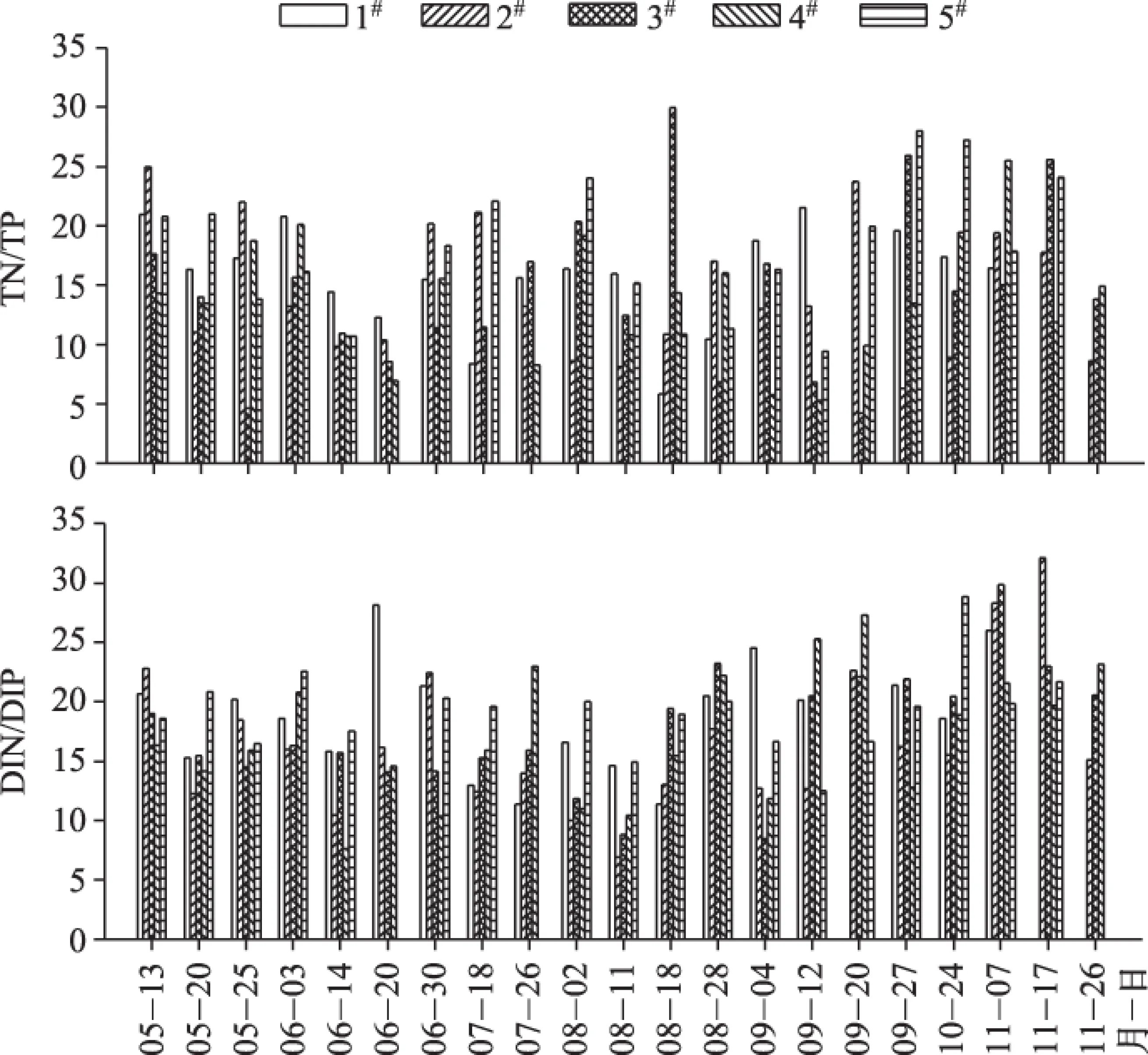
图5 研究期间鄱阳湖水体氮磷比值Fig.5 N/P ratios of Lake Poyang in the study period
近年来,我国太湖、巢湖蓝藻水华频发,水华蓝藻优势种的变化受到水体中氮、磷浓度的影响[40-41]. 相对低的氮、磷浓度有利于太湖水华微囊藻群体的生长,而过高的氮、磷浓度则会抑制微囊藻群体生长,太湖氮、磷浓度(TN为4.57 mg/L,TP为0.165 mg/L)有利于水华微囊藻群体的生长[42]. 太湖水体中的氮磷比为13~51,全年平均值为30,其中夏季较低,春、秋季次之,冬季较高;1-3月和8-9月硅藻为优势种;4-6月绿藻为优势种;6-12月蓝藻为优势种[43]. 吴雅丽等[44]的研究表明,生物固氮即固氮蓝藻的固氮作用目前对太湖氮素输入的贡献很小. 据实验测算,最适合蓝藻生长的氮磷比为10~12,而长期监测资料显示,巢湖水体中氮磷比一般在10~15之间,对于蓝藻的生长繁殖极为有利. 巢湖蓝藻生长过程中受到氮素的限制作用,巢湖早春蓝藻优势种为水华鱼腥藻(Anabaenaflos-aquae),之后是绿色微囊藻(Microcystisviridis)、惠氏微囊藻(M.wesenbergii)和铜绿微囊藻[45]. 鱼腥藻在2009-2014年鄱阳湖湖区中全年可见,夏、秋季鱼腥藻能够产生有固氮能力的异形胞,并成为水华蓝藻的优势种. 鄱阳湖近几年水体氮磷比变化范围为2~35,全年平均值为15,与巢湖的接近,低于太湖(30). 一般影响固氮蓝藻或非固氮蓝藻占优势的最重要因素是氮、磷的相对可利用性[46]. 丝状固氮蓝藻在淡水中短暂的氮缺乏条件下能够成为优势种,主要是由于其能够产生具有固氮能力的异形胞. 当鄱阳湖中磷充足而氮相对缺乏时,能够适应相对低氮条件的固氮鱼腥藻就成为优势种. 夏、秋季鱼腥藻在水体中占优及异形胞的出现反映了鄱阳湖局部湖区营养盐具有氮缺乏阶段.
4 结论
鄱阳湖作为水位波动较大的水体,水体富营养化程度为中营养状态. 硅藻是其浮游植物的优势种,对夏、秋季高频监测结果分析发现,8月蓝藻生物量平均占浮游植物生物量的57%,蓝藻取代硅藻成为浮游植物暂时的优势种. 鱼腥藻为蓝藻的优势种. 夏、秋季鄱阳湖中鱼腥藻及异形胞增加与很多因素有关,如温度、光照、溶解氧等,氮相对缺乏是其中一个重要因素. 鱼腥藻在鄱阳湖水体中占优势以及异形胞的出现都表明某些湖区存在氮相对缺乏的阶段.
[1]Ramaswamy KS, Endley S, Horvitz HRetal. Nitrate reductase activity and heterocyst suppression on nitrate inAnabaenasp. Strain PCC 7120 Require moeA.JournalofBacteriology, 1996, 178: 3893-3898.
[2]Ferber LR, Levine SN, Lini Aetal. Do cyanobacteria dominate in eutrophic lakes because they fix atmospheric nitrogen?FreshwaterBiology, 2004, 49: 690-708.
[3]Liao CFH. The effect of nutrient enrichment on nitrogen fixation activity in the Bay of Quinte, Lake Ontario.Hydrobiologia, 1977, 56(3): 273-279.
[4]Vrede T, Ballantyne A, Mille-Lindblom Cetal. Effects of N∶P loading ratios on phytoplankton community composition, primary production and N fixation in a eutrophic lake.FreshwaterBiology, 2009, 54(2): 331-344.
[5]De Tezanos PP, Litchman E. Interactive effects of N∶P ratios and light on nitrogen-fixer abundance.Oikos, 2010, 119(3): 567-575.
[6]Smith VH. Low nitrogen to phosphorus ratios favor dominance by blue-green algae in lake phytoplankton.Science, 1983, 221: 669-671.
[7]陈宇炜, 徐彩平, 刘霞. 鄱阳湖水华蓝藻现状与成因初探. 中国藻类学会第八次会员代表大会暨第十六次学术讨论会论文摘要集, 2011.
[8]Diaz M, Pedrozo F, Reynolds Cetal. Chemical composition and the nitrogen-regulated trophic state of Patagonian lakes.Limnologica, 2007, 37: 17-27.
[9]Jeppesen E, Søndergaard M, Jensen JPetal. Lake responses to reduced nutrient loading- an analysis of contemporary long-term data from 35 case studies.FreshwaterBiology, 2005, 50: 1747-1771.
[10]金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京:中国环境科学出版社, 1990.
[11]Dokulil MT, Chen W, Cai Q. Anthropogenic impacts to large lakes in China: The Tai Hu example.AquaticEcosystemHealthandManagement, 2000, 3: 81-94.
[12]高柳青, 晏维金. 富营养化对三湖水环境影响及防治探讨. 资源科学, 2002, 24(3): 19-25.
[13]张运林, 秦伯强. 太湖水体富营养化的演变及研究进展. 上海环境科学, 2001, 20(6): 263-265.
[14]Dokulil MT, Teubner K. Eutrophication and restoration of shallow lakes—the concept of stable equilibria revisited.Hydrobiologia, 2003, 506-509: 29-35.
[15]Keating KI. Blue-green algal inhibition of diatom growth: transition from mesotrophic to eutrophic community structure.Science, 1978, 199: 971-973.
[16]徐彩平. 鄱阳湖浮游植物群落结构特征研究[学位论文]. 南京: 中国科学院南京地理与湖泊研究所, 2013.
[17]Wu Z, Cai Y, Liu Xetal. Temporal and spatial variability of phytoplankton in Lake Poyang, the largest freshwater lake in China.JournalofGreatLakesResearch, 2013, 39: 476-483.
[18]Reynolds CS. What factors influence the species composition of phytoplankton in lakes of different trophic status.Hydrobiologia, 1998, 369: 11-26.
[19]Staal M, Meysman FJ, Stal LJ. Temperature excludes N2-fixing heterocystous cyanobacteria in the tropical oceans.Nature, 2003, 425: 504-507.
[21]Lehtimäki J, Moisander P, Sivonen Ketal. Growth, nitrogen fixation, and nodularin production by two Baltic Sea cyanobacteria.AppliedandEnvironmentalMicrobiology, 1997, 63: 1647-1656.
[22]Wasmund N. Occurrence of cyanobacterial blooms in the Baltic Sea in relation to environmental conditions.InternationaleRevuedergesamtenHydrobiologieundHydrographie, 1997, 82: 169-184.
[23]Unrein F, O’Farrell I, Izaguirre Ietal. Phytoplankton response to pH rise in a N-limited floodplain lake: relevance of N2-fixing heterocystous cyanobacteria.AquaticSciences, 2010, 72: 179-190.
[24]Reynolds CS, Walsby AE. Water blooms.BiologicalReviews, 1975, 50(4): 437-481.
[25]Agawin NSR, Rabouille S, Veldhui MJWetal. Competition and facilitation between unicellular nitrogen-fixing cyanobacteria and non-nitrogen-fixing phytoplankton species.LimnologyandOceanography, 2007, 52: 2233-2248.
[26]Niemi A. Blue-green algal blooms and N: P ratio in the Baltic Sea.ActaBotánicaFennica, 1979, 110: 57-61.
[27]Havens KE, James RT, East TLetal. N: P ratios, light limitation, and cyanobacterial dominance in a subtropical lake impacted by non-point source nutrient pollution.JournalofEnvironmentalPollution, 2003, 122: 379-390.
[28]Paerl HW. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters.LimnologyandOceanography, 1988, 33: 823-847.
[29]Laamanen M, Kuosa H. Annual variability of biomass and heterocysts of the N2-fixing cyanobacteriumAphanizomenonflos-aquaein the Baltic Sea with reference toAnabaenaspp. andNodulariaspumigena.BorealEnvironmentResearch, 2005, 10: 19-30.
[30]De Nobel WT, Matthijs HCP, Von Elert Eetal. Comparison of the light-limited growth of the nitrogen-fixing cyanobacteriaAnabaenaandAphanizomenon.NewPhytologist, 1998, 138: 579-587.
[32]Wu JF, Sunda W, Boyle EAetal. Phosphate depletion in the western North Atlantic Ocean.Science, 2000, 289: 759-762.
[33]Reynolds CS. The ecology of freshwater phytoplankton. Cambridge: Cambridge University Press, 1993.
[34]Nõges T, Laugaste R, Nõges Petal. Critical N: P ratio for cyanobacteria and N2-fixing species in the large shallow temperate lakes Peipsi and Vortsjarv, northeast Europe.Hydrobiologia, 2008, 599: 77-86.
[35]Smith VH, Bennett SJ. Nitrogen: phosphorus supply ratios and phytoplankton community structure in lakes.ArchivfürHydrobiologie, 1999, 146: 37-53.
[36]Levine SN, Schindler DW. Influence of nitrogen to phosphorus supply ratios and physicochemical conditions on cyanobacteria and phytoplankton species composition in the Experimental Lakes Area, Canada.CanadianJournalofFisheriesandAquaticSciences, 1999, 56: 451-466.
[37]Bulgakov NG, Levich AP. The nitrogen : phosphorus ratio as a factor regulating phytoplankton community structure.ArchivfürHydrobiologie, 1999, 146: 3-22.
[38]李伟, 何淑嫱. 氮、磷供给比例对实验微藻群落结构的影响. 湖泊科学, 2014, 26(5): 767-772. DOI 10. 18307/2014. 0515.
[39]吴世凯. 长江中下游地区33个浅水湖泊的氮磷比、浮游植物和微囊藻毒素的生态学研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2007.
[40]Xu H, Paerl HW, Qin Betal. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China.LimnologyandOceanography, 2010, 55(1): 420-432.
[41]王书航, 姜霞, 金相灿. 巢湖水环境因子的时空变化及对水华发生的影响. 湖泊科学, 2011, 23(6): 873-880. DOI 10. 18307/2011. 0608.
[42]许慧萍, 杨桂军, 周健等. 氮、磷浓度对太湖水华微囊藻(Microcystisflos-aquae)群体生长的影响. 湖泊科学, 2014, 26(2): 213-220. DOI 10. 18307/2014. 0207.
[43]钱奎梅. 太湖浮游植物有机碳生态作用的初步研究[学位论文]. 南京: 中国科学院南京地理与湖泊研究所, 2008.
[44]吴雅丽, 许海, 杨桂军等. 太湖水体氮素污染状况研究进展. 湖泊科学, 2014, 26(1): 19-28. DOI 10. 18307/2014. 0103.
[45]贾晓会, 施定基, 史绵红等. 巢湖蓝藻水华形成原因探索及“优势种光合假说”. 生态学报, 2011, 31(11): 2968-2977.
[46]Paerl HW. Physiological ecology and regulation of N2fixation in natural waters.AdvancesinEcologicalResearch, 1990, 11: 305-344.
Variations of Anabaena in the transition levels between river- and lake-type of Lake Poyang
QIAN Kuimei1,2, LIU Xia1, QI Lingyan1& CHEN Yuwei1**
(1:StateKeyLaboratoryofLakeScienceandEnvironment,NanjingInstituteofGeographyandLimnology,ChineseAcademyofSciences,Nanjing210008,P.R.China)(2:CollegeofEnvironmentalEngineering,XuzhouInstituteofTechnology,Xuzhou221111,P.R.China)
Lake Poyang is one of the two lakes naturally connecting with Yangtze River, with a dramatic and regular water level fluctuation every year. Data of the weekly monitoring from May to November in 2013 was used to study the variations ofAnabaenaand its heterocyst and the influence factors. It was showed that Cyanophyta was a subdominant species in Lake Poyang. Cyanophyta biomass was accounted for about 57% of total phytoplankton biomass, and Cyanophyta temporarily became the dominant species replacing diatoms in August. The dominant species of Cyanophyta were nitrogen-fixingAnabaenadue to the high water temperature and suitable nutrient in summer and autumn. The nitrogen and phosphorus ratios were around 15 in the study period.Anabaenaproduced heterocyst and became the dominant species of Cyanophyta, reflecting relatively nitrogen deficiency in Lake Poyang. The results can provide a theoretical basis for the protection and utilization of Lake Poyang.
Lake Poyang;Anabaena; transition levels between river and lake
J.LakeSci.(湖泊科学), 2016, 28(3): 566-574
10.18307/2016.0312
©2016 byJournalofLakeSciences
*国家重点基础研究发展计划“973”项目(2012CB417000)、国家自然科学基金项目(41301088)和江苏省博士后科研资助计划项目(1401158C)联合资助. 2015-08-04收稿;2016-01-19收修改稿. 钱奎梅(1982~),女,博士;E-mail:qiankuimei@163.com.
**通信作者; E-mail:ywchen@niglas.ac.cn.
