动物源类药物治疗真菌感染类疾病的历史与展望*
2016-09-01陈壮志李文辉许凯歌李成功高鹏飞
滕 飞,陈壮志,张 云,李文辉,许凯歌,李成功,高鹏飞
(1 云南省昆虫生物医药研发重点实验室,大理大学,云南 大理 671000;2 中国科学院昆明动物研究所,云南 昆明 650223;3 中国西南药用昆虫及蛛形类资源开发利用协同创新中心,大理大学,云南 大理 671000;4 药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000)
动物源类药物治疗真菌感染类疾病的历史与展望*
滕飞1,2,陈壮志1,3,4,张云1,2,李文辉1,2,许凯歌1,3,4,李成功1,3,4,高鹏飞1,3,4
(1 云南省昆虫生物医药研发重点实验室,大理大学,云南大理671000;2 中国科学院昆明动物研究所,云南昆明650223;3 中国西南药用昆虫及蛛形类资源开发利用协同创新中心,大理大学,云南大理671000;4 药用特种昆虫开发国家地方联合工程研究中心,云南大理671000)
回顾了近几十年来对动物源类药物治疗真菌感染类疾病的研究和应用,从中可以领略动物源类抗真菌药物的发展轨迹,预期通过研究历史回顾,发掘药效作用,扩大临床应用,并充分利用现代生物技术,多角度、多途径、多靶点探寻虫类药的作用机制,动物源类抗真菌药的应用会取得新的进展,将在人类疾病的防治中发挥更大的作用。
斑蝥;美洲大蠊;蜂胶;东亚钳蝎;蜈蚣;牛黄;五灵脂;海参;海星;牡蛎;抗真菌
动物是重要的活性化合物来源,在人类生活和生产中都占有重要地位。近年来,从动物中筛选出具有药理活性的化合物,进而探寻大规模工业化生产道路,已经成为药物研究的重要模式。然而长久以来,国内外学者对动物源抗细菌、抗病毒、抗肿瘤及抗心脑血管疾病等的研究较多,而动物源抗真菌药物研究相对较少,但近年来逐步得到重视。本文对近年来动物源抗真菌药物的研究成果做了回顾,并对抗真菌药物的前景进行了展望。
1 斑 蝥
用于药用的斑蝥(Spanish fly)为昆虫纲鞘翅目芫青科昆虫南方大斑蝥(MylabrisphalerataPallas)或黄黑小斑蝥(MylabriscichoriiLinnaeus)[1]。据《神农本草经》记载,斑蝥可以治疗痈疽、溃疡、癣疮等病症。近年研究发现斑蝥有多种新用途,如治疗风湿痛、抗神经痛、斑秃、乳腺增生、鼻炎、肝炎、肿瘤等。利用斑蝥及其衍生物制成的一些疗效显著的中成药、化学药及生化药等相继问世,如治癣药用红膏、斑蝥素注射液、斑蝥酸钠片、复方斑蝥酸钠片、去甲斑蝥素片、斑蝥素乳膏等[2]。
1.1斑蝥的化学成分
研究表明从斑蝥中提取分离的斑蝥素(Cantharidin)是斑蝥抗癌的有效成分,也是其毒性的主要成分[3]。斑蝥素为无色无味发亮结晶,是斑蝥酸的内酐,是一种天然单萜类物质,是斑蝥体内的天然防御性毒素[4],其结构如图1所示。

图1 斑蝥素的化学结构式
去甲斑蝥素(Norcantharidin,NCTH)是由马来酐与呋喃按狄尔斯-阿尔德(Diels-Alder)加成反应后催化氢化制得的一种新式人工合成化合物[5],相关研究表明去甲斑蝥素具有抑制肿瘤和真菌的作用[6-7],其结构如图2所示。

图2 去甲斑蝥素的化学结构式
1.2斑蝥的抗真菌作用研究的历史
斑蝥在抗皮肤真菌性和病毒性疣、瘤等方面有良好的作用[8]。早在1957年,曹仁烈等在斑蝥水浸剂体外抗真菌实验中发现,斑蝥1:4水浸剂体外可抑制堇色毛癣菌(Trichophytonviolaceum)等12种致病真菌。其中石膏样毛癣菌(Trichophytongypseum)的抑菌浓度为4%,红色毛癣菌(Epidermophytomrubrum)的抑菌浓度为4%,羊毛状小孢子菌(Microsporumlanosum)的抑菌浓度为2%[9]。临床及试验结果证明,斑蝥素对一些真菌引起的皮癣有良好效果[10]。
2000年,徐春东等[7]体外实验研究表明,0.5%的去甲斑蝥素水溶液可抑制红色毛癣菌、石膏样毛癣菌和羊毛状小孢子菌3种致病皮肤真菌,且功效明显;1%去甲斑蝥素水溶液均能杀灭红色表皮癣菌、石膏样毛癣菌和羊毛状小孢子菌3种致病皮肤真菌。
1.3斑蝥抗真菌作用的展望
综上所述,斑蝥活性提取物及去甲斑蝥素对多种致病真菌有一定的治疗效果。斑蝥提取物的人工合成的衍生物如去甲斑蝥素将是这一类药物未来的发展方向,但其抗真菌的作用机制尚待深入研究。
2 美洲大蠊
美洲大蠊(Periplanetaamericana)为昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属昆虫,俗称蟑螂。其作为药材始载于《神农本草经》,具有广泛的药理作用,如促血管增生,组织修复作用;强心升压,改善微循环作用;抗菌,抗病毒作用;抗肿瘤,增强免疫作用[11]。
2.1美洲大蠊的化学成分
美洲大蠊中含有多种生物活性成分,目前研究比较多的有硫酸粘多糖、抗菌肽,类胰岛素生长因子和多元醇等。
从美洲大蠊中分离的硫酸粘多糖(Sulfated glycosaminoglycans,GAGs),具有多种药理活性,包括抗凝血、降血脂、抗病毒、抗肿瘤及抗放射等作用[12]。乙酰肝素硫酸盐(Heparan sulfate,HS)是硫酸粘多糖的主要成分,约占90%以上。在美洲大蠊的脂肪体和胸肌中,乙酰肝素硫酸盐的硫酸粘多糖含量非常显著[13]。
金小宝等[14]的研究表明美洲大蠊体内还有一定的天然抗菌成分,在受到外源诱导物刺激后其抗菌成分会明显增加。
蓝江林等[16]研究发现用不同诱导源均可诱导美洲大蠊产生抗菌物质,并且其血淋巴中的抗菌物质最多[15]。其进一步研究了美洲大蠊抗菌肽对大肠杆菌的抗菌机理,结果表明美洲大蠊抗菌肽能使大肠杆菌(EscherichiacoliK88)的细胞质膜损伤,导致大肠杆菌内容物外泄,最后菌体崩解成碎片而使大肠杆菌死亡。
Verhaert等[17]研究发现,美洲大蠊体内存在与生长调节素C类似的物质即I类胰岛素生长因子(Type I insulin-like growth factor,IGF-I)。Lopes等[18]研究发现,美洲大蠊成虫体内可分离提取出胰岛素。
李树楠等[19]研究发现,从美洲大蠊中提取分离的特殊多元醇类化合物W11-a12具有明显的促进肉芽组织增生作用,且无副作用及刺激性。
2.2美洲大蠊的抗真菌作用研究的历史
目前对美洲大蠊抗真菌的研究较少。2013年,白丽等研究表明,美洲大蠊醇水提取物具有显著抑制白色念珠球菌(Moniliaalbican)生长的活性,其抑制真菌生长的能力比氟康唑和5-氟尿嘧啶强80倍,比两性霉素强800倍。该美洲大蠊提取物有效部位可以制备成水凝胶、泡沫凝胶等形式用于防治真菌感染[20]。
2.3美洲大蠊抗真菌作用的展望
基于美洲大蠊药理活性的开发已有了很多成功的先例,如可以促进伤口愈合的康复新液,对乙型肝炎有良好治疗效果的肝龙胶囊。而美洲大蠊的更多药理作用,如抗真菌活性,却没有形成新药。所以,今后深入研究美洲大蠊抗真菌药理活性成分,并且要深入研究美洲大蠊抗真菌的作用机制,将是美洲大蠊抗真菌药物开发的重点。
3 蜂 胶
蜂胶(Propolis)是蜜蜂科昆虫意大利蜂(ApismelliferaL)等从植物幼芽或树干上采集的树脂,混入其上颚腺分泌物、蜂蜡而形成的芳香性胶状固体物质,是蜜蜂用来防止病原性微生物入侵、修补蜂巢和维持蜂巢内环境清洁的重要物质,多于夏季从蜂箱中收集[21-22]。现代药理研究表明,蜂胶具有抑菌、抗炎作用、抗氧化作用、抗肿瘤作用、保护心肌的作用、增强免疫力、降脂、调节血糖的作用[23]。
3.1蜂胶的化学成分
蜂胶黄酮类化合物的药理作用很广,可抗癌、抗过敏、抗炎、抗病毒、抗增生和抗细胞分化活性[24]。通过各种分离技术,目前已从蜂胶中鉴定出多种黄酮类化合物,根据骨架结构可以分为黄酮类、黄酮醇类、二氢黄酮类、二氢黄酮醇类、查尔酮类[25-26]。
目前,已从蜂胶中鉴定出的芳香酸及芳香酯类化合物,主要为羟基苯甲酸和羟基肉桂酸的衍生物,在此为便于总结,按骨架结构分类为苯甲酸类,苯甲酸酯类,肉桂酸类,肉桂酸酯类[25-27]。蜂胶特殊芳香挥发油物质的主要成分为烯、萜类化合物。目前分离鉴定出的此类化合物有19种,包括倍α-愈创木烯、半萜烯乙醇、倍半萜烯二醇、β-芹子烯、丁香烯、β-桉叶油醇、鲨烯等[28]。
蜂胶的抗真菌活性与蜂胶的产地、蜜蜂种类、蜂胶采集位置以及提取方法有密切关系。Hegazi AG等[29]用GC法分析了奥地利、德国、法国产蜂胶的化学成分,并对其抗真菌活性进行了对比分析,其研究结果表明含有乔松素(如图3所示)和香豆素的奥地利蜂胶对白色念珠菌的抗菌活性最好;Velikova等[30]研究表明,含有高含量酚酸酯和咖啡酸苯乙酯(如图4所示)的土耳其布尔萨蜂胶抑制真菌比保加利亚蜂胶效果好。

图3 乔松素的化学结构式

图4 咖啡酸苯乙酯的化学结构式
3.2蜂胶抗真菌的作用研究的历史
国内外相关研究表明,蜂胶对皮癣菌属的真菌有较强的抑制作用。早在1978年,房柱等研究发现1%~10%的蜂胶乙醇浸液或乙醚浸液,对常见的致病真菌如絮状表皮癣菌(Epidermophytonflccosum)、红色毛癣菌、铁锈色小孢子菌(Microsporumferrugincum)、大脑状毛癣菌(Trichophytoncerebriforme)、石膏样毛癣菌、断发毛癣菌(Trichophytontonsurans)、紫色毛癣菌(Trichophytonviolaceum)等都有很强的抑制作用[31]。2009年,Aguüero等[32]研究发现阿根廷蜂胶可抑制皮肤真菌,特别对石膏样小孢子菌(Microsporumgypseum)、须毛癣菌(Trichophytonmentagrophytes)和红色毛癣菌有较强的抑制作用,其最小抑菌浓度在16~125 mg/mL之间;Siqueira等[33]研究发现巴西红蜂胶、绿蜂胶的水提取物能抑制红色毛癣菌、断发毛癣菌,巴西红蜂胶、绿蜂胶的乙醇提取物也能抑制上述三种菌的生长,其中红蜂胶乙醇提取物抗菌效果最好。
国内外相关研究表明,蜂胶对念珠菌属的致病菌也有较强的抑制作用,Silici等[34]研究发现低浓度的蜂胶对引起表层皮肤真菌病的白色念珠菌、光滑念珠菌(Candidaglabrata)、毛孢子菌属菌(Trichosporon)和赤酿母属菌(Rhodotorula)有很好的抑制作用;Dalben-Dota等[35]研究表明,低浓度的蜂胶抽提物对能导致女性阴道念珠菌感染的97株真菌均有体外抑制作用;Oliveira等[36]研究表明,蜂胶提取液对从感染甲癣患者的指甲中分离的白色念珠菌、近平滑念珠菌(Candidaparapsilosis)、热带念珠菌(Oidiumtropioale)均有抑制作用,在浓度为0.25 g/L时,抑菌率达90%以上;Martins等[37]研究发现,20%乙醇蜂胶提取液对从HIV阳性病人口腔内分离的白色念珠菌均有抑制作用,抑制效果接近制霉菌素,而克霉唑、抑康唑等对这些白色念珠菌没有抑制作用。更为重要的是,Quiroga等[21]研究发现,蜂胶提取物的毒性远远低于化学药物抗真菌剂酮康唑等;Ota等[38]研究对比了蜂胶提取物对几种念珠菌的抑制能力,其抑菌效果为白色念珠菌>热带念珠菌>克鲁氏念珠菌(Candidakrusei)>吉利蒙念珠菌(Candidaguilliermondi);Fernandes等[39]研究发现,浓度为0.2~1.6 mg/mL的蜂胶可在体外抑制新生隐球菌ATTC 90112菌株(CryptococcusneoformansATTC90112)的生长。
3.3蜂胶抗真菌作用的展望
蜂胶有着广泛的药理作用,特别是抗真菌作用显著。但蜂胶成分复杂,其抗真菌的活性成分还尚不清楚,抗真菌的机理还有待于进一步研究。值得注意的是蜂胶是天然产物,目前研究暂时没有发现任何毒副作用,以其显著的抗真菌作用,蜂胶将在抗真菌产品开发中广泛应用。
4 东亚钳蝎
东亚钳蝎(Scorpionidae)为节肢动物门蛛形纲钳蝎科动物[1]133-134,是我国传统的名贵中药材。东亚钳蝎具有抗惊厥、抗癫痫、抗血栓、免疫抑制、镇痛、抗真菌和抗癌等药理作用[40]。近年来,随着国内外生物医药学、生物化学及分子生物学的发展,东亚钳蝎和蝎毒素的应用领域不断拓宽,已制成相关的药物应用于临床治疗多种疑难病[41]。
4.1东亚钳蝎的主要化学成分
目前研究表明,东亚钳蝎蝎毒的主要化学成分含有蝎毒素、棕榈酸、甜菜碱、三甲胺、软硬脂酸、硫磺酸、卵磷脂、胆甾醇及铵盐[42]。
蝎毒主要由蛋白质和多肽两部分组成[42-43]。蝎毒中的多肽也是一类活性化合物,边六交等研究表明,自蝎毒中能分离出抗癫痫肽、镇痛肽和抗肿瘤肽三类活性化合物,分别具有抗癫痫、阵痛和抗肿瘤的作用[44]。蝎毒中所含的蛋白质,是一种与蛇毒神经毒相类似的蛋白,蝎毒中的蛋白质按作用不同又分为蝎毒素和酶[45]。
蝎毒中的酶有透明质酸酶和磷脂酶A2等。透明质酸酶可以水解粘液性透明质酸,但其本身没有毒性,但它能加强毒素的作用。磷脂酶A2能使卵磷脂酶解成溶血磷脂酰胆碱,后者可导致细胞溶解,所以其有间接溶血作用,蝎毒中的细胞毒素可以增强此酶的活性[46]。
4.2东亚钳蝎的抗真菌作用研究的历史
1990年报道有体外实验研究表明,1:5全蝎水浸剂可在试管内对奥杜盎氏小芽胞癣苗有抑制作用[47]。
1996年,张贵君等[48]研究表明,全蝎乙醇提取物体外对8种表浅性致病真菌均有抑制作用。尤其对裴氏着色真菌(Fonsecaeapedrosoi)、紧密着色菌(Hormodendrumcompactum)、申克氏孢子丝菌(Sporotrichumschenckii)、絮状表皮癣菌、石膏样毛癣菌抑制作用比较敏感,其抗真菌的作用效果优于大蒜水浸出物。
此外,2008年,栾天庆等[49]临床研究发现,以全蝎为原料的中药全蝎膏外用,对50例真菌引起的银屑病患者进行治疗,总有效达46例,即有效率达92%。
4.3东亚钳蝎抗真菌作用的展望
东亚钳蝎是我国医药产业的重要原料,广泛用于生产中成药。现代的科学技术可以对东亚钳蝎进行了分离纯化、检验分析、晶体结构研究及克隆表达。今后,进一步提高东亚钳蝎的提纯技术,对抗真菌有效成分进行提纯分离,并研究其有效成分的衍生物将是未来研究的重点方向。
5 蜈 蚣
蜈蚣(Centipede)属于节肢动物门,唇足纲整形目蜈蚣科动物,一般药用的蜈蚣为少棘巨蜈蚣(ScolopendrasubspinipesmutilansL.Koch)的虫体。蜈蚣作为药物史载于《神农本草经》,是我国名贵的中药材。蜈蚣有广泛的药理作用,对于治疗癌症、脑血管病、冠心病、慢性肾炎、肝炎、坐骨神经痛、风湿性关节病及多种皮肤类疾病等方面均有显著的效果[50-51]。
5.1蜈蚣的化学成分
方红等对黑头蜈蚣化学成分的研究结果表明,黑头蜈蚣中含有十二种脂肪酸,分别为十四碳酸、十五碳酸、棕榈烯酸、棕榈酸、十七碳酸、油酸、亚油酸、硬脂酸、亚麻酸、二十碳二烯酸、二十碳一烯酸、花生酸等。而其对少棘蜈蚣化学成分的研究结果表明,少棘蜈蚣除含有上述十二种脂肪酸外,还含有二十二碳一稀酸、花生四稀酸、和山愈酸[52]。蜈蚣毒素的相关研究表明,少棘蜈蚣粗毒中有蛋白水解酶、乙酰胆碱酯酶、精氨酸酯酶、类凝血酶、纤维素酶、透明质酸酶、碱性磷酸酶和酸性磷酸酶等酶,以及磷酸二酯酶、ATP酶、核苷酸焦磷酸酶等,这些酶可能为蜈蚣药理活性物质[53]。曲爱兵等采用薄层层析法对蜈蚣提取物进行初步化学分析,结果显示蜈蚣组织提取物中含有类组织胺物质,蜈蚣提取物具有一定的抗肝癌和胃癌作用[54]。
5.2蜈蚣的抗真菌作用研究的历史
1992年,冉永禄等[55]研究表明,少棘蜈蚣和墨江蜈蚣的3%醋酸提取液对石膏样毛癣菌、红色毛癣菌、白色念珠菌、新型隐球菌、石膏样小孢子菌、裴氏着色真菌、羊毛状小孢子菌和申克氏孢子丝菌8种常真菌有抑制作用。少棘蜈蚣的抗真菌广谱性相较于墨江蜈蚣较广[56]。
2007年,任文华等[57]研究发现,少棘蜈蚣水提取物有较高的抗真菌活性,其水提物对真菌酿酒酵母菌ACCC2032菌株(SaccharomycescerevisiaeACCC2032),毛霉菌巴尔通体AS3.3420菌株(MucorbacilliformisAS3.3420)和黑曲霉菌ACCC30005菌株(AspergillusnigerACCC30005)均有抑制作用,其最小抑菌浓度(Minimal inhibitory concentration,MIC)分别为532 μg/mL,232 μg/mL,232 μg/mL。
2008年,周莉莉等[58]研究表明,浓度为250 mg/mL的少棘蜈蚣醇提物体外抑制白色念珠球菌效果较好,而250 mg/mL的少棘蜈蚣水提物抑制白色念珠球菌效果不如醇提物。
5.3蜈蚣抗真菌作用展望
蜈蚣的药效显著,近年来在抗真菌方面取得了一系列进展,值得下一步的深入研究,并且有望在抗真菌的新药研究方面有新的突破。此外,今后必须深入研究蜈蚣抗真菌的活性成分、作用机制及其毒理作用,可以为进一步扩大药源、配制理想剂型和临床应用提供依据。
6 牛 黄
牛黄(Calculus bovis)为哺乳纲偶蹄目牛科牛的胆管、胆囊以及肝管中的结石[65-66]。牛黄作为药材首载于《神农本草经》,是我国的传统中药材。牛黄的主要药理作用有镇静催眠[59]、抗惊厥[60]、保护缺氧心肌、解热镇痛[61]、扩张血管、降血压、增强抵抗力、促进胆汁排泄[62]。
6.1牛黄的化学成分
牛黄的化学成分较为复杂,主要包括胆汁酸[63]、胆红素[64]、胆固醇[65]、蛋白质和氨基酸[66-67]等成分。此外还含有去氧胆酸、胆固醇、胆汁酸盐、脂肪酸、胆酸、卵磷脂、胡萝卜素、微量元素及肽类等成分[68]。
李培峰等[69]研究表明,牛黄中胆红素具有灭活胃肠道消化酶、抗氧化的活性,是牛黄发挥许多重要药理作用不可缺少的成分。颜崇超等[70]研究表明,牛磺酸体外实验能明显抑制二磷酸腺苷ADP,花生四烯酸(Arachidonic acid,AA)及胶原诱导的血小板聚集作用,所以牛黄对血液系统作用的活性物质可能是牛磺酸。相关抗病原微生物实验表明,天然牛黄中的胆酸钠、鹅脱氧胆酸钠、脱氧胆酸钠对链球菌、金黄色葡萄球菌、四叠球菌等亦有抑制作用;牛黄胆酸钠、胆酸钠及鹅脱氧胆酸钠对百日咳杆菌均有抑制作用[71]。
6.2牛黄的抗真菌作用研究的历史
牛黄可以用于治疗霉菌性阴道炎。2005年,刘宪鸣等[72]用牛黄解毒片外用治疗霉菌性阴道炎122例。结果显示,牛黄解毒片治疗霉菌性阴道炎总有效率达87.5%。
牛黄可以用来治疗白色念珠菌引起的阴道炎。2009年,邢艳芳等[73]按照外用栓剂的工艺要求,对“雷氏六神丸”进行剂型改造,制成含有牛黄的六神栓,六神栓外用对小鼠白念珠菌阴道炎具有一定的治疗作用。在一定剂量范围内,随着六神栓药物剂量的增加,其治疗效果明显增加。
6.3牛黄抗真菌作用的展望
牛黄在我国非常重要的一味中药,多种中成药,如安宫牛黄丸、牛黄解毒片、清开灵注射液等都以牛黄为原料,并且在其中对疗效起着关键作用。近年来,牛黄的抗真菌作用引起了学者们的研究,并且证实了牛黄有着良好的抗真菌活性。但牛黄抗真菌的机制尚不清楚,牛黄在临床上抗真菌的应用还没有普及。相信随着现代医药科学技术的发展,学者们对牛黄抗真菌的机制及抗真菌的活性成分的研究将更加深入细致,牛黄的抗真菌应用将更加广泛。
7 五灵脂
五灵脂 (Faeces trogopterorum)又名药本,有灵脂块(血灵脂、糖灵脂)、灵脂米两种。灵脂块是复齿鼯鼠粪便与尿液的混合物夹加以少量泥土混合干燥而成,灵脂米为复齿鼯鼠粪便干燥而得[74]。相关研究证明,五灵脂具有抗血小板凝聚、抗炎抗溃疡、促进纤维蛋白溶解、抑制结核杆菌和真菌、清除自由基抗氧化以及提高免疫力等多方面的作用[75]。
7.1五灵脂的化学成分
五灵脂中主要含有含氮化合物,三萜类化合物,酚酸及简单单萜、二萜酸,维生素样物质、树脂和无机盐等。
杨东明等自五灵脂中可分离得到13中化合物,分别为五灵脂酸、尿嘧啶、苯甲酸、邻苯二酚、3-蒈烯-9,10-二羧酸、间羟基苯甲酸、原儿茶酸、L-酪氨酸、次黄嘌呤和尿囊素等。其中尿嘧啶、苯甲酸、邻苯二酚、3-蒈烯-9,10-二羧酸、间羟基苯甲酸和原儿茶酸在体外实验中可以一直血小板聚集。邻苯二酚、3-蒈烯-9,10-二羧酸、原儿茶酸有一定的抗菌活性[76]。
李强等[77]从五灵脂分离获得了表木栓醇(如图5所示)、二氢谷甾醇(如图6所示)、β-谷甾醇(如图7所示)、胡萝卜苷(如图8所示)等三萜类物质。此类化合物多具有抗菌、抗炎和溶血活性等作用。

图5 表木栓醇的化学结构式
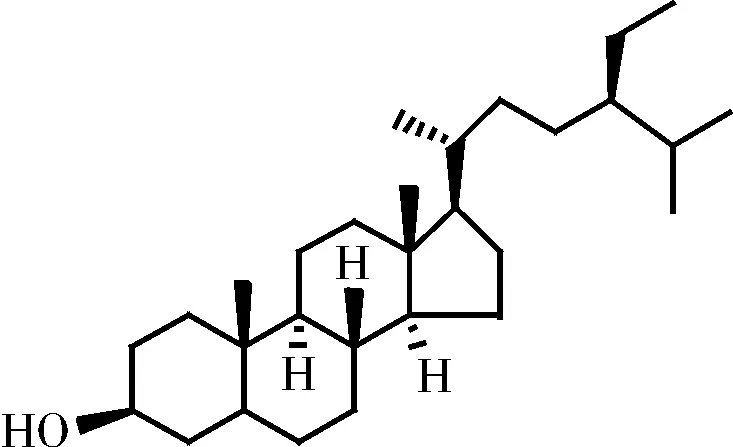
图6 二氢谷甾醇的化学结构式
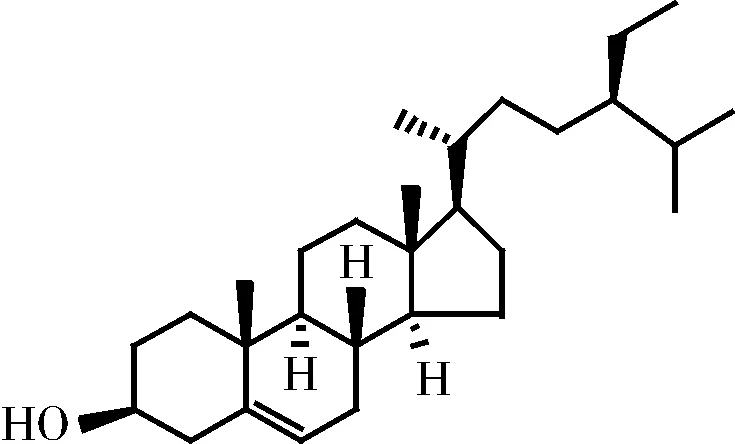
图7 谷甾醇化学结构式
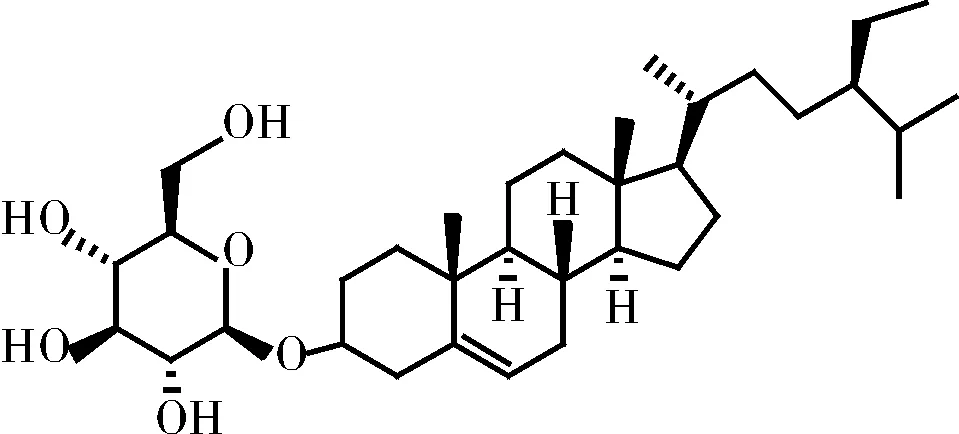
图8 胡萝卜苷的化学结构式
7.2五灵脂抗真菌作用研究的历史
2003年报道的相关研究表明,五灵脂体外可以抑制结核杆菌及多种皮肤真菌,用其水浸剂(1:2),在试管内对堇色毛癣菌、同心性毛癣菌(Trichophytonconcentricum)、奥杜盎氏小芽胞癣菌(Microsporonaudouini)、许兰氏黄癣菌(Achorionschoenleinii)、石膏样小芽胞癣菌、星形奴卡氏菌(Nocardiaasteroids)、腹股沟表皮癣菌(Epidermophytoninguinale)、红色表皮癣菌、紧密着色芽生菌、考夫曼沃尔夫氏表皮癣菌(TrichophytonKaufmann-Wolf)等皮肤真菌均有不同程度的抑制作用[78]。
7.3五灵脂抗真菌作用的展望
研究五灵脂的工作远不及其它动物源类药深入,近几年并无突破性的相关研究报道。其原因可能为五灵脂成分复杂,原料不易获取。进而导致五灵脂抗真菌作用的研究进展缓慢,今后对五灵脂的研究要搞清楚其活性成分,进而阐明其作用机制。
8 海 参
海参(Sea cucumber)为棘皮动物门海参纲木盾手目生物,在我国沿海地区有分布[79]。现代药理研究表明海参具有多种药理活性,如抗血栓、抗凝血、降低血粘度、降血脂、免疫调节、抗肿瘤、抗病毒、抗菌及促细胞生长等作用[80]。
8.1海参化学成分
海参中含有多种海参多糖和海参皂苷。刘桂敏等研究表明,刺参多糖主要分为两类:第一类是刺参黏多糖,即糖胺聚糖,是由葡萄糖醛酸、氨基半乳糖、岩藻糖组成的分支杂多糖,刺参酸性黏多糖(Stichopus acidic mucopolysaccharides,Sjamp)还含有硫酸酯基;第二类是岩藻多糖(Fucidon),这种直链多糖由L-岩藻糖构成。刺参酸性黏多糖和岩藻多糖的硫酸酯基含量非常高[81]。樊绘曾等[82]也研究发现,刺参(Stichopus)中含有刺参酸性黏多糖,高存记等[83]相关实验表明其具有抗血栓作用。岩藻糖化硫酸软骨素(Fucosylated chondroitin sulfate,FCS)也是从海参体壁中提取出的另一种多糖类成分,研究结果表明FCS具有抗凝血活性,其抗凝血作用比肝素更强烈,有抗血栓作用[84]。海参中的皂苷种类很多,有着多种药理作用。海参的皂苷元为3B-20A-二羟-5A-羊毛甾烷-18-羧酸(18→16)内酯,即海参甾烷醇,这是海参所特有的皂苷元。海参中还存在非海参甾烷醇三萜类苷元。从刺参中分离得到的三萜类皂苷,研究表明其有抗肿瘤及抗真菌活性[85]。
8.2海参的抗真菌作用研究的历史
孙鹏[86]对分离得到的5种海参皂苷的进行了体外抗真菌活性实验,结果表明这5种海参皂苷均可抑制近平滑念珠菌、白色念珠菌、热带念珠菌、新生隐球菌(Cryptococcusneoformans)、紧密着色真菌、石膏状小孢子菌、烟曲霉菌(Aspergillusfumigatus)和红色毛癣菌等8种真菌,且有4种海参皂苷的MIC80在0.032 mg/mL以下。
丛日山等[87]研究表明,水溶性海参皂苷对白色念珠菌的抑制作用十分显著,其MIC值为0.063 mg/mL。
袁卫华等[88]研究表明,从奇乳海参中提取的两个三萜皂苷化合物axilogoside A和holothurin B对新型隐球菌、白色念珠菌和烟曲霉菌均有抑制作用,其抑菌浓度为0.004≤MIC80≤0.016 mg/mL。
韩华等[89]研究表明,从糙海参中分离得到3个三萜皂苷化合物scabraside A、echinoside A和holothurin A1,其体外抗真菌活性非常显著,其抑菌浓度为0.001≤MIC80≤0.016 mg/mL)。
8.3海参抗真菌作用的展望
近年来,医药工作者对海参的药理活性研究较为深入,特别是在海参皂苷与黏多糖方面,已证实海参黏多糖具有抗血栓、抗凝血、免疫调节、促进纤维蛋白溶解、抗肿瘤等药理作用,海参皂苷具有抗肿瘤、避孕、溶血、抗真菌等活性,但对黏多糖与皂苷的药理学活性的作用机制研究比较少,还有待深入。随着研究的逐步深入,海参很有可能开发成为抗真菌、抗细菌、抗病毒、抗心血管疾病、抗肿瘤、消炎镇痛等新型药物。而基于海参活性物质研制的抗真菌药物将有着广阔的前景。
9 海 星
海星(Sea star)属棘皮动物门海星纲动物,现代药理研究表明,海星具有抗病毒、抗真菌、抗肿瘤、抗细菌、抗炎、溶血、降压、抗动脉粥样硬化等活性[90]。
9.1海星的活性成分
Simona等[91]研究表明,在南极海水领域不同种类的海星中(Halityleregularis,Coscin-asteriastenuispina,Henricialaeviscula,Culcitanovaeguinea,Oveasterreticulates,Henri-cindowneyae)分离出多种多羟基甾类糖苷、硫酸酯甾类糖苷、多羟基甾醇等天然化合物,体外实验发现,这几种天然化合物对支气管肺癌细胞(NSCLC-N6)有抑制作用。
Qi等[92]研究发现,在海星中存在两种多羟基甾类糖苷Linckosides A和Linckosides B,这两类甾类糖苷对PC12细胞显示出了很强的神经元活性,且能增强神经生长因子对PC12细胞向神经元分化的诱导。
海星的生殖腺中含有两种不饱和脂肪酸二十碳五烯酸(Eicosapentaenoic Acid,EPA)和二十二碳六烯酸(Docosahexaenoic Acid,DHA),研究表明EP A和DHA有降血压、抑制血小板凝集、降血脂、抗肿瘤、提高生物膜流动性、抗炎症等生物活性[93]。
在海星体壁中含有酸性黏多糖,药理活性研究表明海星酸性黏多糖具有抗凝血、抗血栓、降低血清胆固醇、改善微循环等作用,说明海星是治疗冠心病及微循环障碍、脑血栓的优良药物原料[94]。
9.2海星的抗真菌作用研究的历史
2008年,樊廷俊等[95]分离纯化出具有强抗真菌活性的水溶性海星皂苷,体外实验表明其对白色念珠菌和裂殖酵母菌(Schizosccharomyces)两种真菌有很强的抑制作用。
2013年,华影等[97]研究表明,从南海多棘海星水溶性提取物中筛选具有抗真菌活性的物质,体外抑菌实验表明,南海多棘海星水溶性提取物对红色毛癣显示出较强的抗真菌活性[96]其进行了抗真菌的动物实验,结果显示海星水提物对豚鼠皮肤红色毛癣菌感染的皮损有明显的改善。
9.3海星抗真菌作用的展望
目前对海星的药理活性研究主要集中在抗肿瘤、抗炎、治疗心脑血管疾病等方面,对海星的抗真菌研究不多,虽分离出了抗真菌的活性部位,但其抗真菌机理尚不清楚,目前也少有药物上市。所以海星抗真菌机理及海星抗真菌药物的研发将是今后科研工作中的重点。总之,海星中含有大量的药理活性物质,有些物质具有潜在的药用价值,未来将会广泛应用到医药的研究与开发。
10 牡 蛎
牡蛎(Oysters)属于软体动物门瓣鳃纲异柱目牡蛎科,是我国常见的贝类,在我国沿海地区分布广泛,其壳及肉均为传统的中药材[1,98]。牡蛎作为药材首载于《神农本草经》。随着研究的进展,牡蛎软体即牡蛎肉的应用也逐渐广泛,例如胡婷等从江苏和福建产牡蛎中提取多糖体,发现其具有明显防治心血管疾病活性及其他生物活性,如抗血栓、抗凝血、降血脂、抗白细胞降低和提高机体免疫能力等作用,并且暂未发现毒副作用[99]。
10.1牡蛎化学成分
牡蛎肉中含有丰富的氨基酸和蛋白质。楼永明等从牡蛎中分离到甘氨酸、丝氨酸、丙氨酸、赖氨酸、精氨酸、亮氨酸、谷氨酸、异亮氨酸、蛋氨酸、苏氨酸、组氨酸和色氨酸等17种氨基酸[100],陈荣忠等[101]研究表明,牡蛎肉中的牛磺酸含可达到7%,赵鹏等[102]研究表明,从牡蛎肉中分离得到的天然牛磺酸具有较好的降血脂功能。
10.2牡蛎抗真菌作用研究的历史
2005年,宋海霞等[103]从牡蛎软体中分离提取了一种溶菌酶,并应用最小抑菌浓度法和最小杀菌浓度(Minimum bactericidal concentration,MBC)法测定该溶菌酶体外对白色念珠菌CMCC(F)98001的MIC和MBC。实验结果显示来自海洋牡蛎软体的溶菌酶对白色念珠菌CMCC(F)98001的MIC为0.0625%,MBC也为0.0625%。
2008年,兰晓明等[104]研究表明,牡蛎软体中提取的抗菌蛋白对分离的致病性念珠菌超微结构有明显作用,经4 h抗菌蛋白(3.5×10 U·mL)作用,白色念珠菌菌体变为椭圆形,细胞壁松弛,细胞质固缩;16 h后菌体呈圆球形,细胞壁边缘呈毛状,残缺并且明显肿胀,胞浆内容变空,细胞器几乎消失,胞核不清;24 h后,菌体呈不规则形,细胞壁缺失,细胞质解体出现空腔。
2010年,王春波等[105]对牡蛎软体中抗菌蛋白(Antibacterial protein,AP)进行了分离纯化,并采用体外实验验证其对常见致病真菌的抗菌作用。结果表明,此抗菌蛋白抑制白色念珠菌作用强,其最小抑菌浓度范围在0.12~0.20 μg/mL之间,最小杀菌浓度范围在0.25~1.0 mg/mL之间。
10.3牡蛎抗真菌作用的展望
综上所述,近年来对牡蛎抗真菌的研究表明,其抗真菌作用将具有广阔的应用前景,值得进一步研究、开发和利用。但目前牡蛎抗真菌作用在研究机制及临床应用方面研究尚不够深入,没有使牡蛎的药用价值得到更细致全面的应用。随着中药现代化研究的快速发展,牡蛎的抗真菌功能一定会在临床上得到很好的应用。
11 结论与展望
过去几十年来,广大科研工作者对动物源类药物进行了广泛而细致的研究,并取得了大量的成果。但对动物源类药物治疗真菌感染类疾病的研究却相对较少,这将留待我们继续去发掘。根据过去几十年动物源类药物治疗真菌感染类疾病的线索,继而引申发展,通过实践,研究、发掘、探索动物源类药物的药效作用,开展广泛研究,以期扩大临床抗真菌应用范围;同时,充分利用现代生物技术,多角度、多靶点、多途径探寻动物源类药物抗真菌的作用机制,开发新的有效药物,是今后努力的方向。
[1]国家药典委员会.中华人民共和国药典(2010年版一部)[S].北京:中国医药科技出版社, 2010.
[2]江励华,王明艳.斑蝥的研究进展[J].医药导报,2004,23(6):385-386.
[3]曾文南,卢懿.斑蝥素及其衍生物的合成与活性研究进展[J].有机化学,2006(05):579-591.
[4]胡朝阳.斑蝥素含量测定方法研究进展[J].广州化工,2011,39(10):49-51.
[5]张云,李春民,赵桂森.去甲斑蝥素合成工艺的改进[J].化学试剂,2008,29(11):697-698.
[6]孙铭,朱争艳,于美丽,等.去甲斑蝥素纳米控释制剂抗肿瘤的实验研究[J].肿瘤学杂志,2001,7(6):321-325.
[7]徐春东,陆钢.去甲斑蝥素对皮肤致病真菌的药敏实验[J].中国兽医杂志,2000,26(3):33-34.
[8]Moed L, Shwayder T A, Chang M W. Cantharidin revisited: a blistering defense of an ancient medicine[J]. Archives of dermatology, 2001, 137(10): 1357-1360.
[9]王浴生,邓文龙,薛春生.中药药理与应用[M].北京:人民卫生出版社,1983:1140-1146.
[10]张志勇,袁锋.斑蝥素资源及其利用的研究进展α[J].西北农业学报,1996,5(4):89-92.
[11]何正春,彭芳,宋丽艳,等.美洲大蠊化学成分及药理作用研究进展[J].中国中药杂志,2007,32(21):2326-2331.
[12]沈鸣,陈建伟.氨基多糖的药理研究进展[J].上海医药,2001(06):268-270.
[13]Dos Santos AVF, Onofre GR, Oliveira DMP, et al. Heparan sulfate is the main sulfated glycosaminoglycan species in internal organs of the male cockroach, Periplaneta americana[J]. Micron.,2006,37(1): 41-46.
[14]金小宝,王艳,朱家勇.诱导前后美洲大蠊血淋巴抗菌活性的研究[J].广东药学院学报,2006(06):665-666,682.
[15]蓝江林,吴珍泉.美洲大蠊抗菌物质的诱导与提取[J].福建农业大学学报,2004(01):30-33.
[16]蓝江林,周先治,卓侃,等.美洲大蠊(Periplaneta americana L.)抗菌肽杀菌作用初步观察[J].福建农林大学学报(自然科学版),2004,33(2):166-168.
[17]周琼.美洲大蠊(Periplaneta americana L.)资源开发利用的研究[D]. 福州:福建农林大学,2008.
[18]Lopes AR, Terra WR. Purification, properties and substrate specificity of a digestive trypsin from Periplaneta americana (Dictyoptera) adults. [J]. Insect biochemistry and molecular biology, 2003, 33(4): 407-415.
[19]李树楠,李辉,张华明,等.美洲大蠊中促进肉芽生长成份的研究[J].云南医药,1987(03): 174-177.
[20]白丽,高鹏,陈俊雅,等.蟑螂提取物有效部位用于制备抑制真菌生长药物的用途[P].云南:CN102973608A,2013-03-20.
[21]Quiroga EN, Sampietro DA, Soberon JR, et al. Propolis from the northwest of Argentina as a source of antifungal principles[J]. Journal of applied microbiology, 2006, 101(1): 103-110.
[22]南垚,郭伽,郑莲香,等.蜂胶化学成分研究进展[J].世界科学技术,2006(01):61-71+56.
[23]马君,赵玉军,章金钢.蜂胶及其应用[J].动物医学进展,2000(01):16-18.
[24]孔庆峰,许志彤,邓玉文.国内蜂胶黄酮的药理学研究近况[J].实用医药杂志,2006,23(8): 1003-1004.
[25]金朝娜.浙江蜂胶的化学成分研究[D].大连:大连理工大学,2008.
[26]Marcucci MC. Propolis: chemical composition, biological properties and therapeutic activity[J]. Apidologie, 1995, 26(2): 83-99.
[27]Grunberger D, Banerjee R, Eisinger K, et al. Preferential cytotoxicity on tumor cells by caffeic acid phenethyl ester isolated from propolis[J]. Experientia, 1988, 44(3): 230-232.
[28]郭伽,周立东.蜂胶的化学成分研究进展[J].中国养蜂,2000, 51(2):17-18.
[29]Hegazi AG, Abd EI Hady FK, Abd Allah FA. Chemical composition and antimicrobial activity of European propolis[J]. Zeitschrift für Naturforschung C, 2000, 55(1/2): 70-75.
[30]Velikova M, Bankova V, Sorkun K, Houcine S, Tsvetkova I, Kujumgiev A. Propolis from the Mediterranean region: chemical composition and antimicrobial activity[J]. Zeitschrift für Naturforschung C, 2000, 55(9/10): 790-793.
[31]房柱,匡友成.蜂胶对医学真菌抑菌试验[J].微生物学通报,1978(1):12-14.
[32]Aguüero MB, Gonzalez M, Lima B, et al. Argentinean propolis from Zuccagnia punctata Cav.(Caesalpinieae) exudates: phytochemical characterization and antifungal activity[J]. Journal of Agricultural and Food Chemistry, 2009, 58(1): 194-201.
[33]Siqueira ABS, Gomes BS, Cambuim I, et al. Trichophyton species susceptibility to green and red propolis from Brazil[J]. Letters in Applied Microbiology, 2009, 48(1): 90-96.
[34]Silici S, Koc NA, Ayangil D, et al. Antifungal activities of propolis collected by different races of honeybees against yeasts isolated from patients with superficial mycoses[J]. Journal of Pharmacological Sciences, 2005, 99(1): 39-44.
[35]Dalben-Dota KF, Faria MG I, Bruschi ML, et al. Antifungal activity of propolis extract against yeasts isolated from vaginal exudates[J]. The Journal of Alternative and Complementary Medicine, 2010, 16(3): 285-290.
[36]Oliveira ACP, Shinobu CS, Longhini R, et al. Antifungal activity of propolis extract against yeasts isolated from onychomycosis lesions[J]. Memórias do Instituto Oswaldo Cruz, 2006, 101(5): 493-497.
[37]Martins RS, Pereira Jr ES, Lima SM, et al. Effect of commercial ethanol propolis extract on the in vitro growth of Candida albicans collected from HIV-seropositive and HIV-seronegative Brazilian patients with oral candidiasis[J]. Journal of Oral Science, 2002, 44(1): 41.
[38]Ota C, Unterkircher C, Fantinato V, et al. Antifungal activity of propolis on different species of Candida[J]. Mycoses, 2001, 44(9-10): 375-378.
[39]Fernandes FF, Dias ALT, Ramos CL, et al. The "in vitro" antifungal activity evaluation of propolis G12 ethanol extract onCryptococcusneoformans[J]. Revista do Instituto de Medicina Tropical de São Paulo, 2007, 49(2): 93-95.
[40]孙利文,徐惠爽.中药全蝎的研究进展[J].特产研究,1999(1):60-62.
[41]张荒生,王进军.中药全蝎的药理研究进展[J].中国中医急症,2007,16(2):224-226.
[42]周新华,蝎毒的生化研究及临床应用[J].生物化学与生物物理进展,1984,4(2):20-20.
[43]王琳,江岩.东亚钳蝎蝎毒蛋白的分离纯化[J].白求恩医科大学学报,1997,23(2):143-144.
[44]边六交,杨晓燕,王辉,等.钳蝎毒中抗癫痫肽,镇痛肽和抗肿瘤肽的快速同时分离和鉴定[J].分析化学,2005,5:619-622.
[45]吉永华,赵菁.蝎毒素可被用作构建肽类新药分子的“骨架”[J].生命的化学,1996,16(4): 32-34.
[46]余茂耘,韦传宝.蝎毒的生理活性成分及临床应用[J].中国临床康复,2004,8(9):1754-1755.
[47]张师艺,成秀莲.全蝎的成分,药理与中毒治疗[J].国外科技,1990(12):39-42.
[48]张贵君.全蝎乙醇提取物及蝎毒素体外抗表浅致病真菌的实验研究[J].中国中医药科技,1996,3(3):46-46.
[49]栾天庆.中医药治疗寻常性银屑病疗效观察[A].中华中医药学会皮肤科分会第五次学术年会:全国中医,中西医结合皮肤病诊疗新进展高级研修班论文集[C].2008.
[50]周永芹,韩莉.中药蜈蚣的研究进展[J].中药材,2008(2):315-319.
[51]谭复成.蜈蚣的药理作用及应用[J].现代医药卫生,2006,22(13):2031-2031.
[52]方红,邓芬.黑头蜈蚣的化学成分[J].中药材,1999,22(5):226-228.
[53]陶勇.蜈蚣毒的研究进展[J].中国生化药物杂志,2000,21(2):94-95.
[54]曲爱兵,赵维诚,梁良,等.蜈蚣组织提取物抗肿瘤活性的初步研究[J].实用肿瘤学杂志,2003,17(1):29-30.
[55]冉永禄,吴刚,王金焕,等.墨江蜈蚣与少棘蜈蚣的比较研究——Ⅱ.药效和毒理[J].动物学研究,1996,01:79-83.
[56]吴刚,王金焕,冉永禄,等.墨江蜈蚣与少棘蜈蚣对致病真菌和细菌体外生长的影响[J].皮肤病与性病,1992,14(2):12-14.
[57]任文华,张双全,宋大祥,等.少棘蜈蚣水提取物的抗菌活性[J].中药材,2007,30(1):10-14.
[58]周莉莉,黄迎春,任超.蜈蚣醇提取物和水提取物部分药理作用比较[J].时珍国医国药,2008,19(11):2697-2698.
[59]孟庆云.体外培育牛黄的研制及临床[J].中国中医基础医学杂志,2006,12(10):799-800.
[60]刘成德,刘洋,旺建伟.牛黄的药理作用及临床应用概况[J].中医药信息,2006,23(6):14-15.
[61]Schaffer S W, Solodushko V, Kakhniashvili D. Beneficial effect of taurine depletion on osmotic sodium and calcium loading during chemical hypoxia[J]. American Journal of Physiology-Cell Physiology, 2002, 282(5): C1113-C1120.
[62] 闫焕,赵文静,常惟智.牛黄的药理作用及临床应用研究进展[J].中医药信息,2013,(2):114-116.
[63]严克东,张启明.培植牛黄与天然牛黄化学成分比较研究: I. 胆红素和胆酸的含量比较[J].中药材,1990,13(10):11-13.
[64]刘军,邓祝玲.新雪颗粒中胆酸的含量测定[J].中药材,2001,24(11):821.
[65]张启明.天然牛黄的成分研究[J].中国生化药物杂志,1995,16(1):27.
[66]李桃渝,胡会平,成流毓,等.人工培植牛黄元素及氨基酸分析[J].中药材,1989,12(1):18-19.
[67]张启明,严克东,田颂九,等.培植牛黄与天然牛黄化学成分比较研究-Ⅴ. 游离和总氨基酸的测定及比较[J].中药材,1991(9):006.
[68]任立波,周虹.天然牛黄,人工培植牛黄与人工牛黄的鉴别[J].中国药业,2004,13(10):63-63.
[69]李培锋,哈斯苏荣,关红.胆红素含量不同的培植牛黄的镇静、镇痛及抗惊厥作用研究[J].内蒙古农牧学院学报,1998,(03):27-32.
[70]颜崇超,赵熙和,金大勋. 牛磺酸对血小板功能和花生四烯酸代谢的影响[J]. 营养学报,1996,04:379-385.
[71]贾静,孙佳明,臧浩,等.天然牛黄化学成分及药理活性研究进展[J].吉林中医药,2013(03):271-274.
[72]刘宪鸣.牛黄解毒片治疗霉菌性阴道炎112例[J].中国中医药科技,2005,12(3):196-197.
[73]邢艳芳.六神栓的制剂工艺及其对小鼠白念珠菌阴道炎治疗作用的实验研究[D].扬州:扬州大学,2009.
[74]唐绪刚,黄文权.五灵脂药理及临床应用概述[J].中国中医急症,2008,17(1):101-102.
[75]朱翔宇.五灵脂化学成分与质量控制标准研究[D].成都:西南交通大学,2010.
[76]杨东明,苏世文,李铣,等.五灵脂活性成分的研究[J].药学学报,1987,22(10):756-760.
[77]李强,鲁学照.五灵脂的研究进展[J].中国中药杂志,1998,23(9):570-573.
[78]张宝国,张大禄.动物药[M].北京:中国医药科技出版社,2003:60-71.
[79]沈鸣.海参的化学成分和药理研究进展[J].中成药,2001,23(10):758-761.
[80]马天舒,葛迎春.海参活性物质的药理研究进展[J].特产研究,2003,25(1):57-61.
[81]刘桂敏,赵秀梅,陈菊娣,等.刺参酸性粘多糖质控分析方法的研究[J].解放军预防医学杂志,2004,02:107-109.
[82]樊绘曾,陈菊娣,林克忠.刺参酸性粘多糖的分离及其理化性质[J].药学学报,1980(05):263-270.
[83]高存记,李家增,彭林,等.刺参酸性粘多糖对纤维蛋白凝胶结构及其溶解性的影响[J].中华血液学杂志,1996(09):11-14.
[84]Tapon-Bretaudiere J, Drouet B, Matou S, et al. Modulation of vascular human endothelial and rat smooth muscle cell growth by a fucosylated chondroit in sulfate from echinoderm [J]. Thromb Haemost, 2000, 84(2): 332-337.
[85]陈颖,汪树理.海参的化学成分与药理作用研究进展[J].河北渔业,2008(04):6-8.
[86]孙鹏.丑海参和白底辐肛参生物活性成分研究[D].上海:第二军医大学,2007.
[87]丛日山,袁文鹏,樊廷俊,等.仿刺参水溶性海参皂苷的分离制备及抗真菌活性的研究[J].中国海洋大学学报(自然科学版),2006,36(6):959-964.
[88]袁卫华,易杨华,薛梅,等.奇乳海参中两个具有抗真菌活性的三萜皂苷[J].中国天然药物, 2008,6(2):105-108.
[89]韩华,易杨华,李玲,等.糙海参中具有抗真菌活性的三萜皂苷(英文)[J].药学学报,2009(06): 620-624.
[90]王伟红,李发美,黄阁,等.海星化学成分及其活性的研究进展[J].中国海洋药物,2002(05): 46-50.
[91]De Marino S, Iorizzi M, Palagiano E, et al. Starfish saponins. 55.1 isolation, structure elucidation, and biological activity of the steroid oligoglycosides from an Antarctic starfish of the Family Asteriidae[J]. Journal of Natural Products, 1998(11): 1319-1327.
[92]Qi J, Ojika M, Sakagami Y. Linckosides A and B, two new neuritogenic steroid glycosides from the Okinawan starfish Linckia laevigata.[J]. Bioorganic and Medicinal Chemistry, 2002(6): 1961-1966.
[93]韩力挥,袁文鹏,丛日山,等.海星生物活性物质研究进展[J].海洋湖沼通报,2006(02):104-110.
[94]周鹏,顾谦群,王长云.海星皂甙及其他活性成分研究概况[J].海洋科学,2000(02):35-37.
[95]樊廷俊,张铮,袁文鹏,等.水溶性海星皂苷的分离纯化及其抗真菌活性研究[J].山东大学学报(理学版),2008(09):1-5.
[96]华影,唐晓磊,陈章权,等.中国南海多棘海星水提物抗皮肤真菌的活性分析[J].解放军医学院学报,2013(03):265-268.
[97]华影.多棘海星水提物抗皮肤真菌的效果研究[D]. 锦州:辽宁医学院,2013.
[98]冯丽,赵文静,常惟智.牡蛎的药理作用及临床应用研究进展[J].中医药信息,2011,28(01):114-116.
[99]胡婷,陈琼华.牡蛎多糖防治心血管病及其它生物活性[J].中国生化药物杂志,1993(1): 53-56.
[100] 楼永明,朱洪.福建牡蛎软体的化学成份研究[J].海峡药学,2004,15(5):67-68.
[101] 陈荣忠,杨丰.牡蛎肉提取物主要营养成份的分析[J].台湾海峡,1999,18(2):195-198.
[102] 赵鹏,李彬,杨俊峰,等.天然牛磺酸的降血脂作用[J].营养学报,2005,27(1):70-71.
[103] 宋海霞.海洋溶菌酶治疗阴道炎的应用研究[D].青岛:青岛大学,2005.
[104] 兰晓明,牟茜,王春波.牡蛎软体中抗菌蛋白对白色念珠菌超微结构的影响[J].中国海洋药物,2008,27(1):55-57.
[105] 王春波,兰晓明,王洪江,等.牡蛎软体中抗菌蛋白的制备及活性研究[J].海洋与湖沼,2010,41(1):33-38.
History and Prospective of Animal Derived Drugs for Treatment of Fungal Infections Diseases*
TENGFei1,2,CHENZhuang-zhi1,3,4,ZHANGYun1,2,LIWen-hui1,2,XUKai-ge1,3,4,LICheng-gong1,3,4,GAOPeng-fei1,3,4
(1 Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, Yunnan Dali 671000;2 Kunming Institute of Zoology, Chinese Academy of Sciences, Yunnan Kunming 650223;3 Yunnan Provincial 2011 Collaborative Innovation Center for Entomoceutics, Dali University, Yunnan Dali 671000;4 The National-Local Joint Engineering Laboratory for Entomoceutics, Yunnan Dali 671000, China)
The research, applications and cognition of animal derived drugs were reviewed n recent decades. From this we can appreciate the development of application of animal derived drugs by physicians of past papers. Based on textual research of past papers, the therapeutic effects were excavated and the clinical application was extended. The mechanism of animal derived drugs from multi-channel, multi-angle, multi-target was explored by making the best of the modern biological technology. The application of animal derived drugs would make new progress and play a more outstanding role in treatment of fungal infections diseases.
Spanish fly;Periplanetaamericana; propolis;ButhusmartensiiKarsch; centipede; calculus bovis; faeces trogopterorum; sea cucumber; sea star; oysters; antifungal
国家自然科学基金(No.81260676);药用特种昆虫开发国家地方联合工程研究中心创新能力建设项目(项目编号:云发改高技[2015]395);云南省战略性新兴产业项目发展专项资金([2013]1527);云南省高新技术产业发展重点项目([2012]1956);云南省2011协同创新中心项目([2012]25);云南省昆虫生物医药研发重点实验室专项经费(项目编号:2015DG030)。
滕飞(1989-),男,在读硕士研究生,研究方向为分子生物学和生物信息学。
高鹏飞,男,副教授、博士、硕士生导师,主要从事药物新剂型的研究。
TQ460
A
1001-9677(2016)012-0015-08
