黄芪多糖对严重烧伤大鼠心肌组织氧化应激和炎症反应的影响*
2016-08-31巩文艺河北省沧州市中心医院河北沧州061001
巩文艺 韩 冬(河北省沧州市中心医院,河北 沧州 061001)
黄芪多糖对严重烧伤大鼠心肌组织氧化应激和炎症反应的影响*
巩文艺△韩冬
(河北省沧州市中心医院,河北 沧州 061001)
目的 观察黄芪多糖 (APS)对严重烧伤大鼠心肌组织氧化应激和炎症反应的影响并探讨其作用机制。方法 取120只实验用大鼠随机分为6组:假烧伤组、模型组、APS低、中、高(100、200、400 mg/kg)组和地塞米松(5 mg/kg)组;除假烧伤组外,其余各组均采用92℃水浴18 s的方法制备30%TBSAⅢ度烧伤大鼠模型。测定血清中心肌酶(AST、CPK、LDH)和肌钙蛋白T(cTnT)含量,HE染色观察心肌组织病理性形态学变化,测定心肌组织中抗氧化酶(SOD、GSH-Px、CAT、MPO)活性,测定血清中总抗氧化能力(T-AOC)水平和丙二醛(MDA)含量;酶联免疫法(ELISA)检测血清中炎症细胞因子(CRP、TNF-α、IL-1、IL-6、IL-10)含量水平。结果 与模型组比较,APS中、高剂量组大鼠血清中AST、CPK、LDH和cTnT含量显著降低,心肌组织病变呈不同程度好转,以APS高剂量组效果最为显著;APS中、高剂量组心肌组织中SOD、CAT活性显著升高、MDA含量显著降低,其中高剂量组GSH-Px、MPO活性和T-AOC水平显著升高;APS中、高剂量组血清中CRP、TNF-α、IL-6含量显著降低,其中高剂量组IL-1含量显著降低且IL-10含量显著升高;上述差异具有统计学意义(P<0.05或P<0.01)。结论 APS通过改善抗氧化酶活性、提高氧自由基清除能力和降低炎症细胞因子而对严重烧伤大鼠心肌组织氧化应激和炎症反应的影响起抑制作用。
黄芪多糖烧伤氧化应激炎症反应
【Abstract】Objective:To investigate the effects and mechanism of Astraglus Polysaccharides(APS)on oxidative stress and inflammatory responses in severely burned rats.Methods:One hundred and twenty experimental rats were randomly devided into six groups:sham burned group,the model group,APS(100,200,400 mg/kg)groups and Dexamethasone(5 mg/kg)group.All groups,except sham burned group,were made by bathing in 92℃water for 18s after epilation.The content of AST,CPK,LDH and cTnT in serum were determined;the histopathological changes of myocardial tissue was observed by HE staining;the activity of SOD,GSH-Px,CAT and MPO in myocardial tissue were measured;the level of T-AOC and the content of MDA in serum were detected;the level of TNF-α,IL-1,IL-6,IL-8 and IL-10 in serum were also determined.Results:Compared with the model group,the content of AST,CPK,LDH and cTnT in serum of APS(200,400 mg/kg)groups were significantly decreased;the histopathological changes of APS groups were significantly improved,especially in the APS 400mg/kg group;the activity of SOD and CAT in APS(200,400 mg/kg)groups increased significantly and the contents of MDA decreased significantly;the activity of GSH-Px,MPO and the level of T-AOC in APS 400mg/kg group significantly increased;the level of CRP,TNF-α,IL-6 in APS(200,400 mg/kg)treated groups significantly decreased;the level of IL-1 in APS 400mg/kg group significantly decreased and the IL-10 significantly increased;all of the differences above were significant(P<0.05 or P<0.01).Conclusion:APS has inhibitory effects on oxidative stress and inflammatory responses in severely burned rats by improving the activity of antioxidant enzymes,enhancing radical scavenging and down-regulating the content of inflammatory cytokines.
【Key words】Astraglus Polysaccharides;Burn;Oxidative stress;Inflammation
严重烧伤不仅损害皮肤和皮下组织等直接受热力损伤的组织和器官,还可引起全身各组织器官并发症的发生。其中心肌损伤是烧伤早期即出现的并发症之一,还可诱发全身性炎症反应[1-2]。刘晟等[3]研究发现,氧化应激损伤是烧伤所致心肌损伤的重要病理机制之一,这也为研发降低烧伤损伤的新型药物提供了新的思路。黄芪多糖(APS)是中药黄芪的主要活性成分之一,是目前研究比较深入、临床应用比较广泛的中药提取物,具有抗氧化、抗炎、增强机体免疫功能等多种药理学作用[4-6]。本研究将采用92℃水浴18 s的方法制备30%TBSAⅢ度烧伤大鼠模型,观察APS对严重烧伤大鼠心肌组织氧化应激和炎症反应的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1药物与试剂
黄芪多糖 (西安沃森生物科技有限公司,批号:20140627);地塞米松磷酸钠注射液(焦作福瑞堂制药有限公司,规格:1 mL∶5 mg);乳酸钠林格注射液(河南华利药业有限责任公司);SOD、GSH-Px、CAT、MPO、T-AOC、MDA试剂盒购自南京建成生物工程研究所;AST、CPK、LDH、cTnT试剂盒购自深圳迈瑞生物医疗电子股份有限公司;CRP、TNF-α、IL-1、IL-6、IL-8、IL-10酶联免疫(ELISA)检测试剂盒(BlueGene公司生产,编号E02N0011)。
1.2实验动物
清洁级Wistar大鼠(雄性,8周龄,200~240 g),购自河北省实验动物中心,许可证号:SCXK(冀)2008-1-003。动物合格证号:201504027(BlueGene公司生产,编号E02N0011)。
1.3主要仪器
UV-1200紫外-可见光分光光度计 (上海美谱达仪器有限公司);BS-200全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);RM-2135型石蜡切片机(德国Leica公司);iMark型酶标仪(美国 Bio-Rad公司)。
1.4分组与造模
将120只实验用大鼠随机分为:假烧伤组,模型组,APS高、中、低剂量组(400、200、100 mg/kg)组和地塞米松(5 mg/kg)组,每组20只。参照黄跃生[7]报道的实验方法制备30%TBSAⅢ度烧伤大鼠模型:腹腔注射乌拉坦实施麻醉,经10%硫化钠脱毛24 h后,于92℃恒温水浴18s复制30%TBSAⅢ度烧伤(经病理切片证实);假烧伤组大鼠行麻醉、脱毛,然后于37℃恒温水浴18 s。造模完成后,各组大鼠均立即腹腔注射乳酸林格液(40 mg/kg)进行复苏;复苏的同时腹腔注射给药进行治疗,假手术组和模型对照组则分别给予等体积0.9%氯化钠注射液;给药治疗24 h后取材,检测各指标。
1.5标本采集与检测
1.5.1血清中心肌酶和cTnT含量的测定腹腔注射乌拉坦实施麻醉后,开腹经腹主动脉取血,1500 r/min离心10 min后取血清,按照各试剂盒操作方法步骤,通过生化分析仪平行测定各组大鼠血清中AST、CPK、LDH、cTnT含量。
1.5.2观察心肌组织病理性形态学变化待“1.5.1”取血完成后,开胸取心肌组织,4%多聚甲醛固定、石蜡包埋、切片和展片处理后,行常规HE染色,然后通过光学显微镜观察各组大鼠心肌组织病理性形态学变化。1.5.3心肌组织中抗氧化酶活性的测定取心肌组织,冲洗干净后剪碎,加入适量冷裂解液并进行研磨匀浆,3000 r/min离心10 min后取上层清液,按照各试剂盒操作方法逐步进行处理后,通过紫外-可见分光光度计平行测定各组大鼠心肌组织中SOD、CAT、GSHPx、MPO活性。
1.5.4血清中T-AOC水平和MDA含量的测定取“1.5.1”所制备的血清,按照各试剂盒操作方法逐步进行处理后,通过紫外-可见分光光度计平行测定各组大鼠血清中T-AOC水平和MDA含量。
1.5.5血清中炎症细胞因子含量的测定取“1.5.1”所制备的血清,按照ELISA试剂盒操作方法,逐步进行包被、加样、加酶标抗体、加底物液显色、终止反应处理后,通过酶标仪平行测定各组大鼠血浆中CRP、TNF-α、IL-1、IL-6、IL-10含量水平。
1.6统计学处理
2 结 果
表1 各组大鼠血清中心肌酶和cTnT含量的比较(±s)
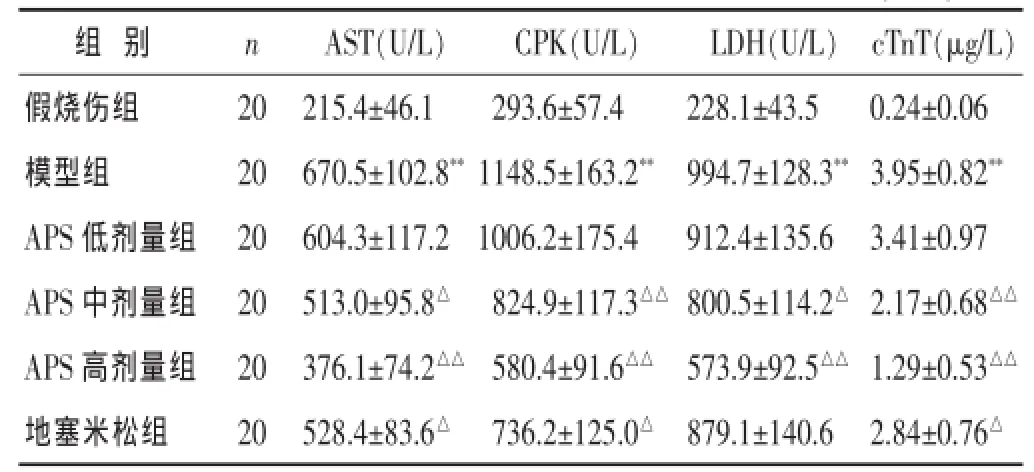
表1 各组大鼠血清中心肌酶和cTnT含量的比较(±s)
与假烧伤组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
?
2.1各组大鼠血清中心肌酶和cTnT含量的比较
见表1。模型组大鼠血清中AST、CPK、LDH、cTnT含量较假烧伤组均显著升高(P<0.01);与模型组比较发现,经APS(200、400 mg/kg)治疗24h能够显著降低严重烧伤大鼠血清中AST、CPK、LDH、cTnT含量 (P< 0.05或P<0.01)。
2.2各组大鼠心肌组织病理性形态学变化的比较
见图1。观察并比较各组大鼠心肌组织病理切片发现:假烧伤组大鼠未见异常,模型组大鼠心肌组织呈现心肌纤维排列紊乱、断裂,毛细血管充血,心肌细胞肿胀等病理性形态学变化;APS各组心肌组织病理性形态学变化明显好转,以APS高剂量(400 mg/kg)组效果最为显著。
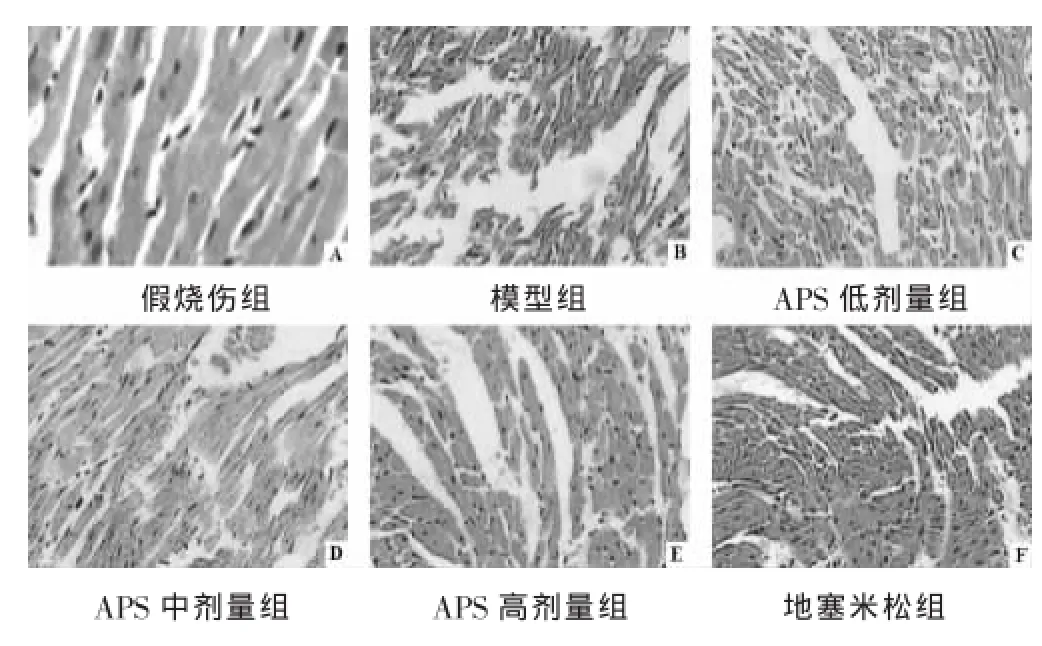
图1 各组大鼠心肌组织病理性形态学变化的比较(HE染色,×200)
2.3各组大鼠心肌组织抗氧化酶活性的比较
见表2。模型组大鼠心肌组织中抗氧化酶(SOD、GSH-Px、CAT、MPO)活性较假烧伤组显著降低 (P< 0.01);与模型组比较发现,经APS(200、400 mg/kg)治疗24 h能够显著升高严重烧伤大鼠SOD、CAT活性,其中APS高剂量(400 mg/kg)组GSH-Px、MPO活性显著升高(P<0.05或P<0.01)。
表2 各组大鼠心肌组织抗氧化酶活性比较(±s)
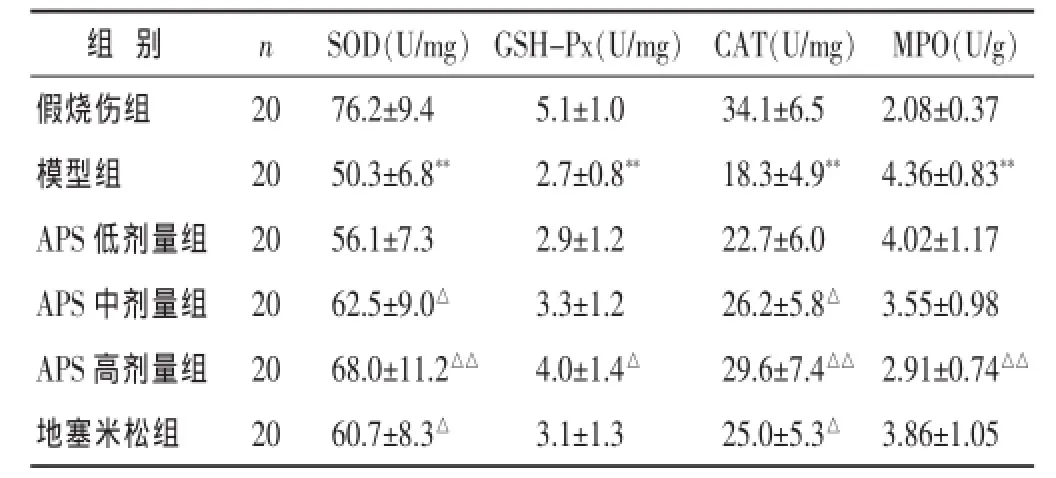
表2 各组大鼠心肌组织抗氧化酶活性比较(±s)
?
2.4各组大鼠血清中T-AOC水平和MDA含量的比较
见表3。模型组大鼠血清中T-AOC水平显著降低且而MDA含量显著升高 (P<0.01);经APS(200、400 mg/kg)治疗24 h能够显著降低严重烧伤大鼠血清中MDA含量(P<0.05或P<0.01),其中高剂量(400 mg/kg)组T-AOC水平显著升高(P<0.01)。
2.5各组大鼠血清中炎症因子含量的比较
见表4。模型组大鼠血清中炎症因子(CRP、TNF-α、IL-1、IL-6)含量显著升高、IL-10含量显著降低,差异均具有统计学意义(P<0.05或P<0.01);与模型组比较发现,经APS(200、400 mg/kg)治疗24 h能够显著降低严重烧伤大鼠血清中CRP、TNF-α、IL-6含量(P< 0.05或P<0.01),其中高剂量(400 mg/kg)组IL-10含量显著升高(P<0.05)。
表3 各组大鼠血清中T-AOC水平和MDA含量比较(±s)
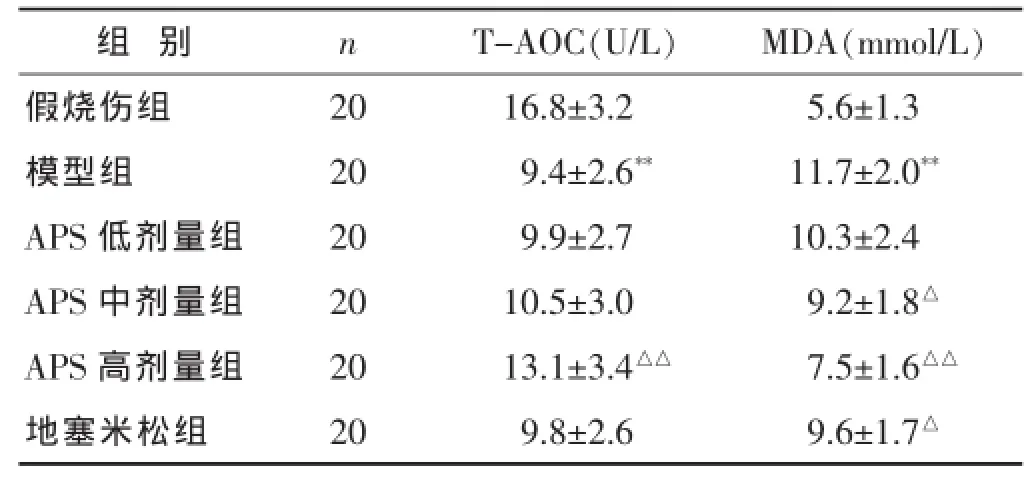
表3 各组大鼠血清中T-AOC水平和MDA含量比较(±s)
组 别 n T-AOC(U/L) MDA(mmol/L)假烧伤组 20 16.8±3.2 5.6±1.3模型组 20 9.4±2.6** 11.7±2.0**APS低剂量组 20 9.9±2.7 10.3±2.4 APS中剂量组 20 10.5±3.0 9.2±1.8△APS高剂量组 20 13.1±3.4△△ 7.5±1.6△△地塞米松组 20 9.8±2.6 9.6±1.7△
表4 各组大鼠血清中炎症因子含量比较(±s)

表4 各组大鼠血清中炎症因子含量比较(±s)
组别 n假烧伤组 20模型组 20 APS低剂量组 20 CRP(mg/L)TNF-α(μg/L)IL-1(pg/mL)4.7±1.9 0.99±0.28 109.5±9.7 20.3±4.6** 2.07±0.46** 167.3±15.2**19.0±5.2 1.89±0.45 152.8±17.6 APS中剂量组 20 16.7±4.3△ 1.56±0.38△△ 140.3±15.9△APS高剂量组 20 13.5±4.0△△1.39±0.42△△ 134.9±15.4△地塞米松组 20 11.9±3.6△△1.15±0.33△△ 117.6±10.8△△IL-6(pg/mL)IL-10(pg/mL)76.9±15.2 42.9±7.3 218.3±24.7** 26.5±5.1**204.5±29.6 28.3±6.4 176.3±28.0△ 30.9±6.0 145.1±23.6△△ 34.2±7.5△92.8±17.5△△ 38.0±7.1△△
3 讨 论
烧伤患者往往并发心肌组织损伤,并且由于心脏体内循环为动力器官,重度烧伤10 min后心输出量即下降50%以上,60 min后心输出量将不足1/3,所以由烧伤所引发的心肌损伤不仅可引起心功能不全,还可能导致或加重其他组织器官损伤,甚至诱发休克[1]。近年来,有研究表明氧化应激和炎症反应是烧伤所致心肌损伤的重要病理机制通路,这也为我们研发减轻烧伤损伤的新型药物提供了新的思路。
体内氧自由基(ROS)过剩是导致机体氧化应激损伤的病理基础。正常状态下,体内ROS的生成与清除处于动态平衡;首先,ROS在SOD催化作用下还原生成H2O2[8],并在GSH-Px或CAT的催化作用下进一步还原生成对人体无害的H2O和O2[9-10];MPO是中性粒细胞特有的酶,其活性也能够反映机体抗氧化能力[11],所以血清中SOD、GSH-Px、CAT及MPO共同构成了机体的抗氧化防御系统,其活性能够反映机体抗氧化能力;血清中T-AOC水平能够反映机体整体抗氧化能力,而血清中脂质过氧化产物MDA含量水平也能够间接反应机体氧化应激损伤程度[12]。
近年来有研究发现,炎症反应与烧伤所引发的心肌损伤密切相关[13],血清中炎症因子CRP、TNF-α、IL-1、IL-6、IL-10含量水平的检测是临床上监测炎症反应的重要指标,炎症反应发生后,血清中TNF-α、IL-1、IL-6、IL-8含量将显著升高而IL-10含量显著降低。黄芪多糖(APS)是中药黄芪的主要活性成分之一。李红法等[4]研究发现,APS能够通过改善机体抗氧化酶活性、提高自由基清除能力而表现出抗氧化作用;李承德等[5]研究发现,APS能够通过调节炎症细胞因子水平而表现出抗炎作用。而张家平等[2]和刘晟等[3]通过实验研究发现,氧化应激和炎症反应是烧伤所致心肌损伤的重要病理机制通路,因此APS对严重烧伤大鼠心肌组织氧化应激和炎症反应可能具有抑制作用。本研究采用92℃水浴18 s的方法制备的30%TBSAⅢ度烧伤模型大鼠进行研究发现:与模型组比较,APS治疗组大鼠心肌组织病变显著减轻,血清中心肌酶(AST、CPK、LDH)含量和cTnT含量显著降低,心肌组织中抗氧化酶(SOD、GSH-Px、CAT、MPO)活性显著升高,血清中T-AOC水平显著升高且MDA含量显著降低;血清中炎症细胞因子(CRP、TNF-α、IL-1、IL-6)含量显著降低,IL-10含量显著升高。结果提示APS对严重烧伤大鼠心肌组织氧化应激和炎症反应具有抑制作用,而表现出对严重烧伤大鼠心肌组织的保护作用[14-15];其作用机制可能与APS能够有效改善抗氧化酶活性、抑制氧化应激损伤以及调节炎症因子表达有关。
[1]黄跃生,李志清,吴庆云,等.缺血缺氧在烧伤后“休克心”中的作用及其机理探讨[J].中华烧伤杂志,2002,18(4):205-209.
[2] 张家平,黄跃生,刘敬,等.烫伤大鼠心肌细胞丝裂素活化蛋白激酶的活化及胞内分布规律的研究[J].中华烧伤杂志,2003,19(3):137-140.
[3]刘晟,陈旭林,蔡晨,等.葛根素对烫伤大鼠早期心肌组织丙二醛、髓过氧化物酶的影响[J].中华急诊医学杂志,2006,15(8):700-702.
[4]李红法,郭松波,满淑丽,等.乙醇分级沉淀提取黄芪多糖及其理化性质和抗氧化活性研究[J].中国中药杂志,2015,40(11):2112-2116.
[5]李承德,周文宾,孙艳,等.黄芪多糖对哮喘大鼠Th17/Treg细胞因子及肺部炎症的影响[J].中国药理学通报,2013,29(9):1275-1278.
[6] 陈丹丹,宋亮,刘丽娟,等.黄芪多糖对肺气虚小鼠免疫调节作用[J].陕西中医学院学报,2007,30(3):35-37.
[7]黄跃生.烧伤后早期心肌损害的分子机制及防治研究进展[J].中华烧伤杂志,2004,20(5):257-259.
[8]Lartigue A,Burlat B,Coutard B,et al.The megavirus chilensis Cu,Zn-Superoxide Dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[9]Yoon GA,Park S.Antioxidant action of soy isoflavones on oxidative stress and antioxidant enzyme activities in exercised rats[J].Nutr Res Pract,2014,8(6):618-624.
[10]Li G,Zhang HX,Wang YP,et al.Protective effect of phloroglucinol on renal ischemia and reperfusion injury[J]. Beijing Da Xue Xue Bao,2015,47(5):743-748.
[11]刘振,王鹏飞,刘玲玲,等.髓过氧化物酶在急性冠脉综合征危险分层中的临床意义[J].中西医结合心脑血管病杂志,2015,13(5):700-701.
[12]Li J,Duan X,Dong D,et al.Hepatic and nephric NRF2 pathway Up-Regulation,an early antioxidant response,in acute arsenic-exposed mice[J].Int J Environ Res Public Health,2015,12(10):12628-12642.
[13]黄跃生.烧伤后早期心肌损害的分子机制及防治研究进展[J].中华烧伤杂志,2004,20(5):257-259.
[14]Dalla Vestra M,Masiero A,Roiter AM,et al.Is podocyte injury relevant in diabetic nephropathy Studies in patients with type 2 diabetes[J].Diabetes,2003,52(4):1031-1035
[15]Murata I,Takemura G,Asano K,et al.Apoptotic cell loss following cell proliferation in renal glomeruli of Otsuka Long-Evans Tokushima Fatty rats,a model of human type 2 diabetes[J].Am J Nephrol,2002,22(6):587-595.
The Effects of Astraglus Polysaccharides on Oxidative Stress and Inflammatory Responses in Severely Burned Rats
GONG Wenyi,HAN Dong. Cangzhou Central Hospital,Hebei,Cangzhou 061001,China.
R285.5文献标志码:A
1004-745X(2016)06-1005-04
10.3969/j.issn.1004-745X.2016.06.017
河北省沧州市科学技术研究与发展计划项目(151302166)
△(电子邮箱:czhjlw@163.com)
(2015-11-20)
