抗炎合剂对脓毒症急性肺损伤大鼠血清可溶性CD80、CD86、TNF-α、IL-10水平的影响*
2016-08-31汪海慧闫国良熊旭东上海中医药大学附属上海市中医医院上海0007上海中医药大学附属曙光医院上海000
汪海慧 闫国良△ 熊旭东(.上海中医药大学附属上海市中医医院,上海 0007;.上海中医药大学附属曙光医院,上海 000)
抗炎合剂对脓毒症急性肺损伤大鼠血清可溶性CD80、CD86、TNF-α、IL-10水平的影响*
汪海慧1闫国良1△熊旭东2
(1.上海中医药大学附属上海市中医医院,上海 200071;2.上海中医药大学附属曙光医院,上海 200021)
目的 观察抗炎合剂对脓毒症急性肺损伤大鼠血清可溶性CD80、CD86水平的影响。方法 清洁级健康雄性SD大鼠随机分为假手术组、模型组、抗炎合剂组、清开灵组。采用盲肠结扎穿孔术(CLP)制备脓毒症急性肺损伤模型,分别于造模后24 h处死动物,并进行肺组织HE染色,测定大鼠血清可溶性CD80、CD86及肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)含量。结果 模型组大鼠CD80、CD86含量较假手术组明显增高(P<0.01),抗炎合剂组CD80、CD86含量较模型组明显降低(P<0.01)。抗炎合剂组CD80含量低于清开灵组(P<0.01),CD86与清开灵组差异不明显(P>0.05)。模型组大鼠血清TNF-α、IL-10含量较假手术组明显增高(P<0.01);抗炎合剂组TNF-α、IL-10较模型组明显降低(P<0.01),而TNF-α/IL-10(Th1/Th2)比值则高于模型组(P<0.05);清开灵组IL-10值高于抗炎合剂组(P<0.01),而TNF-α及TNF-α/IL-10与抗炎合剂组无明显差异(P>0.05)。结论 抗炎合剂可通过减少CD80、CD86的表达减少炎症因子释放,从而有效减轻大鼠的肺损伤程度。
抗炎合剂脓毒症急性肺损伤可溶性CD80可溶性CD86
【Abstract】Objective:To observe the influence of anti-inflammatory decoction on soluble CD80(sCD80),and soluble CD86(sCD86)in serum of rats with acute lung injury induced by sepsis.Methods:Male clean SD rats were randomly divided into sham operation group,the model group,anti-inflammatory group,Qingkailing group. Models with acute lung injury induced by sepsis were reproduced in rats with cecal ligation and puncture(CLP). Each rat was tested 24h after CLP.Histopathological sections of the lung tissues of the rats were stained by HE for observation of histopathological changes.The content of sCD80,sCD86,TNF-α and IL-10 of the serum of the rats were also measured for the observation of inflammation.Results:Compared with sham operation group,there was significant increase in the content of sCD80,sCD86,TNF-α and IL-10 in the serum of the model group.On the other side,compared with the model group,the content of sCD80,sCD86,TNF-α,and IL-10 in the serum of Anti-inflammatory group and Qingkailing group decreased,especially in the Anti-inflammatory group.Conclusion:Anti-inflammatory can effectively decrease the inflammation by decreasing the expression of sCD80 and sCD86 to reduce the production of TNF-α and IL-10 in rats with acute lung injury induced by sepsis.
【Key words】Anti-inflammatory;Sepsis;Acute lung injury;Soluble CD80;Soluble CD86
脓毒症(Sepsis)是由细菌感染所致的全身炎症反应综合征(SIRS)。急性肺损伤(ALI)是各种原因造成弥漫性肺间质及肺泡水肿,而导致的急性低氧性呼吸功能不全。引起ALI的原因中,脓毒症被认为是最主要的高风险因素[1]。目前机体内促炎、抗炎的失衡被视为脓毒症的主要发病机制之一,而调节性T细胞(Treg)介导的辅助性T细胞(Th1)/Th2的漂移被认为是炎症平衡失调的主要原因[2]。CD80、CD86是近年来发现的2个参与T细胞活化的协同刺激分子,具有参与调节Treg的功能[3],并为参与肺系疾病发病机制中的重要因子[4]。目前Th在脓毒症进展过程中的作用越来越受到学者们的关注,而CD80、CD86与脓毒症肺损伤的相关性研究报道相对较少。本课题组在大量临床实践的基础上,创立中药复方“抗炎合剂”并证实其可有效减轻脓毒症患者的炎症反应[5]。综上,本研究拟通过制备脓毒症急性肺损伤大鼠模型,探索脓毒症急性肺损伤大鼠血清可溶性CD80(sCD80)、CD86 (sCD86)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10 (IL-10)的变化,以及中药抗炎合剂对其的影响。现报告如下。
1 材料与方法
1.1动物健康雄性SD大鼠,40只,清洁级,体质量200~220 g,由上海中医药大学附属上海市中医医院实验中心提供,合格证号SYXK(沪)2014-0019,饲养于上海中医药大学附属上海市中医医院实验中心清洁级动物房,室温23℃,湿度50%,12 h照明,动物自由进食饮水。
1.2药物与试剂抗炎合剂由生大黄、黄芩、败酱草、厚朴、黄连组成,所有药物均为符合2010版《中国药典》规定并加工炮制合格的饮片,由上海中医药大学附属上海市中医医院中药房提供,并由制剂中心制备成含生药1.0 g/mL的棕色透明液体,置4℃冰箱保存备用。清开灵胶囊规格:每粒0.4 g(含黄芩甙20 mg),购自神威药业集团,批号14060111。
1.3分组与造模采用盲肠结扎穿孔术(CLP)制备脓毒症急性肺损伤大鼠模型[6]:大鼠经10%水合氯醛麻醉后,以腹正中作一1.5 cm长的切口,找到盲肠,在其根部结扎,用5 mL注射器针头穿通3次,轻挤出少量肠内容物,留置2 mm皮瓣防止针孔闭合,还纳盲肠于腹腔,逐层缝合腹壁切口,术毕皮下注射0.9%氯化钠注射液抗休克。大鼠随机分为4组,即假手术组、模型组、抗炎合剂组、清开灵组,每组各10只,适应性饲养1周。假手术组以生理盐水灌胃3 d后行假手术(经麻醉后开腹,轻轻翻动肠道后关腹),术后24 h麻醉并腹主动脉采血致死;模型组、抗炎合剂组、清开灵组分别以0.9%氯化钠注射液、抗炎合剂、清开灵灌胃3 d (9.9 g/kg)后行CLP术,术后24 h麻醉并腹主动脉采血致死。
1.4标本采集与检测以10%水合氯醛(0.5 mL/100 g)大鼠腹腔注射麻醉,开腹后经腹主动脉取血,4℃静置2 h后,3000 r/min,10 min,4℃离心,吸取上清,分装,按照sCD80、sCD86、TNF-α、IL-10ELISA试剂盒 (购自上海富勒生物科技有限公司)说明书的方法操作,在450 nm处测吸光度,并以TNF-α/IL-10比值作为Th1/Th2。沿大鼠左右肋软骨迅速打开胸腔,快速取出左右肺,冰上切取左、右肺组织。取右肺用冰0.9%氯化钠注射液冲洗表面,取1/3右肺组织标本用于HE染色,余肺组织-70℃保存备用。
1.5统计学处理应用SPSS18.0统计软件。计量资料以(±s)表示。采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1一般情况假手术组大鼠形态、进食、呼吸状况、活动量无明显异常,大便正常;模型组大鼠术后精神萎软,体毛竖立、凌乱,活动减少,多呈蜷缩状,眼鼻处分泌物多,不欲进食,呼吸急促,腹部膨隆,无大便;抗炎合剂组与清开灵组大鼠术后精神状况、活动量及眼鼻分泌物好于模型组。
2.2肺组织病理染色见图1。假手术组肺组织形态、结构正常,肺泡腔内清晰,间质无明显水肿、炎症等病理改变;模型组可见肺间质水肿明显,炎症细胞大量浸润,肺泡明显减少,肺组织实变明显;抗炎合剂及清开灵组与模型组相比,损伤范围较小,肺泡量较多,肺间质水肿及炎性细胞浸润相比模型组较好,肺实变较轻。见图1。

图1 各组大鼠肺组织(HE染色,×100)
2.3各组血清可溶性CD80含量的比较见表1。模型组大鼠CD80含量较假手术组明显增高 (P<0.01),抗炎合剂组CD80含量较模型组明显降低 (P<0.01),并且CD80含量低于清开灵组(P<0.01)。
表1 各组大鼠CD80、CD86表达结果比较(±s)

表1 各组大鼠CD80、CD86表达结果比较(±s)
与假手术组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与抗炎合剂组比较,##P<0.01。下同。
组 别 n CD80(pg/mL) CD86(ng/mL)假手术组 10 18.284±1.990 4.122±0.463模型组 10 49.523±2.717** 6.530±0.258**抗炎合剂组 10 28.908±0.687△△ 3.747±0.194△△清开灵组 10 44.529±2.877## 4.845±0.400
2.4各组血清可溶性CD86含量的比较见表1。与假手术相比,模型组大鼠CD86含量明显增高,差异有统计学意义(P<0.01);抗炎合剂组CD86含量较模型组明显降低(P<0.01),而与清开灵组差异不明显。
2.5各组血清TNF-α、IL-10含量的比较见表2。模型组大鼠血清TNF-α、IL-10含量较假手术组明显增高(P<0.01);抗炎合剂组TNF-α、IL-10较模型组明显降低(P<0.01),而TNF-α/IL-10(Th1/Th2)比值则高于模型组(P<0.05);清开灵组IL-10值高于抗炎合剂组(P<0.01),而TNF-α及TNF-α/IL-10与抗炎合剂组无明显差异(P>0.05)。
表2 各组大鼠TNF-α、IL-10含量及TNF-α/IL-10比值测定(±s)
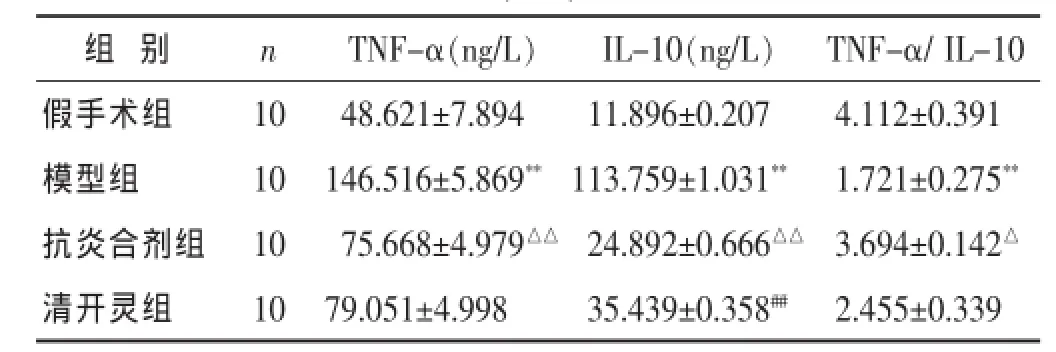
表2 各组大鼠TNF-α、IL-10含量及TNF-α/IL-10比值测定(±s)
组 别 n TNF-α(ng/L)IL-10(ng/L) TNF-α/IL-10假手术组 10 48.621±7.894模型组 10 146.516±5.869**抗炎合剂组 10 75.668±4.979△△11.896±0.207 4.112±0.391 113.759±1.031** 1.721±0.275**24.892±0.666△△ 3.694±0.142△清开灵组 10 79.051±4.99835.439±0.358## 2.455±0.339
3 讨 论
脓毒症属中医学“温病”“热病”范畴,而脓毒症急性肺损伤则属于“喘证”“暴喘”“喘脱”范畴。中医学认为肺失宣降是ALI发生的病理基础,痰热瘀闭是ALI发展的病机,肺不主气是ALI转危之病理关键,而肺与大肠相表里,肺热叶焦、功能失调,肠道津亏,毒邪聚集肠中,久则热毒互结,内陷营血,内损脏腑脉络,气血失和,整体功能失调。基于此,笔者采取清热通腑、活血排毒之法,创立抗炎合剂,方中大黄为君,泻下攻积、清热泻火、活血祛瘀,黄芩、黄连为臣,清热燥湿,泻火解毒,厚朴、败酱草为佐,行气、平喘、消痈排脓,全方共奏苦寒并用以清热,通腑活血以排毒之功。在前期临床试验中,此方联合西医治疗热毒互结、腑气不通及脉络瘀滞的脓毒症急性肺损伤患者在改善症状及减轻炎症反应方面取得了较好的疗效[7-9]。
CD80、CD86属于免疫球蛋白超家族成员,分别于1989、1993年由Freeman首次发现并克隆成功,并在第5届白细胞分化抗原大会正式命名。CD80、CD86是2个提供协同刺激信号的重要分子。近年来研究发现CD80、CD86与CD28结合后可导致T淋巴细胞的增殖,诱导NF-κB和炎性细胞因子的产生[10],并使免疫应答向Th1和Th2分化,其中CD80主要刺激CD4+T细胞向Th1细胞分化,而CD86则共刺激CD4+T细胞向Th2细胞分化[3],这在介导肺部炎症及气道反应上起着重要的作用[11]。脓毒症ALI的本质是机体炎症反应的失控,而促炎反应和抗炎反应失衡是炎症反应失控的主要表现。T辅助淋巴细胞Th1/Th2的功能能够反映机体促炎和抗炎反应的失衡情况。Th1细胞以分泌干扰素-γ(IFN-γ)、TNF-α、IL-2等促炎细胞因子为主,Th2细胞以分泌IL-10、IL-4、IL-5等抗炎细胞因子为主[12]。机体正常时,Th1和Th2细胞功能处于动态平衡中,维持机体正常的细胞免疫和体液免疫。在脓毒症感染过程中,机体启动致炎反应的同时也启动了抗炎反应,感染早期表现为以炎性反应为主的Th1反应,晚期则表现为抗炎反应为主的Th2反应,或表现为混合反应,而促炎介质的增多与脓毒症的病死率增加有关,抗炎介质增加也预示着脓毒症的病情严重程度及预后不良[13-15]。
本项研究中模型组大鼠血清可溶性CD80、CD86、TNF-α、IL-10较假手术组均明显上升,而抗炎合剂组该组指标则明显下降,且TNF-α/IL-10较模型组增高。据此笔者推断抗炎合剂可能通过减少脓毒症ALI大鼠CD80、CD86表达,抑制IL-10、TNF-α等细胞因子的释放,减少Th1向Th2漂移,从而减轻肺组织炎症反应,其可作为治疗脓毒症ALI的一个方向,进一步深入研究。
[1]Bersten AD,Edibam C,Hunt T,et al.Incidence and mortality of acute lung injury and the acute respiratory distress distress syndrome in three Australian states[J].Am J Respir Crit Care Med,2002,165(4):443-448.
[2]李元朝.在脓毒症的发病机制中,辅助性T细胞(Th)1、Th2细胞分别扮演着什么样的角色[J].创伤外科杂志,2010,12(4):343.
[3]陈洁,孙中文.CD80和CD86介导的共刺激信号的比较及其生物学作用[J].国际免疫学杂志,2006,29(1):1-4.
[4]韦旋,邓静敏,邹小英,等.支气管哮喘患者血清sCD86水平及联合吸入治疗对其影响的研究[J].中华哮喘杂志,2012,6(2):18-20.
[5]李越华,李海涛,卜建宏,等.抗炎合剂对脓毒症患者NF-κB、IL-1及IL-10的影响[J].陕西中医,2013,34(7):808-809.
[6]Chaudry IH,Wichterman KA,Baue AE.Effect of sepsis on tissue adenine nucleotide levelas[J].Surgery,1979,85(2):205-211.
[7]李越华,李海涛.抗炎合剂对脓毒症患者核因子NF-κB及炎症因子的影响[J].中国中医急症,2012,21(5):692-693.
[8]李越华,杨兴才,卜建宏.中药抗炎合剂干预全身炎症反应综合征的临床研究[J].中国中西医结合急救杂志,2009,16(5):262-264.
[9]卜建宏,李越华,何文姬.抗炎合剂在早期脓毒症患者中的治疗作用[J].现代中西医结合杂志,2011,20(32):4047-4055.
[10]Nolan A,Kobayashi H,Naveed B,et al.Differential role for CD80 and CD86 in the regulation of the innate immune response in murine polymicrobial sepsis[J].PLoS ONE,2009,4(8):e6600.
[11]Mark DA,Donovan CE,De Sanctis GT,et al.B7-1(CD80)and B7-2(CD86)have complementary roles in mediating allergic pulmonary inflammation and airway hyperresponsiveness[J].Am J Respir Cell Mol Biol,2000,22(3):265-71.
[12]邹晓,宋康.急性肺损伤Th1/Th2细胞因子平衡与中医药的调节作用[J].江西中医药,2008,39(4):71-73.
[13]王萍,张丽丽.脓毒症与辅助T细胞功能[J].河北医药,2009,31(22):3127-3129.
[14]冯英凯,徐剑铖,杨庆华,等.内毒素肺损伤大鼠Th1,Th2细胞凋亡的变化及其作用探讨[J].重庆医学,2005,34(1):74-77.
[15]孙颖,徐岫岚,张秀春.老年缺血性卒中合并急性肺损伤患者血清Th1/Th2细胞因子表达分析[J].细胞与分子免疫学杂志,2010,26(10):1048-1049.
Effect of Anti-inflammatory Decoction on Soluble CD80 and Soluble CD86 in Serum of Rats with Acute Lung Injury Induced by Sepsis
WANG Haihui,YAN Guoliang,XIONG Xudong. Shanghai Traditional Chinese Medicine Hospital Affiliated to Shanghai University of T.C.M.,Shanghai 200071,China.
R285.5文献标志码:A
1004-745X(2016)06-0981-04
10.3969/j.issn.1004-745X.2016.06.011
上海市卫生局科研项目(20124068)
△(电子邮箱:7120@szy.sh.cn)
(2016-02-20)
