银杏内酯B对H2O2诱导H9C2心肌细胞凋亡的影响*
2016-08-31孙立峰田延冰孟剑锋谢兰兰河北省邢台市人民医院河北邢台054031
李 亮 彭 辉 孙立峰 田延冰 孟剑锋 谢兰兰(河北省邢台市人民医院,河北 邢台 054031)
银杏内酯B对H2O2诱导H9C2心肌细胞凋亡的影响*
李亮△彭辉孙立峰田延冰孟剑锋谢兰兰
(河北省邢台市人民医院,河北 邢台 054031)
目的 观察银杏内酯B(GB)对H2O2诱导H9C2心肌细胞凋亡的影响及其机制。方法 将对数生长期的 H9C2心肌细胞随机分为 5组:对照组、H2O2(200 μmol/L)干预组、GB(50、100和 200 μmol/L)+H2O2(200 μmol/L)干预组,每组设10个复孔。经药物干预16 h后,采用MTT法检测细胞存活率;测定培养液中心肌酶(AST、CPK、LDH)活性;检测细胞中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量;通过流式细胞仪检测细胞凋亡状况并计算凋亡率,采用RT-PCR法检测细胞中AKT mRNA、Bcl-2 mRNA、Bax mRNA表达,计算Bcl-2/Bax表达比值,Western blot法检测细胞核因子-κB(NF-κB)蛋白表达并进行半定量分析,比色法检测细胞中Caspase-3、Caspase-9活性。结果 与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞存活率显著升高(P<0.01),培养液中AST、CPK、LDH活性显著降低(P<0.05或P<0.01),细胞中SOD、CAT活性显著升高且MDA含量显著降低(P<0.05或P<0.01);GB干预组细胞凋亡状况明显好转,其中GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞凋亡率显著降低(P< 0.01),AKT mRNA和bcl-2 mRNA表达显著上调(P<0.05或P<0.01),Bax mRNA表达显著下调(P<0.01),Bcl-2/Bax表达比值显著升高(P<0.01),细胞中NF-kB蛋白表达量和Caspase-3、Caspase-9活性显著降低(P<0.05或P<0.01)。结论 GB对H2O2诱导损伤H9C2心肌细胞凋亡具有抑制作用;其作用机制可能与GB能够有效改善抗氧化酶活性、降低氧化应激损伤,下调NF-κB蛋白表达,上调抗凋亡基因AKT和bcl-2表达、下调促凋亡基因Bax表达,提高Bcl-2/Bax表达比值,降低Caspase-3、Caspase-9活性有关。
银杏内酯BH9C2心肌细胞过氧化氢凋亡机制
【Abstract】Objective:To investigate the effects and mechanism of Ginkgolide B(GB)on apoptosis of H9C2 cardiomyocytes induced by H2O2.Methods:H9C2 cardiomyocytes in logarithmic phase were randomly divided into the normal control group,H2O2group,GB(50,100,200 μg/mL)+H2O2groups(n=10).Sixteen hours after the drugs were given,the survival rate was detected with MTT;the activity of AST,CPK and LDH in culture medium were detected;the activity of SOD,CAT and the content of MDA in cardiomyocytes were determinted;the cardiomyocytes apoptosis was observed with flow cytometry and the apoptosis rate was calculated;the expression of AKT mRNA,bcl-2 mRNA and Bax mRNA were detected with RT-PCR,and the ratio of bcl-2/Bax was calculated;the expression of NF-kB proten was detected with Western blot and Semi-quantitatively analysized;the activity of caspase-3 and caspase-9 were determined.Results:Compared with the H2O2group,the survival rate in GB (100,200 μg/mL)+H2O2groups significantly increased(P<0.01);the activity of AST,CPK and LDH in culture medium significantly decreased(P<0.05 or P<0.01);the activity of SOD and CAT in cardiomyocytes significantly increased and the content of MDA significantly decreased(P<0.05 or P<0.01);the cardiomyocytes apoptosis were improved and the apoptosis rate significantly decreased(P<0.01);the expression of AKT mRNA and bcl-2 mRNA was significantly up-regulated,while the expression of Bax mRNA was significantly down-regulated;the ratio of bcl-2/Bax significantly increased(P<0.01);and the expression of NF-kB significantly down-regulated(P< 0.05 or P<0.01);the activity of caspase-3 and caspase-9 significantly decreased(P<0.05 or P<0.01).Conclu-sion:GB has inhibitive effects on apoptosis of H9C2 cardiomyocytes induced by H2O2,which is perhaps related to its effects of improving the activity of antioxidase,depressing oxidative stress,down-regulating the expression of NF-kB proten,up-regulating the expression of anti-apoptotic genes AKT and bcl-2,down-regulating the expression of pro-apoptotic genes Bax,raising the ratio of bcl-2/Bax,and lowering the activity of caspase-3 and caspase-9.
【Key words】Ginkgolide B;H9C2 cardiomyocytes;H2O2;Apoptosis;Mechanism
研究发现,萜内酯类化合物为银杏叶的主要有效成分,包括银杏内酯A、B、C、M和白果内酯。研究表明银杏内酯为血小板活化因子(PAF)拮抗剂,活性最强的即为银杏内酯B(GB),具有抗炎、抗氧化,抗感染等多种药理学作用[1-3]。本实验通过制备H2O2诱导损伤H9C2心肌细胞模型,研究GB对H2O2损伤H9C2心肌细胞凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1试剂与仪器大鼠H9C2心肌细胞株(中国科学院上海细胞库);GB(美国Sigma公司,纯度≥90%);DMEM培养基、小牛血清(美国Gibco公司);二甲基亚砜(DMSO)、甲基四唑蓝(MTT,美国Sigma公司);天门冬氨酸氨基转移酶(AST)、肌酸磷酸激酶(CPK)、乳酸脱氢酶(LDH)活性检测试剂盒(深圳迈瑞生物医疗电子股份有限公司);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性检测试剂盒,丙二醛(MDA)含量检测试剂盒,Caspase-3、Caspase-9活性检测试剂盒,AnnexinV/PI细胞凋亡检测试剂盒(碧云天生物技术公司);NF-κB单克隆抗体(南京建成生物工程研究所);cDNA逆转录试剂盒 (上海斯信生物科技有限公司);AKT、bcl-2、Bax引物(上海博亚生物公司)。主要仪器包括:WT-IND型超净工作台(北京王堂蓝翼科技有限公司);CO2培养箱(美国Thermo公司);超速低温离心机(德国Eppendorf公司);FACSAria流式细胞仪(美国BD公司);BS-200全自动生化分析仪 (深圳迈瑞生物医疗电子股份有限公司);UV-3200PCS紫外可见分光光度计(上海美谱达仪器有限公司);VCX750型超声波细胞破碎仪(美国SONICS公司);RT-PCR仪(武汉新未来仪器技术有限公司);DYY-11型多用电泳仪(北京六一仪器厂);JY-SCZ2电泳槽(北京六一仪器厂)。
1.2细胞的培养与分组H9C2心肌细胞经常规复苏后接种于含15%胎牛血清、100 g/L双抗的DMEM/F12培养液中,然后置于细胞培养箱(37℃、5%CO2)中进行培养,每72小时换液并传代1次。取对数生长期H9C2心肌细胞分为5组:对照组、H2O2(200 μmol/L)干预组、GB(50、100和200 μmol/L)+H2O2(200 μmol/L)干预组,每组设10个复孔。经药物干预16 h后,检测各指标。
1.3检测指标1)细胞存活率的检测:采用MTT法分别测定各组细胞存活率:将细胞接种于96孔培养板内(n=6),每孔加入20 μL MTT溶液(5 mg/mL),经37℃孵育4 h后弃上清,每孔加入150 μL DMSO后振荡15 min,通过酶标仪检测490 nm处OD值,然后计算细胞存活率:细胞存活率(%)=(实验组OD值/对照组OD值)×100%。2)培养液中AST、CPK、LDH活性的测定:取细胞培养液并按照各试剂盒操作方法步骤,通过全自动生化分析仪平行测定各组细胞培养液中AST、CPK、LDH活性。3)细胞内SOD、CAT活性和MDA含量的检测:经离心后弃培养基取细胞,每孔加入2 mL PBS溶液,冰浴中破碎处理30 s后,经3500 r/min低温(4℃)离心10 min后取上清液,然后通过紫外-可见分光光度计平行测定各组细胞裂解液中SOD、CAT活性和MDA含量。4)细胞凋亡的检测及细胞凋亡率的计算:采用胰酶(0.25%)消化细胞,离心后弃上清液,经PBS溶液将洗涤2次后,按照细胞凋亡检测试剂盒操作方法步骤加入500 μL Binding Buffer、5 μL AnnexinV、5 μL PI,混匀,室温避光孵育10 min后采用流式细胞仪进行检测,观察各组细胞凋亡状况并在流式二维图中计算凋亡率。5)细胞中AKT mRNA、bcl-2 mRNA、Bax mRNA表达的检测及bcl-2/Bax表达比值的计算:从基因库中查阅大鼠AKT、bcl-2、Bax、βactin基因cDNA序列并通过Oligo软件设计上、下游引物;常规消化后收集各组细胞,加入适量TRIzol试剂提取总RNA并测定总RNA浓度,取1 μg RNA反转录为cDNA,然后进行PCR反应,扩增完毕后,取PCR产物于琼脂糖凝胶电泳,通过凝胶成像仪观察并照相。以β-actin为内参,由灰度值进行半定量分析AKT mRNA、Bcl-2 mRNA、Bax mRNA表达,并计算Bcl-2/Bax表达比值。6)NF-κB蛋白表达的检测及半定量分析:取细胞裂解提取液,经12000 r/min低温(4℃)离心20 min后取沉淀,BCA法进行蛋白定量,变性后上样、电泳,待溴酚蓝接近胶底部时停止、转膜、春红溶液染色,室温下5%脱脂奶粉封闭2 h,一抗(NF-κB,β-actin)4℃过夜;洗膜,二抗室温摇床上孵育1 h后经ECL显色,实验结果应用Quantity One软件进行分析。7)细胞中Caspase-3、Caspase-9活性的检测[4]:取上述制备的细胞裂解提取液,经3500 r/min低温(4℃)离心10 min后,取上清液5 μL用Bradford法进行蛋白定量,各组均取等量蛋白加入5 μL Caspase-3作为底物,经37℃避光孵育4 h后,测定405 nm处A值,以“实验组A值/对照组A值”表示Caspase-3的活性;Caspase-9活性检测方法同Caspase-3。
1.4统计学处理应用SPSS15.0统计软件分析。计量资料以(±s)表示,组间均数比较采用单因素方差分析;计数资料采用χ2检验。P<0.05为差异有统计学意义。

表1 ART、Bcl-2、Bax、β-actin基因序列
2 结 果
2.1GB对H2O2诱导损伤H9C2心肌细胞存活率的影响见表2。经MTT法检测发现,H2O2干预组H9C2心肌细胞存活率较对照组显著降低 (P<0.01);而与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞存活率显著升高(P<0.01)。
表2 GB对H2O2诱导损伤H9C2心肌细胞存活率的影响(±s)

表2 GB对H2O2诱导损伤H9C2心肌细胞存活率的影响(±s)
与对照组比较,*P<0.05,**P<0.01;与H2O2(200 μg/mL)干预组比较,△P<0.05,△△P<0.01。下同。
组 别 n 剂量(μmol/L) 存活率(%)对照组 10 - 96.73±5.26 H2O2(200 μg/mL)干预组 10 - 40.20±6.31**GB+H2O2(200 μg/mL)干预组 10 50 47.06±6.82 GB+H2O2(200 μg/mL)干预组 10 100 62.42±7.50△△GB+H2O2(200 μg/mL)干预组 10 200 80.67±9.56△△
表3 GB对H2O2诱导损伤H9C2心肌细胞培养液中心肌酶活性的影响(±s)
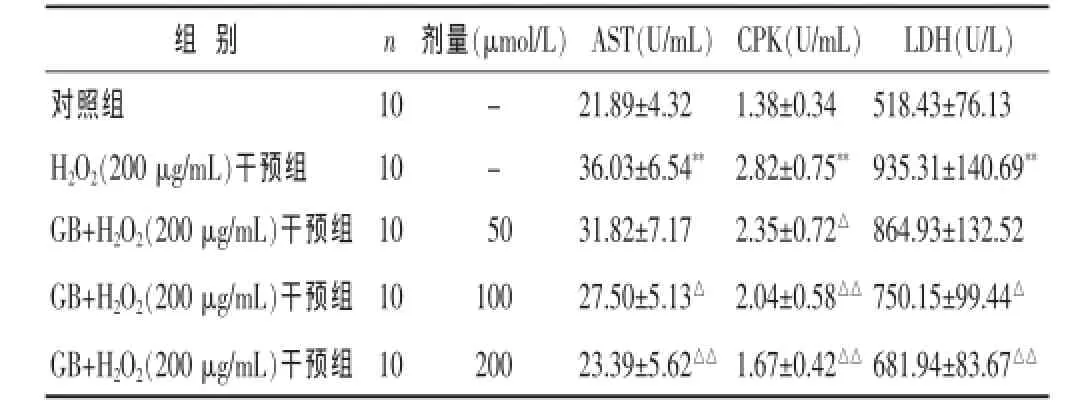
表3 GB对H2O2诱导损伤H9C2心肌细胞培养液中心肌酶活性的影响(±s)
组 别 n 剂量(μmol/L)对照组 10 -H2O2(200 μg/mL)干预组 10 -GB+H2O2(200 μg/mL)干预组 10 50 GB+H2O2(200 μg/mL)干预组 10 100 GB+H2O2(200 μg/mL)干预组 10 200 AST(U/mL)21.89±4.32 36.03±6.54**31.82±7.17 27.50±5.13△23.39±5.62△△CPK(U/mL) LDH(U/L)1.38±0.34 518.43±76.13 2.82±0.75**935.31±140.69**2.35±0.72△ 864.93±132.52 2.04±0.58△△750.15±99.44△1.67±0.42△△681.94±83.67△△
2.2GB对H2O2诱导损伤H9C2心肌细胞培养液中心肌酶活性的影响见表3。H2O2干预组H9C2心肌细胞培养液中AST、CPK、LDH活性显著升高(P<0.01);而与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞培养液中AST、CPK、LDH活性均显著降低(P<0.05或P<0.01)。
2.3GB对H2O2诱导损伤H9C2细胞抗氧化酶活性和MDA含量的影响见表4。H2O2干预组H9C2心肌细胞抗氧化酶(SOD、CAT)活性显著降低且MDA含量显著升高(P<0.01);而与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞SOD、CAT活性显著升高且MDA含量显著降低,差异均具有统计学意义(P<0.05或P<0.01)。
表4 GB对H2O2诱导损伤H9C2心肌细胞抗氧化酶活性和MDA含量的影响(±s)

表4 GB对H2O2诱导损伤H9C2心肌细胞抗氧化酶活性和MDA含量的影响(±s)
组别 n 剂量(μmol/L)对照组 10 -H2O2(200 μg/mL)干预组 10 -GB+H2O2(200 μg/mL)干预组 10 50 GB+H2O2(200 μg/mL)干预组 10 100 GB+H2O2(200 μg/mL)干预组 10 200 SOD(U/mg)107.53±15.21 62.78±14.55**69.02±13.40 83.48±17.13△96.41±22.48△△CAT(U/mg)MDA(nmol/mg)32.52±6.67 6.53±1.38 18.28±5.02** 12.05±2.34**22.92±5.64 10.78±3.12 24.46±7.07△ 7.57±2.04△△29.01±6.81△△ 6.91±1.73△△
表5 GB对H2O2诱导损伤H9C2心肌细胞凋亡率的影响(±s)

表5 GB对H2O2诱导损伤H9C2心肌细胞凋亡率的影响(±s)
组 别 n 剂量(μmol/L) 凋亡率(%)对照组 10 - 3.81±1.84 H2O2(200 μg/mL)干预组 10 - 45.34±6.07**GB+H2O2(200 μg/mL)干预组 10 50 40.23±7.46 GB+H2O2(200 μg/mL)干预组 10 100 31.74±6.39△△GB+H2O2(200 μg/mL)干预组 10 200 16.88±4.15△△

图1 GB对H2O2诱导损伤H9C2心肌细胞凋亡的影响
2.4GB对H2O2诱导损伤H9C2心肌细胞凋亡的影响见表5和图1。通过流氏细胞仪分析发现,对照组H9C2心肌细胞仅存在极少量凋亡细胞,而H2O2干预组凋亡细胞数量较对照组明显增多;而与H2O2干预组比较,GB干预组细胞凋亡状况明显好转,其中GB (200 μmol/L)+H2O2(200 μmol/L)干预组效果最为显著。通过计算并比较凋亡率发现,H2O2干预组H9C2心肌细胞凋亡率较对照组显著升高(P<0.01);而与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞凋亡率显著降低(P<0.01)。
2.5GB对H2O2诱导损伤H9C2心肌细胞凋亡相关基因表达的影响见表6。与对照组比较,H2O2干预组H9C2心肌细胞AKT mRNA、Bcl-2 mRNA和Bax mRNA表达较对照组显著升高 (P<0.05或P<0.01),而Bcl-2/Bax表达比值显著降低(P<0.01);与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组H9C2心肌细胞AKT mRNA、Bcl-2 mRNA表达进一步升高、Bax mRNA表达显著降低,差异均具有统计学意义(P<0.05或P<0.01),Bcl-2/Bax表达比值显著升高(P<0.01)。
表6 GB对H2O2诱导损伤H9C2心肌细胞凋亡相关基因表达的影响(±s)
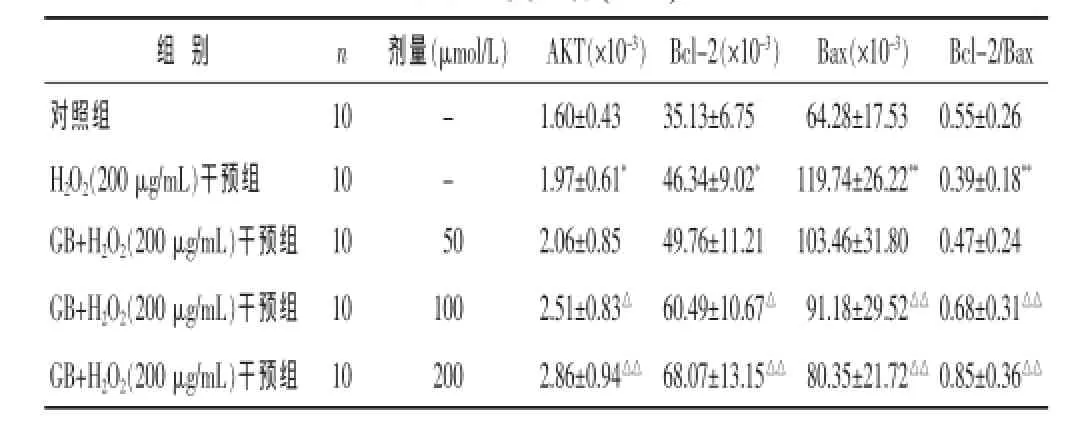
表6 GB对H2O2诱导损伤H9C2心肌细胞凋亡相关基因表达的影响(±s)
组别 n 剂量(μmol/L)对照组 10 -H2O2(200 μg/mL)干预组 10 -GB+H2O2(200 μg/mL)干预组 10 50 GB+H2O2(200 μg/mL)干预组 10 100 GB+H2O2(200 μg/mL)干预组 10 200 AKT(×10-3)1.60±0.43 1.97±0.61*2.06±0.85 2.51±0.83△2.86±0.94△△Bcl-2(×10-3)35.13±6.75 46.34±9.02*49.76±11.21 60.49±10.67△68.07±13.15△△Bax(×10-3) Bcl-2/Bax 64.28±17.53 0.55±0.26 119.74±26.22**0.39±0.18**103.46±31.80 0.47±0.24 91.18±29.52△△0.68±0.31△△80.35±21.72△△0.85±0.36△△
2.6GB对H2O2诱导损伤H9C2心肌细胞NF-κB蛋白表达的影响见表7和图2。通过Western blot检测并进行半定量分析发现,H2O2干预组H9C2心肌细胞中NF-κB蛋白表达量较对照组显著增高(P<0.01);与H2O2干预组比较,GB(100、200 μmol/L)+H2O2(200 μmol/L)干预组H9C2心肌细胞NF-kB蛋白表达量显著降低(P<0.05或P<0.01)。
2.7GB对H2O2诱导损伤H9C2心肌细胞Caspase-3、Caspase-9活性的影响见表8。通过比色法检测发现,H2O2干预组H9C2心肌细胞Caspase-3、Caspase-9活性均显著升高(P<0.01);与H2O2干预组比较,GB (100、200 μmol/L)+H2O2(200 μmol/L)干预组细胞Caspase-3活性显著降低(P<0.05,P<0.01),其中GB (200 μmol/L)+H2O2(200 μmol/L)干预组Caspase-9活性显著降低(P<0.01)。

图2 GB对H2O2诱导损伤H9C2心肌细胞NF-κB蛋白表达的影响
表7 GB对H2O2诱导损伤H9C2心肌细胞NF-κB蛋白表达的影响(±s)

表7 GB对H2O2诱导损伤H9C2心肌细胞NF-κB蛋白表达的影响(±s)
组 别 n 剂量(μmol/L) NF-κB/β-actin对照组 10 - 0.18±0.03 H2O2(200 μg/mL)干预组 10 - 0.47±0.11**GB+H2O2(200 μg/mL)干预组 10 50 0.39±0.14 GB+H2O2(200 μg/mL)干预组 10 100 0.34±0.08△GB+H2O2(200 μg/mL)干预组 10 200 0.27±0.06△△
表8 GB对H2O2诱导损伤H9C2心肌细胞Caspase-3、Caspase-9活性的影响(×10-3,±s)

表8 GB对H2O2诱导损伤H9C2心肌细胞Caspase-3、Caspase-9活性的影响(×10-3,±s)
组 别 n 剂量(μmol/L)对照组 10 -H2O2(200 μg/mL)干预组 10 -GB+H2O2(200 μg/mL)干预组 10 50 GB+H2O2(200 μg/mL)干预组 10 100 GB+H2O2(200 μg/mL)干预组 10 200 Caspase-3 54.75±7.63 103.41±11.5**95.68±13.55 86.01±10.42△72.93±8.35△△Caspase-9 71.49±9.35 124.82±19.27**115.26±26.03 109.55±20.49 84.67±16.82△△
3 讨 论
近年来,刘艳霞等[5]和孙宇等[6]通过动物实验研发发现,继发性心肌细胞凋亡与心肌缺血再灌注损伤密切相关。细胞凋亡是一种有多种基因参与调控的程序化死亡过程,Bcl-2家族基因发挥着重要的调节作用。Bcl-2和Bax都属于Bcl-2家族基因,Bcl-2为抑凋亡基因、Bax为促凋亡基因,二者间相互作用、共同调控细胞凋亡过程[7];并且细胞凋亡的调控不仅与Bcl-2、Bax表达密度有关,甚至更依赖于Bcl-2/Bax表达比值,Bcl-2/Bax比值越低,往往凋亡状况越严重[8]。AKT为抗凋亡基因,参与细胞凋亡过程的调控,在细胞凋亡的启动及整个过程中发挥着重要的调节作用[9]。Caspases蛋白家族参与细胞凋亡启动以及整个过程的调节,其中Caspase-3被认为是各种凋亡刺激因子激活的关键蛋白酶[9],而Caspase-9为Caspase-3的活化刺激因子[10]。
细胞凋亡可由多种因素导致其发生,其中氧化应激损伤是其重要的诱发因素之一[11]。NF-κB为多效能核转录因子,常态下,NF-κB以无活性形式存在于胞质中;而当细胞受到外界因素刺激时,NF-κB将暴露出核定位信号并进入胞核内,调控靶基因的转录与表达。Zhang Q等[12]研究发现,制NF-κB激活能够对抗氧化应激诱导的心肌细胞凋亡,证实NF-κB激活与氧化应激诱导的心肌细胞凋亡密切相关。细胞中ROS含量是反映机体氧自由基损伤最直接的指标,ROS损伤被认为是引起心肌细胞氧化损伤的主要机制[13];Lartigue A等[14]研究发现,正常生理状态下,体内生成的氧自由基在qSOD的催化作用下能够被还原生成过氧化氢,并在CAT或GSH-Px的催化作用下进一步还原生成对人无害的水和氧[15],所以SOD、CAT和GSH-Px三者的活性直接反映机体抗氧化能力;此外,细胞膜极易受氧自由基的攻击发生脂质过氧化而生成MDA,所以血清中MDA的含量能够间接反映心肌细胞损伤程度。并且当细胞膜受氧自由基攻击而受损后,将导致细胞中心肌酶(AST、CPK、LDH)迅速释放入血,使血清中AST、CPK、LDH活性陡然增高,所以临床上将血清中心肌酶活性作为诊断早期心功能损伤的常用生化指标。
本实验通过制备H2O2诱导损伤H9C2心肌细胞模型进行研究发现,GB能够有效改善H2O2诱导损伤H9C2心肌细胞凋亡状况、降低细胞凋亡率、提高细胞存活率,提示GB对H2O2诱导H9C2心肌细胞凋亡具有抑制作用;其作用机制可能与GB能够有效上调抑凋亡基因AKT mRNA、Bcl-2 mRNA表达、下调促凋亡基因Bax mRNA表达、提高Bcl-2/Bax表达比值、降低Caspase-3和Caspase-9活性,以及改善抗氧化酶活性、降低氧化应激损伤,下调NF-κB蛋白表达有关。
[1]Nie ZG,Peng SY,Wang WJ.Effects of Ginkgolide B on lipopolysaccharide-induced TNFalpha production in mouse peritoneal macrophages and NF-κB activation in rat pleural polymorphonuclear leukocytes[J].Acta Pharm Sin,2004,39:415-418.
[2]Zhou LE,Wang WJ,Bai JY,et al.Effects of Ginkgolide B on arachidonic acid metabolizing enzymes and level of intracellular calcium in rat polymorphonuclear leukocytes[J].Acta Pharm Sin,2001,36(2):92-95.
[3]Kitamoto S,Egashira K.Endothelial dysfunction and coronary atherosclerosis[J].Curr Drug Targets Cardiovasc Haematol Disord,2004,4(1):13-22.
[4]陈良金,石孟琼,贺海波,等.珠子参总皂苷对H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J].中国临床药理学与治疗学,2012,17(8):860-867.
[5]刘艳霞,顾云,辛毅,等.大鼠急性心肌缺血再灌注损伤诱导细胞凋亡的实验研究[J].心肺血管病杂志,2009,28(3):191-194.
[6]孙宇,陈建光.细胞凋亡与心肌缺血再灌注损伤研究[J].北华大学学报:自然科学版,2009,10(1):34-43.
[7]张彦清,刘保江,田首元.丙泊酚对大鼠离体缺血/再灌注心肌细胞凋亡和bcl-2/Bax蛋白表达的影响[J].中西医结合心脑血管病杂志,2011,9(1):55-57.
[8]Jayanthi S,Deng X,Bordelon M,et al.Methamphetamine causes differential regulation of pro-death and anti-death bcl-2 genes in the mouse neocortex[J].FASEB J,2001,15 (10):1745-1752.
[9]毛德文,陈月桥,王丽,等.Caspase-8及Caspase-3与细胞凋亡[J].辽宁中医药大学学报,2008,10(10):148-150.
[10]王春光,刘北忠,金丹婷,等.大黄素对裸鼠体内 K562细胞移植瘤的抑制作用及其与调控Caspase-3和Caspase-9表达的关系[J].中草药,2010,41(5):751-756.
[11]陈良金,石孟琼,贺海波,等.珠子参总皂苷对 H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J].中国临床药理学与治疗学,2012,17(8):860-867.
[12]Zhang Q,Huang WD,Lv XY,et al.Ghrelin protects H9c2 cells from hydrogen peroxide-induced apoptosis through NF-κB and mitochondria-mediated signaling[J].Eur J Pharmacol,2011,654(2):142-149.
[13]Misra MK,Sarwat M,Bhakuni P,et al.Oxidative stress and ischemic myocardial syndromes[J].Med Sci Monit,2009,15 (10):209-219.
[14]Lartigue A,Burlat B,Coutard B,et al.The megavirus chilensis Cu,Zn-superoxide dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[15]Jin Y,Liu K,Peng J,et al.Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROSNF-κB signal pathway[J].Toxicol Lett,2014,232(1):149-158.
The Effects and Mechanism of Ginkgolide B on Apoptosis of H9C2 Cardiomyocytes Induced by H2O2
LI Liang,PENG Hui,SUN Lifeng,et al. Xingtai People′s Hospital,Hebei,Xingtai 054031,China.
R289.5文献标志码:A
1004-745X(2016)06-0976-05
10.3969/j.issn.1004-745X.2016.06.010
河北省卫生厅重点科技研究计划(20130359)
△(电子邮箱:baill2015@163.com)
(2015-11-09)
