核酸适配体及其在纸上纳米传感器研究中的应用
2016-08-30冯薇李昱吕雪飞邓玉林北京理工大学生命学院北京100081
冯薇,李昱,吕雪飞,邓玉林(北京理工大学生命学院,北京100081)
核酸适配体及其在纸上纳米传感器研究中的应用
冯薇,李昱,吕雪飞*,邓玉林
(北京理工大学生命学院,北京100081)
摘要:核酸适配体是一种能识别目标物质并与之结合的单链DNA或者RNA,被越来越多地应用于纸上纳米生物传感器的研究中。本文从核酸适配体出发,在综述其特点及筛选原理的基础上,结合纸上纳米生物传感器的特点,综述了核酸适配体在纸上纳米生物传感器中的应用,不难发现,除利用适配体与抗体相似的识别与捕获能力之外,这些传感器还创新性的利用了诸如,适配体易于修饰的特点设计新的信号转换方式,碱基互补配对规则设计适配体与其他分子之间的交联以及适配体可以扩增的特点进行信号放大等等开展相关的研究工作。
关键词:核酸适配体;生物传感器;纸上纳米生物传感器
1 前言
核酸适配体是一种单链DNA或者RNA,能够特异性地与目标分子结合。其最早发现是在1990年,Ellington[1]和Tuerk[2]分别在Nature和Science上发表了他们的研究结果。对于一个给定的目标分子,可以通过指数富集的配基系统进化技术(Systematic Evolution of Ligands by Exponential Enrichment,SELEX) 从特定的寡核苷酸库中筛选得到与其有特异性相互作用的寡核苷酸。自1990年起,研究者不断发现新的适配体,这些适配体结合的分子范围涵盖了蛋白、细胞以及一些小分子。
从2007年开始,核酸适配体开始较多地应用到生物传感器领域[3,4]。生物传感器是能够将生物分子的浓度信号转化成其他形式信号的装置。生物学领域的许多检测终点是以浓度指标来表示,不是可视化的,因此需要结合其他学科的知识体系设计出可将浓度指标转换成光信号或者电信号的生物传感器。通常生物传感器的组成包括:负责与目标物质发生特异性相互作用的生物受体;负责将生物反应的能量信号转化成电信号的信号转换器;负责接收转换器的信号,并适当放大的检测器[5]。基于核酸适配体能够与特定目标结合的性质,非常适合用来捕获生物分子,这一点与抗体非常相似。因此,在生物传感器的设计中,核酸适配体主要作为与目标物质发生特异性相互作用的生物受体。
高效准确的检测方法在医学检验、环境污染物监测和食品安全等领域具有特别重要的地位和作用。比如在医学检验领域的即时检测(point-of-care testing),就要求病人可以不需要医生,独立完成检测,并在较短的时间内得到检测结果。纸上纳米生物传感器非常契合这个概念,已经出现了商品化的诸如早孕试纸、血糖试纸等产品,与此同时,这个检测原理也被许多研究者用于其他生物医学指标的检测中。
本文在介绍核酸适配体特点及其筛选方法的基础上,从基于适配体与目标分子的结合能力、基于修饰的适配体实现信号转换、基于适配体的交联能力进行流体控制以及基于适配体的扩增进行信号放大等几个方面着重介绍了核酸适配体在纸上纳米生物传感器研究中的应用。
2 核酸适配体
2.1核酸适配体的特点
纳米生物传感器中另一个应用广泛的生物受体是抗体,因为能与抗原分子特异性结合,在检测中起到非常重要的作用。而相比于抗体,核酸适配体有多个方面的优势。首先,能与核酸适配体发生亲和作用的配体范围更广。除了蛋白质,还有金属离子[6]、生物小分子[7]甚至细胞[8]。因此核酸适配体在生物传感器中的应用范围应该更广。其次,使用核酸适配体作为亲和受体成本更低。筛选出的核酸适配体可以直接合成和修饰,有些可以直接大量扩增,而制备抗体的成本相对较高。再次,相对于抗体而言,适配体具有更高的稳定性。温度或者pH变化会导致抗体不可逆变性,而适配体不存在这个问题。最后,核酸适配体具备信号放大的能力。利用核酸分子可以扩增的性质,可以将扩增反应用到检测中,即将捕获了目标物质的适配体扩增,扩增倍数就相当于信号放大倍数。
但是目前看来,核酸适配体能够识别的目标分子数量远不及抗体。很多不同的检测方法均是基于为数不多的几种目标分子的核酸适配体而设计的,比如凝血酶的适配体[9-11]。有些分子的核酸适配体虽然已经被筛选出来了,但是很难确定其专一性,在应用于复杂样品检测前,必须确定样品中的其他分子不会对其特异性造成影响。因此,将适配体用于检测,并最终将其商品化,还有很长的路要走。
2.2核酸适配体的筛选
适配体的筛选并不需要在体内进行,也不需要目标分子具有免疫原性,所以金属、生物小分子、大分子甚至是细胞都可以经过体外筛选得到其核酸适配体。这个筛选过程叫做指数富集的配基系统进化技术 (Systematic Evolution of Ligands by Exponential Enrichment,SELEX)。它是一种生物文库技术。起始文库的构建是筛选过程中的第一个关键。筛选过程从一个随机的DNA或者RNA文库开始,通常起始的库通过化学方法合成。起始文库应当保证足够的库容量,1 OD库中可能包含多达1015种DNA。例如Sefah等[12]设计了全长81 bp的单链DNA库,其中5’和3’两端各有18 bp的固定序列,中间45 bp随机合成,这个设计保证了足够大的库容量。筛选过程中的第二个关键问题是筛选方法的选择,筛选通常要进行5-10轮左右,每一轮筛选都是将一个核酸库中能够与目标分子结合的核酸分离出来,作为下一轮筛选的起始文库。针对不同的目标分子,每一轮筛选使用的方法也有一定差异,将目标分子固定或者直接使用磁珠等材料进行分离。筛选中的另一个比较关键的技术是单链DNA制备技术,每一轮得到的DNA文库需要经过PCR扩增,扩增得到的双链DNA需要通过一定的方法解链并分离出单链。常用的方法包括使用链霉亲和素微珠结合双链中标记了生物素的一条链,然后将双链DNA变性解链[13];使用不对称PCR,随后用变性PAGE胶分离不同长度的两条单链等[14]。
2.3纳米生物传感器中的核酸适配体
目前为止,几种常见的目标分子的核酸适配体已经被应用于各种各样的纳米生物传感器中。一个研究思路是,适配体本身不进行任何标记,而是利用适配体与目标分子结合后,引起纳米粒子某些性质的改变实现检测。多种检测手段从不同角度实现了这个思路。纳米粒子性质的检测,包括zeta电势[15]、动态光散射(Dynamic light scattering, DLS)[16,17]和可控电阻脉冲传感技术(Tunable Resistive Pulse Sensing, TRPS)[17]等,对分子的检测限可以达到nM级别;电化学检测,基于适配体与目标分子的结合引起电压电流的改变,此类方法的检测限都比较低,单分析物的检测限可以达到20 ng/L (0.5 pM) 的水平[18];依据颜色变化来达到检测目的,比如适配体与目标分子的结合可能使胶体金聚集等[4,19,20],Vilela等[21]详细综述了基于金纳米粒子和银纳米粒子的聚集实现目标分子检测的研究工作,这些研究通常使用比色的方法,操作简单且成本低廉。
另一个思路是,对适配体进行标记,尽管适配体与目标物亲和能力强,但是这个亲和过程不可见,而将适配体进行标记是一个很好的解决途径。且适配体本身是核酸,很容易进行化学基团修饰。荧光分子[6]与金纳米粒子[22]是两种比较常见的标记物质。对于荧光分子,标记后的核酸适配体和目标分子结合时,适配体会形成特定的三维结构,结构上的变化可以产生相应的信号变化。比如分子信标[23],适配体与目标物结合后,适配体两端修饰的荧光基团和淬灭基团分开,荧光信号增强[24];而对于胶体金,将其标记在适配体上主要起示踪作用。基于标记的适配体的免疫检测方法,继承了ELISA、Dot-Blot、免疫层析等方法的思路,设计了夹心法或竞争法等检测原理的纸上纳米生物传感器。
从现有的研究成果来看,很多基于标记和非标记核酸适配体的纳米生物传感器的设计思路被引入到了纸上纳米生物传感器中。
3 核酸适配体在纸上纳米传感器中的应用
3.1纸上纳米生物传感器
纸上生物传感器的可以分为三类[5]:浸染试纸条[25]、横流分析试纸条[26]和微型纸上分析设备(μPADs)[27]。其中浸染试纸条方面的设计相对较少,相比而言,横流分析试纸条在数量上要远远多于前者,且在设计原理上更加复杂多样。目前,基于抗体的横流分析试纸条较多,已经应用于有害物质如盐酸克伦特罗的检测和临床诊断如人绒毛膜促性腺激素等等。横流分析试纸条(如图1所示)通常由样品垫、结合垫、硝酸纤维素膜和吸水纸四部分组成,四个部分依次固定在一条背板上。常见的设计原理有夹心法和竞争法。夹心法适合用于大分子或者细胞的检测,样品加入到结合垫上,受毛细作用前移,首先经过结合垫上的胶体金-抗体(第一种抗体)/适配体结合物,与其充分接触并发生相应的反应,形成胶体金-抗体1/适配体-抗原结合物后,继续向前移动到第二种抗体的固定位置(检测线),胶体金-抗体1/适配体-抗原结合物与之发生特异性结合而被留下,可通过肉眼观察到胶体金的红色。而竞争法适用于小分子的检测,抗体/适配体与样品中的目标分子结合后,不再与检测线上的目标分子发生相互作用,因此目标分子达到一定浓度时,检测线不显色。但是无论是竞争法还是夹心法,在硝酸纤维素膜上的检测线下游,还有一条质控线,质控线是样品加入(无论样品中是否含有目标分子)时就会显色,用户可以据此判断试纸是否失效。不同于横流分析试纸条,μPADs的通道设计和信号转换方式并没有一个固定的模式。因为在μPADs的设计中引入了微流控芯片的理念。它将纸、玻璃、PDMS等材料结合起来,利用各自的不同性质,保证流体的流动。与此同时,它的检测原理非常多样,尽管是在非常微小的尺寸上,仍然可以应用电化学、电化学发光等检测方法,既保证设备的便携性,又保证了设备的准确性。

图1 横流分析试纸条的检测原理。(A)双抗夹心法(B)竞争法Fig.1 Schematic illustration of the principle of lateral flow assays. (A)The double antibody sandwich method (B) The competitive method
3.2基于适配体与目标分子的结合能力进行识别的纸上纳米生物传感器
适配体对目标分子的识别能力是所有基于适配体的纸上纳米生物传感器的设计基础。随着适配体筛选技术的不断发展以及筛选得到适配体的目标分子种类的逐渐增多,其在生物传感器等领域得到了越来越广泛的关注和认可。有研究人员分别设计了基于抗体的和基于适配体的横流分析试纸条,以期比较适配体和抗体对蛋白分子的识别能力。例如,Xu等[28]设计了免疫层析试纸条,比较了凝血酶适配体和抗体对凝血酶的亲和性和专一性。其中,基于适配体的层析试纸条的设计如图2所示,将凝血酶适配体1与胶体金结合,固定在胶体金垫上,检测线上通过生物素-链霉亲和素相互作用固定了凝血酶适配体2,质控线上用同样方法固定有适配体1的互补序列。当样品中有凝血酶存在,检测线上显色。根据试纸条读卡器检测结果得到基于适配体方法的检测限为2.5 nM,基于抗体方法的检测限为5 nM。可以看出,适配体对凝血酶的识别和检测能力与抗体的相当甚至在一定程度上要高于抗体。免疫层析试纸条检测法省去了现存许多蛋白检测方法中的孵育、冲洗等步骤,适用于即时检测(Point of Care Testing, POCT)。
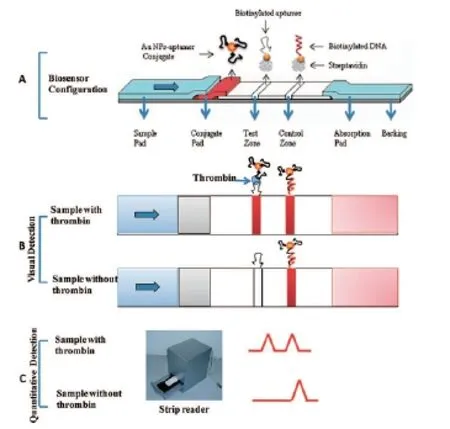
图2 胶体金-适配体偶联物作为探针的试纸条检测凝血酶[28]Fig. 2 Aptamer-functionalized gold nanoparticles as probes in a strip biosensor
部分见诸于报道的试纸条[29,30]的设计与上述的设计相似,是基于夹心法的原理。另一些适配体试纸条则基于竞争法的原理实现的,即利用适配体与目标物质的结合能力强于其与互补链结合能力的性质,这也是基于适配体的检测方法中较为常见的设计,一方面,因为核酸适配体与互补链存在自发结合的倾向,另一方面,如果需要检测小分子,它们没有足够的结合位点,只能用竞争法。在具体的研究过程中,研究者们发现在竞争法的试纸条中会出现即使在目标分子存在的情况下,金标适配体仍然会与互补序列结合的情况,因此互补链序列的设计需要经过反复探索。Shim等研究了基于适配体的层析试纸条快速检测黄曲霉素B1,分别设计了标记有荧光分子Cy5的14 bp和23 bp的互补序列,考察互补序列的长度对检测的影响。检测线上固定有适配体,最初,互补序列结合在适配体上,一旦加入黄曲霉素B1,就会与荧光标记的互补序列竞争性地结合固定了的适配体。互补链与适配体的结合能力越强,加入等量黄曲霉素B1时越不容易释放,检测限荧光降低幅度越小。结果显示,黄曲霉素浓度为10 ng/ml时,14 bp的互补序列的荧光减弱的更多,更符合降低检测限的考量。
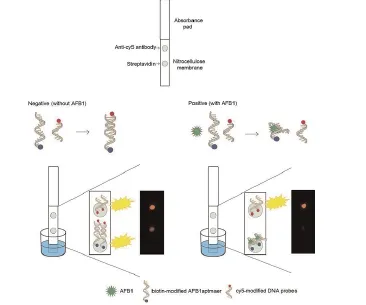
图3 竞争法浸染式试纸条检测黄曲霉素B1[31]Fig. 3 An aptamer-based dipstick assay for the rapid and simple detection of aflatoxin B1
3.3基于修饰的适配体实现信号转换的纸上纳米生物传感器
易于修饰是适配体的另一大特性。在合成单链DNA分子时,可以在其5’或者3’端进行氨基、巯基、生物素等基团的修饰。一些荧光分子,如FAM、Cy5等也可以直接修饰在适配体上。常见诸报道的荧光共振能量转移(FRET)法就是这类荧光标记的一个很好的应用[32, 33]。荧光共振能量转移是指当两个不同的荧光分子距离足够近,且一个荧光分子的发射谱与另一个荧光分子的吸收谱的波长有重叠时,引起荧光猝灭的现象。Zuo等[34]将这个原理应用于纸上纳米生物传感器中进行传染性病原体的检测。荧光分子Cy3标记的适配体以单链形式存在,向体系中加入氧化石墨烯,氧化石墨烯能很好的吸收荧光分子Cy3的能量。借助碱基和氧化石墨烯材料的相互作用,保证荧光分子与氧化石墨烯的距离足够近,进而对荧光分子的荧光进行淬灭。但是当大肠杆菌存在时,核酸适配体与菌体结合,脱离石墨烯表面,荧光信号恢复(图4)。

图4 适配体功能化的氧化石墨烯纳米生物传感器检测病原菌[34]Fig. 4 Aptamer-functionalized graphene oxide nano-biosensors for one step multiplexed pathogendetection
胶体金免疫层析技术[28,35]是发展得最早的纸上传感器。它以胶体金为显色媒介,胶体金通过金硫键的作用与巯基修饰的适配体结合。除此之外,还可以在适配体上修饰生物素,利用生物素与链霉亲和素的特异性相互作用,以及胶体金与链霉亲和素的结合能力,实现胶体金与适配体的偶联[36]。
近年来不断出现的新型纳米材料,如量子点[6,37,39]和纳米微球也已经被用于纸上纳米生物传感器的研究中,其中前者是通过荧光定量,后者则可以根据微球中发光材料的不同,通过肉眼观察或者用荧光检测器检测。现有的大多数荧光纳米材料都可以进行表面修饰,使之带有羧基或其他基团,进而可以与修饰有氨基或者其他基团的适配体发生偶联。
3.4基于适配体的交联能力进行流体控制的纸上纳米生物传感器
在纸上纳米传感器中,适配体并不单单是作为一个识别的分子。DNA或者某些双链RNA分子中,依照碱基互补配对原则,两条互补链在氢键的作用下能够形成稳定的双螺旋结构。将其他材料表面修饰上单链DNA分子后,利用DNA的互补配对,可实现两个分子之间距离的控制。DNA水凝胶传感器就是利用了这个性质[40,41],这类传感器一方面利用了DNA的可逆交联能力,以此调节水凝胶的机械和流变性能;另一方面水凝胶能够干燥后储存,这有益于维持传感器中DNA的稳定。水凝胶分子中可以添加有色物质直接显色,也可以加入某些能够引起颜色变化的物质。Zhu等[40]将酶分子固定在水凝胶之中,利用水凝胶的流变性能改变即可借助于酶促反应实现信号放大(如图5所示)。
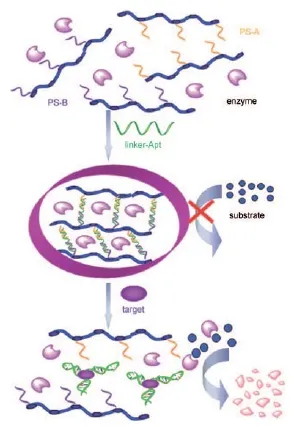
图5 适配体交联水凝胶实现肉眼检测[40]Fig. 5 Principle of DNA cross-linked hydrogel for signal amplification and visual detection
在μPADs设计中,Wei等[42]将适配体作为交联剂,形成水凝胶。将能够与适配体两个不同位置结合的两段DNA链分别接枝在聚丙烯酰胺分子上,当这两种聚丙烯酰胺分子与适配体混合时,可以形成凝胶,阻塞通道。但当适配体与金属离子、腺苷或可卡因结合后,适配体不再参与凝胶的形成,从而引起颜色的改变(如图6所示)。

图6 DNA水凝胶控制的纸上传感器检测多种分子[42]Fig. 6 DNA hydrogel mediated paper-based analytic device for detection of multiple targets
3.5基于适配体的扩增进行信号放大的纸上纳米生物传感器
许多分子,如疾病的生物标志物、病毒、环境污染物等含量均很低,因此信号放大就成为检测痕量目标分子的关键。从现有的研究来看,一旦能够捕捉到目标物质,可将适配体的扩增应用到检测方法中,进而实现信号放大。蛋白分子不能进行扩增,但是核酸分子可以通过聚合酶链式反应(PCR)、滚环扩增(RCA)或单向链置换扩增(SDA)等方式扩增[43,44],可以将蛋白或者细菌的检测最终转变成对核酸的检测。Wu等[45]采用两种适配体,一种适配体修饰了生物素,通过链霉亲和素磁珠分离出适配体和大肠杆菌复合物;另一种适配体负责信号放大,在复合物分离之后,通过单向链置换扩增(SDA)反应将信号放大,形成的大量单链DNA (ssDNA)用于横流分析。在横流分析试纸条的结合垫上固定有胶体金标记的部分互补探针1,检测线上固定有部分互补探针2,两段探针能够分别结合于ssDNA的两个不同区域。当样品中存在扩增后的ssDNA时,ssDNA与探针1和2发生互补,检测线显红色。质控线固定有探针1的互补序列,确保无论阳性样品还是阴性样品,均显红色(图7)。

图7 基于单向链置换扩增的横流生物传感器检测大肠杆菌[45]Fig. 7 Schematic illustration of a sensitive lateral flow biosensor for Escherichia coli O157: H7 detection based on aptamer mediated strand displacement amplification
4 总结与展望
随着核酸适配体的新应用不断涌现,我们希望适配体能真正作为临床诊断或者其他领域的一种潜在的研究工具。现已有多种核酸适配体能够和生物、医学研究中的关键目标分子进行特异性结合,与此同时,新的适配体也在不断通过SELEX技术筛选得到,这为适配体在分析检测领域的广泛应用奠定良好的基础。
核酸适配体对目标分子的亲和能力是纳米生物传感器中的生物受体必须具备的基本性能之一。也正是因为这一亲和能力,让基于适配体的研究试图朝着替代抗体的方向去发展。纸上纳米生物传感器是一类快速检测装置。通常对这类产品的要求是尽量降低实验的设备依赖,可以让病人自己完成诊断。尤其是在第三世界国家,大多数情况下,他们并没有条件依靠仪器进行检测。除此之外,必须要控制成本,因为这类诊断装置基本上都是一次性的,制造成本必须控制。目前的浸染试纸条、横流免疫层析试纸条、纸上分析装置的制造成本都非常低。而且适配体的成本也要低于抗体。从这个角度考虑,适配体与纸上纳米生物传感器的结合是顺势而生。
但是核酸适配体不同于抗体。适配体是核酸,由这个属性出发,基于适配体的纸上纳米生物传感器表现出了更多的可能性。应用荧光修饰的适配体时,研究者充分利用单链DNA可以被氧化石墨烯吸附的特征,利用荧光共振能量转移实现信号转换;基于适配体的交联能力进行流体控制的纸上纳米生物传感器很好的将DNA双链互补配对的原理应用到水凝胶中;基于适配体的扩增进行信号放大的纸上纳米生物传感器则充分利用了核酸可扩增的性质。将适配体与抗体进行比较,也暴露出适配体的某些不足。比如生物样品通常都非常复杂,这就要求核酸适配体拥有和抗体一样的特异性,这也是目前有些人质疑适配体的一个原因。在进行复杂生物样本的分析之前,研究者应当认真地考量适配体的专一性,以保证检测结果的准确性。
基于核酸适配体的纸上纳米生物传感器有着非常广阔的市场前景。快速诊断的概念在生物化学研究、疾病诊断、食品安全等诸多检测领域得以广泛的实现。而互联网的发展也为这类设备提供了发展契机,诊断不再单单发生在医院,微型检测设备可以将诊断结果通过云端储存,也可以通过互联网发送给医生。研究人员需要确保基于核酸适配体的纸上纳米传感器具有较高的准确性和灵敏度,进而推动这类产品在医院、家庭等场所发挥更大的作用。
参考文献
[1] Ellington A D, Szostak J W. Iivitro selection of RNA molecules that bind specifi c ligands[J]. Nature, 1990, 346(6287): 818-822.
[2] Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment- RNA ligands to bacteriophage-T4 DNA-polymerase[J]. Science, 1990, 249(4968): 505-510.
[3] Maehashi K, Katsura T, Kerman K, et al. Label-free protein biosensor based on aptamer-modified carbon nanotube fi eld-effect transistors[J]. Analytical Chemistry, 2007, 79(2): 782-787.
[4] Wang J, Wang L, Liu X, et al. A gold nanoparticlebased aptamer target binding readout for ATP assay[J]. Advanced Materials, 2007, 19(22): 3943-3946.
[5] Parolo C, Merkoci A. Paper-based nanobiosensors for diagnostics[J]. Chemical Society Reviews, 2013, 42(2): 450-457.
[6]Li M, Zhou X, Guo S, et al. Detection of lead (II) with a "turn-on" fluorescent biosensor based on energy transfer from CdSe/ZnS quantum dots to graphene oxide[J]. Biosens Bioelectron, 2013, 43: 69-74.
[7] Bonel L, Vidal J C, Duato P, et al. An electrochemical competitive biosensor for ochratoxin A based on a DNA biotinylated aptamer[J]. Biosensors & Bioelectronics, 2011, 26(7): 3254-3259.
[8] Zheng D, Seferos D S, Giljohann D A, et al. Aptamer Nano-flares for Molecular Detection in Living Cells[J]. Nano Letters, 2009, 9(9): 3258-3261.
[9] Nam K, Eom K, Yang J, et al. Aptamer-functionalized nano-pattern based on carbon nanotube for sensitive, selective protein detection[J]. Journal of Materials Chemistry, 2012, 22(44): 23348-23356.
[10] Cunningham J C, Brenes N J, Crooks R M. Paper electrochemical device for detection of DNA and thrombin by target-induced conformational switching[J]. Anal Chem, 2014,86(12): 6166-6170.
[11] Qin C, Wen W, Zhang X, et al. Visual detection of thrombin using a strip biosensor through aptamer-cleavage reaction with enzyme catalytic amplification[J]. Analyst, 2015,140(22): 7710-7717.
[12] Sefah K, Tang Z W, Shangguan D H, et al. Molecular recognition of acute myeloid leukemia using aptamers[J]. Leukemia, 2009, 23(2): 235-244.
[13] Sefah K, Shangguan D, Xiong X, et al. Development of DNA aptamers using Cell-SELEX[J]. Nat Protoc, 2010, 5(6):1169-1185.
[14] Wang C, Yang G, Luo Z, et al. In vitro selection of highaffinity DNA aptamers for streptavidin[J]. Acta Biochimica et Biophysica Sinica, 2009, 41(4): 335-340.
[15] Li S, Gao Z, Shao N. Non-covalent conjugation of CdTe QDs with lysozyme binding DNA for fluorescent sensing of lysozyme in complebiological sample[J]. Talanta, 2014, 129: 86-92.
[16] Cheng S, Zheng B, Wang M Z, et al. Doublefunctionalized gold nanoparticles with split aptamer for the detection of adenosine triphosphate[J]. Talanta, 2013, 115: 506-511.
[17] Alsager O A, Kumar S, Willmott G R, et al. Small molecule detection in solution via the size contraction response of aptamer functionalized nanoparticles[J]. Biosensors & Bioelectronics, 2014, 57: 262-268.
[18] Hansen J A, Wang J, Kawde A N, et al. Quantumdot/aptamer-based ultrasensitive multi-analyte electrochemical biosensor[J]. Journal of the American Chemical Society, 2006,128(7): 2228-2229.
[19] Huang C C, Huang Y F, Cao Z H, et al. Aptamermodified gold nanoparticles for colorimetric determination of platelet-derived growth factors and their receptors[J]. Analytical Chemistry, 2005, 77(17): 5735-5741.
[20] Selvakumar L S, Thakur M S. Nano RNA aptamer wire for analysis of vitamin B-12[J]. Analytical Biochemistry, 2012,427(2): 151-157.
[21] Vilela D, Gonzalez M C, Escarpa A. Sensing colorimetric approaches based on gold and silver nanoparticles aggregation: chemical creativity behind the assay. A review[J]. Anal Chim Acta, 2012, 751: 24-43.
[22] Zhu J, Zou N, Zhu D, et al. Simultaneous detection of high-sensitivity cardiac troponin I and myoglobin by modified sandwich lateral flow immunoassay: proof of principle[J]. Clin Chem, 2011, 57(12): 1732-1738.
[23] Nielsen L J, Olsen L F, Ozalp V C. Aptamers Embedded in Polyacrylamide Nanoparticles: A Tool for in Vivo Metabolite Sensing[J]. Acs Nano, 2010, 4(8): 4361-4370.
[24] Chen J, Fang Z, Liu J, et al. A simple and rapid biosensor for ochratoxin A based on a structure-switching signaling aptamer[J]. Food Control, 2012, 25(2): 555-560.
[25] Liu J, Mazumdar D, Lu Y. A simple and sensitive "dipstick" test in serum based on lateral flow separation of aptamer-linked nanostructures"[J]. Angewandte Chemie-International Edition, 2006, 45(47): 7955-7959.
[26] Liu G D, Mao X, Phillips J A, et al. Aptamer-Nanoparticle Strip Biosensor for Sensitive Detection of Cancer Cells[J]. Analytical Chemistry, 2009, 81(24): 10013-10018.
[27] Liu Y, Liu Y, Matharu Z, et al. Detecting multiple cell-secreted cytokines from the same aptamer-functionalized electrode[J]. Biosens Bioelectron, 2015, 64: 43-50.
[28] Xu H, Mao X, Zeng Q X, et al. Aptamer-Functionalized Gold Nanoparticles as Probes in a Dry-Reagent Strip Biosensor for Protein Analysis[J]. Analytical Chemistry, 2009, 81(2): 669-675.
[29] Wang L, Chen W, Ma W, et al. Fluorescent strip sensor for rapid determination of toxins[J]. Chem Commun (Camb),2011, 47(5): 1574-1576.
[30] Omidfar K, Kia S, Larijani B. Development of a Colloidal Gold-based Immunochromatographic Test Strip for Screening of Microalbuminuria[J]. Hybridoma, 2011, 30(2): 117-124.
[31] Shim W B, Kim M J, Mun H, et al. An aptamer-based dipstick assay for the rapid and simple detection of aflatoxin B1[J]. Biosens Bioelectron, 2014, 62: 288-294.
[32] Dong H, Gao W, Yan F, et al. Fluorescence Resonance Energy Transfer between Quantum Dots and Graphene Oxide for Sensing Biomolecules[J]. Analytical Chemistry, 2010, 82(13): 5511-5517.
[33] Chang H, Tang L, Wang Y, et al. Graphene Fluorescence Resonance Energy Transfer Aptasensor for the Thrombin Detection[J]. Analytical Chemistry, 2010, 82(6): 2341-2346.
[34] Zuo P, Li X, Dominguez D C, et al. A PDMS/paper/ glass hybrid microfluidic biochip integrated with aptamerfunctionalized graphene oxide nano-biosensors for one-step multiplexed pathogen detection[J]. Lab on a Chip, 2013, 13(19): 3921-3928.
[35] Chou S F. Development of a manual self-assembled colloidal gold nanoparticle-immunochromatographic strip for rapid determination of human interferon-gamma[J]. Analyst,2013, 138(9): 2620-2623.
[36] Bruno J G. Application of DNA Aptamers and Quantum Dots to Lateral Flow Test Strips for Detection of FoodbornePathogens with Improved Sensitivity versus Colloidal Gold[J]. Pathogens, 2014, 3(2): 341-355.
[37] Tong X, Sheng P, Yan Z, et al. Core/shell(thick) CdTe/ CdS quantum dots functionalized TiO2 nanotube: A novel electrochemiluminescence platform for label-free immunosensor to detect tris-(2,3-dibromopropyl) isocyanurate in environment[J]. Sensors and Actuators B-Chemical, 2014, 198: 41-48.
[38] Huang H P, Jie G F, Cui R J, et al. DNA aptamer-based detection of lysozyme by an electrochemiluminescence assay coupled to quantum dots[J]. Electrochemistry Communications,2009, 11(4): 816-818.
[39] Li S J, Gao Z D, Shao N. Non-covalent conjugation of CdTe QDs with lysozyme binding DNA for fluorescent sensing of lysozyme in complebiological sample[J]. Talanta, 2014, 129: 86-92.
[40] Zhu Z, Wu C, Liu H, et al. An aptamer cross-linked hydrogel as a colorimetric platform for visual detection[J]. Angew Chem Int Ed Engl, 2010, 49(6): 1052-1056.
[41] Liu R, Huang Y, Ma Y, et al. Design and synthesis of target-responsive aptamer-cross-linked hydrogel for visual quantitative detection of ochratoxin A[J]. ACS Appl Mater Interfaces, 2015, 7(12): 6982-6990.
[42] Wei X, Tian T, Jia S, et al. Target-responsive DNA hydrogel mediated "stop-fl ow" microfl uidic paper-based analytic device for rapid, portable and visual detection of multiple targets[J]. Anal Chem, 2015, 87(8): 4275-4282.
[43] Guo Q, Yang X, Wang K, et al. Sensitive fl uorescence detection of nucleic acids based on isothermal circular stranddisplacement polymerization reaction[J]. Nucleic Acids Res,2009, 37(3): e20.
[44] Zhang H, LiF, LeC. Binding-induced DNA assembly and its application to yoctomole detection of proteins[J]. Anal Chem, 2012, 84(2): 877-884.
[45] Wu W, Zhao S, Mao Y, et al. A sensitive lateral flow biosensor for Escherichia coli O157:H7 detection based on aptamer mediated strand displacement amplification[J]. Anal Chim Acta, 2015, 861: 62-68.
Email:fengweihlj@163.com。
中图分类号:Q81
文献标识码:A
DOI:[CLC Number] Q81[DocumentCode] A10. 11967/2016140302 10.11967/2016140302
基金项目:⋆国家重大科学仪器设备开发专项课题( 2012YQ04014005)和国家自然科学基金面上项目( 21275019) 资助。
作者简介:冯薇,北京理工大学在读硕士,主要从事生物医学检测研究。
Aptamers and Their Application in Paper-based Nanobiosensors
Feng Wei, Li Yu, Lv Xuefei*, Deng Yulin
( School of Life Science, Beijing Institute of Technology, Beijing, China 100081 ) 650201, P. R. China )
Abstract:Aptamers are single strand of DNAs ( or RNAs ) which can identify target molecules. Aptamershave been involved in many researches in the area of paper-based nanobiosensors. In this paper, features of aptamers, screen methods and applications are discussed. Then various applications of aptamers in paper-based nanobiosensors are summarized. In some ideas, aptamers are used as replacements of antibodies. While some ideas go further. Aptamers are easy to be modifi ed, so it's possible to design new principles for signal transformations. The principle of complementary base pairing can be applied to hydrogel. To lower the limit of detection, researchers use aptamers' amplifi cation in their works.
Key Words:Aptamers; Nanobiosensors; Paper-based nanobiosensors
