黄芩素对阿霉素肾病大鼠肾小管上皮细胞凋亡的调节作用*
2016-08-29易铁钢广州中医药大学深圳附属医院肾病科广东深圳518033
吴 嘉 易铁钢(广州中医药大学深圳附属医院肾病科广东深圳518033)
黄芩素对阿霉素肾病大鼠肾小管上皮细胞凋亡的调节作用*
吴 嘉 易铁钢#
(广州中医药大学深圳附属医院肾病科广东深圳518033)
目的:探讨黄芩素对阿霉素肾病大鼠肾小管上皮细胞凋亡的调节作用。方法:18只雄性Wistar大鼠随机分为正常对照组(正常组,n=6)、阿霉素肾病组(模型组,n=6)和黄芩素治疗组(治疗组,n=6),模型组和治疗组一次性尾静脉注射阿霉素2.0 mg/kg诱导阿霉素肾病动物模型,正常组注射等量生理盐水。造模后第1天开始,治疗组予黄芩素300 mg/(kg·d)灌胃,正常组和模型组予等量蒸馏水灌胃,共治疗8周。8周时留取各组大鼠24 h尿液标本及肾脏组织标本,使用TUNEL检测肾小管上皮细胞凋亡,免疫组化检测肾组织中caspase-3表达,western Blot方法检测肾皮质中Bcl-2及caspase-3蛋白水平。结果:与正常组比较,模型组24 h尿蛋白定量明显升高(P<0.05),肾小管上皮细胞凋亡数量明显增加(P<0.05),肾皮质中caspase-3蛋白水平明显增加(P<0.05),Bcl-2蛋白水平明显下降(P<0.05)。与模型组比较,治疗组24 h尿蛋白定量明显下降(P<0.05),TUNEL阳性肾小管上皮细胞数量明显减少(P<0.05),肾皮质中caspase-3蛋白水平明显下降(P<0.05),Bcl-2蛋白水平明显增加(P<0.05)。结论:黄芩素对阿霉素肾病具有一定的保护作用,其作用机制可能与调节肾小管上皮细胞凋亡有关。
阿霉素肾病;黄芩素;肾小管上皮细胞凋亡;caspase-3;Bcl-2
阿霉素肾病(Adriamycin Nephropathy,AN)动物模型最早由Bertani等于1982年制作成功。其临床特点为大量蛋白尿,病理特点类似微小病变,早期仅表现为电镜下足突融合,后期逐渐出现肾小球硬化及肾小管间质纤维化[1]。作为典型的足细胞损伤模型,许多因素参与AN发生发展[2],其中肾小管上皮细胞(Tubular Epithelial Cells,TECs)凋亡是导致肾小管损伤进而走向小管间质纤维化的重要因素[3]。中药单体黄芩素具有调节细胞凋亡和肾脏保护作用[4~5]。本研究拟从TECs凋亡角度探讨黄芩素对AN的保护作用。
1材料与方法
1.1材料
1.1.1实验动物18只雄性Wistar大鼠,体重170~220 g,购自南方医科大学实验动物中心,适应性喂养1周,实验期间自由饮水、摄食。
1.1.2实验用药、试剂及主要仪器阿霉素(Sigma Aldrich,St.Louis,MI,USA),黄芩素(南京崇原生物有限公司),Bcl-2一抗(Sigma Aldrich,St.Louis,MI,USA),western blot浓度为1∶500,caspase-3一抗(Abcam,Cambridge,UK),western blot浓度为1∶200,免疫组化浓度为1∶20,二抗(Cell signaling Tec,MA,USA),免疫组化试剂盒(Maixin-Bio,Fuzhou,China),TUNEL检测试剂盒(德国Merck),大鼠代谢笼(Tecniplast S.p.a,Buguggiate,Italy),荧光显微镜(Nikon Corporation,Tokyo,Japan),垂直电泳仪(Bio-Rad,Hercules,CA,USA),转膜仪(Bio-Rad,Hercules,CA,USA),罗氏全自动生化分析仪。
1.2方法
1.2.1动物模型制作及干预将18只雄性Wistar大鼠随机分为正常组(n=6)、模型组(n=6)和治疗组(n=6),模型组和治疗组一次性尾静脉注射阿霉素2.0 mg/kg,正常组注射等量生理盐水。造模后第1天开始,治疗组予黄芩素300 mg/(kg·d)灌胃,正常组和模型组予等量蒸馏水灌胃,共治疗8周。
1.2.2标本采集与保存治疗8周后,使用大鼠代谢笼收集各组24 h尿液标本。肾脏组织标本采集步骤如下:10%水合氯醛按35 mg/100 g腹腔注射麻醉,沿腹正中线剖开腹腔,摘除肾脏,切取一半左肾用10%福尔马林固定,经脱水,透明,石蜡包埋,切片4 μm,行TUNEL及检测免疫组织化学染色。剩余肾脏组织分离皮髓质后冻存于-80℃冰箱,以备Western Blot检测。
1.2.3标本测定24 h尿蛋白定量(免疫比浊法),使用罗氏全自动生化分析仪。使用TUNEL检测TECs凋亡,免疫组化检测肾皮质中caspase-3表达分布,Western blot方法检测肾皮质中caspase-3及Bcl-2蛋白水平。
2结果
2.124 h尿蛋白定量与正常组比较,模型组24 h尿蛋白定量明显升高(P<0.05),治疗组经黄芩素干预8周后明显下降(P<0.05)。见图1。
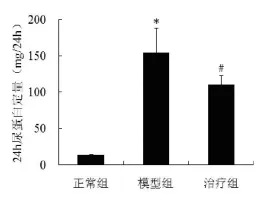
图1 各组大鼠第8周时24h尿蛋白定量
2.2TUNEL阳性TECs数量与正常组比较,模型组TUNEL阳性TECs数量明显增加(P<0.05),治疗组较模型组明显减少(P<0.05)。见图2。
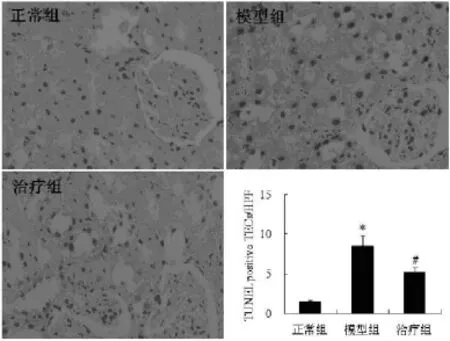
图2 各组大鼠8周时高倍镜视野下TECs凋亡计数
2.3肾组织中caspase-3表达分布免疫组化染色结果显示肾组织中caspase-3表达分布主要集中在肾小管,肾小球中也有少量表达,与TUNEL检测结果基本一致。见图3。

图3 各组大鼠8周时肾组织caspase-3免疫组化染色
2.4肾皮质中caspase-3和Bcl-2蛋白水平Western blot结果显示与正常组比较,模型组肾皮质中caspase-3蛋白水平明显增加(P<0.05),Bcl-2蛋白水平明显下降(P<0.05),与模型组比较,治疗组肾皮质中caspase-3蛋白水平明显下降(P<0.05),Bcl-2蛋白水平明显增加(P<0.05)。见图4。
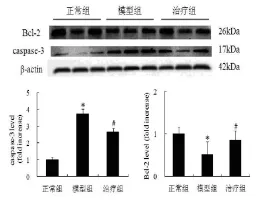
图48 周时各组大鼠肾皮质caspase-3及bcl-2蛋白水平
3 讨论
细胞凋亡是细胞在一定信号刺激下出现的自主性、程序性细胞死亡,其过程受到严格的基因调控,在正常生理过程或病理条件下均可发生,是机体维持细胞数量平衡和清除异常及危险细胞的重要机制[6]。TECs凋亡在缺血性肾损伤、药物性肾损害、梗阻性肾脏病中均起到重要作用。慢性肾病状态下,持续蛋白尿所致TECs凋亡与小管萎缩程度及肾功能损害呈明显正相关[7]。
作为细胞凋亡的重要调节蛋白,caspase-3与Bcl-2的表达与TECs凋亡密切相关[8]。AN进展至8周时,TUNEL检测结果显示模型组大鼠TECs凋亡数量明显增加,这表明TECs凋亡参与了AN肾病的进展。免疫组化染色显示caspase-3主要分布于肾小管,肾小球中仅有少量表达,与TUNEL检测结果基本一致。肾皮质中caspase-3蛋白水平表达上调则进一步证实了肾组织中细胞凋亡的发生。肾皮质中Bcl-2蛋白水平表达下调则提示线粒体凋亡通路可能参与到TECs细胞凋亡进程。经黄
芩素干预8周后,治疗组24 h尿蛋白定量明显下降,表明黄芩素对AN有一定的保护作用。治疗组TECs凋亡减少,caspase-3蛋白水平下调,Bcl-2蛋白水平上调,提示黄芩素可能通过Bcl-2、caspase-3起到调节细胞凋亡的作用,但其具体的作用机制尚需进一步探讨。综上所述,本研究初步证实了黄芩素对AN具有一定的保护作用,其作用机制可能与调节TECs凋亡有关。
[1]Bertani T,Poggi A,Pozzoni R,et al.Adriamycin-induced nephrotic syndrome in rats:sequence of pathologic events[J].Lab Invest,1982,46(1):16-23
[2]Lee VW,Harris DC.Adriamycin nephropathy:a model of focal segmental glomerulosclerosis[J].Nephrology(Carlton),2011,16(1):30-38
[3]OhseT,InagiR,TanakaT,etal.Albumininducesendoplasmic reticulum stress and apoptosis in renal proximal tubular cells[J]. Kidney Int,2006,70(8):1447-1455
[4]Lin M,Li L,Li L,et al.The protective effect of baicalin against renalischemia-reperfusion injury through inhibition of inflammation and apoptosis[J].BMC Complement Altern Med,2014,14(1):1-9
[5]Lee EK,Kim JM,Choi J,et al.Modulation of NF-kB and FOXOs by baicalein attenuates the radiation-induced inflammatory process in mouse kidney[J].Free Radic Res,2011,45(5):507-517
[6]Favaloro B,Allocati N,Graziano V,et al.Role of apoptosis in disease [J].Aging(Albany NY),2012,4(5):330-349
[7]Erkan E,Garcia CD,Patterson LT,et al.Induction of renal tubular cell apoptosis in focal segmental glomerulosclerosis:roles of proteinuria and Fas-dependent pathways[J].J Am Soc Nephrol,2005,16(2):398-407
[8]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J]. Nat Rev Mol Cell Biol,2014,15(1):49-63
R692
Bdoi:10.13638/j.issn.1671-4040.2016.04.044
广东省自然科学基金(编号:2015A030313883);广东省深圳市科技计划项目(编号:JCYJ20140408152909284,JCYJ20150401163247228);广东省深圳市卫生计生系统科研项目(编号:201402079)
#
易铁钢,E-mail:KOKYO_82@163.COM
(2016-03-18)
