纳米二氧化钛对拟南芥生长发育及基因组稳定性的影响
2016-08-29许少歆邓晨光
许少歆,徐 炜,邓晨光,王 婷*
(1.安徽大学物理与材料科学学院,安徽合肥 230601;2.中国科学院合肥物质科学研究院,中国科学院离子束生物工程学重点实验室,安徽合肥 230031)
纳米二氧化钛对拟南芥生长发育及基因组稳定性的影响
许少歆1,2,徐 炜2,邓晨光2,王 婷2*
(1.安徽大学物理与材料科学学院,安徽合肥 230601;2.中国科学院合肥物质科学研究院,中国科学院离子束生物工程学重点实验室,安徽合肥 230031)
[目的]利用3种拟南芥转基因报告系,研究纳米二氧化钛对拟南芥生长发育及基因组稳定性的影响。[方法]将拟南芥分别暴露于2种不同粒径的纳米二氧化钛材料中,检测其生长发育指标的变化,并进一步以DNA损伤修复同源重组频率和表观转录沉默基因(TGS)的激活为遗传学终点,检测纳米二氧化钛对拟南芥基因组稳定性的影响。[结果]在所使用的纳米二氧化钛材料浓度不影响拟南芥生长发育时,可以诱导拟南芥同源重组频率的增加以及同源重组相关基因表达的上调,同时能够激活受TGS调控的TGS-GUS基因、TSI以及180bp。经ICP-MS分析,钛元素在地上部分的含量并无显著增加。[结论]考虑到纳米二氧化钛材料的局部暴露,推测纳米二氧化钛可能通过间接作用诱导植物基因组不稳定性。
纳米二氧化钛;拟南芥;同源重组;基因组不稳定性
纳米材料一般指结构单元在1~100 nm的颗粒,因尺寸微小,具有独特的物理化学性质,如表面效应、光学性质、量子尺寸效应、宏观量子隧道效应和催化性能等,被广泛应用于纺织化工、机械电子、生物医药、催化和材料科学、环境分析等领域[1]。而纳米二氧化钛更是由于其能够防紫外线被广泛应用于化妆品领域[2],同时也应用于抗菌材料及废水中的有机物处理[3]。然而纳米二氧化钛的广泛应用势必会导致其不同程度地释放到环境中,对生态系统和环境产生不可预知的影响。传统意义上纳米二氧化钛被认为是低溶解性低毒的颗粒[4],也有研究表明纳米二氧化钛无毒性[5],近年来,利用动物模型发现暴露于纳米二氧化钛颗粒2年的小鼠其肺癌发生率高于普通小鼠[6-7],该研究结果对上述观念提出了挑战。国际癌症研究中心(International Agency for Research on Cancer,简称IARC)重新将其划分为2B类致癌物,而纳米二氧化钛对于植物的毒性影响仍模糊,既有正促进[3]也有负抑制[8]的结果。
DNA双链断裂(DNA double strand breaks,DSBs)是对于基因组DNA稳定性最危险的威胁,可以通过同源重组进行无错修复。生物和非生物胁迫都可以引起DNA损伤并启动植物中的同源重组修复(homologous recombination,HR)[9]。拟南芥转基因报告系R3L66是基于HR修复的一种报告基因系,该类报告系已被用来检测各种DNA损伤物质的基因毒性,包括电离辐射、重金属、紫外线、除草剂等[10]。真核生物中体细胞HR修复都是由RAD52家族催化完成的[11],而RAD54是RAD52家族的重要成员,正常情况下,RAD54基因表达水平较低,当外界胁迫产生大量DSB时,RAD54基因表达水平显著上调以提高HR修复的频率。而诱导型转基因型15-6#中,AtRAD54的表达水平通过GUS蛋白活性来表达,且在前期研究中,发现其能够反映胁迫条件下AtRAD54的应答情况[12]。外界胁迫诱导植物基因组不稳定性,不仅直接体现在DNA链断裂,也会影响DNA修饰,包括DNA甲基化、组蛋白的翻译后修饰和染色质重塑等表观遗传终点的改变。表观遗传调控基因沉默对维持基因组的完整性至关重要[13]。表观遗传机制是植物对环境胁迫产生必不可少的应激反应。植物中一些重复的基因序列,通常被转录基因沉默(transcriptional gene silencing,TGS)机制调控,能够响应外界胁迫,成为表观遗传调控在胁迫条件下的衡量指标。L5系拟南芥基因组中包含了一段单插入的多拷贝P35S:GUS基因(TGS-GUS),TGS-GUS的表达被TGS机制所调控,因此,L5系拟南芥是用来研究重复元件的表观调控的理想模型[14-16]。利用这3种转基因系,前期实验已经很好地证明了低剂量辐射、致癌物甲醛能够诱导植物基因组不稳定性[12,17-18]。笔者进一步利用这3种拟南芥转基因报告系,研究纳米材料二氧化钛对拟南芥生长发育及基因组稳定性的影响。
1 材料与方法
1.1实验材料
1.1.1拟南芥品系。哥伦比亚生态型野生型拟南芥N1092,购自诺丁汉拟南芥种质中心(Nottingham Arabidopsis Stock Centre,简称NASC);拟南芥AtRAD54promoter::GFP+GUS转基因系15-6#,由Dr.Seiichi Toki(National Institute of Agrobilogical Sciences,Japan)[19]惠赠;拟南芥P35S::GUS(TGS-GUS)转基因系L5-1,由Dr.Ortrun Mittelsten Scheid(Gregor Mendel Institute of Molecular Plant Biology,Austrian Academy of Sciences,Austria)[14]惠赠,拟南芥CaMV35Spromoter::β-glucuronidase(uidA)转基因系R3L66,由Dr.Francois Belzile(Department of phytology,University of Laval,Canada)惠赠[10]。
1.1.2纳米二氧化钛。21 nm粒径二氧化钛,球形,99.5%纯度(购自Sigma-Aldrich);100 nm粒径二氧化钛,球形,金红石和锐钛矿混合物,99.5%纯度(购自Sigma-Aldrich)。使用前,将纳米二氧化钛颗粒悬浮在去离子水中,经超声振荡2次分散(100 W,40 kHz)40 min,然后加入到MS培养基中混合,超声振荡分散(100 W,40 kHz)30 min,点播拟南芥种子。
1.1.3生长条件。将用75%无水乙醇和NaClO消毒的无菌拟南芥种子4 ℃冷处理48 h后,点播在含相应纳米二氧化钛浓度的MS培养基上(10 g/L蔗糖,0.8 g/L琼脂),水平培养,培养条件:温度(21±1)℃,光照周期16 h/d,光照强度约100 μmol/(cm2·s)。
1.2GUS活性定量检测和组织化学定性检测
1.2.1定量检测。取直立于培养基之上,未与培养基接触的地上部分为检测样品。对于15-6#、L5-1品系的拟南芥植株移去下胚轴及以下部分,地上部分(真叶、子叶和部分茎)一棵一组加至1.5 mL eppendorf管中,加入100 μL 4-MUG反应液(50 mmol/L sodium phosphate(pH 7.0),10 mol/L EDTA(pH8.0),0.1% SDS,0.1 % triton X-100,10 mmol/L 4-MUG),37 ℃水浴后,加入50 μL Na2CO3溶液终止反应。检测时每个样品10组,取100 μL反应液加入96孔酶标板中,酶标仪检测荧光强度(激发光波长365 nm,发射光波长455 nm)[20]。
1.2.2定性检测。对于R3L66品系的拟南芥植株,在莲座期(发芽后约20 d)采样,取未接触到纳米材料的地上部分,通过组织化学染色测定。通过计算每个植株的重组事件(蓝点)来计算同源重组频率(Homologous recombination frequency,HRF):HRF=x/n,其中,x为取样中所有重组事件的总数,n为取样的个体数。最终数值是3次独立重复实验、每次实验30个以上检测样本的平均值。
1.3qRT-PCR检测TGS位点和同源重组相关基因qRT-PCR检测纳米二氧化钛材料中暴露7 d后TSI和180bp以及同源重组相关基因AtRAD51、AtDMC1、AtXRCC3的转录水平[13,21]。
取10~20株拟南芥的地上部分(未接触含有纳米材料的培养基),液氮研磨后提RNA,反转录试剂盒为全式金公司的TransScrip® All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(one-step gDNA removal),qPCR反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃15 s,72 ℃10 s,40个循环。所有qPCR数据均为3次生物学重复,每个生物学重复包含3次技术重复,qRT-PCR引物序列见表1[14]。
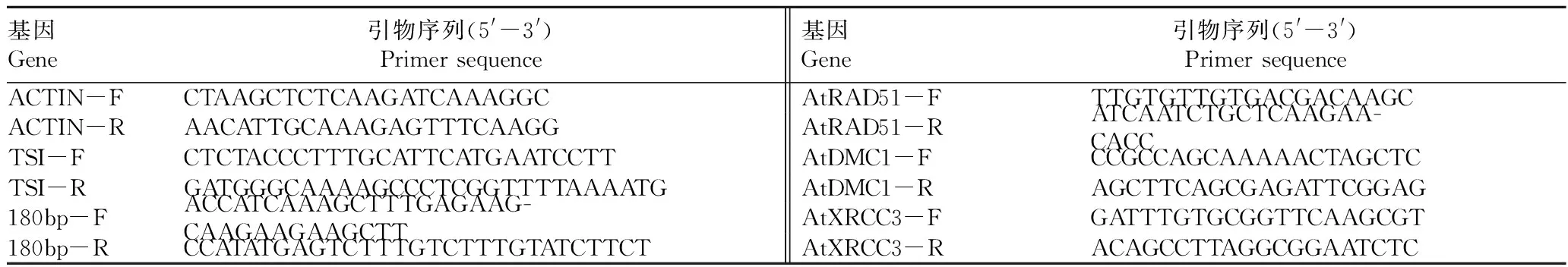
表1 qRT-PCR的引物序列
1.4ROS水平测定取经纳米二氧化钛材料处理7 d后的拟南芥地上部分,用CH-H2DCFDA探针(购自Molecular Probes)检测地上植株中的ROS含量[22]。其中,每个样品约20 mg,实验结果为最少5次独立实验的平均值。
1.5电镜表征纳米二氧化钛材料分别称取2种粒径的纳米二氧化钛,将其分散在水溶液中,超声振荡30 min后,用洁净的镍网夹夹取镍网在分散的纳米二氧化钛溶液中蘸取,保证镍网充分接触悬浮液后,把镍网放在干净的滤纸上自然风干,用TEM观察2种纳米二氧化钛的形态和尺寸。
1.6ICP-MS测定地上部分钛元素含量取根部暴露在含有纳米二氧化钛材料的培养基中7 d后及22 d后的拟南芥没有接触到培养基的地上组织部分,用ICP-MS(X Series 2,Thermo fisher Scientific)检测钛元素的含量。
1.7数据处理所有的数据经过T-检验,P值小于0.05表示有显著性差异。
2 结果与分析
2.1纳米二氧化钛的表征小粒径二氧化钛粒径在21 nm左右,大部分接近圆形或椭圆形,易发生团聚(图1A)。大粒径TiO2粒径在90~100 nm,大部分接近圆形或椭圆形(图1B)。

注:A.21 nm;B.100 nm。Note:A.21 nm;B.100 nm.图1 纳米二氧化钛材料电镜表征结果Fig.1 Measurement results of TiO2-NPs condition by Transmission Electron Microscopy (TEM)
2.2纳米二氧化钛暴露对拟南芥根长及鲜重的影响不同浓度不同粒径的纳米二氧化钛对拟南芥根长及鲜重的影响见图2、3。由图2、3可知,在二氧化钛浓度为10、20、50 μg/mL时,2种粒径的纳米二氧化钛对鲜重及根长均无影响。
2.3根部暴露在纳米二氧化钛中的拟南芥地上部分DNA同源重组频率的变化进一步利用拟南芥品系R3L66的种子萌发及生长在含有不同粒径和浓度的纳米二氧化钛的培养基中,选取22 d的地上部分组织进行检测。因为同源重组频率不仅取决于DNA双链断裂(DSBs)的水平,而且也和底物相关,如供试样品的大小。因此,选取对于拟南芥鲜重无影响的纳米二氧化钛材料的浓度(10、20 μg/mL),结果发现,仅根部暴露在纳米二氧化钛材料中的拟南芥地上部分,在浓度为10和20 μg/mL、粒径为21和100 nm的条件下,均导致同源重组频率的增加(图4),表明不影响植物生长的低浓度纳米二氧化钛能够诱导植物同源重组频率的增加。

图2 不同浓度纳米二氧化钛处理下拟南芥的生长表型Fig.2 Growth of A.thaliana treated by different concentrations of TiO2-NPs
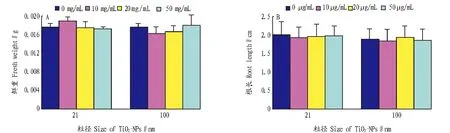
图3 不同浓度纳米二氧化钛处理下拟南芥的鲜重和根长Fig.3 Fresh weight and root length of A.thaliana treated by different concentrations of TiO2-NPs
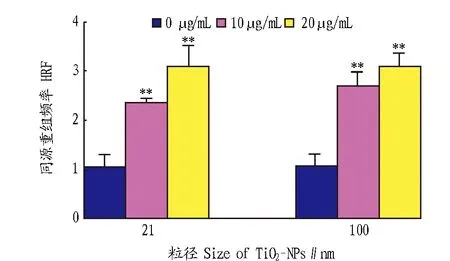
图4 暴露在纳米二氧化钛中的拟南芥同源重组频率的变化Fig.4 Changes of DNA HRF in the aerial plants after exposure to TiO2-NPs
2.4纳米二氧化钛处理诱导拟南芥同源重组相关基因的表达将拟南芥转基因品系15-6#暴露在2种粒径的纳米二氧化钛中,7 d后检测地上部分GUS蛋白的水平,结果发现,2种粒径的纳米二氧化钛在10 μg/mL下不能诱导AtRAD54表达水平的增加,而在20 μg/mL下均能诱导AtRAD54表达水平的增加。但对于50 μg/mL的纳米二氧化钛处理,小粒径的纳米二氧化钛能诱导AtRAD54表达水平的增加,但大粒径的二氧化钛不能诱导AtRAD54表达水平的增加(图5)。利用定量PCR方法进一步检测其他与同源重组相关的基因在浓度20 μg/mL下的表达情况,结果发现,小粒径二氧化钛处理能够诱导AtRAD51、AtDMC1、AtXRCC3的显著增加,而大粒径的二氧化钛能够诱导AtRAD51、AtDMC1、AtXRCC3的增加,但不显著(图6)。

图5 纳米二氧化钛处理后AtRAD54的表达水平Fig.5 The expression levels of AtRAD54 in the seedlings subjected to TiO2-NPs

图6 纳米二氧化钛处理后拟南芥同源重组相关基因的表达水平Fig.6 The expression levels of other HR-related genes in the seedlings subjected to TiO2-NPs
2.5不同粒径的纳米二氧化钛诱导TGS基因激活上述结果显示,纳米二氧化钛能够诱导DNA同源重组的增加以及同源重组修复基因表达水平的增加,表明纳米材料能够增加拟南芥基因组不稳定性。为了进一步证明该结论,选择另一个转基因报告系L5-1,该报告系能够反映受转录沉默调控基因对于外界胁迫的反应。L5-1幼苗在含有不同浓度不同粒径的纳米二氧化钛的培养基中生长,7 d检测地上部分TGS-GUS的表达情况。结果发现,对于暴露在含有纳米二氧化钛材料培养基中的拟南芥,仅粒径21 nm、浓度 20 μg/mL时能够诱导TGS-GUS的激活。而10和50 μg/mL 21 nm的二氧化钛不能诱导TGS-GUS的激活,而大粒径(<100 nm)的纳米二氧化钛在浓度10、20以及50 μg/mL下均不能诱导TGS-GUS的激活(图7)。进一步利用RT-PCR检测了其他2种受TGS调控的内源重复序列TSI和180bp在20 μg/mL的2种纳米粒径二氧化钛暴露下的表达情况。结果发现,21 nm的纳米二氧化钛能够显著诱导TSI和180bp表达的增加,100 nm的纳米二氧化钛处理和对照无显著差异(P>0.05)(图8)。这表明暴露于纳米二氧化钛中能够诱导拟南芥TGS基因的激活,进而导致基因组不稳定性。

图7 纳米二氧化钛处理后TGS-GUS的表达水平Fig.7 The expression levels of TGS-GUS in the seedlings subjected to TiO2-NPs

图8 纳米二氧化钛处理后TSI和180 bp的表达水平Fig.8 The expression levels of TSI and 180 bp in the seedlings subjected to TiO2-NPs
2.6纳米二氧化钛处理后拟南芥地上部分ROS水平的变化由图9可知,与对照组相比,纳米二氧化钛材料处理组的ROS水平显著下降(P<0.05)。考虑到试验中暴露于纳米材料的组织主要是根部,可能是由于纳米材料导致根部氧化胁迫,激活了植株体内抗氧化酶的活性,从而导致地上部分ROS水平有所下降。
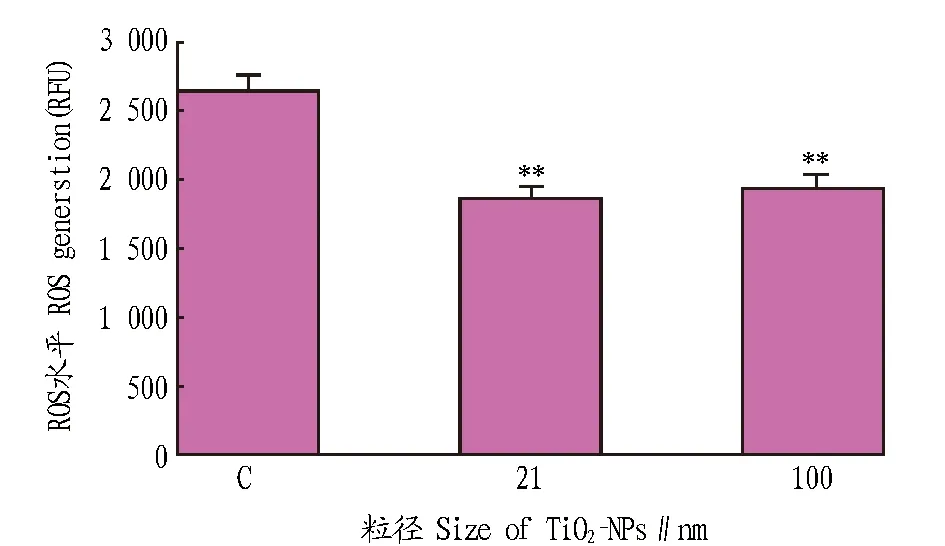
图9 纳米二氧化钛处理后地上部分的ROS水平Fig.9 The level of ROS in the aerial plants after TiO2-NPs treatment
2.7纳米二氧化钛材料处理后拟南芥地上部分钛元素的含量上述结果表明,纳米二氧化钛材料可以诱导拟南芥地上部分组织同源重组频率的增加以及TGS调控基因的激活。但在这一系列实验中,拟南芥仅根部接触到含有纳米二氧化钛材料的培养基,因此,关于纳米二氧化钛材料对于拟南芥的作用机制中亟待解决的问题是,纳米粒子是否首先被根部吸收,再被转运到地上部分,并最终激活地上部分组织中的生物变化。ICP-MS测定对照组与20 μg/mL纳米二氧化钛材料处理组的地上部分钛元素含量,发现在含有纳米二氧化钛培养基中短期暴露7 d后的拟南芥地上部分组织中,钛元素含量均无显著变化,而长期暴露22 d后,2种粒径的钛元素含量均上升(图10)。这表明纳米二氧化钛材料对于拟南芥地上部分组织诱导出的早期的改变(如同源重组修复相关基因的表达以及TGS基因的激活)可能是由受胁迫根部产生的损伤信号间接作用而成的。
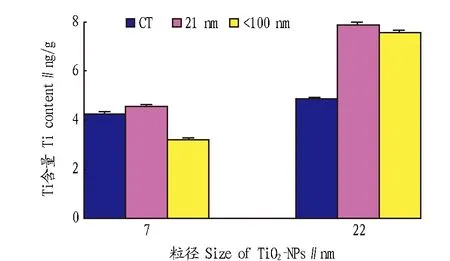
图10 纳米二氧化钛处理后地上部分组织Ti元素含量Fig.10 The content of Ti in the aerial plants after TiO2-NPs treatment
3 讨论
随着纳米材料全球性的应用和环境中纳米材料的释放,纳米材料颗粒的环境毒性已经引起了高度重视,过去的研究大多关注纳米材料对植物生长发育层面的影响,而该实验提供了一个敏感可靠的评估纳米材料对拟南芥遗传毒性的方法。
该实验使用3种反映不同生物学终点的拟南芥转基因品系,评估纳米二氧化钛材料对拟南芥的遗传毒性,结果表明,当纳米二氧化钛浓度为10 μg/mL时,AtRAD54基因的表达和TGS基因的沉默不受影响;当暴露浓度达20 μg/mL时,AtRAD54基因的表达水平和与同源重组频率均上升,同时转录沉默位点相关基因被激活。长期暴露浓度为50 μg/mL的试验组和浓度为20 μg/mL的试验组相比,同源重组频率有所下降,这表明在DNA修复过程中同源重组修复可能被其他修复通路部分取代。
粒径大小已被证明可以极大地影响纳米材料的毒性,在大多数情况下,粒径较小的纳米颗粒因具有较大的表面积体积比,会产生较大的生物反应。在纳米材料诱导同源重组频率改变的实验中,粒径为21 nm和粒径为100 nm的实验组间无差异。但对于AtRAD54基因表达诱导的转录后基因沉默的激活,浓度均为50 μg/mL时,粒径为21 nm的二氧化钛材料可以诱导AtRAD54基因与其他同源重组相关基因表达水平的上调,而粒径为100 nm的二氧化钛不可以。浓度均为20 μg/mL时,粒径为21 nm的二氧化钛可以诱导转录后基因沉默的激活,而粒径为100 nm的二氧化钛不可以。这表明在诱导DNA损伤和转录基因沉默激活方面,小粒径纳米材料具有更高的活性。
研究表明,纳米二氧化钛材料很难被植物根系吸收。该实验经ICP-MS检测到根部暴露在纳米二氧化钛材料中的拟南芥地上部分组织中的钛元素与对照组相比无显著变化,可能是因为钛元素不是拟南芥的必要元素,缺乏相应转运受体。纳米二氧化钛材料对于拟南芥的作用机制可能是根系产生应激信号并由根冠通讯运输至地上部分。以往研究大多认为ROS胁迫是纳米材料毒性的直接来源之一。在该实验中,经纳米二氧化钛材料处理7 d后的拟南芥地上部分组织中ROS水平降低,可能是因为暴露在纳米材料中的根部受到胁迫,产生了应激信号被输送至地上部分,SOD和CAT等抗氧化酶被激活,ROS被清除。因此,对于纳米二氧化钛材料引起的毒性作用,ROS的变化可能不是直接原因。
该研究使用3个对环境敏感的拟南芥转基因品系,研究了纳米二氧化钛对拟南芥的遗传毒性效应。结果表明,纳米二氧化钛处理根部可以诱导拟南芥地上部分中DNA损伤和TGS基因的激活。这表明在评估纳米材料对于生态环境的毒害影响时,植物作为环境中的重要组成部分,也需要被充分考虑。
[1] OBERDÖRSTER G,STONE V,DONALDSON K.Toxicology of nanoparticles:A historical perspective[J].Nanotoxicology,2007,1(1):2-25.
[2] TROUILLER B,RELIENE R,WESTBROOK A,et al.Titanium dioxide nanoparticles induce DNA damage and genetic instabilityinvivoin mice[J].Cancer research,2009,69(22):8784-8789.
[3] CASTIGLIONE M R,GIORGETTI L,GERI C,et al.The effects of nano-TiO2on seed germination,development and mitosis of root tip cells ofVicianarbonensisL.andZeamaysL.[J].Journal of nanoparticle research,2011,13(6):2443-2449.
[4] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans.Cobalt in hard metals and cobalt sulfate,gallium arsenide,indium phosphide and vanadium pentoxide[M].Lyon(FR):International Agency for Research on Cancer,2006:1.
[5] NOHYNEK G J,DUFOUR E K,ROBERTS M S.Nanotechnology,cosmetics and the skin:Is there a health risk?[J].Skin pharmacology and physiology,2008,21(3):136-149.
[6] LEE K P,TROCHIMOWICZ H J,REINHARDT C F.Pulmonary response of rats exposed to titanium dioxide(TiO2)by inhalation for two years[J].Toxicology and applied pharmacology,1985,79(2):179-192.
[7] ILSI R S I.The relevance of the rat lung response to particle overload for human risk assessment:a workshop consensus report[J].Inhalation toxicology,2000,12(1/2):1.
[8] ZHENG L,HONG F,LU S,et al.Effect of nano-TiO2on strength of naturally aged seeds and growth of spinach[J].Biological trace element research,2005,104(1):83-91.
[9] BAUBEC T,PECINKA A,ROZHON W,et al.Effective,homogeneous and transient interference with cytosine methylation in plant genomic DNA by zebularine[J].The plant journal,2009,57(3):542-554.
[10] LI L,SANTERRE-AYOTTE S,BOIVIN E B,et al.A novel reporter for intrachromosomal homoeologous recombination inArabidopsisthaliana[J].The plant journal,2004,40(6):1007-1015.
[11] SYMINGTON L S.Role of RAD52 epistasis group genes in homologous recombination and double-strand break repair[J].Microbiology and molecular biology reviews,2002,66(4):630-670.
[12] LI F,LIU P,WANG T,et al.The induction of bystander mutagenic effectsinvivoby alpha-particle irradiation in wholeArabidopsisthalianaplants[J].Radiation research,2010,174(2):228-237.
[13] MOISSIARD G,BISCHOF S,HUSMANN D,et al.Transcriptional gene silencing byArabidopsismicrorchidiahomologues involves the formation of heteromers[J].Proceedings of the national academy of sciences,2014,111(20):7474-7479.
[14] PECINKA A,DINH H Q,BAUBEC T,et al.Epigenetic regulation of repetitive elements is attenuated by prolonged heat stress inArabidopsis[J].The plant cell,2010,22(9):3118-3129.
[15] ELMAYAN T,PROUX F,VAUCHERET H.ArabidopsisRPA2:A genetic link among transcriptional gene silencing,DNA repair,and DNA replication[J].Current biology,2005,15(21):1919-1925.
[16] LANG-MLADEK C,POPOVA O,KIOK K,et al.Transgenerational inheritance and resetting of stress-induced loss of epigenetic gene silencing inArabidopsis[J].Molecular plant,2010,3(3):594-602.
[17] XU W,WANG T,XU S,et al.Radiation-induced epigenetic bystander effects demonstrated inArabidopsisthaliana[J].Radiation research,2015,183(5):511-524.
[18] 李方华,王婷,卞坡,等.环境污染物甲醛引起拟南芥同源重组频率变化的研究[J].生物物理学报,2009(S1):459-460.
[19] OSAKABE K,ABE K,YOSHIOKA T,et al.Isolation and characterization of the RAD54 gene fromArabidopsisthaliana[J].The plant journal,2006,48(6):827-842.
[20] WEIGEL D,GLAZEBROOK J.Arabidopsis:A laboratory manual[M].New York:Cold Spring Harbor Laboratory Press,2002,249-252.
[21] BOYKO A,HUDSON D,BHOMKAR P,et al.Increase of homologous recombination frequency in vascular tissue ofArabidopsisplants exposed to salt stress[J].Plant and cell physiology,2006,47(6):736-742.
[22] GOMES A,FERNANDES E,LIMA J L F C.Fluorescence probes used for detection of reactive oxygen species[J].Journal of biochemical and biophysical methods,2005,65(2):45-80.
Effects of TiO2-NPs on the Growth, Development and Genome Stability ofArabidopsisthaliana
XU Shao-xin1,2,XU Wei2,DENG Chen-guang2, WANG Ting2*
(1. School of Physics and Materials Science, Anhui University, Hefei, Anhui 230601; 2. Key Laboratory of Ion Beam Bioengineering, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei, Anhui 230031)
[Objective] To study the effects of TiO2-NPs on the genome stability and growth ofArabidopsisthalianaby using three kinds of transgenic lines ofArabidopsisthaliana. [Method] The model plantsA.thalianawere exposed to culture medium contained two different sized TiO2-NPs to study the effects on the growth and development ofA.thaliana, and some genetic and epigenetic changes such as DNA homologous recombination (HR) and the activation of transcriptional gene silencing (TGS) were used to evaluate their genome stability. [Result] When the used TiO2-NPs didn’t affect the growth and development ofA.thaliana, it increased the HR induction, up-regulated the expressions of HR-related genes, and activated the TGS loci (TGS-GUS,TSI, and 180bp). ICP-MS analysis showed that the content of Ti in the aerial plants was not significantly increased. [Conclusion] Considering the localized exposures of the roots to TiO2-NPs, it is speculated that the genome instability of the plants may be induced by TiO2-NPs through an indirect pathway.
TiO2-NPs;Arabidopsisthaliana; Homologous recombination;Genome instability
国家重大科学研究计划项目(2014CB932002)。
许少歆(1993- ),女,安徽合肥人,硕士研究生,研究方向:生物物理学。*通讯作者,助理研究员,博士,从事辐射生物学和环境毒理学方面的研究。
2016-04-06
Q 943
A
0517-6611(2016)19-166-05
