PARP抑制剂对Lewis肺癌细胞及移植瘤放疗增敏作用及其机制
2016-08-27王维段碧霞曾丽
王维 段碧霞 曾丽
电离辐射所致的肿瘤细胞DNA损伤主要为链断裂:单链断裂(single strand breaks,SSBs)与双链断裂(double strand breaks,DSBs);其中SSBs发生的频率是DSBs的10倍-20倍[1]。在通常情况下,电离单击所致的SSBs多能通过细胞内聚腺苷二磷酸核糖聚合酶[poly(ADP-rbose)polymerase,PARP]、DNA连接酶以及其他损伤修复相关因子的参与进行较完整的修复[2],而DSBs的修复则要困难很多,需通过激活同源重组(homologous recombination,HR)或非同源末端连接(nonhomologous end joining,NHEJ)途径完成[1,3]。DSBs成为电离辐射在细胞染色体上最致命的损伤,DNA损伤修复与否则是影响受照细胞存活的关键因素[1,4]。基于PARP在细胞SSBs修复中的关键性作用,靶向抑制其修复的新思路成为近年来研究的热点之一,相关新药Olaparib(PARP1/PARP2/PARP3抑制剂,奥拉帕尼)于2014年12月美国FDA批准上市。临床研究[5-7]结果表明,Olaparib联合紫杉醇、吉西他滨、铂类等化疗药物治疗可使得患者获益。目前,PARP抑制剂在联合放疗方面研究较少,已有的相关研究报告[8,9]显示,其在体外联合照射细胞可提高放疗生物效应。本实验在Lewis肺癌细胞及小鼠移植瘤模型上研究PARP抑制剂联合放疗时生物效应的变化,并探索其可能的机制。
1 材料与方法
1.1 材料
1.1.1 细胞株与实验小鼠 Lewis肺癌细胞株为本实验室保存。C57/BL小鼠:雌性,6周-8周龄,重15 g-20 g,饲养于无特定病原体(specific pathogen free,SPF)级环境,购于北京华阜康生物科技公司,实验动物许可证编号:SCXK(京)2014-0004。实验获本院动物保护和应用委员会批准,动物实验人员资格证书编号:CQLA-2013-0734。
1.1.2 主要试剂 MTT试剂盒购于北京康为世纪生物科技公司,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购于Biosciences公司,Olaparib-AZD2281购于Selleck Chemicals公司,BCA蛋白浓度测定、Beyo ECL Plus发光试剂购于上海碧云天生物技术公司,Anti-Phospho-Histone H2AX(Ser139)购于Upstate公司,Bax、caspase-3、Bcl-2兔抗鼠单克隆抗体购于Abcam公司,TUNEL试剂盒购自美国罗氏公司。
1.2 细胞培养及移植瘤小鼠建模 Lewis肺癌细胞培养于DMEM/HIGHGLUCOSE培养基中(10%胎牛血清,100 μg/mL青霉素-链霉素),于37℃、5%CO2、90%湿度孵箱中培养,细胞贴壁。取对数期生长细胞,消化计数,约1.5×106个细胞/只接种于小鼠右侧肋部。
1.3 MTT检测Olaparib IC10浓度 Lewis细胞以8.0×103个/孔接种于96孔板,细胞贴壁,各孔加入Olaparib[浓度梯度(μmol/L):0、3.125、6.25、12.5、25、50],各浓度3个复孔。培养48 h后各孔中加入20 μL MTT,避光4 h弃上清,加入150 μL二甲基亚砜,避光振荡5 min。酶标仪测各孔吸光度(density,D)值(570 nm波长处)。存活率=(实验组各孔D值/空白组D值)×100%,通过BLISS法计算10%抑制浓度(10% inhibitory concentration,IC10)与50%抑制浓度(50% inhibitory concentration,IC50)值。IC10作为后续Olaparib体外用药浓度。
1.4 克隆形成实验比较 实验分为放疗(radiotherapy,RT)组与Olaparib+RT组,两组照射均含0 Gy、0.5 Gy、1 Gy、2 Gy、4 Gy、6 Gy剂量点。均使用Synergy直线加速器6 MV X射线(剂量率:1 Gy/min)等中心照射,射野10 cm×15 cm,源皮距=100 cm,瓶面放一1.5 cm厚等效有机玻璃。取对数期细胞,根据不同照射剂量点以100个-10,000个细胞/孔(表1)接种于6孔板,待细胞贴壁后,用药组照射前2 h加入Olaparib后行相应剂量点照射。受照细胞培养10 d后,经固定、染色、晾干处理,采用光镜计数各剂量点集落数目(≥50个细胞为一集落)。接种效率=0 Gy点平均集落数/100,存活分数(survival fraction,SF)=该剂量点平均集落数/(该点接种细胞数×接种效率),根据经典单击多靶模型SF=1-[1-exp(-D/D0)]N拟合曲线,得到平均致死剂量D0值,放疗增敏比(sensitivity enhancement ratio,SER)=D0(RT组)/D0(Olaparib+RT组)。
1.5 流式细胞术检测体外细胞凋亡 实验分为空白对照、Olaparib、RT(2 Gy)、Olaparib+RT(2 Gy)组,细胞以3.5×105个/孔密度接种于6孔板上培养24 h(用药组照射前2 h加入Olaparib),接受2 Gy照射。培养24 h,消化、洗涤、离心收集细胞,加入200 μL缓冲液重悬,再加入5 μL Annexin V/FITC和10 μL碘化丙啶,避光孵育15 min后加入300 μL缓冲液待用。使用流式细胞仪分类计数。右上象限及右下象限分别代表晚期与早期凋亡细胞。
1.6 小鼠移植瘤外照射 小鼠移植瘤体积平均长至250 mm3后,随机分为4组(n=5):空白对照、Olaparib、RT(2 Gy×5 d)、Olaparib+RT组,0.9%Nacl或Olaparib(用法用量依据预实验结果及已有研究资料[10]:50 mg/kg/d,灌胃,照射前30 min-60 min给药)。空白对照(0.9%Nacl,d1-d5)、Olaparib组(Olaparib,d1-d5)、RT组(移植瘤照射,2 Gy/d,d1-d5)、Olaparib+RT组(Olaparib,d1-d5;移植瘤照射,2 Gy/d,d1-d5)。每隔2天游标卡尺外部测量移植瘤最大径A及最小径B,瘤块体积V=π/6×[(A+B)/2]3,绘制肿瘤生长曲线,移植瘤长至4倍初体积(1,000 mm3)后处死小鼠。比较各组小鼠移植瘤长至4倍初体积(1,000 mm3)时所需天数。
1.7 Western blot检测γH2AX、Bax/Bcl-2、Caspase-3蛋白表达 收集目的细胞(2 Gy剂量点,受照后2 h)、瘤块组织(小鼠放疗结束后,即d6),RIPA裂解液裂解细胞(组织),调整样品蛋白浓度。8%SDS-PAGE分离样品蛋白60 μg,250 mA恒流电转膜至硝酸纤维滤膜,封闭2 h,置于一抗封闭液中,4℃孵育过夜。将膜置于含辣根过氧化物酶偶联的IgG二抗中,孵育2 h后采用ECL Plus发光试剂显色。以GAPDH为内参,采用Image Lab软件分析条带灰度值,以目的蛋白/GAPDH比值半定量反应蛋白相对表达水平。
1.8 TUNEL法检测瘤块细胞凋亡 采用凋亡细胞的原位末端转移酶标记法(TUNEL法),TdT酶液和荧光标记液按1:9比例混合,配成TUNEL反应液(整个操作步骤按说明书进行)。正常细胞核染为蓝色,凋亡细胞核染为棕黄色,在×400高倍视野(high power,HP)光学显微镜下随机选取5个癌区,计数凋亡细胞数(个/HP)。
1.9 统计学方法 使用IBM SPSS 19.0统计软件进行数据分析。数据以Mean±SD表示,两组数据间比较使用t检验,两组以上数据比较使用单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
2 结果
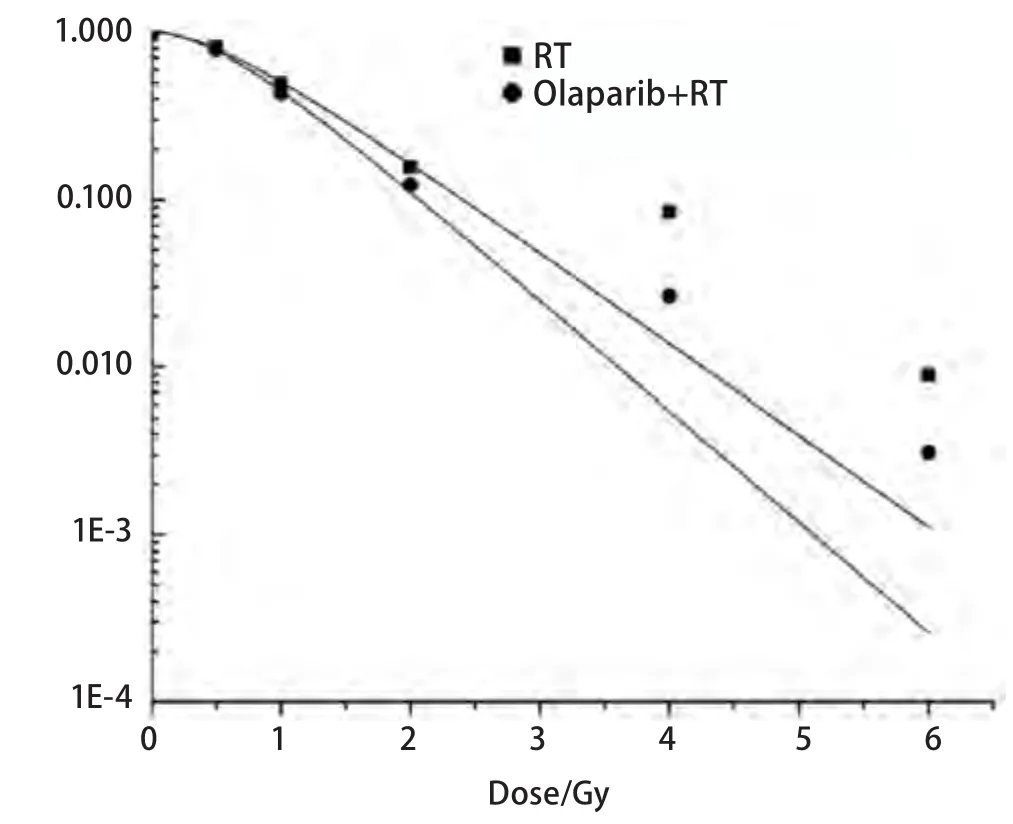
图1 多靶单击模型拟合细胞存活曲线Fig 1 Cell survival curves plotted by the “single-hit multi-target model”.RT:Radiotherapy.
2.1 Olaparib对Lewis细胞增殖抑制作用 MTT检测结果示,Lewis细胞在浓度梯度(μmol/L)为:0、3.125、6.25、12.5、25、50的Olaparib作用下存活百分比依次为:100%、97.33%、84.36%、59.67%、39.16%、24.56%,计算得出IC10与IC50值分别为:4.4 μmol/L、19.6 μmol/L。可见随Olaparib浓度增高,细胞存活率降低,即Olaparib体外对Lewis细胞存在剂量毒性,故选择低毒剂量IC10值作为Olaparib体外用药浓度。
2.2 细胞克隆形成情况 克隆形成实验得出,RT组与Olaparib+RT组细胞在0 Gy、0.5 Gy、1 Gy、2 Gy、4 Gy、6 Gy各剂量点存活分数(表1)。多靶单击模型SF=1-[1-exp(-D/D0)]N拟合曲线(图1)得出放射生物学指标D0值(Gy)在RT组与Olaparib+RT组中分别为:0.797、0.658。Olaparib联合放疗SER为1.211(0.797/0.658)。
2.3 不同处理组细胞体外凋亡差异 细胞接受2 Gy照射后24 h,行流式细胞术检测细胞凋亡率(图2)。Olaparib+RT组、Olaparib组、RT组、空白组中Lewis细胞凋亡率依次为:(24.77±2.0)%、(3.89±1.1)%、(16.22±2.4)%、(0.53±0.1)%。可见Olaparib+RT组细胞凋亡率显著高于其余三组(均P<0.05)。
2.4 不同处理组移植瘤细胞体内凋亡差异 光镜下(×400)Olaparib+RT组、Olaparib组、RT组、空白组移植瘤组织中TUNEL染色阳性(凋亡)细胞的细胞核呈棕黄色(图3),其平均凋亡细胞数(个/HP)依次为:(12.4±1.1)、(4.4±1.1)、(8.0±1.2)、(2.2±0.8)。统计得出,Olaparib+RT组细胞凋亡率显著高于其余三组(均P<0.05)。
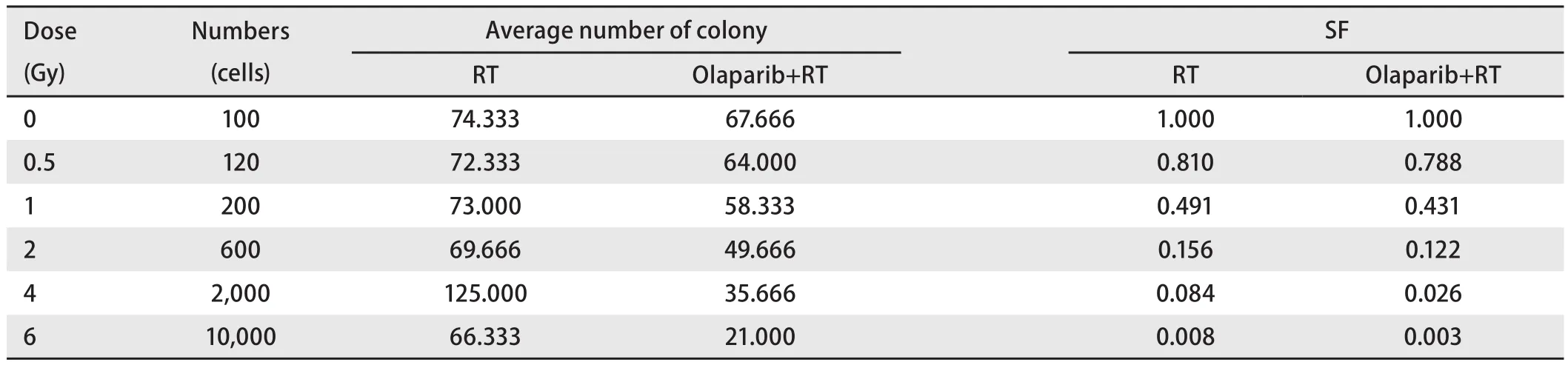
表1 各剂量点细胞存活分数Tab 1 Cell survival fraction at each dose point
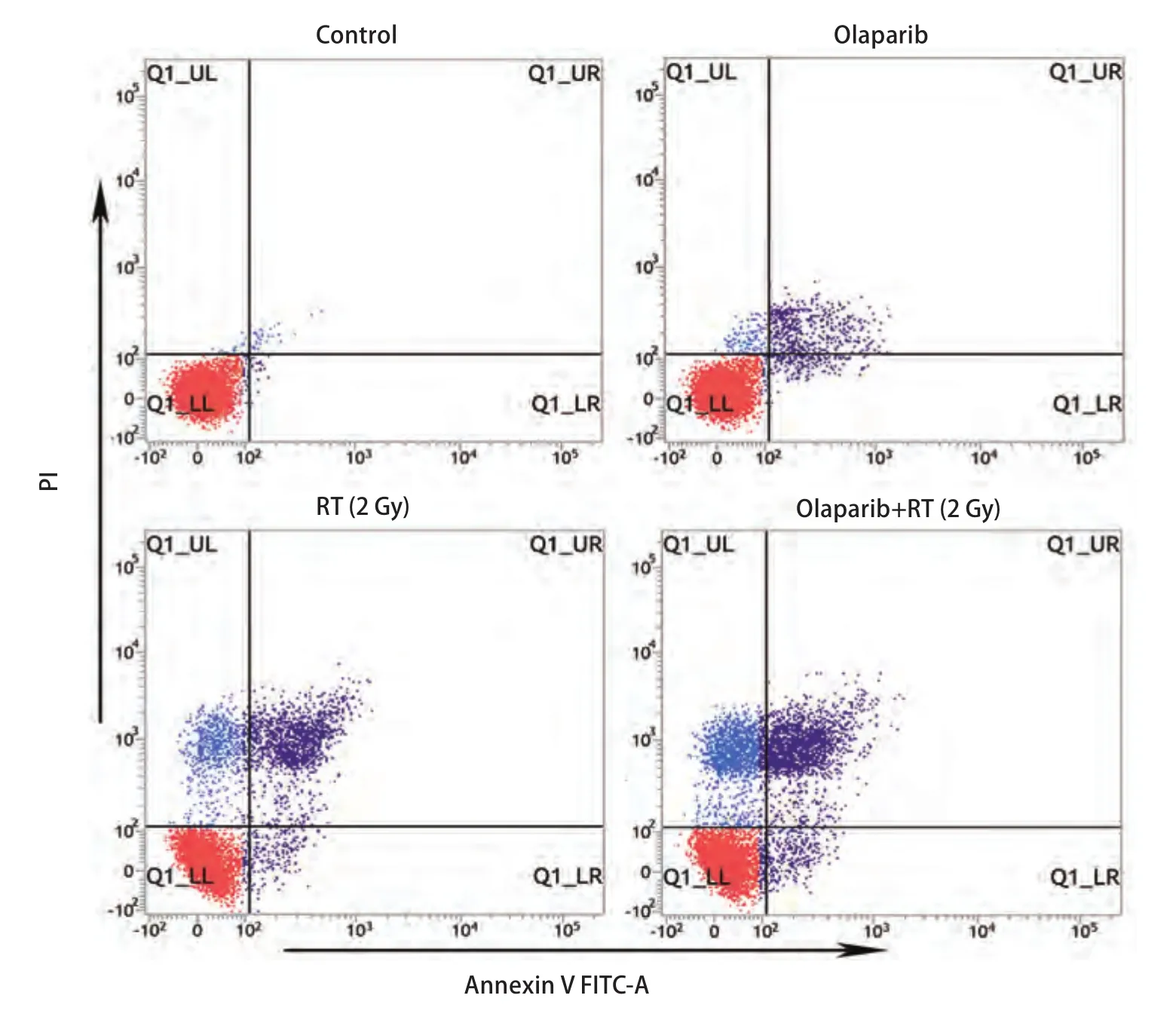
图2 Lewis细胞体外凋亡率差异。流式细胞术检测各组细胞凋亡率,可见Olaparib+RT组细胞体外凋亡率显著高于其余三组(均P<0.05)。Fig 2 Differential cell apoptotic rate in vitro.Cell apoptotic rate was measured by flow cytometry analysis.The apoptotic cells in Olaparib+RT group were significantly higher than the other three groups in vitro (all P<0.05).
2.5 DNA损伤及凋亡相关蛋白表达差异 Lewis细胞在接受2 Gy照射后2 h与移植瘤照射(2 Gy×5 d)后1天,Western blot检测各处理组γH2AX(DNA双链断裂相关蛋白),促凋亡蛋白Bax、Caspase-3,抗凋亡蛋白Bcl-2表达。结果显示,Olaparib+RT组与RT组相比,γH2AX、Bax、Caspase-3蛋白在体外实验中分别上调60.5%、40.0%、42.0%,在移植瘤中分别上调71.4%、37.7%、31.3%;Bcl-2体外实验中下调45.2%,移植瘤中下调61.0%(图4)。
2.6 移植瘤生长曲线比较 各处理组小鼠用药及放疗过程中精神饮食状态正常,无明显全身性不良反应,各组移植瘤体积平缓长至250 mm3左右,开始相关实验。各组移植瘤增长过程中均有出现1个-2个移植瘤中央部破溃。10 Gy剂量照射结束后同时剥取未破溃瘤块行前述组织相关指标检测(图5A)。在Olaparib+RT组、Olaparib组、RT组、空白组中移植瘤增长至4倍初体积(1,000 mm3)所需时间(d)依次为:(29.6±3.8)、(11.6±2.6)、(21.2±2.3)、(10.8±1.1)(图5B)。可见,Olaparib+RT组移植瘤长至4倍初体积所需天数显著高于其余三组(均P<0.05)。
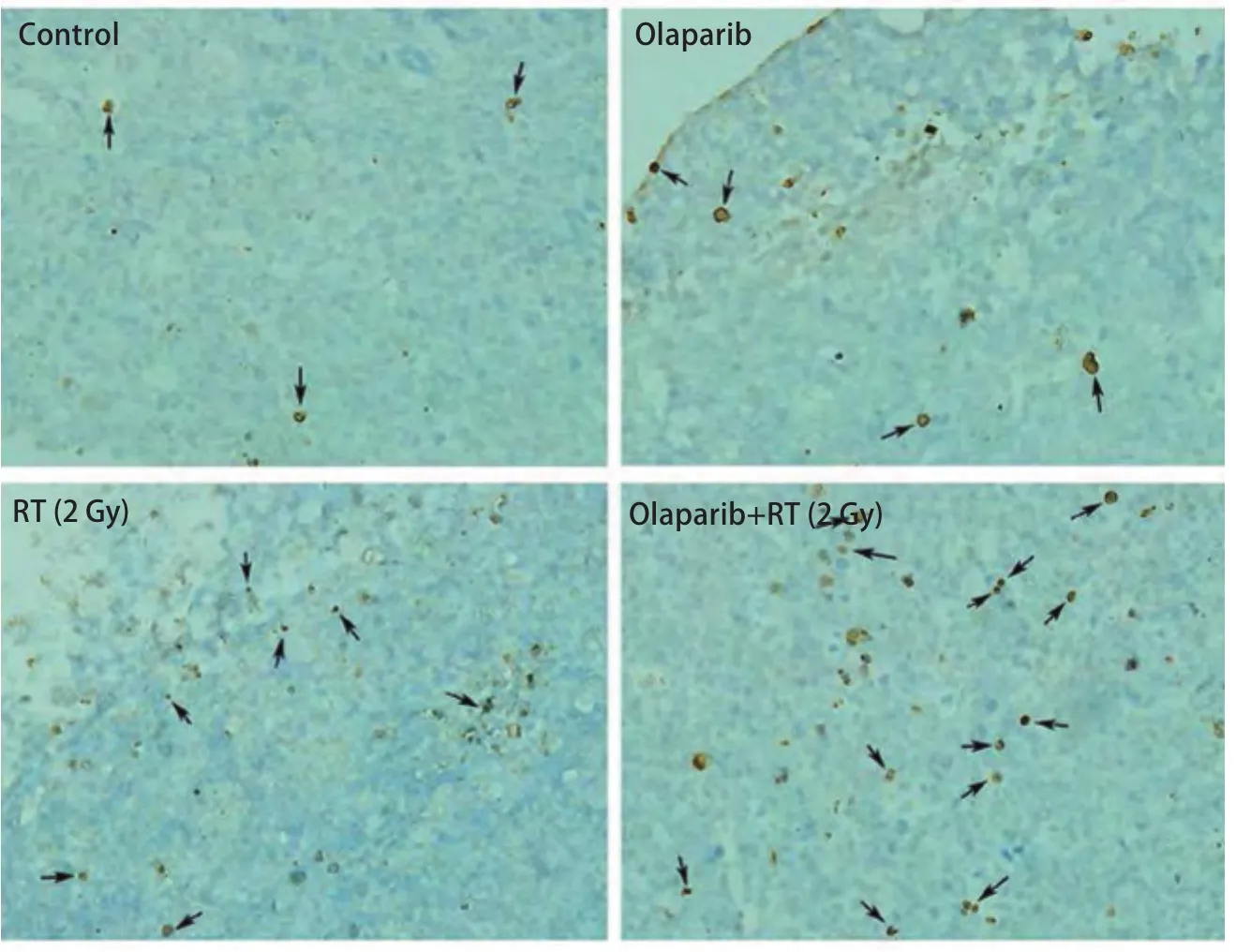
图3 Lewis细胞体内凋亡率差异。TUNEL染色检测各组细胞凋亡情况(×400)。Olaparib+RT组细胞体内凋亡率显著高于其余三组(均P<0.05)。Fig 3 Differential cell apoptotic rate in vivo.Cell apoptotic rate in xenograft tissues was observed by TUNEL stain (×400).The apoptotic cells in Olaparib+RT group were significantly higher than the other three groups in vivo (all P<0.05).
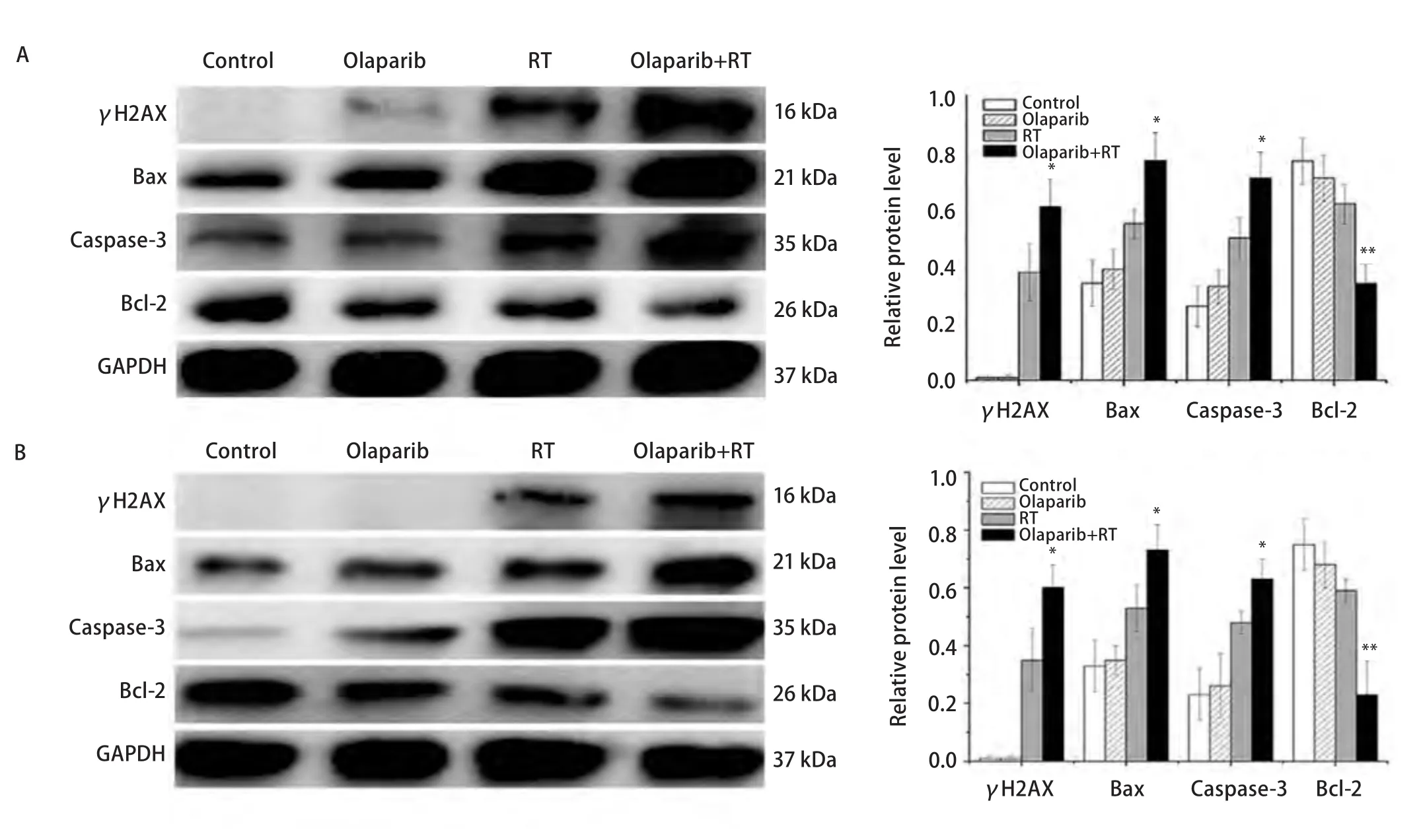
图4 Lewis细胞体内外DNA损伤及凋亡相关蛋白表达。A:Lewis细胞体外照射(2 Gy)后;B:Lewis移植瘤照射结束(2 Gy×5 d)后,Western blot检测γH2AX、Bax、Caspase-3、Bcl-2蛋白表达。*P<0.05,**P<0.01相较于RT组。Fig 4 DNA damage and apoptosis related protein expression of Lewis cells in vitro and in vivo.The ralative protein levels of γH2AX,Bax/Bcl-2,Caspase-3 were measured by Western blot.A:After Lewis cells were irradiated in vitro (2 Gy);B:After Lewis xenografts were irradiated (2 Gy×5 d ).*P<0.05,**P<0.01 vs RT group.
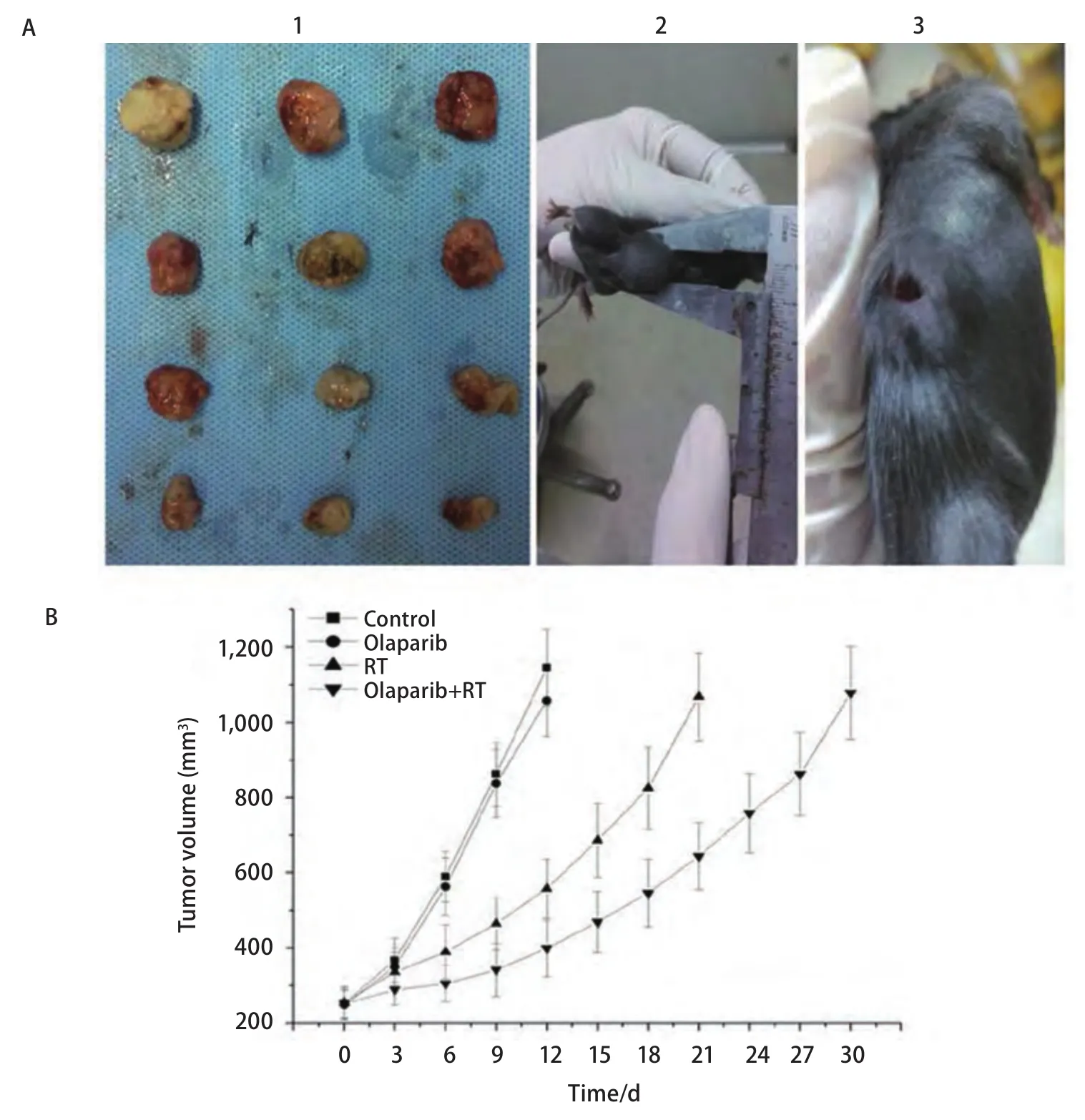
图5 荷瘤小鼠与移植瘤生长延缓曲线。A1:Lewis移植瘤照射(2 Gy×5 d)后剥取瘤块用于相关指标检测;A2:荷瘤小鼠(未破溃);A3:荷瘤小鼠(瘤块中心破溃);B:移植瘤增长至4倍初体积(1,000 mm3)生长延缓曲线。Fig 5 Tumor-bearing mice and Lewis xenografts growth delay curves.A1:Xenografts were isolated for detecting at the next day after irradiated (2 Gy×5 d);A2:Tumor-bearing mice without xenograft rupture;A3:Tumor-bearing mice with xenograft rupture;B:Delay curves of Lewis xenografts increasing to quadruple size from the start.
3 讨论
根据经典的“单击多靶”模型,电离辐射可致肿瘤细胞内产生大量的SSBs,同样的,作用于DNA化学结构的细胞毒类药物也可使肿瘤细胞产生较多SSBs。多数的SSBs能通过PARP等相关因子修复,当PARP活性被靶向抑制后,大量外源性的SSBs存在于细胞内,当进入下一个复制叉后,SSBs可转变为DSBs[11]。修复DSB,必须通过激活HR或NHEJ信号通路来完成,若该通路中的关键分子(如BRCA1/2、ATM等)发生功能突变,即可对细胞产生所谓的“合成致死”效应,这就是Olaparib及其他PARP抑制剂在临床研究中单药或联合化疗治疗伴有BRCA1/2突变的恶性肿瘤的基础。
凋亡是肿瘤细胞受电离辐射后产生的主要生物效应之一,在线粒体介导的凋亡途径中,细胞在生存信号缺失、DNA严重受损(如DSB)、生长因子缺乏等情况下,可通过Bcl家族的促凋亡成员(如Bax等)与抗凋亡成员(如Bcl-2等)调控线粒体膜通透性,释放凋亡活性物质进入细胞质,引起Caspase级联反应,诱导细胞凋亡[12]。与正常组织细胞相比,DNA损伤修复通路在肿瘤细胞中过度激活,并且在机体接受放化疗时,对其有着负性调控作用[13]。本实验旨在研究Olaparib联合放疗时,是否可通过增加Lewis细胞DNA损伤及凋亡而起到放疗增敏作用。
本实验首先在体外细胞水平研究Olaparib联合放疗时的增敏效应。运用MTT技术检测Olaparib对Lewis细胞的增殖抑制作用,可见随药物浓度增加,抑制率上升,即Olaparib单药对Lewis细胞存在细胞毒作用,故选择低毒剂量IC10值作为体外联合放疗时的药物浓度。通过放射生物学研究常用的克隆形成实验,比较了单纯放疗与Olaparib联合放疗在Lewis细胞层面的生物效应差异,得出Olaparib联合放疗组D0值较RT组增加了21.1%,SER为1.211,证实了Olaparib体外的放疗增敏效应。为进一步探究其可能机制,检测不同处理组与受照细胞DSBs相关的敏感指标,即与DSBs量存在对应关系的磷酸化组蛋白H2AX(γH2AX),其被认为是检测DNA双链断裂的“金标准”。通过蛋白印迹相对定量得出,γH2AX在空白及单药Olaparib组中未表达,而在RT与Olaparib+RT组中高表达,且联合组γH2AX表达量较RT组增加约60%。可见,体外Lewis细胞在低剂量Olaparib联合放疗时即可显著增加DSBs形成。
实验进一步通过流式细胞术检测不同处理组细胞的凋亡率得出,Olaparib联合放疗组较单放疗组细胞凋亡率显著提高。研究[14-16]表明,Bax与Bcl-2蛋白可形成异源二聚体抑制凋亡,Bax间可形成同源二聚体促进凋亡,即在Bax/Bcl-2途径中Bax促进凋亡而Bcl-2抑制凋亡,并进一步通过细胞色素C及Caspase-9等因子激活下游Caspase-3蛋白,最终诱导细胞凋亡。本研究对这些凋亡相关蛋白检测发现,Lewis细胞在接受2 Gy照射后,Olaparib联合放疗组促凋亡蛋白Bax及Caspase-3较单纯放疗显著增加,抗凋亡蛋白Bcl-2显著下降。Wesierska等[17]研究PARP-1抑制剂AZD2261发现,其可显著抑制乳腺癌MCF-7与Skbr-3细胞克隆形成,并通过Caspase-3蛋白的激活诱导细胞凋亡。在本实验中,Olaparib单药组对Lewis细胞凋亡影响较小(约3.89%),考虑与用药浓度较低相关(IC10值浓度)。Tuli等[18]研究PARP1/2抑制剂ABT-888联合放疗胰腺癌MiaPaCa-2细胞时发现,ABT-888单药(10 μmol/L)时对MiaPaCa-2细胞凋亡相关蛋白Caspase表达影响小,而当联合放疗时可显著提高促凋亡蛋白表达。这与本研究结果相一致。
在Lewis细胞移植瘤模型实验中,Olaparib单药给予5 d较空白对照组并未引起明显的肿瘤生长延缓,而当联合放疗(2 Gy×5 d)后,观察到移植瘤显著的生长延缓效应,与单纯放疗组相比,其增长至4倍初体积所需天数多出近10 d。同体外研究类似,实验检测了受照射后移植瘤组织中凋亡细胞、DNA损伤及凋亡相关蛋白的表达情况,获得了与体外研究一致的结果,即联合组较单纯放疗组移植瘤组织中凋亡细胞更多,DSBs相关γH2AX、促凋亡蛋白Bax与Caspase-3表达更高,抗凋亡蛋白Bcl-2表达下调,进一步验证了体内外Olaparib联合放疗时的增敏效应。
综上所述,本研究通过Lewis肺癌细胞及移植瘤模型证实了Olaparib的放疗增敏效应,其可通过增加受照Lewis细胞的DSBs形成,上调Bax/Bcl-2促凋亡体系蛋白表达而提高照射生物效应。为PARP抑制剂在联合放疗方面的应用提供了实验依据,为临床肺癌放疗提供一个新的优良的放疗增敏剂,值得进一步的体内及临床研究。
