藤茶中杨梅素高效转化工艺研究
2016-08-25许江峰钟世安
许江峰,李 慧,钟世安
(中南大学化学化工学院,湖南 长沙 410083)
藤茶中杨梅素高效转化工艺研究
许江峰,李慧,钟世安
(中南大学化学化工学院,湖南长沙410083)
本试验以藤茶中提取的二氢杨梅素为原料,利用焦亚硫酸钠脱氢氧化作用制得淡黄色成品,分离纯化后对其进行了红外光谱、核磁共振氢谱表征,确认产物为杨梅素。综合单因素试验结果,选取Na2S2O5与NaOH用量比例、反应液浓度、反应温度为影响因素,杨梅素收率为响应值,对反应参数进行效应面分析优化。结果显示,当Na2S2O5与NaOH用量比例为0.52,反应液浓度为36.68%,反应温度为100.8 ℃时,杨梅素收率最高可达65.49%,纯度高达96%,与预测收率65.65%的相对误差仅为0.24%。
杨梅素;响应面优化法;焦亚硫酸钠;半合成
杨梅素(3,5,7-三羟基-2-(3,4,5-三羟基苯基)-4H-1-苯并呋喃-4-酮)又称杨梅酮、杨梅黄酮,属黄酮醇类化合物。近年来研究发现,杨梅素在消炎镇痛、降低血糖血脂、抑制糖尿病并发症、治疗心血管疾病、抗疟以及抗肿瘤等多方面具有很好的药理活性[1-6]。Ki等证实杨梅素对丝裂原活化蛋白激酶具有强烈的抗癌活性[7]。此外,杨梅素在调节诱导细胞凋亡方面的应用[8]也得到医学者的广泛关注。杨梅素作为一种具有显著药用价值的天然活性物质,分布于葡萄科、菊科等植物中,目前杨梅素的提取分离研究主要来源于藤茶[9],而藤茶中杨梅素的含量只占2%[10]左右,赵全成在碱性环境下提取杨梅素的产率只有5%[11],覃洁萍在提取过程中加入碱性转化剂转化二氢杨梅素得到杨梅素,收率最高也只有8%[12],这极大程度上阻碍了杨梅素提取工艺的工业化生产。因此,全面而系统的研究藤茶中二氢杨梅素的提取纯化进而实现杨梅素半合成的工艺优化方法具有很高的研究意义。
1 实 验
1.1试剂及仪器
实验所用试剂有:藤茶(食用级),张家界家中林特产;乙醇(AR),天津市大茂化学试剂厂;焦亚硫酸钠(AR),阿拉丁试剂;二氢杨梅素(AR),阿拉丁试剂;杨梅素(AR), 阿拉丁试剂;氢氧化钠(AR),安耐吉化学;盐酸(AR),安耐吉化学。
所用到的仪器设备有:RCT-Basic磁力加热搅拌器,德国IKA实验设备有限公司;FDF-101S集热式恒温加热磁力搅拌器,郑州长盛实验设备有限公司;UV-2450紫外分光光度计,日本岛津有限公司;FA1204B电子天平,上海精科天美化学仪器有限公司;DZF-6021真空干燥箱,上海一恒科学仪器有限公司;SHA-C常温水浴振荡器,常州澳华仪器有限公司;KQ-50E超声波清洗器,昆山市超声仪器有限公司;800-1台式电动离心机,北京中兴伟业仪器有限公司。
1.2分析方法的建立
标准溶液的配置:分别准确称取杨梅素与二氢杨梅素标准品12.5 mg、25.0 mg,用甲醇溶解,定容至25 mL,得到浓度分别为0.5 mg/mL和1.0 mg/mL的标准溶液。
1.2.1最大吸收波长的确定
量取适量上述浓度的杨梅素与二氢杨梅素标准液,以甲醇溶剂为参比,于紫外分光光度计上进行全波长扫描,分别测定两种溶液的最大吸收波长。
1.2.2标准曲线的绘制
色谱条件:Kromasil C18柱(250 mm×4.6 mm,5 μm),流动相:甲醇:水:冰醋酸=50:50:1(V/V/V);检测波长:292 nm(二氢杨梅素),375 nm(杨梅素);检测柱温:30 ℃;进样量:20 μL;流速:1.0 mL/min。
分别吸取1.0 mg/mL 二氢杨梅素标准液0.05, 0.1, 0.3, 0.5, 1.0, 3.0, 5.0 mL和0.5 mg/mL 杨梅素标准液0.1, 0.2, 0.6, 1.0, 2.0, 6.0, 10 mL依次置于10 mL容量瓶中,甲醇定容,得到系列浓度的对照品混合液,0.45 μm滤膜过滤,待用。在上述色谱条件下,分别进样20 μL,测定峰面积,测3次取平均值。以样品溶液浓度(C)为横坐标,色谱峰面积(A)为纵坐标进行线性回归,得到二氢杨梅素和杨梅素的线性回归方程。
1.2.3杨梅素收率的计算
杨梅素收率按如下公式计算:

(1)
1.3藤茶中杨梅素的转化制备
1.3.1二氢杨梅素的提取
称取20 g干燥的藤茶粉样品,每次加蒸馏水300 mL于100 ℃油浴中浸提,分两次进行浸提,然后趁热过滤,合并两次滤液,将滤液浓缩,1~5 ℃下冷却析出浅黄色沉淀,过滤。将沉淀滤渣用一定量的无水乙醇溶解,静置过滤除去不溶物后,将所得的乙醇溶液浓缩得到乙醇浸膏,于50 ℃干燥,称重。
1.3.2杨梅素的转化工艺
以二氢杨梅素为原料半合成杨梅素的反应路线如图1所示。

图1 杨梅素半合成路线
称取干燥的藤茶粗提物 5 g于100 mL无水乙醇中进行重结晶,加热搅拌超声2.5 h后趁热过滤,将滤液减压浓缩得到乙醇浸膏,按一定的料液比加入NaOH与Na2S2O4的混合溶液于一定温度下进行搅拌回流反应。反应结束后,调节pH至弱酸性,用冰块进行快速冷却,放置过夜,减压过滤得到沉淀,50 ℃充分干燥,称重,测定产品中杨梅素的含量,并计算杨梅素得率。
2 结果与讨论
2.1最大吸收波长的确定
以甲醇为参比,在190~500 nm波长范围内扫描,结果如图2所示,二氢杨梅素与杨梅素的最大吸收波长分别为292 nm和375 nm。

图2 二氢杨梅素和杨梅素的紫外吸收光谱图
2.2标准曲线的绘制
分别在二氢杨梅素与杨梅素最大吸收波长下进行HPLC检测,以样品溶液浓度(C)为横坐标,色谱峰面积(A)为纵坐标进行线性回归,结果如图3所示。计算可得二氢杨梅素和杨梅素的线性回归方程分别为Y1=689525+1.95266X1(R2=0.9989,n=7),线性范围为0.005~0.5 mg/mL;Y2=-249278+5.23018X2(R2=0.99911,n=7),线性范围为0.005~0.5 mg/mL。
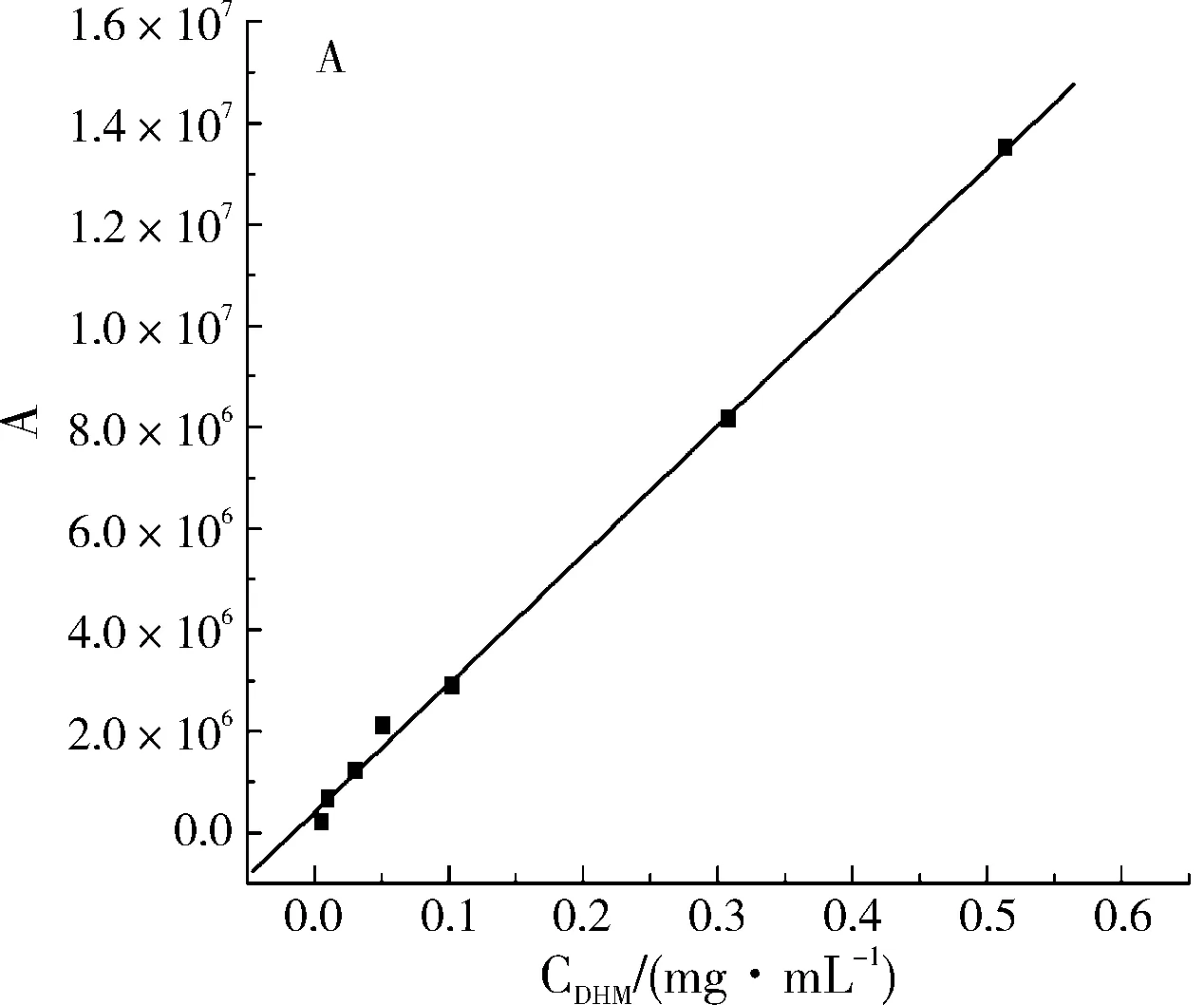
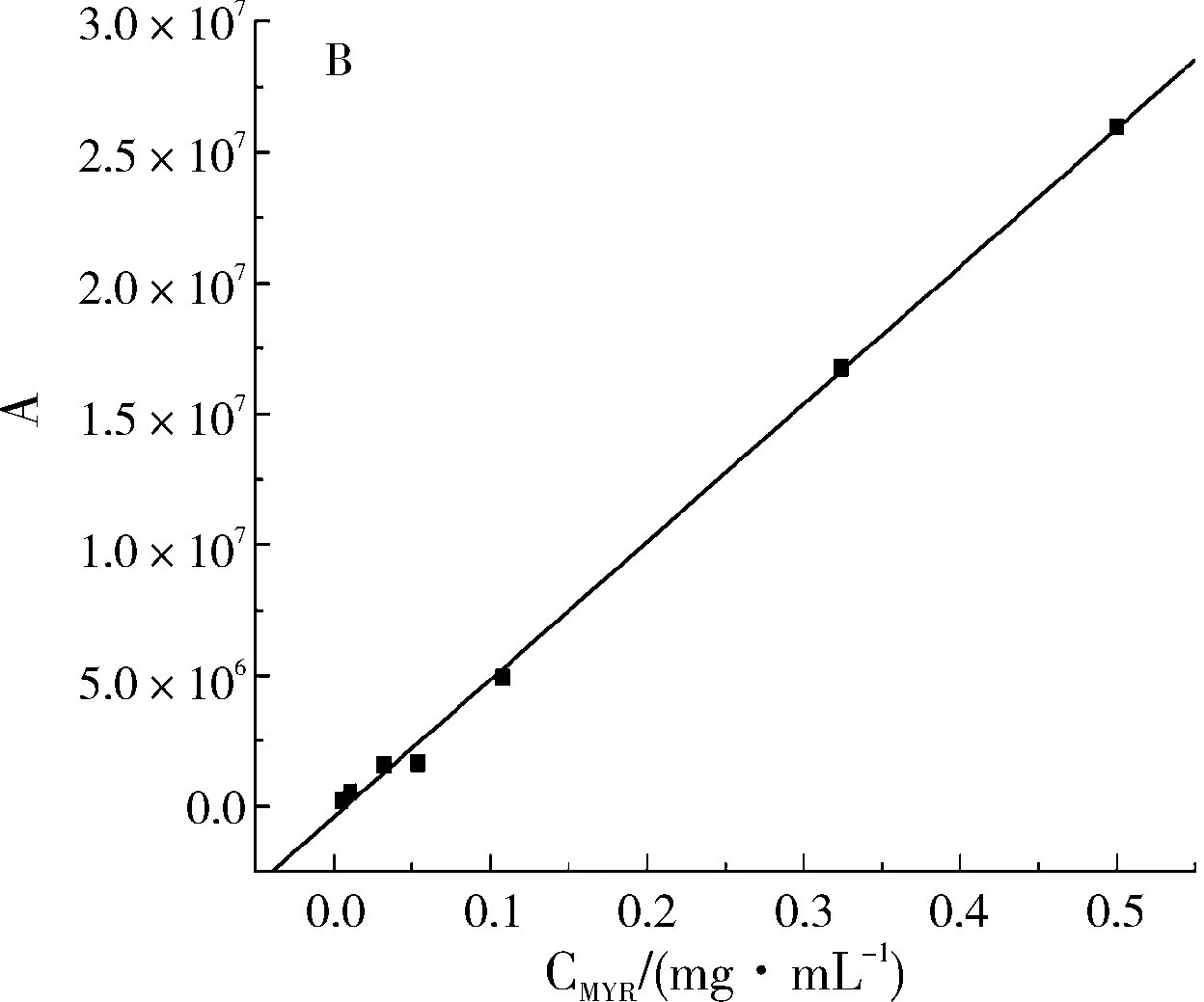
图3 二氢杨梅素(A)和杨梅素(B)的标准曲线
2.3藤茶粗提物的定性定量分析
图4为藤茶粗提取物与标准品的HPLC谱图。
由HPLC谱图可知,图4B中保留时间在3.9 min附近的峰可归为二氢杨梅素,根据杨梅素与二氢杨梅素的极性大小判断,保留时间较长的8.5 min附近的小峰应归属为杨梅素的吸收峰。通过对提取物进行定量分析,粗提取物中二氢杨梅素含量为67.65%。


图4 标准品(A)与提取物(B)的HPLC谱图
2.4产物的结构鉴定
将反应制得的粗产物通过硅胶层析柱分离纯化得到黄色产物,然后对其进行红外光谱分析和核磁共振氢谱分析。
2.4.1FT-IR分析
对产物进行红外光谱分析,结果如图5所示。

图5 产物的FT-IR图
通过对产物的红外光谱图进行结构解析,可知波数3285 cm-1附近的吸收峰应为缔合羟基的吸收峰,1665 cm-1处的吸收峰对应于C=O的共轭吸收峰。1597、1464、1518 cm-1处为苯环结构,1327、1026 cm-1处的吸收峰应归属于C-O-C的反对称伸缩振动和对称伸缩振动。结果显示,该物质具有黄酮类物质的特异性官能团,且产物的红外光谱图与杨梅素标准品的红外光谱图峰型一致。
2.4.21H NMR氢谱分析
以氘代二甲基亚砜为溶剂对产物进行核磁共振氢谱表征,结果如图6所示。
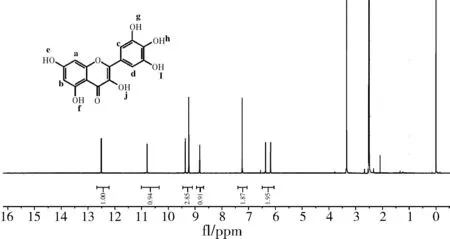
图6 产物的1H NMR谱图
对产物的1H NMR图进行结构解析,结果如下(δ):6.37(a),6.18(b),7.24(c、d),9.37(e),12.51(f),9.24(g、i),8.83(h),10.80(j)。该图谱数据与文献报道的数据[13]一致,可知脱氢产物的结构与杨梅素结构相符。结合FT-IR分析结果可以推断合成的化合物即为杨梅素。
2.5合成条件对杨梅素产率的影响
为了寻找杨梅素的最佳合成工艺,选取n(Na2S2O5)/n(NaOH)、反应液浓度、反应温度、反应时间等4个可能影响杨梅素收率的合成条件进行单因素考察试验。
2.5.1Na2S2O5与NaOH的用量比例
在半合成反应中,控制反应液浓度为35%,100 ℃下反应6 h,探索不同的n(Na2S2O5)/n(NaOH)比例对杨梅素收率的影响,结果如表1所示。

表1 不同的Na2S2O5与NaOH用量比例下杨梅素收率情况Table 1 Myricetin yield of different ratio of Na2S2O5 and NaOH
结果表明,随着Na2S2O5用量的增大,杨梅素收率逐渐增大,其中比例由0.20升高到0.60时杨梅素收率显著提高。
2.5.2反应液浓度
控制n(Na2S2O5)/n(NaOH)比例为0.60,100 ℃下反应6 h通过改变反应液浓度来探究其对杨梅素收率的影响,结果如表2所示。

表2 不同反应液浓度下杨梅素收率情况Table 2 Myricetin yield of different reaction solution concentration
结果显示,随着反应液浓度的增大,杨梅素收率逐渐增大,其中反应液浓度由10%升高到35%的过程中杨梅素收率显著提高。
2.5.3反应温度的考察
控制n(Na2S2O5)/n(NaOH)比例为0.60,反应液浓度为35%,反应6 h,通过改变反应温度探讨其对杨梅素合成收率的影响,结果如表3所示。

表3 不同反应温度下杨梅素收率情况Table 3 Myricetin yield of different reaction temperature
结果显示,反应温度由80 ℃上升到100 ℃的过程中杨梅素收率显著增加,而100 ℃到120 ℃杨梅素收率显著降低,说明当反应温度在120 ℃附近时不利于该半合成反应的进行,有可能有副反应发生。
2.5.4反应时间的考察
控制n(Na2S2O5)/n(NaOH)比例为0.60,反应液浓度为35%,反应温度100 ℃时,通过改变反应时间探究其对杨梅素合成收率的影响,结果如表4所示。

表4 不同反应时间杨梅素收率情况Table 4 Myricetin yield of different reaction time
结果显示,当反应时间由4 h增加到6 h时杨梅素收率显著提高而反应时间增加到8 h的过程中收率变化不大,可见反应在6 h左右已经基本完全。
2.6响应面法优化半合成工艺
根据单因素实验情况综合分析,选取n(Na2S2O5)/n(NaOH)、反应液浓度、反应温度为影响因素,杨梅素收率为响应值,反应时间为6 h,采用响应面优化法对以上三个因素进行工艺优化设计。
2.6.1响应面实验设计与结果处理
根据Design-Expert 8.0数据统计分析软件设计实验方案,通过实验得到各组对应杨梅素收率如表5所示。
进一步对表数据进行回归分析,得到回归方程为:
Y=58.58+21.23A+5.62B+3.38C+3.40AB+3.51AC+2.52BC-21.76A2-6.79B2-6.16C2
(2)
式中,A为n(Na2S2O5)/n(NaOH);B为反应液浓度;C为反应温度;Y为杨梅素收率。

表5 响应面实验法设计方案及结果Table 5 Experimental design and results of RSM
根据所得方程对数据进行回归以及方差分析,结果如表6所示。

表6 回归模型的方差分析Table 6 Results of regression analysis
从表6中可知回归模型P<0.0001,具有很好的显著水平,而失拟项P>0.05不显著,说明所建立的回归模型比较准确,拟合度较好,并且相关系数R2=0.9999说明实验方案比较可靠,可以用于实验数据分析与参数优化。
对实验考察因素A、B、C和其两两交互项AB、AC、BC以及各因素二次方项A2、B2、C2进行分析,发现其P值均小于0.05,说明以上三种因素对杨梅素收率均存在显著性影响,而且影响并不是呈现单一的线性关系,而是具有复杂而显著的曲面效应。
2.6.2响应面图与等高线图分析
运用Design-Expert8.0软件对模型数据制作响应曲面图分析考察因素对杨梅素收率的影响情况,得到三因素两两交互项的三维响应曲面图,如图7所示。
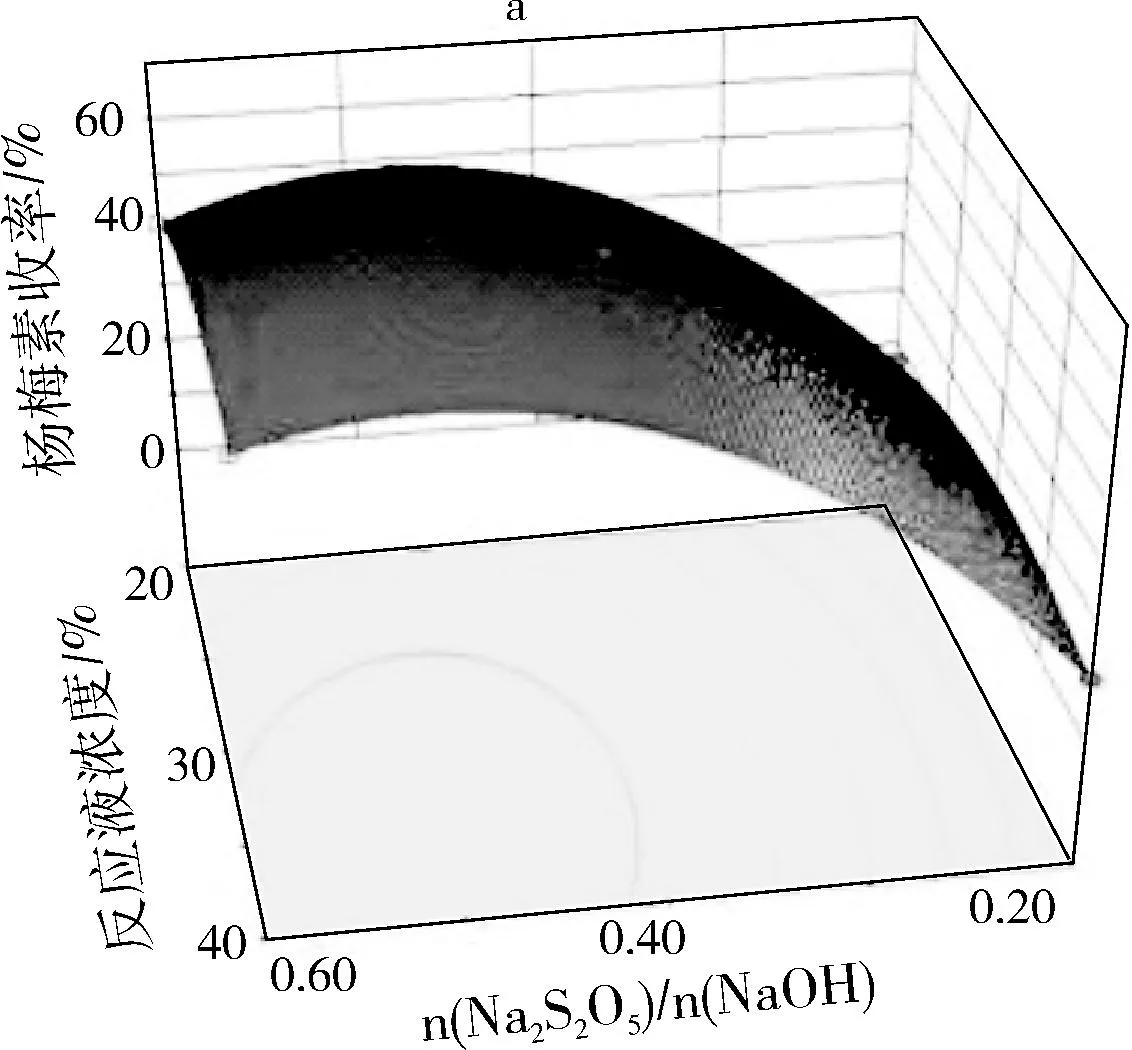


图7 响应曲面图
根据三因素两两交互的曲面图可以看出,响应曲面图的最高点即对应为杨梅素收率的极大值。根据Design-Expert 8.0分析得,当n(Na2S2O5)/n(NaOH)比例为0.52,反应液浓度为36.68%,反应温度为100.79 ℃时,杨梅素收率最大,为65.65%。
2.6.3实验验证分析结果
为了检验响应面优化的结果,取n(Na2S2O5)/n(NaOH)比例为0.52,反应液浓度为36.68%,反应温度为100.8 ℃进行五组平行试验,反应时间均为6 h测定杨梅素平均收率为65.49%,与预测结果65.65%相对误差仅为0.24%,说明预测结果比较准确,该响应面分析优化方案比较可靠。
3 结 论
以藤茶中提取的二氢杨梅素为原料,通过在碱性环境下焦亚硫酸钠脱氢反应半合成制得杨梅素,根据单因素试验结果,选取n(Na2S2O5)/n(NaOH)用量比例、反应液浓度、反应温度为影响因素,杨梅素收率为响应值,进行效应面分析优化。结果显示当n(Na2S2O5)/n(NaOH)比例为0.52,反应液浓度为36.68%,反应温度为100.79 ℃时,杨梅素收率最大,可达65.49%纯度高达96%,与预测值65.65%的相对误差仅为0.24%。
本试验以天然物质藤茶为原料,提取得到的二氢杨梅素经纯化后利用焦亚硫酸钠脱氢氧化作用半合成制备杨梅素,大大提高了杨梅素的收率,不仅为藤茶深加工提供了新的发展方向,还为半合成杨梅素提供了新的参考方法。
[1]Hiermann A, Schramm H W, Laufer S.Anti-inflammatory activity of myricetin-3-O-beta-D-glucuronide and related compounds[J]. Journal of Pharmaceutical Sciences, 1979, 68(5): 421-427.
[2]Kandasamy N, Ashokkumar N. Protective effect of bioflavonoid myricetin enhances carbohydrate metabolic enzymes and insulin signaling molecules in streptozotocin-cadmium induced diabetic nephrotoxic rats[J]. Toxicology & Applied Pharmacology, 2014, 279(2): 173-185.
[3]Kim Y S, Kim J H, Jung D H, et al. Myricetin inhibits advanced glycation end product (AGE)-induced migration of retinal pericytes through phosphorylation of ERK1/2, FAK-1, and paxillin in vitro and in vivo[J]. Biochemical Pharmacology, 2015, 93(4): 496-505.
[4]Scarabelli T M, Sofia M, Safwat A A, et al. Targeting STAT1 by myricetin and delphinidin provides efficient protection of the heart from ischemia/reperfusion-induced injury [J]. Febs Letters, 2009, 583(3): 531-541.
[5]Jin H, Xu Z, Cui K, et al. Dietary flavonoids fisetin and myricetin: Dual inhibitors of Plasmodium falciparum falcipain-2 and plasmepsin II[J]. Fitoterapia, 2014, 94(2): 55-61.
[6]HUANG Haizhi, Chen A Y, YE Xingqian, et al. Myricetin inhibits proliferation of cisplatin-resistant cancer cells through a p53-dependent apoptotic pathway[J]. International Journal of Oncology, 2015, 47(4): 1494-1502.
[7]Lee K W, Kang N J, Rogozin E A, et al. Myricetin is a novel natural inhibitor of neoplastic cell transformation and MEK1[J]. Carcinogenesis, 2007, 28(9): 1918-1927.
[8]ZHANG Xiaohong, CHEN Shiyong, TANG Lin, et al. Myricetin Induces Apoptosis in HepG2 Cells Through Akt/p70S6K/Bad Signaling and Mitochondrial Apoptotic Pathway[J]. Anti-Cancer Agents in Medicinal Chemistry, 2013, 13(10): 1575-1581.
[9]Ong K C, Khoo H E. Biological effects of myricetin [J]. General Pharmacology, 1997, 29(2): 121-126.
[10]ZHANG Yousheng, YANG Weili, GONG Yushun. Determination of dihydromyricetin in Ampelopsis grossedentata by RP-HPLC[J]. Chinese Traditional & Herbal Drugs, 2001, 32(11): 983-984.
[11]赵全成.杨梅素的制备新方法[P].中国:200810050893.5,2008-11-05.
[12]覃洁萍.一种杨梅素的制备方法[P].中国:200610019693.4,2007-01-03.
[13]Saldanha L L, Vilegas W, Dokkedal A L. Characterization of flavonoids and phenolic acids in Myrcia bella Cambess.Using FIA-ESI-IT-MSn and HPLC-PAD-ESI-IT-MS combined with NMR[J]. Molecules, 2013, 18(7): 8402-8416.
Highly Efficient Conversion Process Study of Myricetin in the Ampelopsis
XU Jiang-feng, LI Hui, ZHONG Shi-an
(School of Chemistry and Chemical Engineering, Central South University, Hunan Changsha 410083, China)
Myricetin was obtained through dehydrogenation of dihydromyricetin by the sodium metabisulfite. And the dihydromyricetin was extracted from the ampelopsis. The ehydrogenation products were characterized by FT-IR and1H NMR, which proved to be myricetin. Considering the results of the single factor experiment, the response surface process was conducted by selecting the proportion of Na2S2O5and NaOH, concentration of the solution, and reaction temperature as the impact factors and the yield of myricetin as the response value. The results showed that the yield of myricetin reached up to 65.49% and the purity of obtained myricetin exceeded 96% when the dosage ratio of Na2S2O5and NaOH was 0.52, the concentration of the solution was 36.68% and the temperature was 100.8 ℃. Compared with the predicted yield of 65.65%, the relative error was only 0.24%.
myricetin; response surface methodology; sodium metabisulfite; semisynthesis
许江峰(1991-),女,硕士研究生在读,制药工程专业。
钟世安(1972-),男,教授,从事天然药物化学研究。
TQ35
A
1001-9677(2016)014-0080-05
