氨法脱碳过程中氨逃逸规律及其抑制
2016-08-22马双忱陈公达温佳琪焦坤灵
马双忱,陈公达,温佳琪,马 岚,焦坤灵
(华北电力大学环境学院,河北 保定 071003)
氨法脱碳过程中氨逃逸规律及其抑制
马双忱,陈公达,温佳琪,马岚,焦坤灵
(华北电力大学环境学院,河北 保定 071003)
近年来随着环境保护的不断深入,控制温室气体排放逐渐成为研究重点,而火力发电作为CO2最大的集中排放源,对其实施碳捕集是必要的。氨法脱碳优点众多,但氨逃逸问题始终没有得到很好解决。通过实验研究明晰了CO2浓度、氨水吸收剂浓度、吸收反应温度对氨逃逸的影响规律,基于金属离子的络合效果探讨了几种金属离子对氨逃逸的抑制效果,发现Ni2+对氨逃逸有较好的抑制效果,并通过紫外分光光谱推测了其抑氨机理。本研究成果可对氨逃逸问题的解决提供一定的参考。
碳捕集;氨水;氨逃逸;吸收;化学过程
DOI:10.11949/j.issn.0438-1157.20151437
本工作选用氨水作为主体溶液,开展鼓泡塔中氨水吸收CO2过程中的氨逃逸实验研究,研究吸收反应温度、吸收剂氨水浓度、CO2体积分数等因素对氨水吸收CO2过程中氨逃逸的影响,以期为处理氨法碳捕集过程中的氨逃逸问题提供基础数据参考。
1 机 理
1.1CO2的脱除机理
CO2的吸收过程总反应为[9]
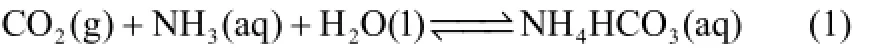
整个吸收过程详细的反应分为以下反应[式(2)~式(6)],这些化学平衡对碳捕集均有显著影响[8-9]。
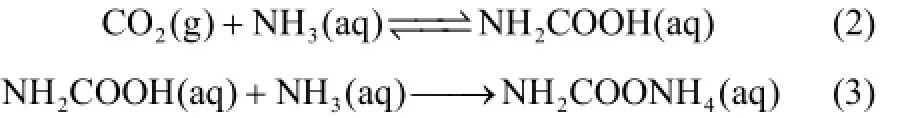

1.2氨水吸收CO2过程中氨逃逸的机理
氨水的挥发过程本质是传质过程,是氨分子从液相转移到气相的传递过程。氨水在气液相的浓度差使得氨分子从浓度较高的液相向浓度较低的气相转移,从而产生物质交换。浓度差是物质交换的推动力。如图1所示。

图1 氨逃逸传质示意图Fig.1 Mass transfer of ammonia escape
整个过程可归类为相际间传质过程。参照Lewis-Whitman双膜理论分析,氨的挥发传质又可细化分为以下3个步骤。首先是氨分子在液相中的单相扩散过程,此过程中溶质氨通过分子自由扩散或流动更新逐渐由液相主体扩散至液膜-气膜分界面,其中氨浓度越靠近相界面处越低。其次是氨分子通过气膜和液膜的过程,溶质氨以分子扩散的方式依次通过液膜、气膜,当处于CO2吸收时液膜内将发生相关化学反应。在气液界面处存在一层很薄的气膜,依据亨利定律,在一定条件下气膜内的氨分压与液膜中氨的浓度成一定的平衡关系。最后是氨分子在气相空间中的单相扩散过程,气相主体气流中的氨分压很低,气膜中的氨扩散至气相主体中[27-28]。所涉及到的平衡方程见式(7)
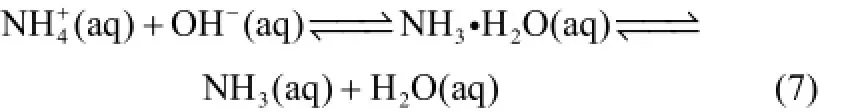
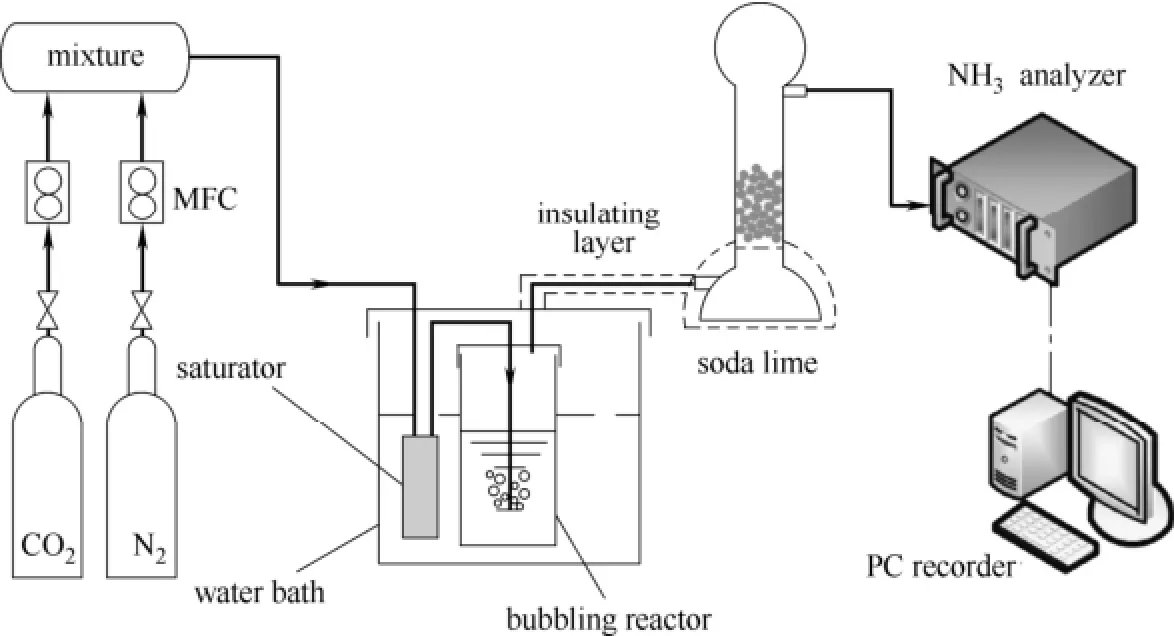
图2 实验装置Fig.2 Schematic view of experimental apparatus
2 实验方法
2.1试剂
本实验所选实验药品为:氨水(AR)、氯化镍(AR)、氯化铜(AR)、氯化钴(AR)、氯化锂(AR)、氯化锰(AR)、氯化镁(AR)、氯化钙(AR)、氯化锌(AR)、氯化铁(AR)、氯化亚铁(AR)、氯化钡(AR),均购自天津(香港)新通精细化工有限公司;钠石灰干燥剂,购自上海市五四化学试剂有限公司;CO2(99.995%)和N2(99.996%),购自保定北方特种气体有限公司。
2.2实验装置
图2为本研究中的实验装置,通过质量流量控制器将N2、CO2按照一定流量配制模拟烟气,经由气体缓冲瓶混合均匀,总流量1 L·min-1。而后经过饱和器再进入250ml具砂板鼓泡反应器(CS-B300250C),与150ml氨水吸收溶液接触,氨水浓度范围为1%~8%(质量分数)。鼓泡反应器内温度由恒温磁力搅拌器(DF-101S)进行控制,温度范围283~313 K。实验采用红外烟气分析仪(SR-2000A)测定NH3浓度,量程0~40%。本次实验采用条件实验法对温度、氨水浓度、CO2浓度几个因素进行讨论。
3 结果与讨论
3.1氨水浓度对氨逃逸的影响
实验中NH3气体分析仪为在线监测记录,可记录鼓泡反应中氨逃逸浓度随时间的变化。图3为气体成分为15%(体积分数)CO2时氨逃逸随氨水浓度关系曲线,实验温度为293 K。
从趋势上看,氨逃逸随氨水浓度的上升而显著上升,氨水中溶质的浓度是决定氨逃逸浓度的关键因素,并且氨逃逸曲线随反应时间逐渐降低,气体成分为15%(体积分数)CO2时溶质的损失包括挥发和与CO2发生化学反应两部分,溶质损失较大,导致氨水浓度明显降低,随时间累积后表现为氨逃逸挥发浓度明显降低。

图3 氨水浓度对氨逃逸的影响Fig.3 Effect of ammonia concentration on ammonia escape
3.2温度对氨逃逸的影响
图4为在气体成分为15%(体积分数)CO2混合气体条件下,不同温度时4%(质量分数)氨水的氨逃逸曲线。温度对氨逃逸的影响主要集中在两个方面:一是温度影响游离氨在水中的电离程度,温度越高,平衡常数越小,游离氨的数量越少,水合氨解离程度越低;二是温度影响气液平衡关系,温度越高,亨利常数越大,相同液相氨浓度所对应的平衡分压越高,传质推动力及传质速率越大。电离平衡常数与温度近似呈线性关系,而亨利常数与温度呈近指数关系。显然系统气液平衡系数受温度影响更敏感,变化更剧烈[29]。这与上述温度升高使得亨利常数剧增,进而导致氨逃逸显著增大的实验结果相吻合。说明氨法碳捕集过程中降低温度可以使氨的逃逸量减少。冷冻氨法正是基于这一事实开发,说明氨法脱碳过程降低温度可以有效控制氨的逃逸量[19]。

图4 温度对氨逃逸的影响(15% CO2)Fig.4 Effect of CO2concentration on ammonia emission (15% CO2)
3.3不同CO2浓度对氨逃逸的影响
在293 K和4%氨水浓度条件下不同入口CO2浓度的氨逃逸曲线如图5所示。从CO2浓度变化情况分析,氨逃逸量随CO2浓度的增加而逐渐降低。即模拟烟气中CO2组分含量越低,氨的逃逸越剧烈。气相中CO2含量较高时,会更多地消耗液相中的氨组分,使得液相中游离氨的浓度减少,传质推动力减弱,进而氨的逃逸量减少。相比温度和氨水浓度对氨逃逸的影响,CO2吸收带来的影响很小。

图5 CO2浓度对氨逃逸的影响(293 K)Fig.5 Effect of CO2concentration on ammonia escape (293 K)
3.4添加金属离子对氨逃逸的影响
以上分别讨论了其他条件不变的情况下氨水浓度、温度、CO2浓度对氨逃逸的影响。作者在经过相关文献的参阅以及大量对比实验后决定在该实验的基础上进行优化改进的尝试。考虑到典型工程采用的材料为不锈钢、铜件或镍钢,其中的铁、铜、镍等金属离子能与NH3反应,而燃煤中亦存在若干能与NH3发生配位反应的重金属,依照典型碳捕集工艺流程,溶液将被不断循环吸收和解吸,放出的只有CO2,理论上金属离子将一直存在于氨水溶液中,不会损失[11-12]。因此选取了一系列金属离子氯化物作为氨水溶液添加剂,考察5 min内氨逃逸总量的变化。
氨逃逸总量按式(8)计算
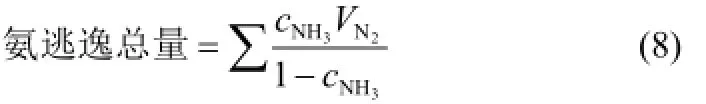
式中,3NHc为仪器每0.5 min测量的氨逃逸体积浓度值,%;2NV为每0.5 min的N2通过量,L(可通过质量流量控制器得出)。
为了使金属离子对氨逃逸的研究效果明显,在4%氨水中加入0.02 mol·L-1的不同金属离子,考察5 min内氨逃逸总量变化,变化曲线如图6所示。由于曲线过于密集,为了便于进一步研究差异,将数据经式(8)处理,结果见图7。
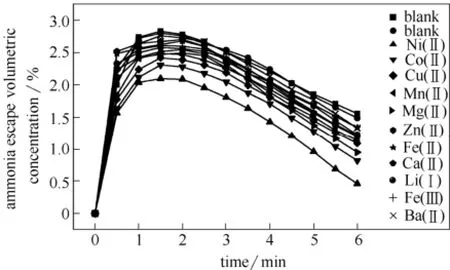
图6 不同金属离子条件下氨逃逸浓度变化(298 K,15% CO2)Fig.6 Ammonia escape curves with metallic ion species (298 K, 15% CO2)
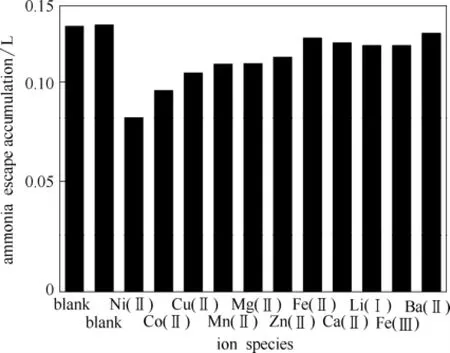
图7 不同金属离子对氨逃逸的影响(298 K,15% CO2)Fig.7 Effect of metallic ion species on ammonia escape (298 K, 15% CO2)
由图6、图7可明显看出,金属离子的添加确实在一定程度上降低了氨水中的氨逃逸率,但不同金属的效果不同。根据数据处理后的图7,在4%氨水中Ni2+、Co2+、Cu2+的抑制效果最为明显,而添加Ba2+、Ca2+、Fe3+、Fe2+、Zn2+等离子后的效果并不显著。Ni2+、Co2+、Cu2+等金属离子的添加能使氨水溶液发生化学改性,与氨发生络合反应,而不同的金属离子与NH3 络合形成的配离子配位能力不同,造成了对抑制氨逃逸量多少差异的现象,实验结果证明Ni2+具有较好的氨逃逸抑制效果。因此在4%氨水中对不同浓度Ni2+进行进一步实验,结果如图8所示。
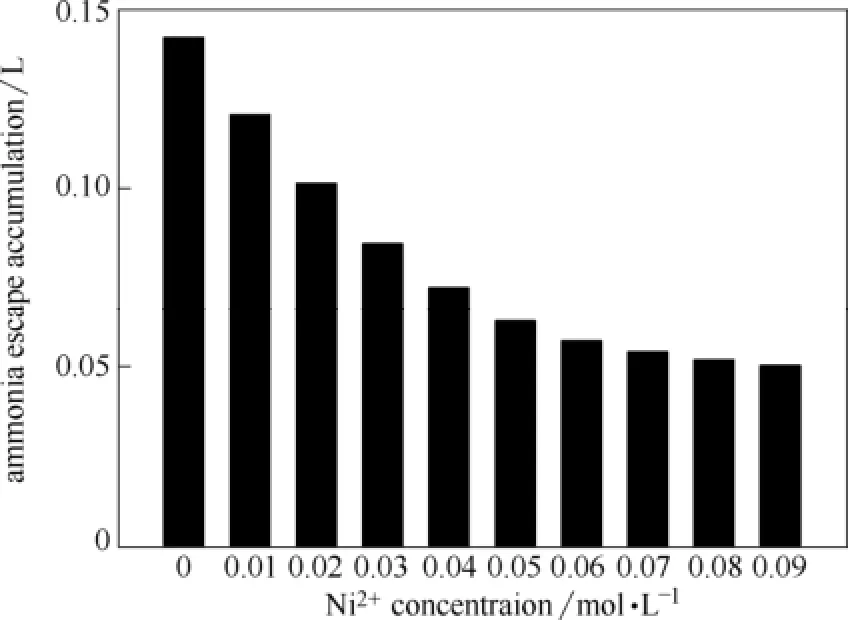
图8 不同Ni2+浓度对氨逃逸的影响(298 K,15% CO2)Fig.8 Effect of Ni2+concentration on ammonia escape (298 K, 15% CO2)
由图8可以看出,在4%氨水中加入Ni2+也对氨逃逸有抑制效果,但是继续增加添加剂浓度不会大幅增强抑制效果。分析原因,一方面为氨的浓度相对恒定,低浓度Ni2+时氨为过量,反应平衡由Ni(Ⅱ)控制,高浓度Ni(Ⅱ)时平衡趋于饱和,从而使得增速放缓,并且在0.09 mol·L-1出现浅蓝色氢氧化物沉淀,这也是抑制效果无法继续提升的原因之一。
3.5机理分析


使用紫外吸收光谱对氨水、NiCl2溶液及混合溶液进行光谱扫描,结果如图9所示。显然混合后溶液的光谱图像与混合前不同,相比NiCl2溶液的光谱扫描结果,混合后的曲线左移明显,这证明氨水与NiCl2溶液混合后产生了新生色团物种,配位效应使得d-d轨道发生配位场跃迁,生成[Ni(NH3)x]2+。金属离子的添加一定程度上有利于氨逃逸的控制,减少了扩散到大气中的游离氨,但这些抑制剂的加入也存在着一些弊端。在本次具体的实验研究中发现,在氨水中加入Fe2+、Mn2+、Fe3+等金属离子会产生絮状物,造成吸收反应接触面不同程度的堵塞,可能因此导致反应效率低下。同时若金属离子外漏可能造成二次污染,从而给环境带来更大的影响,除此以外一些金属如Co2+、Ni2+等的价格较为昂贵,这些可能的问题在实际应用中亦需要多加重视。
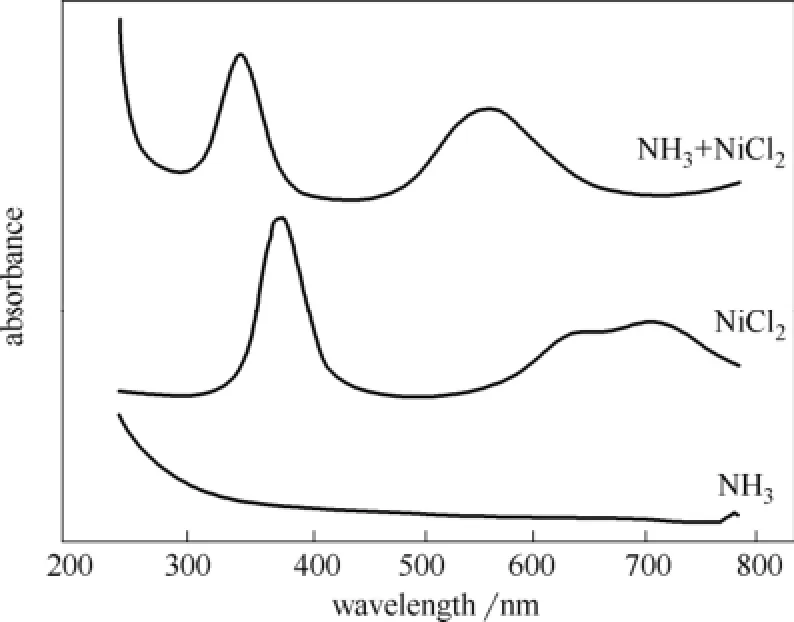
图9 紫外分光光谱扫描结果Fig.9 Results of UV-visible spectrophotometer
4 结 论
实验研究了鼓泡反应器中氨法碳捕集吸收过程中氨逃逸问题,发现氨逃逸受氨水浓度和温度影响很大,随其上升而迅速上升,而受CO2分压影响有所降低,因此在保证脱碳效率的前提下应降低温度和氨水浓度。本研究尝试加入不同金属离子,对比了不同离子对氨逃逸的抑制效果,发现Ni2+效果最好,并通过紫外分光光谱验证了抑制机理,证明配位效应在抑制氨逃逸中起作用,根据实验结论以Ni2+为主的金属离子适合作为抑制氨逃逸的潜在添加剂。
References
[1]MACFARLANE J W, SCOTT T B. Reduction of carbon dioxide on jet spray formed titanium dioxide surfaces [J]. Journal of Hazardous Materials, 2012, 211/212 (2): 247-254.
[2]HAN K, CHI K A, MAN S L, et al. Current status and challenges of the ammonia-based CO2capture technologies toward commercialization[J]. International Journal of Greenhouse Gas Control, 2013, 14 (2):270-281.
[3]MONDAL M K, BALSORA H K, VARSHNEY P. Progress andtrends in CO2capture/separation technologies: a review [J]. Energy,2012, 46 (1): 431-441.
[4]MA S, WANG M, HAN T, et al. Kinetic experimental study on desorption of decarbonization solution using ammonia method [J]. Chemical Engineering Journal, 2013, 217 (1): 22-27.
[5]LEI L, NING Z, WEI W, et al. A review of research progress on CO2capture, storage, and utilization in Chinese Academy of Sciences [J]. Fuel, 2013, 108 (11): 112-130.
[6]DAVISON J. Performance and costs of power plants with capture and storage of CO2[J]. Energy, 2007, 32 (7): 1163-1176.
[7]MA S, CHEN G, GUO M, et al. Path analysis on CO2resource utilization based on carbon capture using ammonia method in coal-fired power plants [J]. Renewable & Sustainable Energy Reviews,2014, 37 (3): 687-697.
[8]AN C Y, BAI H. Comparison of ammonia and monoethanolamine solvents to reduce CO2greenhouse gas emissions [J]. Science of the Total Environment, 1999, 228: 121-133.
[9]BAI H, YEH A C. Removal of CO2greenhouse gas by ammonia scrubbing [J]. Industrial & Engineering Chemistry Research, 1997,36 (6): 2490-2493.
[10]QIN F, WANG S, HARTONO A, et al. Kinetics of CO2absorption in aqueous ammonia solution [J]. International Journal of Greenhouse Gas Control, 2010, 4 (5): 729-738.
[11]曾庆, 郭印诚, 牛振棋, 等. 填料塔中氨水吸收二氧化碳的传质性能 [J].化工学报, 2011, 62 (S1): 146-150. ZENG Q,GUO Y C, NIU Z Q, et al. Mass transfer performance of CO2absorption into aqueous ammonia in a packed column [J]. CIESC Journal, 2011, 62 (S1): 146-150.
[12]刘芳,王淑娟,陈昌和, 等. 电厂烟气氨法脱碳技术研究进展 [J].化工学报, 2009, 60 (2): 269-276. LIU F, WANG S J, CHEN C H, et al. Research progress of CO2capture by using ammonia from flue gas of power plant [J]. CIESC Journal, 2009, 60 (2): 269-276.
[13]CORTI A, LOMBARDI L. Reduction of carbon dioxide emissions from a SCGT/CC by ammonia solution absorption-preliminary results[J]. International Journal of Thermodynamics, 2004, 7 (4): 173-181.
[14]CIFERNO J P, DIPIETRO P, TARKA T. An economic scoping study for CO2capture using aqueous ammonia [R]. Pittsburgh, PA: National Energy Technology Laboratory, US Department of Energy, 2005.
[15]MA S, SONG H, WANG M, et al. Research on mechanism of ammonia escaping and control in the process of CO2capture using ammonia solution [J]. Chemical Engineering Research & Design,2013, 91 (7): 1327-1334.
[16]BUDZIANOWSKI W, KOZIOL A. Stripping of ammonia from aqueous solutions in the presence of carbon dioxide. Effect of negative enhancement of mass transfer [J]. Chemical Engineering Research & Design, 2005, 83: 196-204.
[17]BUDZIANOWSKI W M. Mitigating NH3vaporization from an aqueous ammonia process for CO2capture [J]. International Journal of Chemical Reactor Engineering, 2011, 9 (1). DOI: 10.1515/1542-6580.2711.
[18]YOU J K, PARK H S, YANG S H, et al. Influence of additives including amine and hydroxyl groups on aqueous ammonia absorbent for CO2capture [J]. Journal of Physical Chemistry B, 2008, 112 (14):4323-4328.
[19]YU H, QI G, WANG S, et al. Results from trialling aqueous ammonia-based post-combustion capture in a pilot plant at Munmorah Power Station: gas purity and solid precipitation in the stripper [J]. International Journal of Greenhouse Gas Control, 2012, 10 (9):15-25.
[20]ZHANG M, GUO Y. Rate based modeling of absorption and regeneration for CO2capture by aqueous ammonia solution [J]. Applied Energy, 2013, 111 (4): 142-152.
[21]VERSTEEG P, RUBIN E S. A technical and economic assessment of ammonia-based post-combustion CO2capture at coal-fired power plants [J]. International Journal of Greenhouse Gas Control, 2011, 5(6): 1596-1605.
[22]MANI F, PERUZZINI M, BARZAGLI F. The role of zinc (Ⅱ) in the absorption-desorption of CO2by aqueous NH3, a potentially cost-effective method for CO2capture and recycling [J]. ChemSusChem,2008, 1 (3): 228-35.
[23]KIM Y, LIM S R, PARK J M. The effects of Cu(Ⅱ) ion as an additive on NH3loss and CO2absorption in ammonia-based CO2capture processes [J]. Chemical Engineering Journal, 2012, s211/212 (47):327-335.
[24]MA S, SONG H, ZANG B, et al. Experimental study of Co(Ⅱ)additive on ammonia escape in carbon capture using renewable ammonia[J]. Chemical Engineering Journal, 2013, 234 (12):430-436.
[25]马双忱,陈公达,马宵颖, 等. 氨法碳捕集过程中氨逃逸控制 [J].化工学报, 2014, 65 (10): 4086-4093. MA S C, CHEN G D, MA X Y, et al. Ammonia escape control in carbon dioxide capture using ammonia method [J]. CIESC Journal,2014, 65 (10): 4086-4093.
[26]LI K, YU H, TADE M, et al. Theoretical and experimental study of NH3suppression by addition of Me(Ⅱ) ions (Ni, Cu and Zn) in an ammonia-based CO2capture process [J]. International Journal of Greenhouse Gas Control, 2014, 24 (6):54-63.
[27]LIMPT H V, BEERKENS R, LANKHORST A, et al. Mass transfer relations for transpiration evaporation experiments [J]. International Journal of Heat and Mass Transfer, 2005, 48:4265-4281.
[28]BAJWA K S, ANEJA V P, ARYA S P. Measurement and estimation of ammonia emissions from lagoon-atmosphere interface using a coupled mass transfer and chemical reactions model, and an equilibrium model [J]. Atmospheric Environment, 2006, 40 (3):275-286.
[29]时钧. 化学工程手册 [M]. 北京:化学工业出版社, 1996. SHI J. Chemical Engineering Handbook [M]. Beijing: Chemical Industry Press, 1996.
[30]SPEIGHT J G. Lange's Handbook of Chemistry [M]. New York:McGraw-Hill, 2005.
Ammonia escape and its prevention in CO2absorption process using ammonia solution
MA Shuangchen, CHEN Gongda, WEN Jiaqi, MA Lan, JIAO Kunling
(School of Environment, North China Electric Power University, Baoding 071003, Hebei, China)
With awareness of environmental protection in recent years, control of greenhouse gas emission has become an important issue. A large port of CO2come from power plants combustion of fossil fuel, and its capture is necessary for fire-coal power plants. Chemical absorption of CO2by alkaline absorbent is one of widely use methods. Among the removal technologies of air pollutants by chemical absorbents, ammonia method has many advantages. However, ammonia method has a serious ammonia escape problem, leading to a less favorable selection for the application. The effects of CO2concentration, ammonia concentration, absorption temperature on ammonia escape were experimentally investigated in the paper. Based on consideration of coordination chemistry principle, some metal ions were selected and studied as additives. The results indicated that addition of Ni2+showed a good performance for the control of ammonia escape, and it was confirmed by the results obtained by UV-visible spectrophotometer. These results could be valuable for solution of ammonia escape.
carbon capture; ammonia solution; ammonia escape; absorption; chemical processes
引 言
近年来,CO2等温室气体的过量排放所引起的气候变化已成为全球性的环境问题,并引起各国的广泛关注[1-3]。根据统计,CO2主要来自化石燃料的燃烧,其中又以电厂燃烧排放为主要来源。鉴于我国能源储量特点,以煤为主的能源结构在近期内无法发生根本性改变,因此实现电厂烟气CO2减排对遏制全球气候异常至关重要[4-6]。在众多碳减排技术中,氨水作为吸收剂具有成本低、吸收效率高、再生能耗低、副产物资源化佳以及无腐蚀问题等优点,具有良好的发展前景[7-12]。其中又以采用加热方式进行吸收液再生同时解吸分离纯净CO2的再生氨法碳捕集为主要的研究方向[13-14]。然而由于氨的高挥发性,氨法碳捕集应用过程中氨的逃逸问题严重限制了氨法的应用,研究表明氨逃逸的根源是液相中游离氨浓度过高[15-16]。吸收过程中氨的逸出将导致吸收剂浓度下降,影响后续吸收效果,而氨泄漏到大气中会造成非常严重的二次污染,对生态环境和人体健康都可能造成危害,吸收后烟气的除氨也需要消耗大量的水和能量;同时在解吸过程中氨和CO2一起挥发,分离回收这部分逃逸氨的能耗非常大[17-21]。因此,为了使氨法碳捕集技术得到广泛的应用推广,并且避免氨逃逸造成的二次环境污染,研究氨的逃逸问题很有必要。Mani等[22]研究指出加入Zn2+能够有效减少氨的损失,但ZnCO3的产生会引起反应器结垢,最终影响吸收效果。Kim等[23]提出用Cu2+改进氨的吸收,但由于Cu2+与氨的络合稳定系数很高,造成碳捕集效率明显下降。作者[24-25]采用NHD、Co2+等进行抑制氨逃逸的实验研究,也取得了较好的效果,明确了某些离子的络合作用对降低游离氨浓度、抑制氨逃逸有效。Li等[26]研究了多种金属(Ni2+,Cu2+,Zn2+)对氨法碳捕集中氨逃逸的抑制作用,模拟得到了不同pH和CO2负荷条件下的金属离子溶解度及络合物的物种分布,指出在这几种金属中Ni2+的效果较好。
date: 2015-09-11.
Prof. MA Shuangchen, msc1225@163.com
supported by the Fundamental Research Funds for the Central Universities (2014ZD39, 2014XS84).
X 511
A
0438—1157(2016)05—2064—06
2015-09-11收到初稿,2015-10-15收到修改稿。
联系人及第一作者:马双忱(1968—),男,教授。
中央高校基本科研业务费专项资金(2014ZD39,2014XS84)。
