玉米秸秆中不同木质素脱除方法对纤维素酶吸附及酶解效果的比较
2016-08-22田顺风程力顾正彪洪雁李兆丰李才明
田顺风,程力,顾正彪,洪雁,李兆丰,李才明
(江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;江南大学食品学院,江苏 无锡 214122;江南大学食品营养与安全协同创新中心,江苏 无锡 214122)
玉米秸秆中不同木质素脱除方法对纤维素酶吸附及酶解效果的比较
田顺风,程力,顾正彪,洪雁,李兆丰,李才明
(江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;江南大学食品学院,江苏 无锡 214122;江南大学食品营养与安全协同创新中心,江苏 无锡 214122)
利用不同预处理方法获得的玉米秸秆底物研究木质素脱除对纤维素酶吸附量及酶解效率的影响。相比于其他处理方法,2%(质量分数)NaOH处理的底物具有最高的木质素脱除率(85%),最高的底物可及性[4.7 mg·(g葡聚糖)-1]及酶解效率(18.9%)。通过对不同处理获得的底物进行Langmuir吸附等温曲线模拟,获得了最大吸附量(Wmax)与吸附平衡常数(K),且木质纤维素酶水解效率与纤维素酶吸附量具有很好的线性关系(R2>0.8),表明脱除木质素能很好地提高底物可及性与酶解效率。然而,提高NaOH浓度(3%,4%)进一步脱除木质素时,底物可及性与碳水化合物转化为单糖的效率反而明显下降。因此,适当脱除木质素而提高底物对纤维素酶的可及性将有助于获得更有效的酶水解效果。
玉米秸秆;生物质;生物能源;纤维素酶吸附;预处理;木质素脱除;酶水解效率
DOI:10.11949/j.issn.0438-1157.20151570
引 言
木质纤维素是地球上最丰富的可再生生物能源[1],主要由3种聚合物组成:纤维素、半纤维素和木质素。然而,木质纤维素对酶和微生物的“生物顽抗性”是低成本生产可再生能源的主要瓶颈[2]。因此,大多数种类的木质纤维素在降解之前要进行预处理,以降低生物质顽抗性,进而通过酶水解获得较高的还原糖得率[3]。
生物质顽抗性可归咎于多个因素[4-6],例如木质素和纤维素形成的复合物,纤维素的聚合度,纤维素的结晶度,木质素含量,木质素结构及分布,半纤维含量和粒径大小(比表面积)等。其中,木质素相关因素,像木质素含量,木质素的分布及物理结构,木质素与碳水化合物之间的连接以及木质素与酶之间的疏水作用等被认为是最重要的影响因素[7-10]。一般认为木质素通过两种可能的方式降低酶作用效率:纤维素酶非特异性结合木质素;木质素作为物理屏障阻碍酶对纤维素的可及性[11]。木质素被认为是不利于纤维素酶作用的主要障碍之一,因此脱除木质素通常能增强底物的酶水解效率[12-17]。亚氯酸钠法、石灰处理、臭氧处理和碱性过氧化氢处理等方法已被报道用于脱除木质素并提高酶解效率。
不过,关于木质素脱除的方面仍存在争论,尤其是更为剧烈的木质素脱除处理方式[11,17]。较高程度的脱除木质素没有明显增加底物可及性,并不能引起相应底物酶降解效率的提高。据报道,次氯酸钠处理后的料浆木质素含量低于15%时,酶水解效率持平而不是继续明显提高[11]。
一般认为,内切纤维素酶在木质纤维素水解中具有重要作用,内切纤维素酶在纤维素多糖链上的非结晶区域随机性地内切β-1,4-葡萄糖苷键,释放长短不一的纤维寡糖,在水解过程中与其他纤维素酶形成很好的协同作用[18]。本文针对原木质纤维素及NaOH处理、碱性Na2SO3和碱性H2O2处理得到的样品,比较不同脱木质素方法对内切纤维素酶的吸附量及酶解效率(还原糖生成量)的影响。同时,获得不同处理得到的底物酶吸附与底物酶降解之间的关系。最后,进行了不同木质素脱除水平的研究,确定进一步脱除木质素对底物酶水解的影响。
1 材料与方法
1.1原材料与试剂
本实验所用干燥玉米秸秆由山东诸城兴茂玉米开发有限公司提供。玉米秸秆用植物粉碎机磨碎并筛取粒径250~380 μm的作为原材料。筛选的原材料室温下储存于自封袋中。实验中所用纤维素酶(22178-25G,Lot#BCBM7947V,5 FPU·ml-1,1.4 mg 蛋白质·ml-1),是一种内切纤维素酶,购买于Sigma,溶解在0.05 mol·L-1pH 4.5的柠檬酸缓冲溶液里。纤维素酶滤纸酶活通过标准方法确定[19],纤维素酶蛋白质含量通过Bradford方法确定,且以牛血清蛋白(BSA)作为标准品[20]。
1.2原材料预处理方法
1.2.1NaOH处理30 g(干)原料放入240 ml质量分数为2%的NaOH溶液中,在120℃反应30 min[21]。反应后混合体系通过过滤进行固液分离,固体部分用去离子水洗到中性。洗过之后的湿渣全部转移到衡重的容器中,并在4℃密封储存。一部分固体残渣用于成分分析[22]。
1.2.2碱性Na2SO3处理(ASSP)30 g(干)原料放入300 ml碱性Na2SO3溶液,120℃反应50 min。其中,碱用量为0.5%(质量分数),氢氧化钠与亚硫酸钠的质量比为4:1[23]。反应之后的混合体系通过过滤进行固液分离,固体部分用去离子水洗到中性。洗过之后的湿渣全部转移到衡重的容器中,并在4℃密封储存。一部分固体残渣用于成分分析[22]。
1.2.3碱性H2O2处理30 g(干)原料放入600 ml碱性H2O2溶液中,50℃反应6 h。H2O2的质量分数为2%,且其pH用5 mol·L-1NaOH调到11.5[24]。反应之后的混合体系通过过滤进行固液分离,固体部分用去离子水洗到中性。洗过之后的湿渣全部转移到衡重的容器中,并在4℃密封储存。一部分固体残渣用于成分分析[22]。
1.2.4浓碱处理进一步脱除木质素为进一步研究木质素含量尤其是更高水平脱除木质素对酶吸附及木质纤维素酶降解的影响,原木质纤维素用不同浓度的NaOH处理。其中,NaOH质量分数0.5%~4%,固液比为1:8,反应温度和反应时间分别为120℃、30 min[21,25]。预处理后的固体部分用去离子水洗到中性。洗过之后的湿渣全部转移到衡重的容器中,并在4℃密封储存。一部分固体残渣用于成分分析[22]。
1.3预处理前后的底物对纤维素酶的吸附
底物对纤维素酶的可及性可用纤维素酶蛋白质在底物上的吸附量[mg·(g 葡聚糖)-1]来表征[25-26]。不同底物纤维素酶吸附实验在0.05 mol·L-1体积为100 ml的柠檬酸缓冲溶液体系里进行,温度控制在4℃以避免底物部分水解,保持反应体系中葡聚糖含量为1 g/100 ml,且初始纤维素酶添加量为6.5 mg·(g 葡聚糖)-1,其中搅拌桨转速为130 r·min-1。在加入纤维素酶之前,过量的牛血清蛋白(最终浓度0.2 mg·ml-1)加入到反应体系中,并在60 min内达到平衡。牛血清蛋白可以非特异性结合到木质素表面并阻碍纤维素酶不可逆地吸附到木质素上,从而木质素对纤维素酶的影响可以忽略[27-28]。反应体系中与木质素结合的牛血清蛋白通过Bradford法确定[20]。在反应期间,0、15、30、45、60和75 min时分别从体系里取出约1 ml样品,立刻用孔径0.22 μm的滤膜过滤除去悬浮的固体。滤液中总蛋白质含量通过Bradford法确定[20]。通过从总的初始纤维素酶和牛血清蛋白添加量里扣除未吸附的纤维素酶和牛血清蛋白,可以确定吸附到纤维素上的酶量[26]。以没有添加纤维素酶的底物作为空白实验以去除木质纤维素底物中蛋白质的影响。
Langmuir吸附动力曲线通常用于描述纤维素酶在底物上的吸附过程。为确定吸附等温线,不同质量的纤维素酶(6.5~18 mg·g-1葡聚糖)加入到100 ml的0.05 mol·L-1柠檬酸缓冲溶液里,反应体系中葡聚糖含量控制为1%,在4℃保持90 min从而达到吸附平衡。吸附到底物上的纤维素酶量确定方法同上。吸附参数(最大吸附量Wmax,平衡常数K)通过使用Origin软件模拟Langmuir吸附方程确定[29]。

式中,W为吸附的蛋白质量,mg·ml-1;K为吸附平衡常数,ml·mg-1;C为游离蛋白质量,mg·ml-1。
1.4预处理对木质纤维素底物酶水解效率的影响
浓度0.05 mol·L-1柠檬酸(pH 4.5)缓冲溶液水解反应体系中,葡聚糖含量为1 g/100 ml。所有反应成分添加到150 ml的三角瓶里,总体积为100 ml。体系在50℃的水浴锅中反应12 h,转速160 r·min-1。添加纤维素酶之前,在预置的温度下反应体系维持15 min从而使体系达到平衡。纤维素酶添加量6.5 mg·(g葡聚糖)-1,不同底物的酶水解程度(还原糖生成量)被确定。分别在1、2、4、8和12 h取大约1 ml的反应混合物,取样后立刻煮沸10 min进行酶灭活,然后用三硝基水杨酸法(DNS)确定还原糖生成量[14,30]。反应体系中没有酶和没有底物的空白实验作为对照组。
为了研究纤维素酶吸附量与底物水解程度之间的关系,不同初始量的纤维素酶(6.5~18 mg·g-1葡聚糖)分别加入到上述反应体系中。
1.5X射线衍射分析
原料与不同处理的木质纤维素的X射线衍射结晶度通过使用Bruker D8衍射仪测得。其中,扫描范围10°~50°,扫描速度2 (°)·min-1,扫描电压与电流分别为30 kV、30 mA。玉米秸秆的结晶度(CrI),通过衍射数据及Segal方程计算获得[31]

式中,I002为木质纤维素结晶区(纤维素)的强度,2θ=22°;Iam为非结晶区(半纤维素、木质素)峰强度,2θ=18°。
2 结果与讨论
2.1不同处理对木质纤维素化学成分的影响
表1总结了预处理前后木质纤维素主要成分含量的变化情况。与未处理和其他手段处理获得的木质纤维素相比,NaOH处理脱除最多的木质素。同时,由于部分木质素的脱除,所有预处理方法均导致底物中葡聚糖和木聚糖成分相对含量提高。NaOH处理有最低的物料得率,ASSP次之,而碱性H2O2处理有最高的物料得率,这不仅与木质素脱除有关,还与提取物溶解和葡聚糖、木聚糖部分降解有关。结果表明,NaOH处理是一种非常有效的脱除木质素方法,氢氧根离子更容易破坏成分之间的化学键,使木质素溶解在碱溶液里,从而导致大量木质素脱除[32]。

表1 R预处理前后底物组分含量Table 1 Compositions for corn stover solids produced by different delignification approaches/%
2.2纤维素酶在不同底物上的吸附
纤维素酶吸附到底物表面上通常是木质纤维素酶水解的第1步。对于内切纤维素酶,深入了解其吸附过程对理解底物酶水解机制有重要作用。图1显示了不同木质纤维素底物的纤维素酶吸附曲线。对所有底物,酶吸附在15 min内达到最大值,并在90 min内基本达到平衡,这个结果和相关研究报道的结果一致[28]。与原木质纤维素相比[2.5 mg·(g 葡聚糖)-1],木质素含量最低的NaOH处理的底物具有最高的纤维素酶吸附量[4.7 mg·(g 葡聚糖)-1],ASSP次之[3.5 mg·(g 葡聚糖)-1],而碱性H2O2处理有最低的纤维素酶吸附量[3.2 mg·(g 葡聚糖)-1],表明木质素和半纤维素的脱除有利于纤维素酶的吸附。
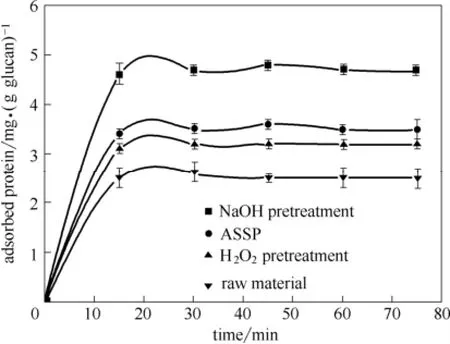
图1 纤维素酶在不同处理底物上的吸附曲线Fig.1 Cellulase adsorption kinetics for different substrates

图2 4℃不同底物的Langmuir等温吸附曲线Fig.2 Adsorption of cellulase versus unbound enzyme at 4℃ characterized by Langmuir adsorption isothermal
Langmuir吸附等温曲线通常用于描述不同底物的吸附行为[29,33]。4℃条件下,内切纤维素酶的吸附行为满足Langmuir方程(R2>0.95),如图2所示。通过模拟Langmuir得到的吸附常数、最大吸附量和底物与酶的结合强度(吸附常数与最大吸附量的乘积),见表2。很明显,NaOH处理的底物具有最大的纤维素酶吸附能力(比原木质纤维素提高20%),ASSP次之(比原木质纤维素提高15%),而碱性H2O2处理有最小的纤维素酶吸附能力(比原木质纤维素提高12%),这与之前的实验数据是一致的。结果表明,通过预处理脱除木质素有利于纤维素酶的吸附,从而促进更多的酶与底物相结合。同时,这些预处理方法中,NaOH处理的固体所具有的吸附常数几乎是其他预处理方法产生底物的酶吸附常数平均值的2倍,这可能与NaOH处理能最大程度脱除木质素有关。NaOH处理的底物有较大酶吸附能力,木质素脱除可能是一个潜在的主要原因,因为处理过程中孔洞的产生及木质素与碳水化合物的复合物被破坏引起空间位阻作用减小,从而提高了底物的可及性[11]。
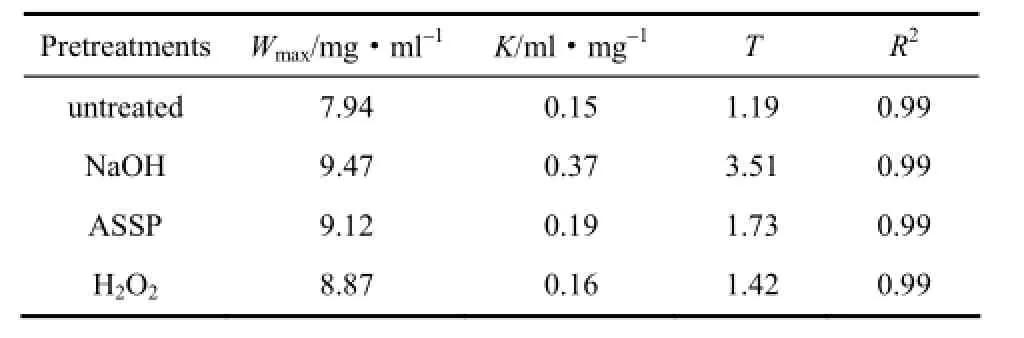
表2 R不同底物的最大吸附量(Wmax),吸附常数(K)及结合强度(T=WmaxK)Table 2 Maximum cellulase adsorption capacities (Wmax),affinity constants (K), and strengths of adsorption(T=WK) for corn stover solids
2.3不同预处理木质纤维素酶水解效率的比较
控制相同的初始酶添加量[6.5 mg·(g 葡聚糖)-1],对预处理前后的的玉米秸秆进行酶水解动力学研究。图3中,NaOH处理的底物12 h内酶解效率最大,为18.9%,ASSP次之,为15.6%,原玉米秸秆为最小,为7.3%,而碱性H2O2处理的底物为15%。总地来看,所有底物酶水解效率均不高,这与所用纤维素酶是内切纤维素酶有关,而内切纤维素酶通常更倾向作用于非结晶区纤维素[34]。与原材料相比,所有预处理的木质纤维素底物酶降解效率均有显著的提高,这是因为脱除木质素对底物酶水解中有重要影响。与本发现类似,研究报道木质素为含量14.6%的石灰处理的底物具有最高酶解效率,这与其较高的纤维素酶吸附能力有关[25]。据报道,随着木质素的脱除,纤维素的降解逐渐提高[35]。对于木质素含量比较高的木质纤维素,木质素对于底物酶水解效率具有重要影响,部分脱除木质素有助于获得较高的糖转化率。

图3 不同预处理底物酶解效率比较Fig.3 Comparison of enzymatic saccharification over different reaction time for different delignified substrates
2.4不同底物的吸附能力与酶解之间的关系
纤维素酶吸附量与酶作用有效性是影响纤维素水解的两个主要方面[34]。一般认为,纤维素酶吸附到底物表面或嵌插其内部是木质纤维素酶水解的第1步。为了确定纤维素酶吸附量与酶降解之间的关系,分别在两种情况下对12 h酶水解效率与纤维素酶吸附量进行比较,一种是相同纤维素酶初始添加量下不同底物之间的比较,另一种是固定底物浓度而改变初始纤维素酶添加量。结果表明,相同纤维素酶初始添加量下不同底物之间,底物酶解效率与纤维素酶吸附量之间均具有较好的线性关系(R2>0.80),如图4(a)~(e);而通过改变初始纤维素酶添加量,所有反应底物的酶水解效率与所测纤维素酶吸附量明显呈线性关系(R2>0.90),如图4(f)所示。其他文献也报道了纤维素水解与酶吸附能力有很好的线性关系[36]。这种线性关系表明,提高底物对纤维素酶的吸附量是促进木质纤维素底物酶水解产糖的最重要因素之一[27]。
2.5浓碱进一步脱除木质素对成分的影响
为研究更剧烈脱除木质素对木质纤维素底物成分的影响,用不同质量浓度的NaOH溶液处理原木质纤维素以选择性脱除木质素。见表3,预处理后50%~90%的木质素被脱除。原材料在更剧烈的处理条件下,木质素脱除更为有效,这可能由于木质素更容易遭到破坏。但同时随着NaOH处理浓度的增大,木质素脱除率的增长幅度逐渐减小,且处理后物料得率明显下降,尤其是在剧烈的处理条件下。随着更为剧烈地脱除木质素,葡聚糖和木聚糖的保留率分别从95%、90%下降到46.6%、81%,木聚糖保留率明显比葡聚糖保留率减少得更多,表明浓碱处理过程中半纤维素比纤维素更容易遭到破坏。

图4 不同底物的纤维素酶吸附能力与12 h酶解效率之间关系Fig.4 Relationship between cellulase adsorption capacity and 12 h enzymatic digestibility for raw material and pretreated corn stover solids
2.6浓碱进一步脱除木质素对纤维素酶吸附及酶水解的影响
预处理脱除木质素有利于纤维素酶吸附及底物酶降解。目前为止,已经提出了几个机制解释木质素对酶解的影响。尽管一般认为木质素通过阻止底物对纤维素酶的可及性减缓水解过程,但木质素脱除是提高底物可及性还是提高酶作用有效性还是其共同作用仍有争议。因此本研究尝试确定进一步脱除木质素对底物可及性和酶水解的影响,而初始纤维素酶添加量仍为6.5 mg·(g 葡聚糖)-1。
进一步脱除木质素对纤维素酶吸附及底物酶水解的影响如图5所示。由图可见,一定程度地脱除木质素明显有利于提高底物可及性,而在更剧烈的处理条件下进一步脱除木质素却不利于底物对纤维素酶的吸附,呈现出底物可及性下降的趋势。据报道,脱除木质素过程中,预处理产生孔洞并打破木质素与碳水化合物之间的复合物,能有效提高纤维素的可及性[37]。然而,木质素含量减少到一定程度,将不会对酶水解有明显作用[38]。一种可能的原因是,剧烈的处理过程中大量非结晶区纤维素被破坏,影响了纤维素的结构。而内切纤维素酶通常对非结晶区纤维素有更高的亲和作用力,因此导致木质纤维素底物可及性的下降。
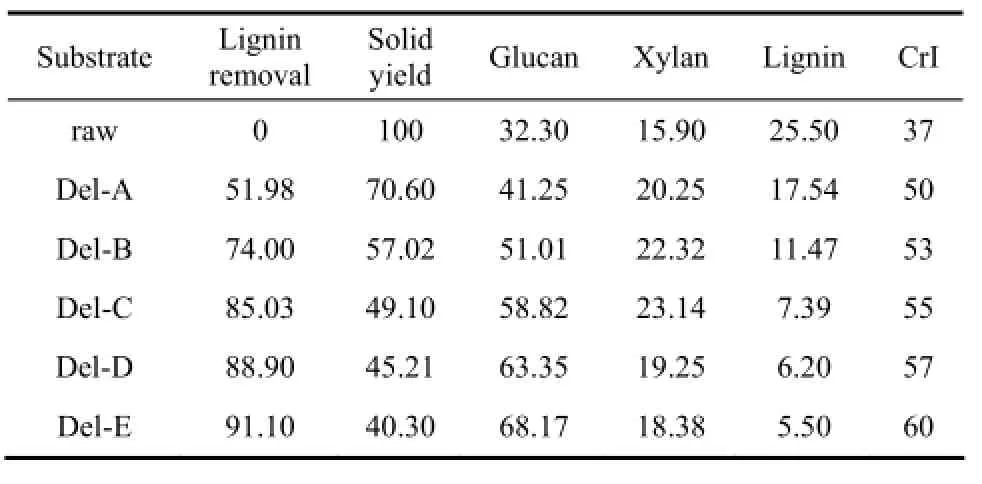
表3 R进一步脱除木质素后底物组分及结晶度Table 3 Lignin removal, solid yield, compositions and crystallinity of extensive delignified corn stover solids/%

图5 进一步脱除木质素对底物可及性与酶水解的影响Fig.5 Effect of selective lignin removal by different concentrations of NaOH on cellulase adsorption capacity and enzymatic digestibility
同时,图5中显示,处理后底物的酶水解行为与纤维素对酶的吸附呈现相似规律。当用质量分数为2%的NaOH处理木质纤维素而脱除85%的木质素时,预处理的底物具有最高的酶水解效率。然而,原木质纤维素经更剧烈NaOH(3%、4%)处理,分别脱除88.90%和91.10%的木质素时,预处理后底物的酶水解效率反而下降。更高水平的脱除木质素没有明显提高底物的可及性,也不会引起底物相应的高水平酶水解效率,呈现出边际效应,从而再次表明在木质纤维素有效生成可发酵糖过程中,提高底物可及性是比脱除木质素更为重要的考虑因素。
上述结果显示,更高水平的脱除木质素没有引起更高的酶降解效率。其中,一个可能的原因是酶水解过程受底物结晶度的影响。通常高结晶度不利于底物酶水解[39-41],因为结晶区的纤维素不易被纤维素酶尤其是内切纤维素酶水解。表3中,随着NaOH浓度增大,处理后底物的结晶度不断增大,从而不利于底物的水解。另外,在进一步处理过程中,由于木质素对纤维素酶形成的物理障碍已被充分移除,因此木质素已不再是酶水解过程中的主要障碍[37],底物酶水解效率开始取决于其他重要的因素[17,23]。同时,在进一步脱除木质素的过程中,大量的非结晶区纤维素被破坏而减少[40],不利于内切纤维素酶的吸附而导致底物酶降解效率的下降。
3 结 论
与其他预处理方法相比,质量分数为2%的NaOH处理后底物木质素含量最低,并且分别有最高的底物可及性[4.7 mg·(g 葡聚糖)-1]与酶解效率(18.9%),而除原木质纤维素外碱性H2O2处理后底物的可及性与酶解效率最低,表明木质素脱除在木质纤维素酶水解过程中有重要作用。对各反应底物,木质纤维素酶水解效率与纤维素酶吸附量具有很好的线性关系,适当脱除木质素能很好提高底物可及性与酶解效率。然而,进一步脱除木质素不利于可及性与底物酶解效率的提高。因此,为获得更加有效的酶水解,采用适当的木质素脱除手段并提高底物对纤维素酶的可及性是极为重要的考虑因素。
References
[1]HIMMEL M E, DING S-Y, JOHNSON D K, et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production[J]. Science, 2007, 315 (5813): 804-807.
[2]ZHANG Y H P, DING S Y, MIELENZ J R, et al. Fractionating recalcitrant lignocellulose at modest reaction conditions [J]. Biotechnology and Bioengineering, 2007, 97 (2): 214-223.
[3]崔美, 黄仁亮, 苏荣欣, 等. 木质纤维素新型预处理与顽抗特性[J]. 化工学报, 2012, 63 (2): 677-687. DOI: 10.3969/j.issn.0438-1157.2012.03.002. CUI M, HUANG R L, SU R X, et al. An overview on lignocellulose pretreatment and recalcitrant [J]. CIESC Journal, 2012, 63 (2):677-687. DOI: 10.3969/j.issn.0438-1157.2012.03.002.
[4]MOSIER N, WYMAN C, DALE B, et al. Features of promising technologies for pretreatment of lignocellulosic biomass [J]. Bioresource Technology, 2005, 96 (6): 673-686.
[5]刘黎阳, 牛坤, 刘晨光, 等. 离子液体预处理油料作物木质纤维素[J]. 化工学报, 2013, 64 (S1): 104-110. DOI: 10.3969/j.issn.0438-1157.2013.z1.015. LI L Y, NIU K, LIU C G, et al. Effect of ionic liquid pretreatment on lignocellulosic biomass from oilseeds [J]. CIESC Journal, 2013, 64(S1): 104-110. DOI: 10.3969/j.issn.0438-1157.2013.z1.015.
[6]KIM S, HOLTZAPPLE M T. Effect of structural features on enzyme digestibility of corn stover [J]. Bioresource Technology, 2006, 97 (4):583-591.
[7]ALVIRA P, TOMAS P E, BALLESTEROS M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review [J]. Bioresource Technology, 2010,101 (13): 4851-4861.
[8]SALEHI S M A, KARIMI K, BEHZAD T, et al. Efficient conversion of rice straw to bioethanol using sodium carbonate pretreatment [J]. Energy & Fuels, 2012, 26 (12): 7354-7361.
[9]BERLIN A, BALAKSHIN M, GILLKES N, et al. Inhibition of cellulase, xylanase and β-glucosidase activities by softwood lignin preparations [J]. Journal of Biotechnology, 2006, 125 (2): 198-209.
[10] DING S Y, LIU Y S, ZENG Y, et al. How does plant cell wall nanoscale architecture correlate with enzymatic digestibility? [J]. Science, 2012, 338 (6110): 1055-1060.
[11]YU Z, JAMEEL H, CHANG H M, et al. The effect of delignification of forest biomass on enzymatic hydrolysis [J]. Bioresource Technology,2011, 102 (19): 9083-9089.
[12]LIU Z, PADMANABHAN S, CHENG K, et al. Two-step delignification of miscanthus to enhance enzymatic hydrolysis: aqueous ammonia followed by sodium hydroxide and oxidants [J]. Energy & Fuels, 2014, 28 (1): 542-548.
[13] MOU H, LI B, FARDIM P. Pretreatment of corn stover with the modified hydrotropic method to enhance enzymatic hydrolysis [J]. Energy & Fuels, 2014, 28 (7): 4288-4293.
[14]KIM S, HOLTZAPPLE M T. Lime pretreatment and enzymatic hydrolysis of corn stover [J]. Bioresource Technology, 2005, 96 (18):1994-2006.
[15]LI C, WANG L, CHEN Z, et al. Ozonolysis pretreatment of maize stover: the interactive effect of sample particle size and moisture on ozonolysis process [J]. Bioresource Technology, 2015, 183: 240-247.[16]SELIG M J, VINZANT T B, HIMMEL M E, et al. The effect of lignin removal by alkaline peroxide pretreatment on the susceptibility of corn stover to purified cellulolytic and xylanolytic enzymes [J]. Applied biochemistry and Biotechnology, 2009, 155 (1/2/3): 94-103.
[17] LI M, FOSTER C, KELKAR S, et al. Structural characterization of alkaline hydrogen peroxide pretreated grasses exhibiting diverse lignin phenotypes [J]. Biotechnology Biofuels, 2012, 5 (1): 38.
[18]KLEMAN-LEYER K M, SIIKA-AHO M, TEERI T T, et al. The cellulases endoglucanase Ⅰ and cellobiohydrolase Ⅱ of Trichoderma reesei act synergistically to solubilize native cotton cellulose but not to decrease its molecular size [J]. Applied and Environmental Microbiology, 1996, 62 (8): 2883-2887.
[19]GHOSE T. Measurement of cellulase activities [J]. Pure and Applied Chemistry, 1987, 59 (2): 257-268.
[20]SMITH P, KROHN R I, HERMANSON G, et al. Measurement of protein using bicinchoninic acid [J]. Analytical Biochemistry, 1985,150 (1): 76-85.
[21]CHEN M, ZHAO J, XIA L. Comparison of four different chemical pretreatments of corn stover for enhancing enzymatic digestibility [J]. Biomass and Bioenergy, 2009, 33 (10): 1381-1385.
[22]SLUITER A, HAMES B, RUIZ R, et al. Determination of structural carbohydrates and lignin in biomass [R/OL]. National Renewable Energy Laboratory (NREL). 2007. http://www.nrel.gov/biomass/pdfs/ 42618.pdf.
[23]LI Q, GAO Y, WANG H, et al. Comparison of different alkali-based pretreatments of corn stover for improving enzymatic saccharification[J]. Bioresource Technology, 2012, 125: 193-199.
[24]QI B, CHEN X, SHEN F, et al. Optimization of enzymatic hydrolysis of wheat straw pretreated by alkaline peroxide using response surface methodology [J]. Industrial & Engineering Chemistry Research, 2009,48 (15): 7346-7353.
[25]KUMAR R, WYMAN C E. Cellulase adsorption and relationship to features of corn stover solids produced by leading pretreatments [J]. Biotechnology and Bioengineering, 2009, 103 (2): 252-267.
[26]ROLLION J A, ZHU Z, SATHITSUKSANOH N, et al. Increasing cellulose accessibility is more important than removing lignin: a comparison of cellulose solvent-based lignocellulose fractionation and soaking in aqueous ammonia [J]. Biotechnology and Bioengineering,2011, 108 (1): 22-30.
[27]YANG B, WYAMN C E. BSA treatment to enhance enzymatic hydrolysis of cellulose in lignin containing substrates [J]. Biotechnology and Bioengineering, 2006, 94 (4): 611-617.
[28]ZHU Z, SATHITSUKSANOH N, VINZANT T, et al. Comparative study of corn stover pretreated by dilute acid and cellulose solvent-based lignocellulose fractionation: enzymatic hydrolysis, supramolecular structure, and substrate accessibility [J]. Biotechnology and Bioengineering,2009, 103 (4): 715-724.
[29]DU R, SU R, LI X, et al. Controlled adsorption of cellulase onto pretreated corncob by pH adjustment [J]. Cellulose, 2012, 19 (2):371-380.
[30]ZHANG J, MA X, YU J, et al. The effects of four different pretreatments on enzymatic hydrolysis of sweet sorghum bagasse [J]. Bioresource Technology, 2011, 102 (6): 4585-4589.
[31]SEGAL L, CREELY J, MARTIN A, et al. An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer [J]. Textile Research Journal, 1959, 29 (10):786-794.
[32]CHANG V S, HOLTZAPPLE M T. Fundamental factors affecting biomass enzymatic reactivity [J]. Applied Biochemistry and Biotechnology, 2000, 84 (1): 5-37.
[33]LU Y, YANG B, GREGG D, et al. Cellulase adsorption and an evaluation of enzyme recycle during hydrolysis of steam-exploded softwood residues [J]. Applied Biochemistry and Biotechnology, 2002,98/100 (1/2/3/4/5/6/7/8/9): 641-654.
[34]ZHANG Y H P, LYND L R. Toward an aggregated understanding of enzymatic hydrolysis of cellulose: noncomplexed cellulase systems[J]. Biotechnology and Bioengineering, 2004, 88 (7): 797-824.
[35]LEU S Y, ZHU J. Substrate-related factors affecting enzymatic saccharification of lignocelluloses: our recent understanding [J]. Bioenergy Research, 2013, 6 (2): 405-415.
[36]KOTIRANTA P, KARLSSON J, SIIKA-AHO M, et al. Adsorption and activity of Trichoderma reesei cellobiohydrolase Ⅰ, endoglucanaseⅡ, and the corresponding core proteins on steam pretreated willow[J]. Applied Biochemistry and Biotechnology, 1999, 81 (2): 81-90.
[37] MOONEY C A, MANSFIELD S D, TOUHY M G, et al. The effect ofinitial pore volume and lignin content on the enzymatic hydrolysis of softwoods [J]. Bioresource Technology, 1998, 64 (2): 113-119.
[38]ZHU L, O'DWYER J P, CHANG V S, et al. Structural features affecting biomass enzymatic digestibility [J]. Bioresource Technology,2008, 99 (9): 3817-3828.
[39]MANSFIELD S D, MOONEY C, SADDLER J N. Substrate and enzyme characteristics that limit cellulose hydrolysis [J]. Biotechnology Progress, 1999, 15 (5): 804-816.
[40]FAN L, LEE Y H, BEARDMORE D. The influence of major structural features of cellulose on rate of enzymatic hydrolysis [J]. Biotechnology and Bioengineering, 1981, 23 (2): 419-424.
[41]FAN L, LEE Y H, BEARDMORE D H. Mechanism of the enzymatic hydrolysis of cellulose: effects of major structural features of cellulose on enzymatic hydrolysis [J]. Biotechnology and Bioengineering, 1980,22 (1): 177-199.
Comparison of different lignin removal processes for corn stover on cellulase adsorption and enzymatic hydrolysis
TIAN Shunfeng, CHENG Li, GU Zhengbiao, HONG Yan, LI Zhaofeng, LI Caiming
(State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China; School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China; Synergetic Innovation Center of Food Safety and Nutrition,Jiangnan University, Wuxi 214122, Jiangsu, China)
Experiments were conducted for various pretreated substrates to investigate the impact of lignin content on cellulase adsorption and substrate digestibility. Compared with other treatments, 2% (mass) NaOH pretreated solids with the highest level of lignin removal (85%) exhibited the highest accessibility to cellulase [4.7 mg protein·(g glucan)-1] and enzymatic digestibility (18.9%). The obtained maximum adsorption capacity (Wmax) and equilibrium constant (K) derived from fitting the Langmuir adsorption isotherm for different delignified substrates indicated that the removal of lignin benefited cellulase adsorption. The relationship between cellulase adsorption capacities and enzymatic digestibility for raw and pretreated solids correlated well (R2>0.8), supporting the hypothesis that carbohydrate conversion was primarily dominated by enhancing substrate accessibility owing to lignin removal. Nevertheless, further delignification by NaOH with concentrations of 3% (mass) and 4% (mass)was unfavorable to improving substrate accessibility to cellulase and enhancing carbohydrates conversion to monosaccharide. It appeared that the appropriate delignification to some degree was a significant pretreatment factor to be taken into consideration to achieve more effectively enzymatic digestibility.
date: 2015-10-19.
chenglichocolate@163.com
supported by the Key Program of the National Natural Science Foundation of China (31230057), the National Natural Science Foundation of China (31371787) and the Twelfth Five-Year National Key Technology Research and Development Program of the Ministry of Science and Technology of China (2012BAD34B07).
corn stover; biomass; bioenergy; cellulase adsorption; pretreatment; lignin removal; enzymatic digestibility
TS 721.1
A
0438—1157(2016)05—2084—09
2015-10-19收到初稿,2016-01-08收到修改稿。
联系人:程力。第一作者:田顺风(1990—),男,硕士研究生。
国家自然科学基金重点项目(31230057);国家自然科学基金项目(31371787);十二五科技部国家重点科技研究与发展规划项目(2012BAD34B07)。
