利用微生物燃料电池同步降解沼液和三苯基氯化锡
2016-08-22顾冬燕贾红华伍元东吴夏芫雍晓雨
顾冬燕,贾红华,伍元东,周 俊,吴夏芫,郑 涛,雍晓雨
(1南京工业大学生物与制药工程学院,江苏 南京 211816;2南京工业大学生物能源研究所,江苏 南京 211816;3中国科学院广州能源研究所,广东 广州 510640)
利用微生物燃料电池同步降解沼液和三苯基氯化锡
顾冬燕1,2,贾红华1,2,伍元东1,2,周俊1,2,吴夏芫1,2,郑涛3,雍晓雨1,2
(1南京工业大学生物与制药工程学院,江苏 南京 211816;2南京工业大学生物能源研究所,江苏 南京 211816;3中国科学院广州能源研究所,广东 广州 510640)
微生物燃料电池(MFC)作为一种同步产电和除污的新型电化学装置,为有效处理难降解有机污染物提供了一种途径。基于阴极Fenton反应,提出了一种耦合典型双室MFC中阳极沼液产电及阴极降解有机锡的新方法。结果表明,阳极产电生物膜经驯化后MFC的最高电压提高了50.32%,而且电压稳定时间延长了1倍。MFC运行结束后,阳极沼液COD、总氮、总磷的去除率分别为85.35%±1.53%、59.20%±5.24%、44.98%±3.57%。阴极三苯基氯化锡(TPTC)的降解率随其初始浓度增加而降低。在添加100 µmol·L-1TPTC时,MFC的最高输出电压为280.2 mV,最大功率密度为145.62 mW·m-2。TPTC在14 d后完全降解,降解效率为91.88%,降解速率约为0.273 µmol·L-1·h-1。研究结果可为利用MFC同步处理阳极有机废水和阴极有机污染物的实际应用提供基础支持。
微生物燃料电池;产电;降解;沼液;三苯基氯化锡;电化学;生物过程
DOI:10.11949/j.issn.0438-1157.20151527
引 言
微生物燃料电池(microbial fuel cell,MFC)是利用产电微生物的分解代谢将贮存在有机物中的化学能转化为电能的生物电化学装置[1-3]。产电菌分解底物生成的电子经外电路传递到阴极,被阴极的电子受体(如O2)消耗,从而产生电流[4]。
前期MFC的研究主要致力于提高其产电性能,包括电池的构型设计[1]、产电微生物筛选[5]、底物优化[6]、阴阳极材料合成[5]等。近年来, MFC的应用愈发受到关注,如有机废水处理、微生物电化学合成有机小分子和微生物传感器等[5],其中大部分废水处理的研究是在阳极室中进行。生产、生活及其他各类废水中含有丰富的有机物(主要是蛋白质和糖类化合物),利用废水作为MFC的阳极接种物[7-8]既能保证MFC有充足的原料来源,满足日益增长的能源需求,同时又能有效处理各类污染物,有利于环境治理。我国是一个农业大国,近年来为实现农业生产和农民生活的循环发展,节约农村能源,沼气产业发展迅速。沼液作为沼气厌氧发酵后的残余物,含有大量有机质、丰富的氨基酸及各种生长激素和维生素,而且含有厌氧发酵菌(anaerobic fermentative bacteria)、厌氧纤维素分解菌(anaerobic cellulose-decomposing bacteria)、硫酸盐还原菌(sulfate-reducing bacteria)和产甲烷菌(methanogens)等多种微生物菌群[9],是MFC产电的有效原料。曹琳等[8]以沼液为原料对单室MFC产电降解特性进行研究,结果表明MFC在利用沼液产电的同时对沼液中的有机物、氮、磷等物质有一定的降解能力。
然而截至目前对利用MFC阴极反应降解污染物鲜有报道。有研究表明Fenton反应对一些难降解污染物有较好的降解效果[10-11],如蒋胜韬等[12]利用Fenton反应对硝基苯化工废水进行降解,废水中硝基苯的去除率为94.1%,CODCr和TOC 的去除率分别为78.6%和60.5%,证明了Fenton反应去除污染物的高效性。本研究尝试将Fenton反应与MFC相结合,即MFC通过电解反应生成H2O2,结合阴极电极上产生的Fe2+构成Fenton试剂。H2O2能迅速与Fe2+反应生成·OH 和Fe3+,利用·OH无选择性的强氧化能力达到高效降解有机物的目的。
本研究拟利用典型双室MFC阳极沼液产电,同时激活阴极Fenton反应,从而同步降解阳极沼液和阴极三苯基氯化锡(triphenyltin chloride, TPTC),为利用MFC阴阳极耦合处理污染物的实际应用提供基础支持。
1 实验材料和方法
1.1材料和装置
沼液来自南京工业大学生物质能源研究所沼气工程,使用前保存在4℃冰箱中。驯化生物膜所用培养基成分(1 L)为:Na2HPO4·12H2O 11.53 g,NaH2PO4·2H2O 2.77 g,KCl 0.13 g,NH4Cl 0.31 g,葡萄糖1 g,调节pH为7.0。阴极液为2% NaCl水溶液,用1 mol·L-1盐酸调pH为3。实验使用的甲醇、乙腈、冰乙酸为色谱纯试剂。三苯基氯化锡(TPTC)购自国药集团化学试剂有限公司。其他试剂如无特殊说明均为分析纯。
双室微生物燃料电池由阴极室和阳极室两个电极室构成,中间由质子交换膜(3.0 cm×3.0 cm,Nafion-117,DuPont,USA)分隔开,每个电极室装液体积均为30 ml,阴极室利用空气泵持续通入空气。使用的电极材料为石墨毡(阴、阳极电极大小均为1.5 cm×2 cm,厚5 mm)。石墨毡使用前用4 mol·L-1盐酸浸泡24 h,重复4次以除去其表面可能存在的原始催化物[13]。阳极直接以石墨毡为电极,阴极电极按1.2节所述方法进行修饰。外电阻(ZX94A,上海正阳仪表厂)用钛丝(φ0.5 mm,南京华嘉化学试剂有限公司)连接,阻值为2 kΩ。保持实验在30℃条件下进行。当电池电压降到50 mV以下时停止运行。
1.2复合阴极的制备
称取0.3 g FeCl3·6H2O,溶于100 ml去离子水,得FeCl3溶液;称取0.6 g NaBH4,溶于40 ml去离子水,得NaBH4溶液。将阴极电极置于装有Fe3+溶液的锥形瓶中,超声20 min。缓慢滴加NaBH4溶液,使Fe3+还原为铁。最后将制备的复合阴极用去离子水充分漂洗至溶液澄清,并在50℃真空干燥箱中干燥至恒重[13]。
1.3MFC的运行
为提高MFC的产电能力,对阳极生物膜进行驯化,将沼液与培养基依次按2:1、2:1、2:1、1:1、1:1(体积比)的比例混合后添加到MFC的阳极,阴极电极为修饰过的复合阴极。当电池电压下降到50 mV以下时更换阴极液和阳极液,按下一比例驯化,直至电压不再明显升高。随后,将100%新鲜沼液分别接种到未驯化和驯化后的MFC阳极,比较驯化前后MFC的产电情况。
后续以驯化好的阳极进行研究,主要分为4部分讨论,编号为A~D,4部分在同一批电池中进行。除非另有说明,实验的初始条件如1.1节所述,而且阳极均接种100 %新鲜沼液,阴极分别添加不同浓度的TPTC。实验A、B、D同时进行。实验A是为检测MFC对沼液的生物降解情况,分别对MFC运行前后的阳极沼液取样测定其化学需氧量(COD)、总氮含量、总磷含量。实验B是为检测MFC对阴极TPTC的降解情况,分别对TPTC的4个不同浓度(100、200、300、400 µmol·L-1)进行研究,从电池运行0 min开始,每隔2 d取电池阴极液,测定TPTC的浓度。实验C是对MFC的电化学性能进行检测,在更换新鲜阴阳极液后,以阴极未经修饰的MFC为对照,分别测定MFC的极化曲线、功率密度曲线及循环伏安曲线(CV)。实验D是进一步对MFC阴极TPTC的降解效果进行评价,以实验B为基础,以添加相同浓度TPTC的开路MFC为对照,探究初始添加浓度为100 µmol·L-1时TPTC的降解效果。
TPTC的添加方式[14]:称取一定量的TPTC,用少量甲醇溶解,待甲醇挥发尽,在容器底部形成一层薄膜,然后加入阴极液,超声20 min使其充分混合。
1.4反应后TPTC样品的处理
取出待测的电池阴极液(30 ml),用甲醇润洗电池内壁,重复洗2次至HPLC检测不到TPTC,将2次洗液合并,并用甲醇将溶液定容至10 ml(溶液a),进行液相分析。用1 mol·L-1盐酸将阴极液的pH调至2,加入10 ml乙酸乙酯萃取,剧烈振荡使其充分混合,然后静置30 min使其分层,收集上层乙酸乙酯有机相。再加入10 ml乙酸乙酯萃取,重复上述过程,萃取3次,合并3次萃取所得有机相,并加入一定量的无水Na2SO4除去有机相中的水分。在40℃恒温水浴下进行旋转蒸发,将有机相蒸干,最后用甲醇将样品从瓶中洗出,定容至5 ml(溶液b),萃取所得下层液体用去离子水定容至50 ml(溶液c),分别进行高效液相色谱检测。上述3种液体(溶液a、b、c)计算得到的浓度之和为TPTC的浓度[15]。
对照组TPTC剩余率X的计算公式

TPTC去除率Y的计算公式
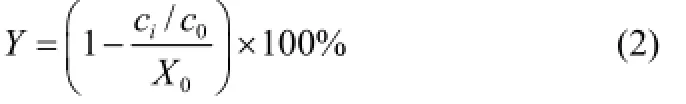
式中,ci为经1.4节所述方法处理后计算得到的TPTC浓度,µmol·L-1;c0为初始添加的TPTC浓度,µmol·L-1;X0为空白组TPTC的剩余率。
1.5检测方法
(1)输出电压U:用数据采集卡每隔2 min记录一次电池两端电压(单位为mV),制成时间-电压曲线图。
(2)化学需氧量(COD)、总氮含量、总磷含量:测定方法分别为重铬酸钾法(GB 11914—89)、碱性过硫酸钾消解紫外分光光度法(HJ 636—2012代替GB 11894—89)、钼酸铵分光光度法(GB 11893—89)。
(3)极化曲线及功率密度曲线:待电池运行稳定后,将其在开路状态下维持数小时或过夜,使输出电压稳定不变,记录此时开路电压值。从大到小改变外电阻阻值(100~0.25 kΩ),在各阻值下运行5~10 min 或更久,使电池电压在1 min内变化少于2 mV,用数据采集卡记录当时的电压值U。根据式(3)计算出电流密度I,根据式(4)计算出功率密度P,制成极化曲线及功率密度曲线。

式中,R为外电阻,变化范围为0.25~100 kΩ;A为阳极有效表面积,该实验中为3 cm2;U为某阻值下的输出电压,mV;I为电流密度,mA·m-2;P为功率密度,mW·m-2。
(4)循环伏安曲线(CV):当电池电压达到最大并趋于稳定时测定。打开电化学工作站(PGSTAT302N,Metrohm)及软件,断开MFC,以铂丝电极作对电极、甘汞电极作参比电极,扫描的电压范围为-1.1~0.4 V,扫描速率为0.005 V·s-1进行扫描。
(5)HPLC法测定TPTC的含量[16]:使用的色谱柱为SinoChrom ODS-BP C18反相色谱柱,样品的紫外检测波长为257 nm,操作温度为25℃,流速为0.6 ml·min-1。进样前样品用0.22 µm微孔滤膜过滤,每次进样量为20 µl。HPLC的流动相的配比为乙腈:冰乙酸:水=65:12:23(体积比),另添加0.05%三乙胺(pH=3.0),流动相在使用前进行超声脱气处理。
2 实验结果与讨论
2.1生物膜的驯化
产电微生物通过降解代谢有机质产生电子并随外电路流入阴极,因此对生物膜进行驯化以提高MFC的产电能力是降解污染物的首要条件,而且本研究所用沼液经过了厌氧产沼气发酵,有机质总量已有部分降解,属于低强度废水,需驯化以提高产电菌的活性。图1显示在驯化第1次周期中MFC产电较低,最高电压约为64.4 mV。在之后的驯化过程中电池的最高电压逐渐增加,达到最高电压所需的时间越来越少,表明沼液中的产电菌开始富集,逐步形成生物膜[17-18],能较快利用沼液中的营养成分产电。到驯化第5周期,电池电压维持稳定,从而结束驯化。该驯化过程中未添加活性污泥等外源菌株,简化了电池的驯化和启动过程。
从图2可以看到,驯化前后MFC产电的总体变化趋势一致,但驯化后的MFC最高电压为280.2 mV,较驯化前(最高电压为186.4 mV)提高了50.32%;而且电压在150~280.2 mV范围内维持了236.64 h,约是驯化前(118.08 h)的2倍。MFC的阳极直接参与氧化反应,吸附在电极表面的产电菌细胞密度越大,产电量越高[19-20],而阳极生物膜经过驯化后产电菌富集吸附在电极上,反应产生大量电子,所以产电性能得到较大提高。
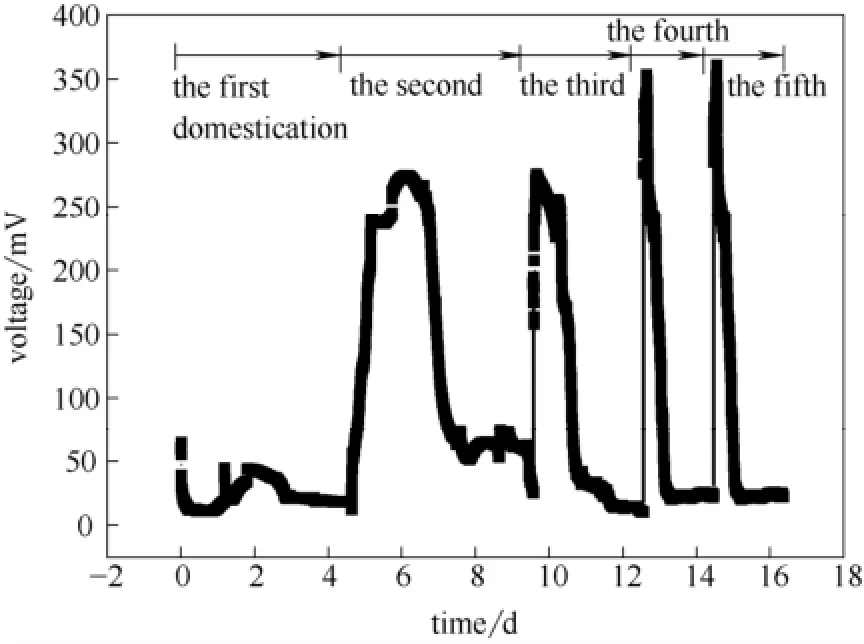
图1 MFC产电的驯化过程Fig.1 Domestication process of electricity generation

图2 驯化前后MFC产电的对比Fig.2 Comparison of voltages before and after domestication
2.2沼液中COD、N、P的去除情况
以沼液作为阳极接种物,待MFC电压降至50 mV以下时,对阳极室中的沼液进行取样检测,观察电池运行前后沼液中COD、总氮、总磷的变化(表1)。MFC运行结束后,COD、总氮、总磷的去除率分别为85.35%±1.53%、59.20%±5.24%、44.98%± 3.57%。隋倩雯等[21]利用氨吹脱工艺对猪场沼液进行处理,通过对初始氨氮浓度、pH、气液比、温度等参数的优化,氨氮和总磷的最高去除率分别达81.84%和97.44%,但COD去除率仅为30.13%,而且该工艺能耗较大;马焕春等[22]研究了电化学法处理沼液的效果,通过对极电压、反应时间、极板间距、初始pH及不同电化学反应条件进行优化,COD和总磷的最优去除率分别达59%和46.58%,但因需外接电源,同样增大了能耗。在本研究中,MFC阳极的产电菌产电会消耗沼液提供的有机质底物及其他营养物质。传统的生物脱氮主要通过微生物的硝化和反硝化作用完成,硝化菌在好氧条件下将氨氮转化为硝态氮,再在厌氧条件下将硝态氮还原成气态氮(N2)或N2O、NO;生物除磷主要是通过好氧和厌氧条件下的聚磷菌摄磷和放磷作用完成[8]。本实验由于MFC阳极处于厌氧状态,可能主要依靠沼液中的相关厌氧微生物生长繁殖或反硝化聚磷菌[23-24]的作用消耗氮、磷,因此对总氮、总磷的去除能力一般。但该系统对COD降解效果较好,证明了MFC同步产电除污的可行性。

表1 R反应前后沼液中COD、总氮、总磷的含量变化Table 1 COD, Total N and Total P changes in biogas slurry before and after reaction
2.3阴极TPTC降解潜力分析
TPTC在水中溶解度较低,因此考察了阴极对不同浓度的TPTC的降解效率。如图3所示,在前5 d中TPTC去除率变化较慢,之后去除速度明显加快,添加100 µmol·L-1TPTC的MFC在14 d后已检测不到TPTC。这可能是因为实验初始MFC产生的电压较低,传递到阴极的电子较少,从而生成的H2O2浓度较低,由Fenton反应形成的·OH浓度较低,因此TPTC降解较慢,而当电压上升后·OH浓度随之增加,TPTC去除率变化明显加快。从图3还可以看到,随着TPTC初始浓度的增加,最终TPTC去除的时间从10 d增加到20 d。这表明TPTC的初始添加浓度对其去除效果有较大影响,正如Tao等[25]利用BES-Fenton系统降解对硝基苯酚时降解率随其初始浓度增加而减小。因此,通过对降解效果的研究,TPTC的最佳初始浓度为100 µmol·L-1。

图3 不同初始浓度的TPTC去除率的比较Fig.3 Comparison of TPTC removal efficiency with different initial concentrations
2.4电化学性能的测定
为形成阴极Fenton反应,按1.2节所述利用FeCl3·6H2O和NaBH4反应对阴极电极进行修饰。记阴极未经修饰的对照MFC为MFC-1,复合阴极MFC为MFC-2。图4显示了MFC-1和MFC-2的极化曲线及功率密度曲线。与MFC-1相比,MFC-2的开路电压(open-circuit voltage,OCV)、输出电压U和功率密度P更高。MFC-2的开路电压为610 mV,比MFC-1(OCV=425 mV)高43.53%。而且MFC-2产生的最大功率密度为145.62 mW·m-2,比MFC-1(28.16 mW·m-2)高417.12%,此时对应的MFC-2的电流密度为899.44 mA·m-2,电压为161.9 mV。这说明阴极电极经修饰后对产电有一定的促进作用[26]。此外,从极化曲线还可以得到MFC-2的内阻约为0.6 kΩ。本研究的产电效果不低于其他类似的研究,如Wang等[27]利用阴极Fenton反应降解亚砷酸盐,使用有效容积为75 ml、电极大小为4.4 cm×4.4 cm的MFC,产生的电流密度为0.563 A·m-2,最大功率密度达135.3 mW·m-2。但本实验中MFC初始电压上升较慢,后续将就迅速提高MFC电压输出进行相关研究。
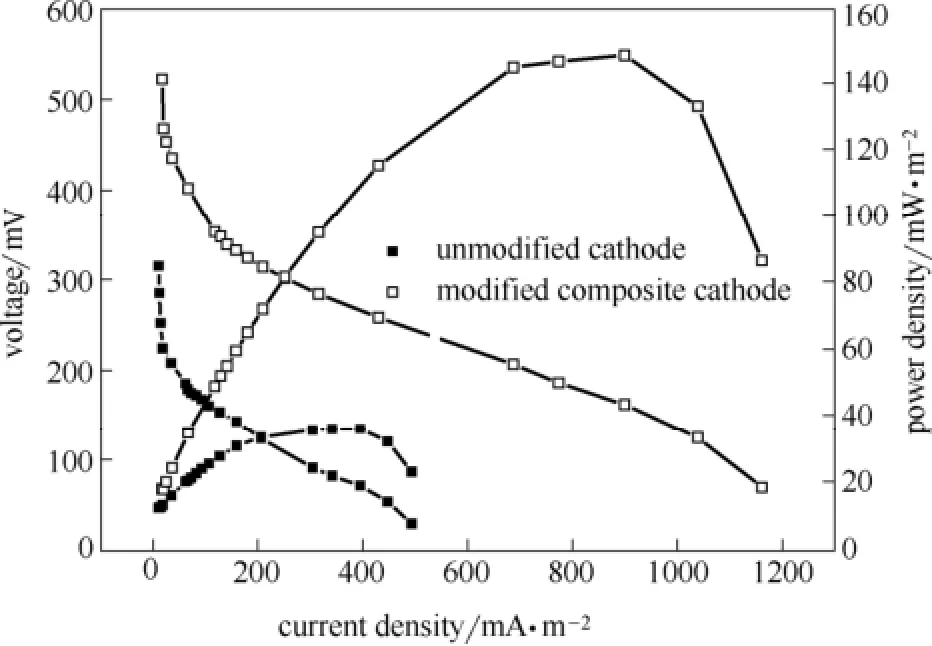
图4 MFC-1和MFC-2的极化曲线和功率密度曲线Fig.4 Polarization and power density curves of MFC-1 and MFC-2
从CV结果(图5)可以看到,在-1.1~0.4 V扫描范围内,MFC-2在-0.363 V、-0.022 V(氧化)和-0.278 V、-0.537 V(还原)处有2对明显的氧化还原峰,说明了MFC-2中电化学活性介体的存在。这2对氧化还原峰是在复合阴极上通过两电子还原溶解氧生成H2O2产生的,而在MFC-1中没有观察到相应的峰,表明这两个电极上过电位的差异,电极经修饰后促进了两电子的氧气还原反应,导致较大的电流响应,氧气还原反应在修饰过的复合阴极上更易发生[28]。
2.5MFC阴极TPTC的降解
记开路的空白MFC为MFC-3,闭路MFC为MFC-4,而且阴极均添加100 µmol·L-1TPTC。当电压降至低于50 mV时,MFC-3和MFC-4同时运行结束,将2组电池的阴极液按1.4节所述方法处理,分别进行液相分析。据式(1)计算得MFC-3的TPTC的剩余率为91.88%,而MFC-4在运行14天后已检测不到TPTC。据式(2)得MFC-4的TPTC的去除率约为91.88%,降解速率约为0.273 µmol·L-1·h-1。
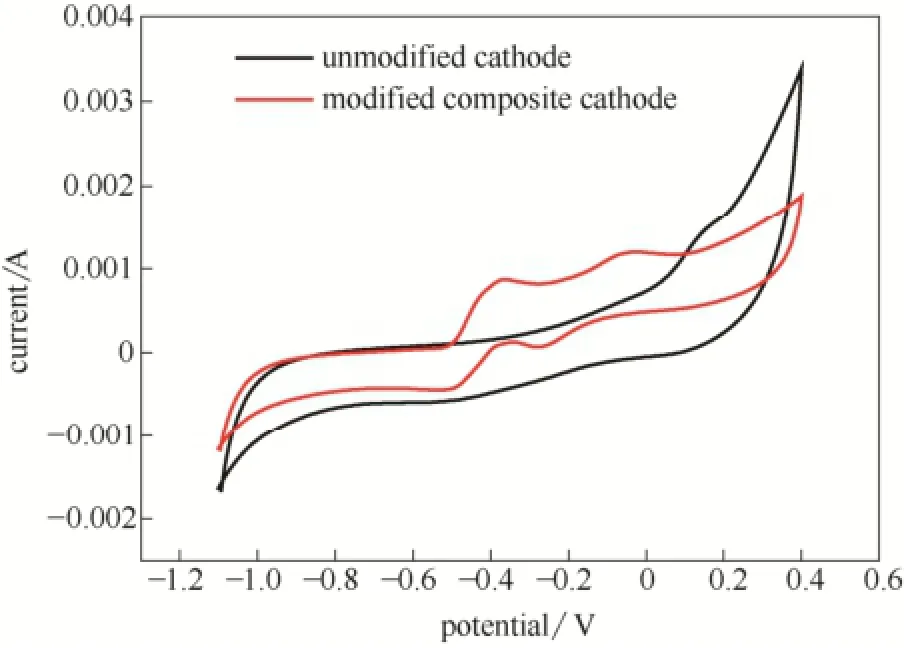
图5 扫描速率为5 mV·s-1时未修饰阴极和复合阴极MFC的CV曲线Fig.5 Cyclic voltammetrys of MFCs with unmodified and modified electrodes at a scan rate of 5 mV·s-1
有机锡化合物因具有化学稳定性高、抗水解以及延迟催化活性等特点,在生产生活中应用广泛,也因此对环境造成了严重污染。目前,有机锡降解的方法有化学法[29]、紫外催化降解法[30]、微生物法[31],主要是键发生断裂、锡原子上连接的有机基团逐步脱去的过程,即R4Sn→R3SnX→R2SnX2→RSnX3→SnX4。由于化学法和紫外催化降解法对化学品和能量的要求使成本较大,目前众多科研都致力于微生物法降解有机锡的研究。但由于TPTC结构复杂且在水中溶解度较低,单纯的微生物降解性能并不理想,需额外添加表面活性剂或其他有机锡分解因子使TPTC乳化,从而降低其表面张力,增强与微生物的亲和力[32]。据报道,Soderquist等[33]利用光催化作用降解三苯基锡,其降解率达97.4%,但降解速率非常慢,仅为0.003 µmol·L-1·h-1;Ye等[34]利用Brevibacillus brevis降解0.5 mg·L-1三苯基锡,5 d后去除率达60%,溶液中相关金属离子浓度增加后去除率提高了15%~25%,可得降解速率约为0.009 µmol·L-1·h-1。本研究采用MFC阴极Fenton反应降解TPTC,·OH的强氧化能力使降解速率大大提高。该方法为有效降解有机锡化合物提供了一种新思路。后续将致力于研究该方法降解TPTC的具体过程,对TPTC的降解产物进行分析,并进一步提高TPTC的降解速率。
3 结 论
(1)实验研究了生物膜驯化前后MFC产电的变化。结果表明,驯化之后MFC的最高电压提高了50.32%,而且电压在150~280.2 mV范围内维持的时间延长了1倍。
(2)MFC产电的同时对阳极沼液有降解效果,其COD、总氮、总磷去除率分别达85.35%±1.53%、59.20%±5.24%、44.98%±3.57%。
(3)当MFC以沼液为阳极接种物、O2为阴极电子受体、外接2 kΩ电阻时,最高输出电压为280.2 mV,内阻约为0.6 kΩ,最大功率密度为145.62 mW·m-2。
(4)利用MFC产电激活阴极Fenton反应可以降解TPTC,当TPTC添加浓度为100 µmol·L-1时14 d后完全降解,降解速率约为0.273 µmol·L-1·h-1。
References
[1]LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells: methodology and technology [J]. Environmental Science & Technology, 2006, 40 (17): 5181-5192. DOI: 10.1021/es0605016.
[2]YONG X Y, FENG J, CHEN Y L, et al. Enhancement of bioelectricity generation by cofactor manipulation in microbial fuel cell [J]. Biosens. Bioelectron., 2014, 56: 19-25. DOI: 10.1016/ j.bios.2013.12.058.
[3]YONG X Y, SHI D Y, CHEN Y L, et al. Enhancement of bioelectricity generation by manipulation of the electron shuttles synthesis pathway in microbial fuel cells [J]. Bioresource Technology, 2014, 152: 220-224. DOI: 10.1016/j.biortech.2013.10.086.
[4]SHEN H B, YONG X Y, CHEN Y L, et al. Enhanced bioelectricity generation by improving pyocyanin production and membrane permeability through sophorolipid addition in Pseudomonas aeruginosa-inoculated microbial fuel cells [J]. Bioresource Technology, 2014, 167: 490-494. DOI: 10.1016/j.biortech.2014.05.093.
[5]王维大, 李浩然, 冯雅丽, 等. 微生物燃料电池的研究应用进展[J]. 化工进展, 2014, 33 (5): 1067-1076. DOI: 10.3969/j.issn.1000-6613.2014.05.001. WANG W D, LI H R, FENG Y L, et al. Research and application advances in microbial fuel cell [J]. Chemical Industry and Engineering Progress, 2014, 33 (5): 1067-1076. DOI: 10.3969/ j.issn.1000-6613.2014.05.001.
[6]刘晶晶, 孙永明, 孔晓英, 等. 微生物燃料电池中底物的研究进展[J]. 环境科学与技术, 2011, 34 (6): 104-108. DOI: 10.3969/ j.issn.1003-6504.2011.06.023. LIU J J, SUN Y M, KONG X Y, et al. Research advance on substrates in microbial fuel cells [J]. Environmental Science & Technology, 2011,34 (6): 104-108. DOI: 10.3969/j.issn.1003-6504.2011.06.023.
[7]PANT D, VAN BOGAERT G, DIELS L, et al. A review of the substrates used in microbial fuel cells (MFCs) for sustainable energy production [J]. Bioresource Technology, 2010, 101 (6): 1533-1543.DOI: 10.1016/j.biortech.2009.10.017.
[8]曹琳, 雍晓雨, 周俊, 等. 以沼液为原料的微生物燃料电池产电降解特性 [J]. 化工学报, 2014, 65 (5): 1900-1905. DOI: 10.3969/ j.issn.0438-1157.2014.05.049. CAO L, YONG X Y, ZHOU J, et al. Electrical and degradation characteristics of microbial fuel cell using biogas slurry as substrate[J]. CIESC Journal, 2014, 65 (5): 1900-1905. DOI: 10.3969/j.issn.0438-1157.2014.05.049.
[9]夏大平, 王振, 苏现波, 等. 生物甲烷气实验的外加菌源(沼液)中厌氧菌群测定 [J]. 高校地质学报, 2015, 21 (1): 168-171. DOI:10.16108/j.issn.l006-7493.2014057. XIA D P, WANG Z, SU X B, et al. Determination of anaerobic bacterial consortia in added microbial sources (biogas slurry) for biogenic methane experiment [J]. Geological Journal of China Universities,2015, 21 (1): 168-171. DOI: 10.16108/j.issn.l006-7493.2014057.
[10]NEYENS E, BAEYENS J. A review of classic Fenton's peroxidation as an advanced oxidation technique [J]. Journal of Hazardous Materials,2003, 98 (1/2/3): 33-50. DOI: 10.1016/S0304-3894(02)00282-0.
[11]PERA-TITUS M, GARCÍA-MOLINA V, BAÑOS M A, et al. Degradation of chlorophenols by means of advanced oxidation processes: a general review [J]. Applied Catalysis B: Environmental,2004, 47 (4): 219-256. DOI: 10.1016/j.apcatb.2003.09.010.
[12]蒋胜韬, 祝建中, 管玉江, 等. 非均相类Fenton 法降解硝基苯化工废水的效能及其机制 [J]. 化工学报, 2014, 65 (4): 1488-1494. DOI: 10.3969/j.issn.0438-1157.2014.04.045. JIANG S T, ZHU J Z, GUAN Y J, et al. Performance of heterogeneous Fenton-like system for degradation of nitrobenzenecontaining wastewater [J]. CIESC Journal, 2014, 65 (4): 1488-1494. DOI: 10.3969/j.issn.0438-1157.2014.04.045.
[13]LI J P, AI Z H, ZHANG L Z. Design of a neutral electro-Fenton system with Fe@Fe2O3/ACF composite cathode for wastewater treatment [J]. J. Hazard. Mater., 2009, 164 (1): 18-25. DOI:10.1016/j.jhazmat.2008.07.109.
[14]GRAUPERA E, LEAL C, GRANADOS M, et al. Determination of tributyltin and triphenyltin in sediments by liquid chromatography with fluorimetric detection assessment of spiking procedures [J]. J. Chromatogr. A, 1999, 846 (1/2): 413-423. DOI: 10.1016/S0021-9673(98)01033-4.
[15]晏云鹏, 全学军, 葛淑萍, 等. 垃圾渗滤液生化出水絮凝-纳滤处理及过程机理 [J]. 化工学报, 2015, 66 (6): 2280-2287. DOI:10.11949/ j.issn. 0438-1157. 20150099. YAN Y P, QUAN X J, GE S P, et al. Flocculation-nanofiltration treatment of biologically treated leachate and process mechanism [J]. CIESC Journal, 2015, 66 (6): 2280-2287. DOI: 10.11949/ j.issn. 0438-1157. 20150099.
[16]于振花, 荆淼, 王小如, 等. 液液萃取-高效液相色谱-电感耦合等离子体质谱同时测定海水中的多种有机锡 [J]. 光谱学与光谱分析,2009, 29 (10): 2855-2859. DOI: 10.3964/j.issn.1000-0593(2009)10-2855-05. YU Z H, JING M, WANG X R, et al. Simultaneous determination of multi-organotin compounds in seawater by liquid-liquid extraction-high performance liquid chromatography-inductively coupled plasma mass spectrometry [J]. Spectroscopy and Spectral Analysis, 2009, 29 (10):2855-2859. DOI: 10.3964/j.issn.1000-0593(2009)10-2855-05.
[17] REGUERA G, NEVIN K P, NICOLL J S, et al. Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells [J]. Appl. Environ. Microbiol., 2006, 72 (11):7345-7348. DOI: 10.1128/AEM.01444-06.
[18]LEDEZMA P, GREENMAM J, IEROPOULOS I. Maximising electricity production by controlling the biofilm specific growth rate in microbial fuel cells [J]. Bioresource Technology, 2012, 118:615-618. DOI: 10.1016/j.biortech.2012.05.054.
[19]孟瑶, 付玉彬, 梁生康, 等. 石油污染物对海底微生物燃料电池性能的影响及加速降解效应 [J]. 环境科学, 2015, 36 (8): 3080-3085. DOI: 10.13227/j.hjkx.2015.08.048. MENG Y, FU Y B, LIANG S K, et al. Effects of oil pollutants on the performance of marine benthonic microbial fuel cells and its acceleration of degradation [J]. Environmental Science, 2015, 36 (8):3080-3085. DOI: 10.13227/j.hjkx.2015.08.048.
[20]KANG C S, EAKTASANG N, KWON D Y, et al. Enhanced current production by Desulfovibrio desulfuricans biofilm in a mediator-less microbial fuel cell [J]. Bioresource Technology, 2014, 165: 27-30. DOI: 10.1016/j.biortech.2014.03.148.
[21]隋倩雯, 董红敏, 朱志平, 等. 提高猪场沼液净化处理效果的氨吹脱控制参数 [J]. 农业工程学报, 2012, 28 (11): 205-211. DOI:10.3969/j.issn.1002-6819.2012.11.033. SUI Q W, DONG H M, ZHU Z P, et al. Ammonia stripping control parameters for improving effluent treatment effect in anaerobic digesters of piggery wastewater [J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28 (11): 205-211. DOI:10.3969/j.issn.1002-6819.2012.11.033.
[22]马焕春, 陈玉成, 陈瑶. 电化学法预处理沼液的研究 [J]. 中国沼气, 2014, 32 (2): 26-29. DOI: 10.3969/j.issn.1000-1166.2014.02.007. MA H C, CHEN Y C, CHEN Y. Pretreatment of biogas slurry by electrochemical process [J]. China Biogas, 2014, 32 (2): 26-29. DOI:10.3969/j.issn.1000-1166.2014.02.007.
[23]余鸿婷, 李敏. 反硝化聚磷菌的脱氮除磷机制及其在废水处理中的应用 [J]. 微生物学报, 2015, 55 (3): 264-272. DOI: 10.13343/ j.cnki.wsxb.20140329. YU H T, LI M. Denitrifying and phosphorus accumulating mechanisms of denitrifying phosphorus accumulating organisms(DPAOs) for wastewater treatment—a review [J]. Acta Microbiologica Sinica, 2015, 55 (3): 264-272. DOI: 10.13343/j.cnki.wsxb.20140329.
[24]王聪, 王淑莹, 张淼, 等. 多因素对反硝化除磷过程中COD、N 和P 的去除分析 [J]. 化工学报, 2015, 66 (4): 1467-1475. DOI:10.11949/j.issn.0438-1157.20141549. WANG C, WANG S Y, ZHANG M, et al. Analysis of COD, N and P in denitrifying phosphorus removal under multivariate condition [J]. CIESC Journal, 2015, 66 (4): 1467-1475. DOI: 10.11949/j.issn.0438-1157.20141549.
[25]TAO H C, WEI X Y, ZHUANG L J, et al. Degradation of p-nitrophenol in a BES-Fenton system based on limonite [J]. Journal of Hazardous Materials, 2013, 254: 236-241. DOI: 10.1016/ j.jhazmat.2013.03.061.
[26] ZHUANG L, ZHOU S G, LI Y T, et al. In situ Fenton-enhanced cathodic reaction for sustainable increased electricity generation in microbial fuel cells [J]. Journal of Power Sources, 2010, 195 (5):1379-1382. DOI: 10.1016/j.jpowsour.2009.09.011.
[27]WANG X Q, LIU C P, YUAN Y, et al. Arsenite oxidation and removal driven by a bio-electro-Fenton process under neutral pH conditions [J]. Journal of Hazardous Materials, 2014, 275: 200-209. DOI: 10.1016/j.jhazmat.2014.05.003.
[28]LI Y, LU A H, DING H R, et al. Microbial fuel cells using naturalpyrrhotite as the cathodic heterogeneous Fenton catalyst towards the degradation of biorefractory organics in landfill leachate [J]. Electrochemistry Communications, 2010, 12 (7): 944-947. DOI:10.1016/j.elecom.2010.04.027.
[29]STANG P M, LEE R F, SELLGMAN P F. Evidence for rapid,nonbiological degradation of tributyltin compounds in autoclaved and heat-treated fine-grained sediments [J]. Environmental Science and Technology, 1992, 26 (7): 1382-1387. DOI: 10.1021/es00031a016.
[30] HOCH M. Organotin compounds in the environment: an overview [J]. Applied Geochemistry, 2001, 16 (7): 719-743. DOI: 10.1016/S0883-2927(00)00067-6.
[31] SUN G X, ZHOU W Q, ZHONG J J. Organotin decomposition by pyochelin, secreted by Pseudomonas aeruginosa even in an iron-sufficient environment [J]. Appl. Environ. Microbiol., 2006, 72 (9):6411-6413. DOI: 10.1128/AEM.00957-06.
[32]HUANG J, YE J S, MA J W, et al. Triphenyltin biosorption,dephenylation pathway and cellular responses during triphenyltin biodegradation by Bacillus thuringiensis and tea saponin [J]. Chemical Engineering Journal, 2014, 249:167-173. DOI: 10.1016/j.cej.2014.03.110.
[33]SODERQUIST C J, CROSBY D G. Degradation of triphenyltin hydroxide in water [J]. J. Agric. Food Chem., 1980, 28 (1): 111-117. DOI: 10.1021/jf60227a015.
[34]YE J S, YIN H, PENG H, et al. Biosorption and biodegradation of triphenyltin by Brevibacillus brevis [J]. Bioresource Technology, 2013,129: 236-241. DOI: 10.1016/j.biortech.2012.11.076.
Synchronously degradation of biogas slurry and triphenyltin chloride in microbial fuel cell
GU Dongyan1,2, JIA Honghua1,2, WU Yuandong1,2, ZHOU Jun1,2, WU Xiayuan1,2,ZHENG Tao3, YONG Xiaoyu1,2
(1School of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816, Jiangsu, China;2Bioenergy Research Institute, Nanjing Tech University, Nanjing 211816, Jiangsu, China;3Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China)
As a novel electrochemical apparatus for synchronous electricity generation and decontamination,microbial fuel cell (MFC) provides a way to effectively deal with the refractory pollutant. A new method of electricity production by anodic biogas slurry coupling with cathodic triphenyltin chloride degradation was proposed based on the cathodic “Fenton” reaction in a typical dual-chamber MFC. The results showed that the maximum voltage was 50.32% higher and the stable time of the voltage was 2 times longer after biofilms domestication. In the end of the operation, the removal efficiency of COD, Total N and Total P of the biogas slurry were 85.35%±1.53%, 59.20%±5.24% and 44.98%±3.57%, respectively. Besides, the triphenyltin chloride(TPTC) degradation efficiency decreased with increasing initial concentration. In addition, when 100 µmol·L-1TPTC was added to the cathodic chamber, the highest output voltage and the maximum power density of the MFC arrived at 280.2 mV and 145.62 mW·m-2, respectively. TPTC was removed after 14 d with the degradation of 91.88% and a rate of about 0.273 µmol·L-1·h-1. This study provided the foundational supports for simultaneously decomposing anodic organic effluent and cathodic organic pollution by MFC.
date: 2015-10-09.
YONG Xiaoyu, yongxiaoyu@njtech.edu.cn
supported by the National Basic Research Program of China (2013CB733904), the Natural Science Foundation of Jiangsu Province (BK20130932), the Natural Science Foundation of the Jiangsu Higher Education Institutions (13KJB530009) and the Special Research Fund Project of Key Laboratory of Environmental and Applied Microbiology of CAS (KLEAMCAS201503).
microbial fuel cell; electricity generation; degradation; biogas slurry; triphenyltin chloride;electrochemistry; bioprocess
TM 911.45
A
0438—1157(2016)05—2056—08
2015-10-09收到初稿,2015-11-18收到修改稿。
联系人:雍晓雨。第一作者:顾冬燕(1990—),女,硕士研究生。
国家重点基础研究发展计划项目(2013CB733904);江苏省自然科学基金项目(BK20130932);江苏省高校自然科学研究项目(13KJB530009);中国科学院环境与应用微生物重点实验室专项研究基金计划(KLEAMCAS201503)。
