基于ITS2序列的荆芥及其混伪品的DNA条形码鉴定
2016-08-22周建国邬兰马双姣石林春金钺姚辉
周建国 邬兰 马双姣 石林春 金钺 姚辉
基于ITS2序列的荆芥及其混伪品的DNA条形码鉴定
周建国 邬兰 马双姣 石林春 金钺 姚辉
目的 通过分析裂叶荆芥及其混伪品的ITS2条形码序列,探索鉴定荆芥、荆芥穗及其混伪品的新方法,以保证荆芥的质量及临床疗效。方法 对裂叶荆芥样品进行DNA提取、PCR扩增ITS2片段和双向测序,所有序列用软件MEGA 6.0进行相关数据分析,对裂叶荆芥及其混伪品间的种间序列差异进行分析比较,计算其种间、种内K2P遗传距离,并构建邻接树。结果 裂叶荆芥ITS2序列长度为232 bp,G+C含量为66.8%,序列高度保守,种内无变异位点。裂叶荆芥与其混伪品种间变异位点较多,种间K2P最小距离为0.0175,大于其种内距离,NJ树显示可以将裂叶荆芥与其混伪品完全分开。结论 ITS2序列可鉴别荆芥、荆芥穗及其混伪品,为荆芥的种质资源鉴定和保证临床用药安全提供了良好的技术手段。
荆芥; ITS2序列; 鉴定; DNA条形码; 混伪品
荆芥为中国传统中药材,《中华人民共和国药典》(一部)记载其来源为唇形科植物荆芥Schizonepeta tenuifolia Briq.的干燥地上部分,具有解表散风,透疹,消疮的功效,常用于感冒、头痛、麻疹等症[1]。该物种在《Flora of China》收录为裂叶荆芥Nepeta tenuifolia Benth.。临床应用中,荆芥药材混伪品主要为同属多裂叶荆芥Nepeta multifida L.、荆芥 Nepeta cataria L.、藜科土荆芥 Chenopodium ambrosioides L.。荆芥药材临床多采用栽培品[2],裂叶荆芥(为区别于混伪品荆芥N.cataria L.,下文荆芥、荆芥穗药材基原物种称为裂叶荆芥)靠种子繁殖。据文献资料记载[3],裂叶荆芥子的混伪品主要为车前子,已有学者对二者从药材来源、性状、显微、理化等方面进行了研究[4-6],而在分子鉴定方面仅见邬兰等[7]对裂叶荆芥子和车前子进行了ITS2序列分析。裂叶荆芥的干燥花穗作为荆芥穗入药,其混伪品主要为水荆芥(香薷)Elsholtzia ciliata (Thunb.)Hyland.[8]的干燥花穗。目前,对荆芥药材、荆芥子和荆芥穗及其混伪品的鉴别缺少综合性研究与分析。
DNA条形码技术是利用基因组中相对较短的、标准的DNA片段对物种进行准确鉴定的新方法,具有简便高效的特点,不受样品性状以及研究者的专业水平限制,适用于中药材的真伪鉴定[9-11]。目前,对植物类药材来说,ITS2片段是最具优势的DNA条形码序列之一[12-13],已被《中华人民共和国药典》收录[14-15]。本研究运用ITS2序列对荆芥药材、荆芥子和荆芥穗及其混伪品进行鉴定研究,旨在为该药材的用药安全及种质资源保护等方面提供分子依据。
1 材料与方法
1.1 材料
研究材料包括7个物种60份样品,其中荆芥药材、荆芥子和荆芥穗样品共41个,包括基原植物样本4份、药材样本25份、对照药材样本1份、荆芥子样本11份和复核样本2份,分别来源于陕西秦岭、湖北神农架林区、国家药用植物种质资源库及河北安国药市、安徽亳州药市、日本东京某汉方药店等,复核样本(样本号为YC0176MT07,YC0176MT08)由北京市药品检验所、湖南省食品药品检验研究院进行复核验证,从GenBank上下载的裂叶荆芥序列6条。裂叶荆芥混伪品序列19条,具体样本信息见表1。
1.2 方法
1.2.1 DNA提取 裂叶荆芥干燥叶片及种子样品取样量分别为20 mg和50 mg,种子类的样品研磨后用核分离液[100 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA(pH 8.0),0.7 mmol/L NaCl,2% PVP40,0.4% β-巯基乙醇]洗涤3次,均利用植物DNA提取试剂盒(Bioteke Co.,China)提取DNA,按操作说明进行。叶片样品65℃水浴30分钟,种子类65℃水浴1小时。
1.2.2 PCR扩增及测序 ITS2通常采用引物包括S2F:5′-ATGCGATACTTGGTGTGAAT-3″和 S3R: 5″-GAC GCTTCTCCAGACTACAAT-3′。扩增程序为94℃,5 min;94℃,30 s,56℃,30s,72℃45 s,40个循环;72℃,10 min。PCR反应体积为25 μL,参照Chen等[12]的研究方法。电泳查看PCR扩增情况,PCR扩增产物由中国农业科学院开放实验室进行双向测序。
1.2.3 数据处理 对测序得到的峰图利用CodonCode Aligner V 5.1.5进行比对和拼接,去除引物区,获得严格一致性序列,将实验数据和从GenBank上下载的序列使用基于隐马尔可夫模型HMMer[16]注释方法以获得 ITS2间隔区序列,然后将所有序列用软件Molecular Evolutionary Genetics Analysis 6.0进行分析比对,并基于 Kimura-2-parameter(K2P)双参数模型计算遗传距离,用邻接(NJ)法构建系统分类树。
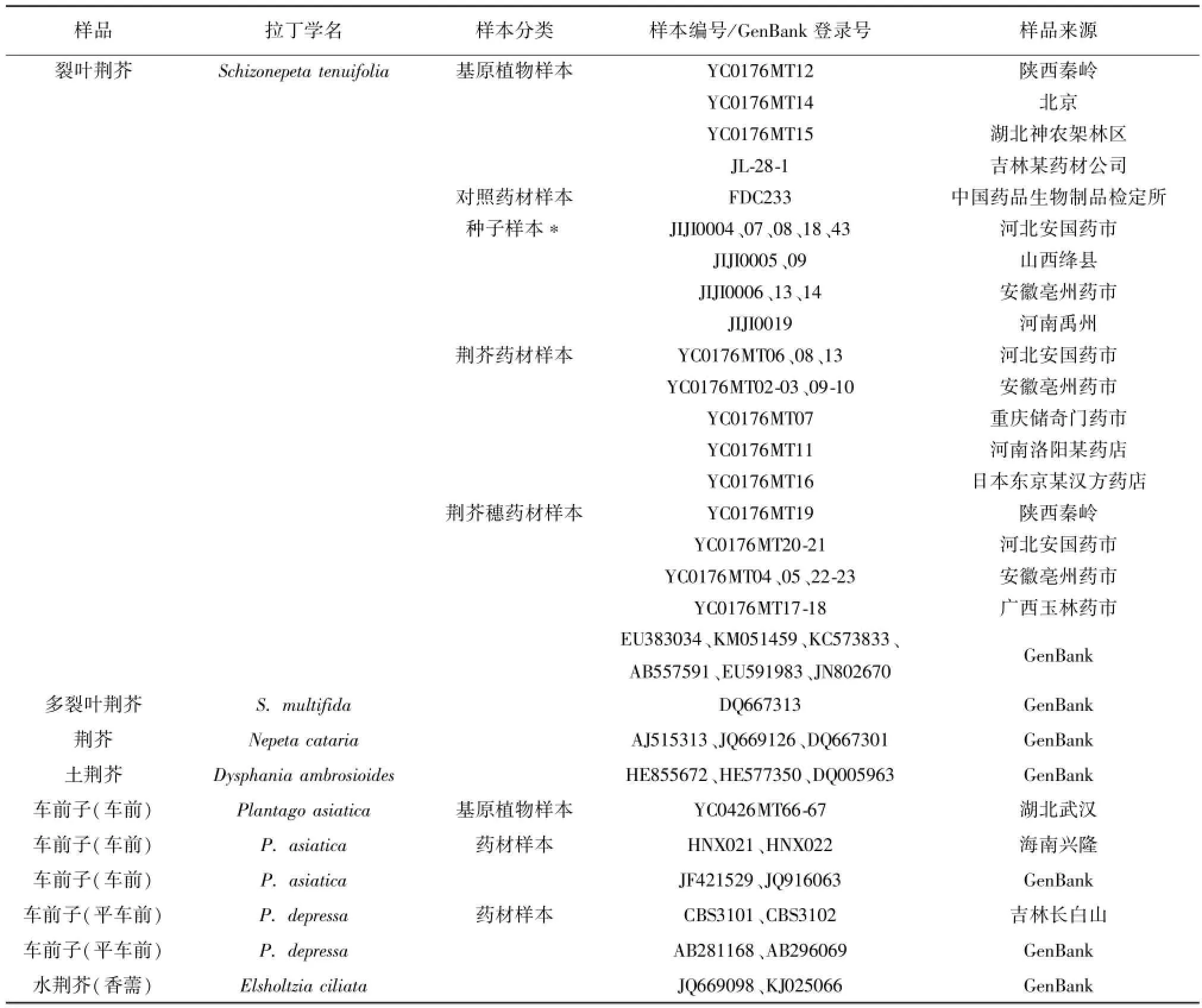
表1 裂叶荆芥及其混伪品的样品信息
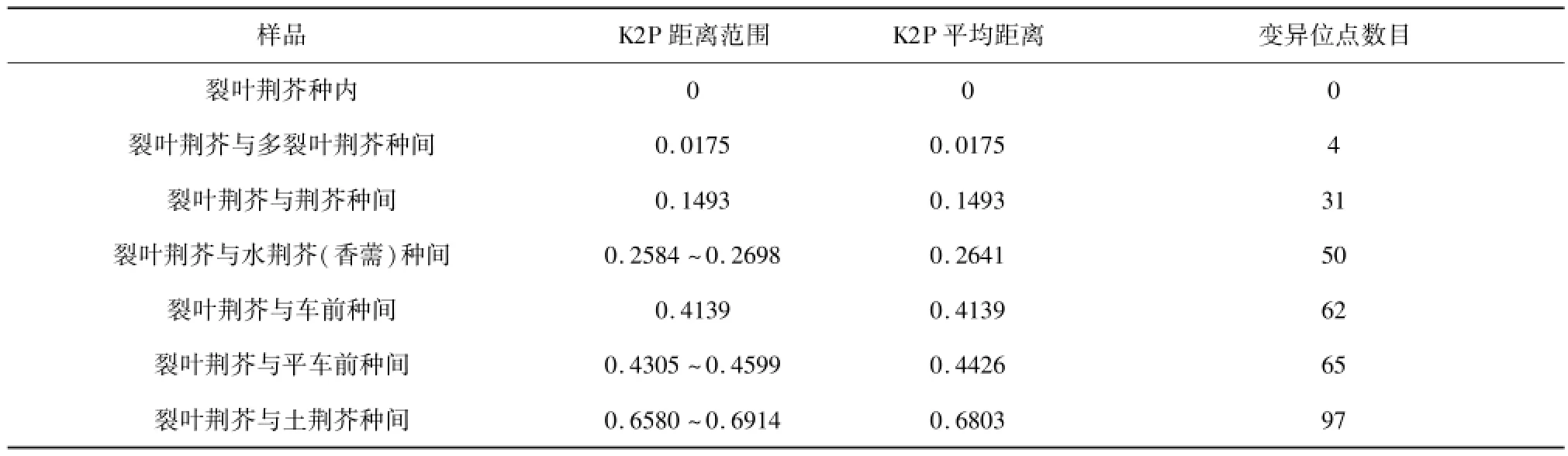
表2 裂叶荆芥及其混伪品ITS2序列种内种间K2P距离计算结果与变异位点数目
2 结果与分析
2.1 裂叶荆芥与其混伪品ITS2序列种内种间变异分析
裂叶荆芥叶片和种子不同来源样品与从GenBank上下载的序列共有41条,序列长度均为232 bp,G+C含量为66.8%,种内无变异位点,K2P遗传距离为0。荆芥样品与其混伪品种间序列进行比对后,长度为281 bp,ITS2序列间变异位点较多,达151个,裂叶荆芥与其混伪品的K2P距离范围为:0.0175~0.6914(见表2)。种间最小K2P距离大于种内K2P距离。
2.2 裂叶荆芥及其混伪品的ITS2序列聚类分析
因为裂叶荆芥种内无变异位点,所以选取其中两条 ITS2序列(样本号:YC0176MT06、YC0176MT19),用MEGA 6.0构建裂叶荆芥及其混伪品NJ系统分类树(图1),从NJ树中可以看出,裂叶荆芥聚为一支,其混伪品各自聚为一支。因此,ITS2条形码序列可将裂叶荆芥及其混伪品很好地区分开来。
3 讨论
3.1 荆芥药材、荆芥子及荆芥穗的DNA提取
荆芥药材、荆芥子和荆芥穗采用DNA提取试剂盒一般都能成功提取其DNA,但荆芥子内含丰富油脂,研磨时易被氧化,而且易粘在离心管壁上,损失较大,提取时应加大样品量,加大聚乙烯吡咯烷酮的使用量,用核分离液洗涤多次,并延长水浴时间。在其他种子类药材DNA提取中也采用类似处理,如凃媛等[17]研究发现天仙子等种子类药材65℃水浴3小时的DNA提取效率较高,宋明等[18]在提取车前子DNA时用核分离液洗涤三次,以56℃水浴8~9小时,可以成功提取其所有样品DNA。
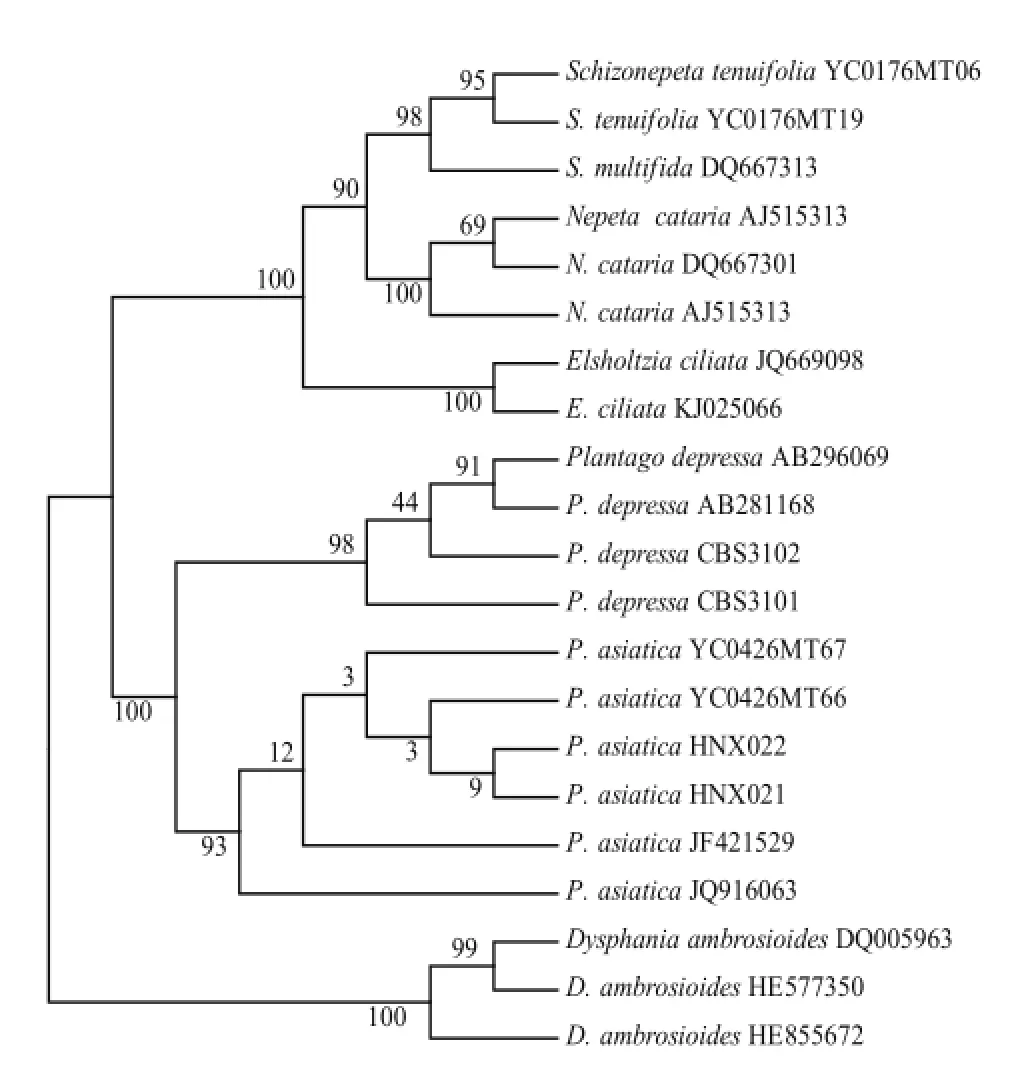
图1 基于ITS2序列构建的裂叶荆芥及其混伪品的NJ树
3.2 应用ITS2条形码鉴定荆芥药材、荆芥子、荆芥穗及其混伪品的稳定性和准确性
辛天怡等[19]指出DNA条形码鉴定稳定性是指不同产地、不同批次的样品均能够稳定地获得DNA条形码序列。本研究从各地收集了荆芥药材、荆芥子、荆芥穗的相关样品共35个,均可稳定获得ITS2序列。所有序列经比对后发现均无变异位点,种内K2P距离为0,说明采用DNA条形码鉴定荆芥具有良好的稳定性。荆芥与其混伪品ITS2序列变异位点较多,种间K2P距离大于种内距离,基于NJ树也可以明显区分荆芥及其混伪品。本研究中荆芥子与其混伪品车前子ITS2序列的研究结果与邬兰等[7]的研究结果一致。因此,应用ITS2条形码鉴定荆芥药材、荆芥子、荆芥穗及其混伪品具有良好的重复性和稳定性。
3.3 DNA条形码分子鉴定在实际工作中的意义
中国是中药资源生物多样性最丰富的国家[20]。由于中医在中国保健事业中的重要地位,大量利用中药已使中国成为自然资源消费的国际大国[21]。所以,中药基原的准确鉴定对资源的可持续利用和临床疗效起着至关重要的作用。荆芥作为解表透疹药在临床上广泛使用,但市场上荆芥质量良莠不齐,存在以次充好、以假乱真的现象,传统生药鉴定方法难以满足现代中药准确鉴定的需求。作为传统鉴定方法的有效补充,中药材DNA条形码分子鉴定指导原则中明确指出,DNA条形码技术通过精密度考察和方法适用性考察,确保鉴定结果稳定、可靠[22]。在对金钱草[23]、砂仁[24]、羌活[19]、大黄[25]、北豆根[26]等药材DNA条形码的分析,验证了ITS2条形码序列用于中药鉴定的稳定性和准确性。利用DNA条形码技术对荆芥药材、荆芥子和荆芥穗进行准确鉴定,有利于保证药材在市场上的流通和监管,有利于保护荆芥种质资源,从源头上保证荆芥药材的质量安全和临床疗效。
致谢
感谢北京市药品检验所、湖南省食品药品检验研究院对部分样品进行复核!
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:232-233.
[2] 高峰.荆芥种质资源评价与种子质量标准研究[D].中国中医科学院,2007:17-25.
[3] 颜承秀,张丹.几种常见种子中药的伪品鉴别[J].吉林中医药,2004,24(6):53.
[4] 陈政威,金朝阳.车前子样品中混伪品来源鉴定[J].时珍国医国药,2001,12(11):1000.
[5] 张洁,荆复礼.车前子及其混伪品的性状与薄层色谱鉴别[J].中药材,1994,17(2):20-21.
[6] 王统康.一阶导数光谱法鉴别车前子与其伪品荆芥子[J].时珍国医国药,1999,10(12):915.
[7] 邬兰,刘义梅,熊永兴,等.基于ITS2序列的车前子原植物及其混伪品的分子鉴定[J].世界科学技术——中医药现代化,2013,15(9):1896-1900.
[8] 李树殿.荆芥与香薷的鉴定[J].特产科学实验,1982,2:5-7,63-64.
[9] Schindel DE,Miller SE.DNA barcoding,a useful tool for taxonomists[J].Nature,2005,435(7038):17.
[10] 陈士林,宋经元,姚辉,等.药用植物DNA条形码鉴定策略及关键技术分析[J].中国天然药物,2009,7(5):322-327.
[11] 陈士林,姚辉,宋经元,等.基于DNA barcoding(条形码)技术的中药材鉴定[J].世界科学技术-中医药现代化,2007,9 (3):7-12.
[12] Chen SL,Yao H,Han JP,et al.Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species[J]. PLoS ONE,2010,5(1):e8613.
[13] Yao H,Song JY,Liu C,et al.Use of ITS2 region as the universal DNA barcode for plants and animals[J].PLoS ONE,2010,5(10):e13102.
[14] 国家药典委员会.中华人民共和国药典(2010年版第三增补本)[M].北京:中国医药科技出版社,2014:92-94.
[15] 国家药典委员会.中华人民共和国药典(2015年版四部)[M].北京:中国医药科技出版社,2015:383-385.
[16] Keller A,Schleicher T,Schultz J,et al.5.8S-28S rRNA interaction and HMM-based ITS2 annotation[J].Gene,2009,430:50-57.
[17] 凃媛,熊超,师玉华,等.细小种子类毒性药材天仙子的DNA条形码鉴定[J].世界科学技术——中医药现代化,2014,16(11):2337-2342.
[18] 宋明,张雅琴,林韵涵,等.基于ITS2和psbA-trnH序列对细小种子类药材车前子的鉴定比较[J].中国中药杂志,2014,39(12):2227-2232.
[19] 辛天怡,姚辉,罗焜,等.羌活药材ITS/ITS2条形码鉴定及其稳定性与准确性研究[J].药学学报,2012,47(8):1098-1105.
[20] 陈士林,苏钢强,邹健强,等.中国中药资源可持续发展体系构建[J].中国中药杂志,2005,30(15):1141-1146.
[21] 肖培根,陈士林.国家中药资源宏观管理系统的建立——中药现代化的基础[J].中国中药杂志,2003,28(1):8-10.
[22] 陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志,2013,38(2):141-148.
[23] 庞晓慧,宋经元,孙超,等.中药金钱草及其混淆品的ITS2序列分析与鉴别[J].环球中医药,2011,4(2):95-98.
[24] 韩建萍,李美妮,石林春,等.砂仁及其混淆品的ITS2序列鉴定[J].环球中医药,2011,4(2):99-102.
[25] 李美妮,韩蕊莲,韩建萍,等.大黄与易混伪品土大黄、虎杖原植物的ITS2序列鉴定[J].环球中医药,2012,5(3):185-189.
[26] Yang P,Li XW,Zhou H,et al.Molecular Identification of Chinese Materia Medica and Its Adulterants Using ITS2 and psbA-trnH Barcodes:A Case Study on Rhizoma Menispermi[J]. Chinese Medicine,2014,5(4):190-198.
(本文编辑:韩虹娟)
Identification of Schizonepeta tenuifolia Briq.and its adulterants based on ITS2 sequence by DNA barcoding method
ZHOU Jian-guo,WU Lan,MA Shuang-jiao,et al.The Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine,Ministry of Education,Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100193,China
YAO Hui,E-mail:scauyaoh@sina.com
Objective This study aimed to explore a new method to identify the original plant of Schizonepeta tenuifolia Briq.and its adulterants by the ITS2 sequence,and assure its quality and clinical curative effect.Methods Genomic DNA of S.tenuifolia were extracted and then the ITS2 sequences were obtained by direct PCR amplification and sequenced bidirectionally.All data of sequences were analyzed by software MEGA 6.0,the Kimura 2-Parameter(K2P)distances were calculated,and the phylogenetic tree was constructed by the neighbor joining(NJ)method.Results The sequence length of the ITS2 of Schizonepeta tenuifolia was 232bp,and the G+C content was 66.8%.The intra-specific variation was highly conservative.There were many variation sites of ITS2 sequences between Schizonepeta tenuifolia Briq.and its adulterants.The results showed that the minimum inter-specific divergence was 0.0175,which was larger than the maximum intra-specific divergence.The NJ tree indicated that Schizonepeta tenuifolia could be distinguished from its adulterants obviously.Conclusion The ITS2 region can be used as a barcode for identification of Schizonepeta tenuifolia Briq.,which provide a new technique for the authentication of germplasm resouces and ensure clinical safety in utilization of traditional Chinese medicine.
Schizonepeta tenuifolia Briq; ITS2 sequence; Identification; DNA barcoding;Adulterants
重大新药创制国家科技重大专项(2014ZX09304307001);国家科技支撑计划(2011BAI07B08)
100193 中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室[周建国(硕士研究生)、马双姣(硕士研究生)、石林春、金钺、姚辉];中国中医科学院中药研究所[邬兰(博士研究生)]
周建国(1993-),2015级在读硕士研究生。研究方向:中药资源与分子鉴定。E-mail:1312905813 @qq.com
姚辉(1976-),博士,研究员。研究方向:中药资源学。E-mail:scauyaoh@sina.com
R282.5
A doi:10.3969/j.issn.1674-1749.2016.08.005
(2016-03-01)
