缺氧诱导因子在肝病和肝细胞癌发病及治疗中的作用:现状及展望
2016-08-15范晔于乐成
范晔 于乐成
缺氧诱导因子在肝病和肝细胞癌发病及治疗中的作用:现状及展望
范晔于乐成
缺氧诱导因子(hypoxia inducible factors,HIFs)是一种转录因子,能活化调节细胞代谢、血管生成、增殖和迁移的不同信号通路,使细胞能够对低氧或缺氧环境做出应答。HIFs受到氧依赖性和非氧依赖性信号的调节,包括线粒体功能障碍、活性氧基团(reactive oxygen species,ROS)、内质网应激(endoplasmic reticular stress,ERS)和病毒感染等。已发现HIFs在多种肝病的发病机制中起作用。本文论述了HIFs对肝细胞生物学和炎症应答的影响,以及靶向于HIFs的治疗策略对多种肝病的潜在治疗价值[1]。
一、肝脏的组织结构和生理性氧梯度
氧是所有活细胞存活所必需的。氧通过脉管系统运行周身,受代谢需求以及组织或器官功能状态的调节。肝脏具有独特的结构和功能,从而影响其生理学和氧平衡:通过肝动脉接受氧含量高的血液,而肝门静脉中的血液氧含量很低。流向肝小叶中央静脉的定向血流建立了一种生理性氧梯度,导致氧分压(PaO2)在门静脉周围区域是60~65 mmHg(8%),在肝实质静脉周围区域则为30~35 mmHg(4%)。这种氧梯度与肝实质各区带的功能差异和结构异质性密切相关(图1)。“氧含量正常(normoxia)”和“缺氧(hypoxia)”等相关术语的定义取决于相应器官所暴露的正常氧张力。必须指出的是,尽管肝内存在不同的氧张力,但在正常健康肝脏中并未观察到缺氧反应。而在病毒性肝炎、代谢紊乱、脂肪性肝炎、炎症和癌变期间发生的适度的氧张力变化,足以诱发缺氧应答以稳定HIFs。
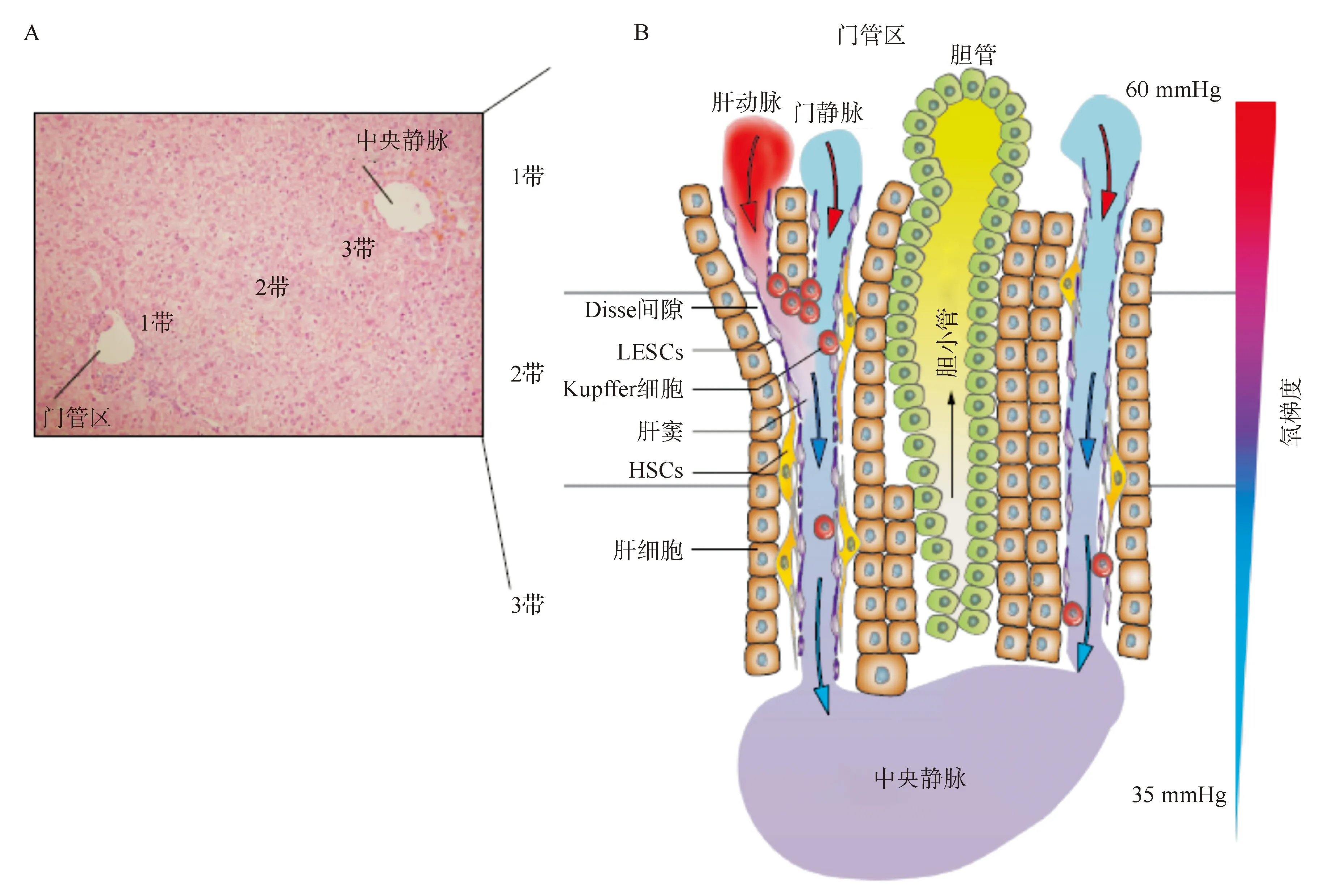
A:肝小叶(苏木精和伊红染色)被分为三个区带,从汇管区延伸至小叶中央静脉。B:血液经肝动脉和门静脉进入肝脏(1带/门静脉周围区),通过肝窦流经肝小叶,血液含有丰富的氧气和营养物质;当血液到达3带(中央静脉周围区),氧气和营养物质被消耗。1带:门脉周围区。2带:中间区。3带:中央静脉周围区。LESCs:肝窦内皮细胞。HSCs:肝脏星状细胞。
图1肝脏的组织结构和氧梯度
二、HIFs的调节
(一)氧依赖性调节细胞通过协调性转录反应来适应低氧,这种转录受HIFs的调控。HIFs属于“周期节律性蛋白-芳烃受体核转运蛋白-专一蛋白” (period circadian protein-aryl hydrocarbon receptor nuclear translocator-single minded protein,PAS)家族。HIFs可与靶基因中的缺氧应答元件(hypoxia responsive elements,HREs)相结合,从而调控大量信号事件,导致靶基因转录增加或减少。
有三种HIF转录因子,即HIF-1、HIF-2和HIF-3,是由α和β亚基组成的异质性二聚体。α亚基受氧诱导性蛋白降解反应的调控,而β亚基是组成性表达。虽然HIF-α亚基在缺氧时是稳定的,但在正常氧张力下,HIF-α可被含有脯氨酰羟化酶功能域的蛋白质(prolyl hydroxylase domain-containing proteins,PHD1-3)对其脯氨酰残基进行羟基化,从而迅速被降解。删除肝脏特异性PHD2,可使HIF-1α稳定表达,而删除PHD3则可稳定HIF-2α,这显示了HIF调控的差异性。羟脯氨酰基残基被von Hippel-Lindau(pVHL)E3泛素连接酶识别, 使得HIF-α亚基多聚泛素化,成为蛋白酶体降解的靶点(图2)。缺氧时PHD活性降低,导致HIF-α亚基稳定表达,并通过其N末端和C末端的反式激活域与调控元件结合。HIFs和CREB结合蛋白(CBP)发生关联,形成转录激活因子复合物。随着低氧时间延长,正如在病理状态下所观察到的那样,HIF-1α依赖性反馈回路增加PHD的表达,导致HIF-1α羟基化再激活和降解。因此,HIF-1α的表达可代表对低PaO2的急性应答,而HIF-2α的水平可随缺氧时间延长而增加,从而在慢性缺氧中发挥某种作用。
另一种氧敏感性羟化酶,即因子抑制性HIF(factor inhibiting HIF,FIH)也很重要,可调控HIF-1α的表达。FIH可羟化HIF-1α的C末端反式激活区的一个天冬酰胺残基(在人类为N803),但并不羟化HIF-2α,从而抑制异二聚体HIF-1α结合至其转录共激活因子p300。据报道,虽然PHDs对氧的亲和力较低(体外表观Km为230-250 μM,略高于21% O2),而FIH的Km为90 μM(8%)。这高度提示可被缺氧反式激活的基因具有其识别标志,例如FIH可限制HIF-1α的C末端反式激活区而不是N末端区的活性。通过这种方式,细胞可呈现出双相的HIF-1α依赖性转录特征:中度缺氧时为PHD灭活依赖性型,更严重缺氧时为PHD 和FIH灭活依赖性型。
(二)氧非依赖性调节多种氧非依赖性信号事件和细胞应激可使HIFα亚基在有氧情况下仍能保持稳定,这种表型称为“假性缺氧”(图3)。细胞表面受体,例如G蛋白偶联受体和受体酪氨酸激酶,可促进HIF-1α mRNA的翻译和反式激活活性。在磷脂酰肌醇-3-激酶(PI3K)通路上,某种生长因子(例如胰岛素样生长因子1)和同源受体相结合,激活PI3K,进而刺激下游的丝氨酸/苏氨酸激酶Akt和雷帕霉素的机械靶蛋白(mechanistic target of rapamycin,mTOR),从而在微环境和HIF信号之间提供一种联系,因为mTOR的活性取决于局部环境中氨基酸的浓度。另外,生长因子还能激活EPK和p70S6K1,后者是HIF-1α mRNA翻译所必需的重要因子。除了激活p70S6K1,EPK还能刺激MAPK相互作用蛋白,通过抑制4E结合蛋白(4E-BP)而激活翻译起始因子elF4E和mTOR。
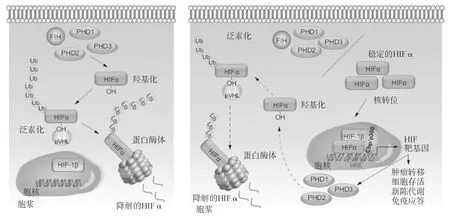
图2氧依赖性HIF信号
在正常氧张力下(氧含量正常),细胞的氧感受器脯氨酰羟化酶(PHD1-3)和因子抑制性HIF(FIH)对HIFα亚基的特异性残基进行羟基化(PHDs使HIF-1α和2α羟基化,FIH使HIF-1α羟基化)。羟基化的HIFα被von Hippel-Lindau(pVHL)E3泛素连接酶识别并被泛素化,聚泛素化的HIFα导致蛋白酶体的降解。在低氧下(缺氧)条件下,PHD和FIH活性被抑制,导致稳定的HIFα表达和发生核转位,并在细胞核中与β亚基形成二聚体。在Cbp/p300等共激活分子的协助下,HIF复合物发挥转录因子的作用,结合至被定义为缺氧应答元件(HREs)的特异DNA序列,从而激活肿瘤转移、细胞存活、新陈代谢和免疫应答等众多信号事件中的基因转录。HIFα信号通路具有自我调控性,细胞核中的HIF-1α促进PHD的表达,产生负反馈回路,从而确保此通路不被组成性活化。
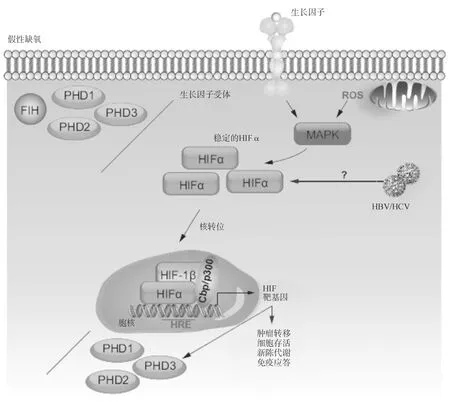
图3氧非依赖性HIF信号
在假性缺氧状态下,脯氨酰羟化酶(PHD)和因子抑制性HIF(FIH)功能丧失,导致不管氧张力如何,缺氧诱导因子α(HIFα)都能组成性表达。这种状况可以是病毒感染或异常激酶信号的结果。例如:生长因子和同源受体相结合后,激活MAPK通路,稳定HIFα。类似地,线粒体功能障碍能促进活性氧(ROS)的产生,可作用于MARK从而稳定HIFα。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)可通过尚不清楚的机制使HIF-1α在氧含量正常的情况下也能保持稳定。
营养可供性的改变能直接影响HIFα蛋白的水平。鉴于PHDs和FIH的活性都有赖一种酮戊二酸,因此凡能导致低水平2-氧代酸的情况均可能增加HIF的转录活性。最后,线粒体功能障碍可借助来自电子传递链的ROS灭活PHD的活性,从而稳定HIFα亚基。炎症时ROS水平可通过多种机制得以增加,包括NADPH氧化酶活性和作为对内质网应激(ERS)应答的下游钙的释放。
HIF系统在体内受许多互联信号机制的调控。在可影响肝脏并稳定HIFs的病理条件下,潜在的机制可能会随着时间而改变,导致HIF-1α的表达延长。例如,在缺血期间,血流量的急性减少可使HIF-1保持稳定。但一旦再灌注,大量涌入的ROS就会激活PHDs,导致氧非依赖性HIF的表达。可能的情况是,在肝脏生理氧梯度的较低端(即~4% O2),组织PaO2或非缺氧通路的较小改变即对HIFs的调控产生显著的影响。
三、HIFs在不同肝病发病机制中的作用及潜在治疗价值
(一)缺血-再灌注性肝损伤缺血-再灌注(I/R)介导的肝损伤发生在肝脏切除和移植前的器官保存阶段,是移植肝功能异常的一个主要因素。缺血期间,氧和营养物质的损失导致ATP水平急剧下降,引起膜功能和代谢异常。但在血液供应恢复(再灌注)后,由ROS介导的细胞蛋白和脂质的氧化所引起的细胞损伤,即使未导致细胞死亡,也将引起明显的细胞功能受损。虽然用完全缺氧的液体灌注肝脏可导致整个肝小叶均匀缺血,但血流减少引起的缺血在肝脏中央周围区域是不同的,提示存在缺血性代谢应答,而肝脏其余部分则不受影响。大量的器官研究显示,HIFs在保护肝脏免受I/R损伤方面具有重要作用。HIF的活化处于许多已得到很好描述的保护性通路的下游,包括腺苷、一氧化氮和AKT信号等,其活性支持氧非依赖性ATP的产生以及“细胞保护系统”的上调,例如抗氧化剂和抗细胞凋亡蛋白,从而允许在缺血期间和缺血后细胞能够生存。
(二)脂肪性肝病脂肪性肝病或肝脂肪变性,是肝细胞胞浆中大泡性或微泡性脂滴的过度累积,是促进肥胖、2型糖尿病及心血管疾病形成的一个主要健康问题。临床上分为酒精性脂肪性肝病(AFLD)和非酒精性脂肪性肝病(NAFLD),两者均可导致肝纤维化、肝硬化和肝癌。有报道表明连续给大鼠喂饲乙醇饮食,可导致肝脏缺氧,虽然HIF-1对酒精性肝损伤的直接作用尚不清楚。应用大鼠肝细胞进行研究表明,小静脉周围细胞脂质新生增强,加上进入细胞的外源性脂肪酸和极低密度脂蛋白酯化增加,都间接支持低氧能够调节肝脏脂质代谢。文献报道支持HIFs具有调节肝脏脂肪生成的作用,近来的研究致力于阐明HIF-1和2α对肝脏脂肪形成的相对促进作用。
关于HIF-1α在脂肪性肝炎中的作用,相关报道是相互矛盾的。给肝细胞特异性Hif-1α敲除的小鼠喂饲乙醇饮食,可通过抑制HIF-1α的靶基因,亦即分化的胚胎软骨细胞基因1(differentiated embryo chondrocyte gene 1,Dec1),而致使甘油三酯和脂质累积。Dec1超表达可逆转酒精对肝脏生物学的不良影响,这支持受HIF-1α调控的基因在保护小鼠不发生AFLD方面具有正向调控作用。但Nath等报道,激活HIF-1α可诱导喂饲乙醇的cre-lox小鼠模型发生肝细胞脂肪变性和甘油三脂水平增加,而删除HIF-1α可阻止乙醇诱导的脂质堆积。这些研究结论不一致性的原因尚不清楚,可能与所使用的小鼠模型不同有关;但最近另一项研究的结论与Nath等的发现相一致,即HIF-2敲除的成年小鼠可发生肝脂肪变性。相反,Kim等报道,激活小鼠肝脏中的HIF-1α或HIF-2α对脂质堆积的影响甚微。激活HIF-1α和HIF-2α均可促进大泡性脂质堆积,但这种表型与以脂肪变性为特征的人类肝病之间的关系还有待阐明。
Vhl/Hif1α基因失活可导致转基因小鼠发生HIF-2α特异性应答,诱导脂肪性肝炎伴脂肪酸β氧化受损和肝细胞中脂滴增加。而HIF2α失活可减轻脂肪性肝炎。这些数据突出说明HIF-2α具有解除肝脂质平衡的潜在作用。破坏小鼠的Vhl可导致HIF-2α依赖性肝脏脂质堆积的增加,基因组分析研究显示与脂肪酸合成及摄取相关的基因转录增加。这些研究突出显示HIF-2α可作为脂肪性肝炎的潜在治疗靶点。然而,肝脏特异性Phd3敲除的小鼠可稳定表达HIF-2α,其胰岛素信号得以改善,这使得HIF-2α对肝脏脂肪生成的干扰作用显得扑朔迷离。这些观察结果得到了Wei等的支持,他们发现小鼠肝脏中HIF-2α的表达和通过诱导胰岛素受体底物2而增加的肝脏胰岛素敏感性之间存在关联。他们还发现,在应用血管内皮生长因子(VEGF)抑制剂治疗后,有糖尿病小鼠和无糖尿病小鼠的糖耐量及胰岛素信号均得以改善。VEGF的抑制可限制肝窦血管化,诱导局部缺氧,导致HIF-2α表达。
上述数据突出显示了HIF-2α在肝脏中的多重作用,其在肝脏中的表达既能改善糖尿病,又能加重脂质代谢紊乱。下一步研究需要阐明HIFs赖以调节肝脏脂质平衡的机制。
(三)肝脏炎症各种病因引起的慢性肝炎以免疫细胞侵润而致肝细胞损伤为特征,但肝实质中不同的氧水平对免疫细胞功能的影响尚不清楚。已知炎症可诱导代谢供需比值的偏移而导致局部组织缺氧,诱导细胞类别依赖性HIF转录活性,从而调节促炎和抗炎应答。新近研究表明HIF-1α可上调TLR4在巨噬细胞中的表达,提示炎症部位的缺氧应激可增强对细菌性病原体的固有细胞应答。在缺氧的巨噬细胞,IFN-γ、MHC-II和可促进抗原递呈能力及免疫突触形成以提高T细胞因子产生的共刺激分子均是增加的。应用髓源特异性Hif1敲除的小鼠进行研究显示,HIF-1在促进树突状细胞合成干扰素和活化T细胞方面具有重要作用。Larbi等报道,改变了的CD3/CD28依赖性T细胞增殖以及低氧张力下呼吸途径向糖酵解的转换,提示活化阈值、增殖和对细胞凋亡的敏感性在不同的缺氧水平是不同的。新近两份报道突出显示,在人和鼠单个核细胞,缺氧对诱导FOXP3表达具有正调节作用,导致调节性T细胞(Tregs)对效应细胞增殖的抑制频率和能力均增加。该结果与下述报道是一致的,亦即在慢性HCV和HBV感染者的肝脏中,发现能够产生白细胞介素-8(IL-8)的FOXP3+CD4+调节性T细胞的富集。总之,这些研究突出显示了HIFs在联接固有免疫和适应性免疫系统过程中的多重作用,并展示了代谢信号的缺氧依赖性改变如何诱导抗炎程序,这为慢性肝炎的治疗提供了新的契机。
肝纤维化以I型胶原等细胞外基质(ECM)蛋白在肝实质中的过度沉积为特征,是对持续或反复发生的损伤的愈合反应。肝实质血管的改变可促进该区域缺氧。需要注意的是,纤维化模式随潜在疾病的不同而异。HIF-1α的表达能激活肝星状细胞(HSCs)和成纤维细胞分化为成肌纤维细胞,成肌纤维细增殖并迁移至受损区域分泌ECM。结扎胆管制作的肝纤维化小鼠模型在术后3d即有HIF-1α表达增加,而Hif1α缺失的小鼠在胆管结扎后,肝纤维化介质的产生显著减少。
肝损伤发生后,巨噬细胞募集到炎症区域,分泌转化生长因子β(TGF-β)和血小板衍生的生长因子(PDGF),激活HSCs并促进肝纤维化形成。在原发性胆汁性肝硬化(PBC)和原发性硬化性胆管炎(PSC)患者肝活检标本的巨噬细胞、成纤维细胞和肝细胞中可检测到核HIF-1α。总之,这些数据支持巨噬细胞可表达HIFs并在肝纤维化的发生进展过程中具有某种潜在作用,但尚不清楚在肝纤维化背景下巨噬细胞是如何获得缺氧表型。应用经过遗传学处理的小鼠研究显示,破坏肝脏特异性Vhl后,可通过HIF-2α依赖性方式增强促肝纤维化基因的表达,这也得到全基因组微列阵分析的证实;这些发现提示HIF-2α在肝纤维化的形成过程中具有潜在的正向作用。相反,在HIF-2α特异性缺失的小鼠,促纤维化基因的表达显著减少。
(四)病毒性肝炎HBV和HCV均能稳定HIF-1α并促进假性缺氧状态的形成。这两种病毒感染均可导致严重的进展性肝病,包括脂肪性肝炎、肝纤维化、肝硬化和肝癌。HBx蛋白是具有转录活性的多功能蛋白,可与核转录因子相互作用,并对细胞浆内的RAS/RAF/MAP信号转导通路等进行调制。表达HBx的转基因小鼠可发生腺瘤和恶性肿瘤。体外研究显示HBV的致瘤性由HIF-1α介导,导致细胞的侵犯性和增殖性均增强。HBx基因中的常见突变可增强HIF-1α的表达和转录活性,提示不同的HBV基因型可预测肝癌的发病机制。虽然越来越多的证据表明HBx能稳定HIF-1α,但大部分报道均是采用异位蛋白表达、而不是采用病毒感染的方式进行研究,这也反映了全长HBV基因组在体外对靶细胞的感染能力有限。但不管如何,在感染细胞背景研究HBx的活性是一种全球性尝试,突出表明研发能够支撑HBV复制的体外细胞培养系统是非常必要的。
HCV相关研究展现了一种病毒诱导的假性缺氧应答,在氧分压正常时有HIF-1α的稳定表达。缺氧可促进HCV复制,而抑制HIF-1α活性可减弱HCV复制。目前尚不清楚HIF-1α在HCV生命周期中的作用。但可以假设,HIF依赖性肝细胞渗透性和代谢的改变分别有利于病毒的传播和复制。体外研究显示,肝细胞的极性可限制HCV进入肝细胞内,而HCV可通过促进HIF依赖性VEGF的转录激活来克服这种障碍,使肝细胞去极化,有助于HCV播散。VEGF是已得到很好认识的受HIF-1α调控的因子,在血管生成和HCV感染中有着不可或缺的作用,并和血管新生增加有关,这提示受HIF调控的基因在促进病毒生命周期方面起着关键作用。
高通量代谢组学的发展为病毒如何调节宿主代谢提供了新的视野。对HCV感染细胞的代谢特点进行研究显示,细胞从能量消耗表型转变为能量保护表型,从而促进被感染细胞的存活。鉴于HIF-1α在调节糖代谢方面的作用,HCV对HIF-1α的稳定作用可能会诱导一种转化的代谢表型,以利病毒复制。Ripoli等报道,HCV感染可导致肝细胞线粒体氧化磷酸化减弱,糖酵解酶表达增加;这些发现表明肝细胞的代谢发生了向有氧糖酵解的漂移,有助于阐明病毒感染对宿主生物能量学的影响。而且,这些结果还提示HIF-1α依赖性细胞程序的重排可能会促进HCV相关性肝细胞癌(HCC)的发病机制。
(五)肝细胞癌
1. HIFs在HCC发病和转移机制中的作用HCC最主要的危险因素是慢性肝病,尤其是HBV和HCV感染。尽管HCC的治疗取得了很大进展,但绝大数患者都在诊断后一年内因为复发和转移而死亡。由于血管系统的缺陷和高强度的代谢活动,缺氧就成为HCC等实体肿瘤的突出特征,并与预后不良和对化放疗不敏感有关。HIF介导的基因表达涉及HCC转移的各个步骤,包括上皮-间质转换(EMT)、细胞外基质侵入、內渗、外溢和次生转移灶等。HIF-1α在HCC中的表达是术后临床结果的消极预后因素,与肿瘤转移相关。HBV和HCV 对HIF的稳定作用在HCC发病机制中的地位有待明确。
HCC等实体肿瘤的糖酵解水平很高,而缺氧介导的转录应答可上调该通路中的各种酶,包括己糖激酶2(HK2)和乳酸脱氢酶A(LDHA),从而巩固和加强这种糖酵解表型。据报道,糖酵解可为HCC等实体肿瘤提高能量, HK2表达的增加可刺激癌细胞增殖。而在HCC小鼠模型,抑制HK2的表达可增加肿瘤细胞凋亡,限制肿瘤生长。LDHA调控由丙酮酸盐产生乳酸盐的过程;体内外研究显示,敲除LDHA可抑制肿瘤生长和转移。这些报告提示糖代谢在HCC的转移过程中具有某种作用,而HIF-1α信号很可能在其中扮演一种极为重要的角色。稳定的HIF-1α可能是有氧糖酵解的驱动因素之一,这是在许多肿瘤中观察到的一种表型。
Ma等报道一种HCC小鼠模型,其恶变肝细胞糖异生减少,应用一种合成类固醇恢复糖异生水平,可抑制HCC细胞的生长。自从发现HIF-2α的表达可减少肝脏糖异生以来,人们推测HIF-2α在HCC的发病机制中具有某种正调节作用。但新近有数据显示HIF-2α在HCC小鼠模型中的超表达可抑制肿瘤生长,这突出表明今后还需进一步研究这种转录因子在HCC转移中的作用。
2. HIFs和HCC微环境HCC的微环境包括细胞外基质中的肿瘤细胞各种间质细胞。间质细胞包括成血管细胞、免疫细胞和肿瘤相关成纤维细胞(CAFs)等。越来越多的证据表明,间质细胞在解释肿瘤进展和治疗应答方面具有重要作用,尤其是在乳腺癌、肺癌和胰腺癌。微环境的改变,尤其是间质成纤维细胞的改变,可影响肿瘤在相邻上皮细胞的启动,促使肿瘤进展。而且,微环境对化疗耐药和药物输送也有重要影响。因此,靶向于间质细胞以消除它们对肿瘤的支撑作用,是一种很有吸引力的治疗策略。但对于低氧如何诱导间质细胞应答,以及所诱导的各种旁分泌途径如何促进HCC生长,目前尚不清楚。在大多数肿瘤中,CAFs是最具优势的细胞类型之一,但有关HCC中这种细胞类型的研究十分有限。Lin等报道两种人类CAF细胞系能上调与增殖、转移、侵润及血管发生相关的细胞因子和生长因子(APLN、CCL2、CCL26、CXCR4、IL-6、MUC1、LOXL2、PDGFA、PGK1、VEGFA)的表达,从而促进HCC。新近一项研究显示,HCC衍生的肿瘤细胞可分泌溶血磷脂酸(LPA),激活肿瘤周围的成纤维细胞,使之采取一种CAF表型,从而加速HCC进展。抑制LPA可阻断小鼠模型成肌纤维细胞的分化转移和肿瘤进展,从而提供了一种令人激动的治疗新靶点。鉴于大量报道显示LPA能激活PI3K并稳定脂肪细胞、结肠肿瘤细胞和PC3前列腺肿瘤细胞中的HIF-1α,因此推测在HCC中存在HIF-1α依赖性通路。
HCC常与大量的淋巴细胞相关,包括肿瘤特异性CD8细胞、调节性T细胞、自然杀伤性T细胞(NKT)和NK细胞。多种免疫调节机制与抗肿瘤免疫的抑制密切相关,包括表达于肿瘤细胞的PD-1等促凋亡分子、调节性T细胞和免疫抑制性髓源性细胞(MDSCs)的募集,以及可溶性NKG2D配体(MICA/B)所致NK应答的灭活。新近报道PD-1配体是HIF-1α的直接靶点,这提示同时阻断PD-L1和HIF-1α可能是治疗HCC的一种新方法。Doedens等报道,HIFs可影响转录表达以及病毒特异性细胞毒性T细胞(CTL)的效应分子和共刺激-抑制性因子,突出显示这可能是促进病毒和肿瘤清除的一种新策略。因此,HIF-1α可对肿瘤和血管细胞施加直接作用,优选出由趋化因子介导的抑制性促血管生成性T细胞亚群。总之,目前对缺氧如何影响固有免疫细胞及其在HCC发生中的作用知之尚少,有必要进一步研究HIFs在抗HCC免疫中的作用。
3. HIFs和HCC的治疗HCC患者实际上既有肝癌,又有慢性肝病基础。根据不同的情况,可采取癌灶切除、肝移植、经肝动脉插管栓塞化疗(TACE)、化疗、放疗、免疫治疗和/或生物治疗等。其中,TACE虽可在一定程度上改善HCC患者的生存率,但疾病进展和治疗引起的癌灶缺氧可促进肿瘤的血运重建、侵润和转移。
靶向于HIF调控的VEGF的抗血管生成剂可用作包括HCC在内的多种肿瘤的一线和二线治疗。靶向于VEGF受体的激酶抑制剂索拉菲尼和舒尼替尼已分别用于HCC和胃肠道间质肿瘤的治疗。随机安慰剂对照3期临床试验证实多靶点的激酶抑制剂索拉菲尼可改善晚期HCC患者的生存情况。但这种改善其实意义并不突出,仅能延长生存期2~3个月,且并无任何临床或分子生物标记物来判断哪些患者最有可能受益。其他多种靶向于VEGF的药物(包括舒尼替尼和布立尼布)未能被证实有任何生存受益,不论是作为一线或二线治疗药物,大部分患者在诊断后的一年内因肿瘤进一步转移而死亡。治疗诱导的肿瘤缺氧在放疗、化疗、抗血管生成剂和血管破坏剂治疗时均可见到。新近研究显示,抗VEGF抑制剂的耐药与更具侵袭性/转移性的肿瘤表型和HIF依赖性血管生成通路的激活相关。
HCC的3期临床试验失败率高,这迫使科学家们对试验设计进行优化,同时考虑肿瘤的分子特性以便选择最有可能产生应答的患者进行治疗。寻找治疗应答的分子预报器已成为临床肿瘤学研究的标准实践内容,而这有赖于“致癌成瘾(oncogenic addiction)”概念的建立。“致癌成瘾”概念是基于个体的、对有利于肿瘤进展的特异性分子改变的事先认知。与肺癌、结肠癌或乳腺癌等其他实体肿瘤不一样的是,目前对HCC的致癌成瘾环路信息所知有限。大量研究聚焦于HCC的分子特性,旨在识别可预测肿瘤治疗结果的基因标志物。迄今为止,各研究之间的一致性十分有限,这可能反映了HCC的异质性。
Van Malenstein等报道一种与HCC不良预后相关的七基因缺氧基因标志物,但其定义的缺氧肿瘤基因标志物乃是与一种体外对照样品对比mRNA特点而得出的,而这种对照样品中的HepG2肝母细胞瘤细胞是在2%氧浓度条件下培养72 h。但据报道,HIF的表达和转录活性在缺氧24~48 h后最佳,至72 h时已显著下降,这就对上述研究结论形成了限制。新近Nault等报道一种HCC五基因分值,与不同临床背景下肝切除术后患者的生存情况有关,其中RAN、TAF9、RAMP3和HN1为四个新发现的基因,反映了与HCC预后相关的信号传导通路。这些基因是否受HIFs的调控转录,这些新的生物标志物又将如何指导临床对患者进行分层治疗,值得关注。
4. HIF作为治疗靶点的可能性数项体内研究突显了靶向于HIF通路以抑制肿瘤进展的价值,以及通过调节缺氧肿瘤微环境以改善VEGF靶向疗法的效能。在临床前模型中,靶向于HIFs的策略能限制γ放疗和抗血管生成剂治疗所诱导的肿瘤缺氧过程中不需要的效能,从而显著提高疗效。许多直接或间接靶向于HIF的药物已在进行临床前研究或临床试验,主要是作为治疗晚期肿瘤的一种新手段。
HIF-1α拮抗剂EAN-2968是一种被锁定的反义寡核苷酸,能特异性下调HIF-1α mRNA和蛋白的表达。体内研究显示,其可特异而持久地下调小鼠肝脏中的HIF-1α和VEGF,对人类异种移植物也具有抗肿瘤作用。
应用α-酮戊二酸衍生物诱导PHD酶活性是一种新的靶向于肿瘤缺氧区的疗法。这种疗法可同时减少经由HIF-1α和2α的信号传导,从而较仅靶向于一种HIF亚型的治疗策略具有能更强的杀肿瘤效应。
超氧化物歧化酶模拟物等能抑制ROS产生的药物也能降低HIF水平。其他可间接抑制HIF-1转录活性的药物包括雷帕霉素等mTOR抑制剂,AKT活性抑制剂,以及NVP-BEZ235等具有双重特异性的mTOR/PI3K抑制剂。这些制剂靶向于与HIF轴相平行的其他重要信号传导通路。
四、总结和展望
近年的研究突出显示,HIFs可调控细胞代谢、炎症、血管再生和增殖过程中大量基因的转录,与代谢性疾病、脂肪性肝炎、病毒性肝炎及HCC等多种肝病的发生发展密切相关。HIF的表达及相关转录活性受到低氧张力、炎症和病毒感染等的调控。这说明HIFs在慢性肝病和HCC的发病机制中具有重要作用。当前的认识主要是基于小鼠模型,今后有必要进一步在人类验证这些发现,研发整合有肝氧水平的体外培养体系,以期进一步明确氧张力对离体肝脏固有居留细胞和浸润的免疫细胞功能的影响。HBV、HCV、EBV和CMV等病毒均可诱导细胞出现假性缺氧。病毒对HIF通路的这种劫持效应可能有利于其生命周期的多个环节,但同时也为控制病毒复制及相关疾病提供了新的治疗靶点,亦即靶向于HIFs的药物对各种炎性肝病和HCC等具有潜在治疗价值[1]。
[1]Wilson GK, Tennant DA, McKeating JA. Hypoxia inducible factors in liver disease and hepatocellular carcinoma: Current understanding and future directions. J Hepatol, 2014, 61: 1397-1406.
(本文编辑:张苗)
2016-02-16)
210002南京中医药大学附属解放军八一医院全军肝病中心
于乐成,Email:gslsycy@163.com
