不同品种谷子幼苗对干旱胁迫的生理响应及SiZFP252基因的表达分析
2016-08-12张耀元张彬马芳芳丁美娇胡韬光李萍韩渊怀
张耀元,张彬,马芳芳,丁美娇,胡韬光,李萍,韩渊怀,2,3*
(1.山西农业大学 农学院,山西 太谷 030801; 2.农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030031; 3.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷 030801)
不同品种谷子幼苗对干旱胁迫的生理响应及SiZFP252基因的表达分析
张耀元1,张彬1,马芳芳1,丁美娇1,胡韬光1,李萍1,韩渊怀1,2,3*
(1.山西农业大学 农学院,山西 太谷 030801; 2.农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原 030031; 3.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷 030801)
摘要:[目的] 谷子是我国北方重要杂粮和抗旱作物,锌指蛋白是一类具有“指状”结构域的转录因子,主要有C2H2、C4和C6等类型。其中,C2H2型锌指蛋白与逆境胁迫密切相关。为探究C2H2型锌指蛋白转录因子与谷子抗旱的关系,对2个谷子品种幼苗在自然干旱胁迫下的生理响应及SiZFP252基因的表达特性进行研究。[方法] 以晋谷45和晋谷42为试验材料,在田间自然干旱条件下,对苗期谷子材料进行生理水平含量以及POD、SOD抗氧化酶活性等生理指标的测定,并进一步分析了谷子抗旱相关基因SiZFP252的表达特性。[结果] 研究表明:晋谷45的MDA和含量显著低于晋谷42,且抗氧化酶POD和SOD酶活性显著高于晋谷42;干旱胁迫条件下锌指蛋白基因SiZFP252在晋谷45中的表达水平高于晋谷42。[结论] 晋谷45的抗旱性强于晋谷42,且两者抗旱性差异可能与干旱胁迫下处于幼苗期的两个谷子品种的SiZFP252表达差异有关。
关键词:谷子;苗期;SiZFP252;抗旱性
谷子(SetariaitalicaBeauv.)属禾本科狗尾草属,具有耐旱、耐瘠薄、适应性强等特点,是我国北方重要杂粮和抗旱作物[1],在作物抗旱种质资源利用方面具有独特的研究价值[2]。由于谷子不同时期对干旱胁迫的生理应答存在一定差异[3],且不同品种间抗旱性也存在显著差异[4]。因此,对谷子抗旱种质资源的筛选和鉴定以及抗旱分子机制的探究具有重要意义。 锌指蛋白(zinc finger protein)是一类具有“指状”结构域的转录因子,在植物生长发育及对逆境胁迫的耐受性方面具有重要作用,其中植物C2H2型锌指蛋白研究较为明确,其具有一段高度保守的氨基酸特征序列QALGGH,已有报道表明C2H2型锌指蛋白与逆境胁迫相关[5,6],在拟南芥、小麦、水稻等植物中也相继分离鉴定出C2H2型锌指蛋白基因。在谷子中已鉴定出124个C2H2型锌脂蛋白转录因子,定位于9条染色体上,与玉米、高粱和水稻中的同源基因亲缘关系较近,且锌指蛋白基因在不同环境条件下的表达模式存在一定差异及组织特异性[7]。例如,ZFP179在水稻的根、茎、叶、幼穗等组织中均有表达,且在幼穗中表达最高,该基因的过表达可增强水稻对盐的耐受性[8];ZFP182在高盐、干旱和低温条件下表达增强,研究表明该基因在烟草中的异源表达和在水稻中的超表达使转基因植株对盐胁迫的耐受性明显提高[9]。张彬等[10]在2个抗旱性不同谷子品种中分离得到SiZFP182基因,并对其表达模式进行分析,推测干旱胁迫下苗期SiZFP182序列差异与表达差异相关。ZFP252则受到干旱和高盐胁迫诱导[11],该基因在水稻根、茎、叶、花中组成型表达,胁迫诱导该基因的过表达可使细胞中游离组氨酸、吡咯啉-5-羧酸以及组氨酸转运体的含量增加,并提高具有清除活性氧功能酶的含量,从而提高水稻幼苗应对氧胁迫的能力[12,13]。同时,OsZFP252超表达增强了转基因水稻植株的耐盐性和耐旱性,这种抗旱性与OsDREB1A的诱导表达相关,导致游离脯氨酸和可溶性糖类的积累[14]。OsZFP252的过量表达会导致渗透调节物如脯氨酸、可溶性糖、LEA蛋白等的积累,共同作用并诱导抗逆相关的基因表达,进一步增强植物的抗旱、抗盐特性。 目前,对谷子抗旱性的研究多集中在生理生化响应方面,相关分子机制研究较少,尤其在C2H2型锌指蛋白与谷子抗旱性差异方面;且生理生化或分子水平的相关研究也多采用盆栽试验,不能真实反映自然状态下谷子对干旱胁迫的响应。本试验拟通过田间自然干旱胁迫条件下2个品种谷子苗期抗旱相关生理指标的测定,以及SiZFP252基因的表达分析,初步对这2个谷子品种抗旱性进行评价,以期明确SiZFP252基因与谷子抗旱性的关系,为后续深入探索谷子抗旱机制、发掘谷子特有的抗旱基因资源奠定基础。
1 材料与方法
1.1试验材料
本试验在山西农业大学科研试验田进行,田间试验布局:将试验田分隔为对照区和干旱区,田间旱棚控制干旱条件,2个试验小区均种植晋谷42(JG42)和晋谷45(JG45)两个谷子品种,每个品种3次生物重复,待幼苗长至四叶一心时,选择健康状况良好、生长状况一致幼苗的最新展开叶,一部分用于分子实验,取材后立即放入液氮冷冻,然后转移至-80 ℃超低温冰箱保存待用。另一部分用于生理指标测定,现取现测。
1.2谷子苗期生理指标的测定
丙二醛(MDA)含量的测定采用硫代巴比妥酸显色法[14]:取0.15 g叶片置于研钵,加少许石英砂和2 mL 0.1%的三氯乙酸,充分研磨后转移到试管中,用3 mL 0.1% TCA冲洗研钵,合并提取液,再加5 mL 0.5%硫代巴比妥酸溶液,混匀;沸水浴15 min,冰浴冷却至室温;转移提取液于10 mL离心管,3 000 r·min-1离心15 min,收集上清并测量体积,以0.5%的硫代巴比妥酸为参比,测量其在532和600 nm处吸光值,3次重复。MDA含量/mmol·g-1·FW-1= (A532-A600)×V/(155×W),V为上清总体积/mL,W为样品鲜重/gFw。
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光化还原法:取0.15 g叶片置于研钵,加1.5 mL 50 mmol·L-1磷酸缓冲液(pH 7.8)研磨成浆,12 000 r·min-14 ℃离心15 min,上清液为SOD提取液,3次重复。取5支试管,分别加入氮蓝四唑反应液5 mL,其中 3支各加酶提取液100 μL,另外2支为对照,1支保存于暗处,作为参比;另1支对照管和3支样品管在25 ℃下光照20 min,测定560 nm处吸光值。SOD活性/U·g-1·Fw-1=2×(Ack-AE)V/(Ack×W×Vt),其中Ack为照光对照管吸光值;AE为样品管吸光值;V为酶液总体积/mL;Vt为测定时所用的酶液体积/mL;W为样品鲜重/gFw。
过氧化物酶(POD)活性测定采用愈创木酚比色法[14]:POD提取方法同SOD,以0.1 mol·L-1磷酸缓冲液(pH 6.0)为参比,比色时,在比色杯加入5 μL酶提取液和3 mL反应混合液(0.1 mol·L-1磷酸缓冲液50 mL,30%的过氧化氢28 μL和19 μL愈创木酚混合液)后立即计时,反应3 min后在470 nm处测定吸光值。POD酶活性/△OD470·g-1·Fw-1·min-1=△A×Vt/(W×Vs×T),其中△A为3 min内吸光值变化量,Vt为酶液总体积/mL,W为样品鲜重/gFw,Vs为取酶液量/mL,T为反应时间/min。

1.3SiZFP252基因在2个品种干旱胁迫下的苗期表达特性分析
1.3.1PCR引物信息
根据NCBI数据库中水稻OsZFP252基因(登录号:AY219847.1)的氨基酸序列,在Phytozome v11.0中通过与已收录的谷子基因组数据比对,获取谷子中与OsZFP252同源性最高的基因,命名为SiZEP252(Si023013m)。并以该基因cDNA序列为模板,利用Primer 5.0软件设计定量PCR引物,由北京华大基因科技有限公司合成,内参基因为SiActin(Si004277m),Forward primer:TGCTCAGTGGAGGCTCAACA;Reverse primer:CCAGACACTGTACTTGCGCTC。目的基因为SiZFP252, Forward primer:CACTACGACGGCACCATTG;Reverse primer:GGGCTTCTTGAAGGCGAT。
1.3.2SiZFP252基因表达模式分析
RNA提取:在液氮中对叶片组织进行研磨,取0.1 g置于RNase-free离心管中,并用RNAiso Plus植物RNA提取试剂盒(大连宝生物TAKARA)进行提取。采用1%的琼脂糖凝胶电泳检测其完整性,上样量为5 μL,紫外凝胶系统观察并拍照;e-spect蛋白核酸分析仪检测其浓度,上样量为1 μL。
反转录:为避免基因组DNA的对后续试验的影响,需DNA消化后再进行反转录,得到的cDNA模板稀释10倍后供定量试验使用。具体步骤参见Takara PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒说明书。
qRT-PCR定量分析:使用SYBR Premix Ex Taq II (Tli RNaseH Plus)试剂盒进行qRT-PCR反应,反应体系为10 μL体系(表1)。采用Bio-Rad CFX96TMReal Time System进行定量试验。以SiActin为内参,通过Bio-Rad CFX Manager 3.1软件获得相对表达量,并用OriginPro 9.0软件作图。

表1 qRT-PCR反应体系
2 结果与分析

图1 干旱胁迫对JG45和JG42苗期生理指标的影响Fig.1 Effect of drought stress on physiological indicators of JG42 and JG45 during seedling stage 注:A:MDA含量;含量;C:SOD活性;D:POD活性;字母表示各品种间5%水平上的差异显著性。Note: A: The content of MDA; B: The content of ; C: SOD activity; D: POD activity; small letters show the difference significant of cultivars at the level of 5%.
2.2苗期干旱胁迫对谷子幼苗抗氧化酶SOD与POD酶活性的影响
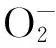
2.3SiZFP252基因在干旱胁迫下的表达模式
通过qRT-PCR对JG45和JG42谷子幼苗在田间干旱胁迫下SiZFP252基因的表达特征进行比较分析(图2)发现,2个品种干旱胁迫下的SiZFP252表达水平均高于各自对照组,且SiZFP252在谷子苗期叶片中的表达也呈现出品种间差异,即干旱处理下,该基因在JG45的表达水平高于JG42,推测干旱胁迫诱导了SiZFP252基因的表达。
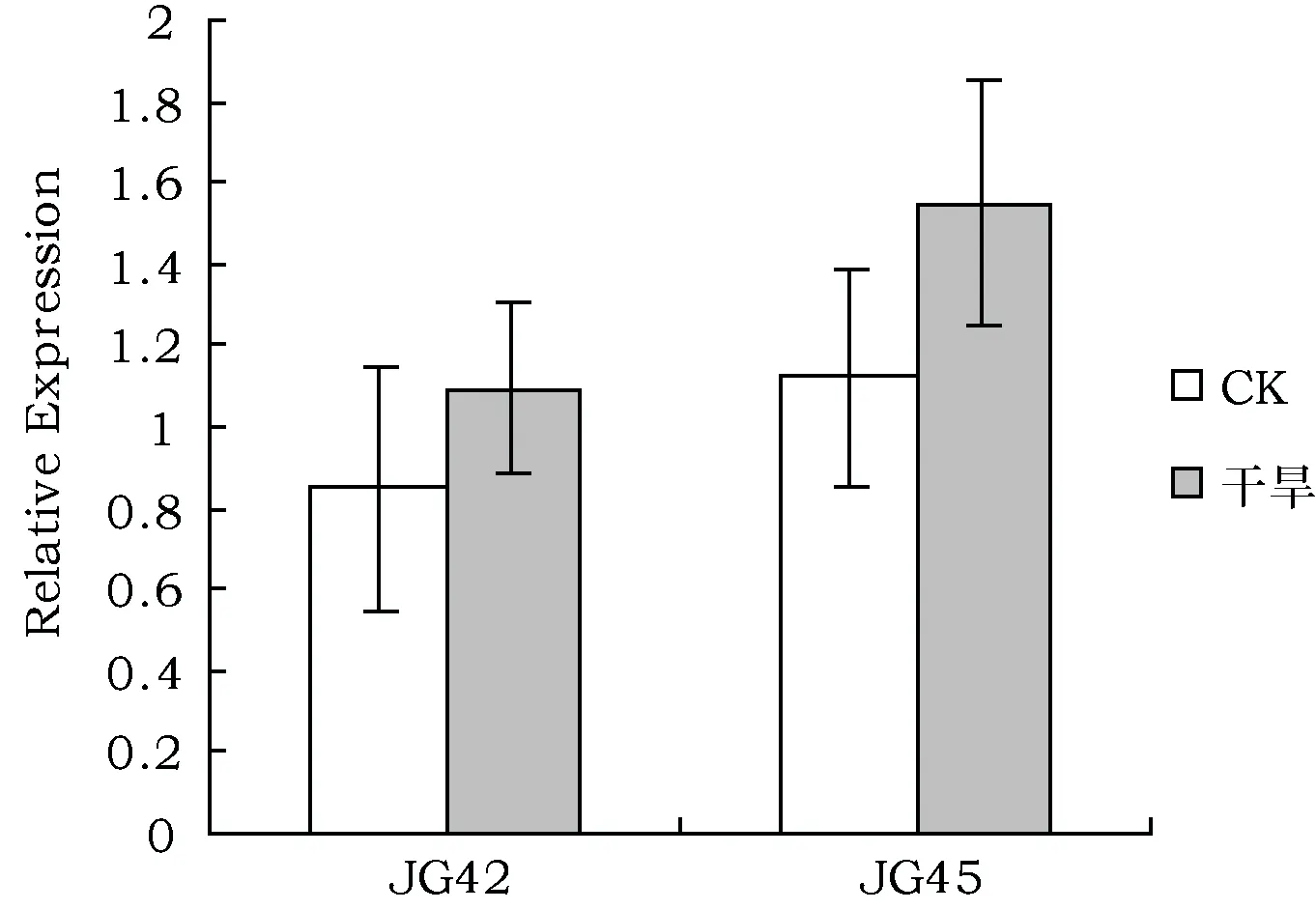
图2 SiZFP252在干旱胁迫下JG42与JG45中表达模式Fig.2 Expression patterns of SiZFP252 gene of JG42 and JG45 in drought stress
3 讨论与结论
植物对干旱胁迫的响应是一个比较复杂的调控网络,其中,转录因子的调控作用尤为重要。C2H2型锌脂蛋白转录因子在低温、干旱及盐胁迫条件下上调表达,而一些候选基因的过表达也会激活其他胁迫相关基因的表达,二者相互作用,共同提高了植物对逆境胁迫的耐受性[15]。

其次,本研究对谷子抗旱相关转录因子基因SiZFP252在干旱胁迫下的表达水平进行了分析,发现该基因在2个品种胁迫处理下的表达水平均有提高,且JG45的增幅大于JG42,结合之前JG45抗旱性强于JG42的结论,进而推测两者抗旱性差异可能与该基因表达水平存在一定相关性。
综合以上结果,初步推断JG45和JG42对干旱胁迫的不同反应,可能与苗期干旱胁迫下2个谷子品种的SiZFP252基因表达差异有关。要全面了解SiZFP252基因与谷子抗旱机制的关系,需要进一步对该基因在谷子不同器官以及不同发育时期的表达特性进行研究,并在后续试验中构建表达载体,通过遗传转化来验证其分子作用机制及功能。
参考文献
[1]宋国亮,赵治海,范光宇.谷子杂交种张杂谷5号的选育及栽培技术[J].现代农村科技,2010(15):22-23.
[2]杨希文,胡银岗.谷子DREB转录因子基因的克隆及其在干旱胁迫下的表达模式分析[J].干旱地区农业研究,2011,29(5):69-74.
[3]刘佳,仪慧兰,郭二虎,等.不同时期谷子对干旱胁迫的响应[J].山西大学学报,2015,38(1):160-164.
[4]裴帅帅,尹美强,温银元,等.不同品种谷子种子萌发期对干旱胁迫的生理响应及其抗旱性评价[J].核农学报,2014,28(10):1897-1904.
[5]宋冰,洪洋,王丕武,等.植物C2H2型锌指蛋白的研究进展[J].基因组学与应用生物学,2010,29(5):1133-1141.
[6]田路明,黄丛林,张秀海,等.逆境相关植物锌指蛋白的研究进展[J].生物技术通报,2005,6:12-16.
[7]Muthamilarasan M,Bonthala V S,Mishra A K,et al.C2H2 type of zinc finger transcription factors in foxtail millet define response to abiotic stresses[J].Funct Integr Genomic, 2014,14(3):531-543.
[8]Sun S J,Guo S Q,Yang X,et al.Functional analysis of a novel Cys/His2-type zinc finger protein involved in salt tolerance in rice[J]. J Exp Bot,2010,61(10):2807-2818.
[9]Huang J,Yang X,Wang M M,et al.A novel rice C2H2-type zinc finger protein lacking DLN-box/EAR-motif plays a role in salt tolerance[J].Biochim Biophys Acta,2007,1769(4):220-227.
[10]张彬,禾璐,候蕊,等.谷子C2H2型锌指蛋白基因SiZFP182的克隆及表达分析[J].中国农业大学学报,2015(5):9-15.
[11]郭书巧,黄骥,江燕,等.水稻C2H2型锌指蛋白基因RZF71的克隆与表达分析[J].遗传,2007,29(5):607-613.
[12]Huang J,Sun S J,Xu D Q,et al.Increased tolerance of rice to cold,drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger proteinZFP245[J].Biochem Bioph Res Co,2009,389(3):556-561.
[13]Todaka D,Nakashima K,Shinozaki K,et al.Toward understanding transcriptional regulatory networks in abiotic stress responses and tolerance in rice[J].Rice,2012(5):6.
[14]Xu D Q,Huang J,Guo S Q,et al.Overexpression of a TFIIIA-type zinc finger protein geneZFP252 enhances drought and salt tolerance in rice (OryzasativaL.)[J].FEBS Lett,2008,582(7):1037-1043.
[15]Kielbowicz-Matuk A.Involvement of plant C2H2-type zinc finger transcription factors in stress responses[J].Plant Sci,2011,186:78-85.
[16]田敬园.复配抗旱剂对干旱胁迫下谷子种子萌发及幼苗生长的生理特性的影响[D].山西农业大学,2013.
[17]金不换.干旱胁迫对不同品种早熟禾形态和生理特性影响的研究[D].东北农业大学,2009.
[18]王贺正,李艳,马均,等.水稻苗期抗旱性指标的筛选[J].作物学报,2007,33(9):1523-1529.
[19]朱永波,张仁和,卜令铎,等.玉米苗期抗旱性鉴定指标的研究[J].西北农业学报,2008,17(13):143-146.
(编辑:邢国芳)
收稿日期:2016-05-05 修回日期:2016-06-14
作者简介:张耀元(1990-),女(汉),山西晋中人,硕士研究生,研究方向:植物基因工程 *通讯作者:韩渊怀,教授,博士生导师。Tel:0354-6287239;E-mail:swgctd@163.com
基金项目:教育部2013年高等学校博士学科点专项科研基金联合资助课题(20131403110001);山西省科技攻关项目(20150311006-2)
中图分类号:S515
文献标识码:A
文章编号:1671-8151(2016)09-0614-05
Responses to drought stress and expression analysis ofSiZFP252 of seedlings of different foxtail millet varieties
Zhang Yaoyuan1, Zhang Bin1, Ma Fangfang1, Ding Meijiao1, Hu Taoguang1, Li Ping1, Han Yuanhuai1,2,3*
(1.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China; 2.KeyLaboratoryofCropGeneResourcesandGermplamEnhancementonLoessPlateau,MinistryofAgriculture,Taiyuan030031,China; 3.ShanxiKeyLaboratoryofGeneticResourcesandGeneticImprovementofMinorCrops,Taigu030801,China)
Abstract:[Objective] Foxtail millet is an important minor crop with strong drought resistance in North China, zinc finger protein is a kind of transcription factors with “finger-like” structure domain, including C2H2、C4 and C6 types, ect. C2H2 zinc finger protein is closely related to adversity stress. To explore the relationships between C2H2 zinc finger protein transcription factors and the drought resistance of foxtail millet, we conducted the research on physiological responses to drought stress and expression analysis of SiZFP252 in two foxtail millet varieties during seedling stage. [Methods] In this study, Jingu45 and Jingu42 were selected as the research materials, through the treatment of natural drought stress for foxtail millet seedlings, drought-resistant related physiological indicators were measured at physiological level, including the content of MDA, and the enzyme activities of POD, SOD, and the expression characteristics of SiZFP252 was also analyzed at molecular level.[Results] The results showed that the content of MDA and in Jingu45 was significantly lower than that in Jingu42, and the activity of antioxidant enzymes POD and SOD was significantly higher than that Jingu42; the expression level of SiZFP252 in Jingu45 was higher than that in Jingu42. [Conclusion] The above results indicated preliminarily that Jingu45 had a stronger drought resistance than Jingu 42 and the differences of drought resistance ability for Jingu 45 and Jingu 42 might be related to the differences of expression level of SiZFP252.
Key words:Foxtail millet; Seedling stage; SiZFP252; Drought resistance
