原花色素降血脂机制研究进展
2016-08-10李澜奇陈士国叶兴乾浙江大学生物系统工程与食品科学学院浙江杭州310058
张 妤,李澜奇,龚 辉,陈士国,叶兴乾*(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
原花色素降血脂机制研究进展
张 妤,李澜奇,龚 辉,陈士国,叶兴乾*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
摘 要:原花色素是以黄烷-3-醇为基本单元,在自然界中广泛存在的多酚类物质,具有多种生物活性。本文综述了原花色素如何调节甘油三酯和胆固醇代谢过程中的关键蛋白从而控制体内主要脂类的含量;此外,还总结了原花色素如何调节体质量、能量摄入以及通过调节AMP依赖蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)信号通路影响能量消耗,进而综合调控体内血脂的含量,达到降低血脂的功能。
关键词:原花色素;甘油三酯;胆固醇;AMP依赖蛋白激酶;代谢
引文格式:
张妤, 李澜奇, 龚辉, 等.原花色素降血脂机制研究进展[J].食品科学, 2016, 37(13): 220-225.DOI:10.7506/spkx1002-6630-201613040. http://www.spkx.net.cn
ZHANG Yu, LI Lanqi, GONG Hui, et al.The hypolipidemic mechanism of proanthocyanidins[J].Food Science, 2016,37(13): 220-225.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613040. http://www.spkx.net.cn
原花色素(proanthocyanidins)是植物中广泛存在的具有C6·C3·C6结构的多酚类物质,也被称为缩合单宁。在大多数发达国家的饮食中,原花色素是继木质素后,第二大类被广泛食用的天然酚类物质[1]。原花色素因其能够影响生理功能和细胞代谢,被认为是天然的活性物质。大量研究结果表明,原花色素具有抗氧化、抗癌、抗菌以及保护心血管等生理活性[2-5]。高血脂症是目前世界上日益增长的健康问题,它与很多代谢失调的疾病有关,如II型糖尿病和心血管类疾病等。本文从原花色素调控甘油三酯、胆固醇代谢,以及通过AMP依赖蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)信号通路调节能量代谢角度详述了原花色素的降血脂机制。
1 原花色素调节体质量与能量摄入
原花色素是由黄烷-3-醇为基本单元,如(+)-儿茶素(catechin)、(+)-表儿茶素(epicatechin)、没食子儿茶素(gallocatechin)、表没食子儿茶素(epigallocatechin)及它们的衍生物组成的寡聚体和多聚体[6]。通常,黄烷-3-醇通过C4→C8或C4→C6连接形成B型原花色素,以C2→O7或C2→O5连接形成A型原花色素[7]。常见的富含B型原花色素的植物有苹果、可可豆、葡萄籽;富含A型的则有坚果、李子、蔓越莓等。
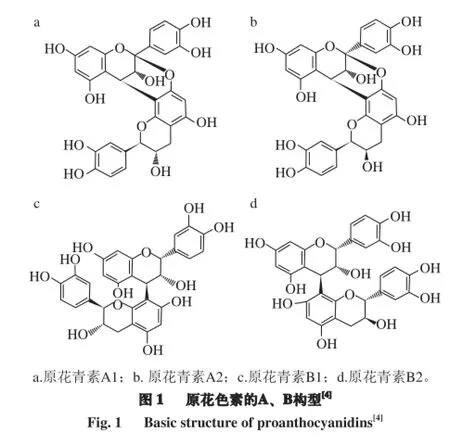
Caimari等[8]以仓鼠为实验模型,使其摄入葡萄籽原花色素长达15 d,发现高脂仓鼠的各部位的白色脂肪组织(white adipose tissue,WAT)的质量均明显下降(下降率约16.6%~18.8%),而正常仓鼠的WAT质量的下降率也可达8.8%~10.5%。Dorenkott等[9]以高脂小鼠为实验对象,使其摄入混合可可粉原花色素(含单体、寡聚体和多聚体),也发现小鼠的增重、脂肪量、血糖不耐受和胰岛素抗性的现象都得到缓解,而且,寡聚的原花色素在调节肥胖小鼠的体质量方面效果更明显。Kimura等[10]通过给小鼠摄入坚果籽壳原花色素的饮品,在减轻体质量和脂肪组织的质量方面,效果明显。但是,同样也有文献报道,原花色素的摄入对不同动物的体质量无显著影响[11-13]。所以,关于原花色素对体质量和能量摄入的影响和多种因素有关,如不同的动物模型、剂量、原花色素的种类、来源和聚合度等。
2 原花色素调节甘油三酯代谢
体内最常见的脂类是甘油三酯、脂肪酸和胆固醇,它们在体内的代谢途径各不相同,所以原花色素会通过不同途径调节它们的代谢。大量动物实验表明,高脂小鼠或大鼠通过摄入不同来源的原花色素,如葡萄籽、坚果等,血脂各类指标均得到改善,如血液中甘油三酯、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、超低密度脂蛋白(very low density lipoprotein,vLDL)的含量明显降低;高密度脂蛋白(high density lipoprotein,HDL)的含量显著提高[10,14-16]。血液中的甘油三酯、TC、LDL和vLDL的含量高,会导致脂肪在血管内膜的累积,造成动脉粥样硬化,形成血栓以及引发各类心血管疾病[17],所以控制这些脂肪指数的含量,是控制肥胖和减少心血管疾病风险的重要因素。
膳食摄入的脂肪分解后产生甘油三酯,甘油三酯是三分子长链脂肪酸和甘油形成的脂肪分子,是体内含量最多的脂类,大部分组织可以利用甘油三酯的分解产物供给能量。甘油三酯并不能直接被小肠吸收,它需要被脂肪酶水解,释放出脂肪酸,形成甘油二酯或甘油单酯,才能被小肠细胞吸收。在小肠细胞内,甘油单酯、甘油二酯和脂肪酸重新酯化后形成的甘油三酯,和磷脂、胆固醇、蛋白质结合,形成乳糜微粒(chylomicron,CM),再从细胞内排出,进入淋巴系统,体内很多组织可以捕获CM,从而利用甘油三酯作为能量[18]。血液中甘油三酯含量过高会导致动脉粥样硬化,并引发各类心血管疾病,所以控制血液中的甘油三酯的含量是预防各类心血管疾病的关键[19]。
2.1 原花色素调节甘油三酯吸收途径
原花色素可以通过调节甘油三酯吸收和分解途径中的主要控制点来控制其含量。首先,脂肪酶是影响甘油三酯在体内吸收关键酶,原花色素可以抑制其活性,从而限制了膳食脂肪的吸收。有文献报道,葡萄籽提取物和苹果原花色素抑制胰腺酶效果显著,IC50可达1.4 mg/mL,而且抑制效果和原花色素的聚合度有关[20]。Wang Shihui等[21]的实验结果显示,原花色素通过减少猪胰腺酶的α-螺旋和增加β-折叠对其活性结构造成改变,从而抑制其活性,且抑制率可达34%。而且,A构型以及分子质量或聚合度越大的原花色素,抑制胰腺酶效果更好。所以,不同类型的原花色素在构型、分子质量和聚合度上的差异,对脂肪酶的影响效果不一样,从而影响甘油三酯的吸收。
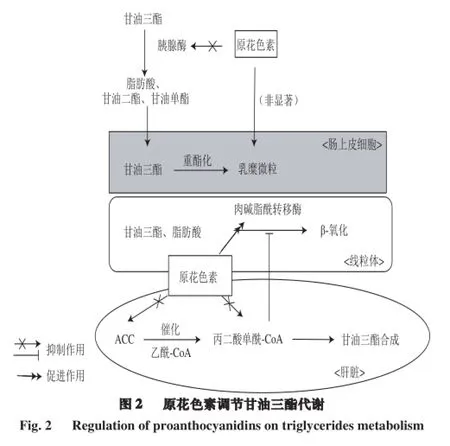
甘油三酯被胰腺酶或胆汁水解后,形成脂肪酸和甘油单酯,进入肠上皮细胞后形成CM被运输到其他组织中。CM是体内运输脂肪的重要脂蛋白之一,其主要作用是运输外源性的甘油三酯,所以控制CM的含量在降低体内甘油三酯方面也起着重要作用。原花色素含量丰富的食品,如红葡萄酒,能够降低体内CM和Apo48(CM的特殊标记物)的含量[22]。Naissides等[23-24]的实验表明,在Caco-2细胞中,红酒能够显著减少Apo48的分泌,Vidal等[25]从苹果原花青素提取物也得到类似的结果,但是从另一种红酒多酚提取物中效果却不明显。此外,有实验以17 个高脂女性为实验对象,结果表明,她们摄入红葡萄酒提取物后,1 h内,Apo48含量明显降低,但是6 h后效果不明显;且Naissides等[23]的实验表明,长期摄入红酒酚类物质对Apo48的效果也不显著。所以,原花色素类物质对CM的影响与其种类来源、纯度、剂量和摄入时间的长短均有关系。
2.2 原花色素调节甘油三酯分解途径
被分解的甘油三酯和脂肪酸随后被肉碱脂酰转移酶1 (carnitine palmitoyltransferase 1,CPT1)转移至线粒体经历β-氧化。β-氧化和脂肪酸的合成途径也有紧密关系。在肝脏中,乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)催化乙酰辅酶A形成丙二酸单酰辅酶A(malonyl-CoA),这是脂肪酸合成的关键限速步骤,而丙二酸单酰辅酶A能限制CPT1活性,从而脂肪酸的氧化被抑制[26]。所以,上调脂肪氧化过程和下调脂肪合成过程中的关键蛋白表达,是加速脂类消耗和防止其在体内累积的重要因素。Ikarashi等[27]的实验表明,高糖高脂小鼠摄入刺槐原花色素提取物后,肝脏中的ACC水平下调,同时肌肉中的CPT1的mRNA表达上调,此外,血液中的血糖、胰岛素含量和肝脏中的脂肪酸合成酶含量均有所下降。同样,Casanova等[28]的实验观察到大鼠摄入25 mg/kg的葡萄籽原花色素提取物21 d后,AMPKα磷酸化水平增强导致AMPK的活性增强,其下游蛋白CPT1b和脂蛋白脂肪酶(lipoprotein lipase,LPL)的表达上调;同时肌肉中的线粒体功能和氧化能力均有所改善。综上所述,原花色素通过调节甘油三酯代谢过程中的关键蛋白来加速甘油三酯的β-氧化以及限制其合成,从而控制体内甘油三酯含量。
3 原花色素调节胆固醇代谢
胆固醇是一种环戊烷多氢菲的衍生物,广泛存在于动物体内,在脑及神经组织中最为丰富,在肾、脾、皮肤、肝和胆汁中含量也高,是体内不可缺少的重要物质,它不仅参与形成细胞膜,而且是合成胆汁酸、VD以及甾体激素的原料。体内胆固醇代谢失衡导致胆固醇含量过高,易引起各类心血管疾病的风险[8]。原花色素可以通过调节胆固醇的合成途径和代谢途径中的关键酶和转录因子来控制其含量。
3.1 原花色素调节胆固醇合成途径
在胆固醇的合成途径中,3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)在HMG-CoA还原酶催化下形成甲羟戊酸,HMG-CoA还原酶是这步反应的限速酶,是体内合成胆固醇的关键控制点[19]。大量实验显示HMG-CoA还原酶抑制剂,如他汀类药物能够降低血液中的胆固醇含量,从而减少心血管疾病的风险[29]。但是,原花色素对于HMG-CoA还原酶的作用并不显著,且很多文献的实验结果并不一致。del Bas等[19,30]的实验显示给小鼠急性摄入葡萄籽原花青素能够降低肝脏中HMG-CoA还原酶以及和其他胆固醇合成相关酶的表达。但是,有实验表明用葡萄籽原花青素培养HepG2肝癌细胞反而导致HMG-CoA还原酶的mRNA水平上调,且Quesada等[15]的实验表明高脂小鼠慢性服用葡萄籽原花青素提取物10 d后,肝脏中的HMG-CoA还原酶的活性并未受到影响。这些实验结果说明,原花色素类物质通过HMG-CoA还原酶途径调节脂肪代谢会受到各种实验因素的影响,如动物类型、原花色素种类以及剂量等。
3.2 原花色素调节胆固醇分解途径
胆固醇的代谢途径主要是在肝脏中形成胆汁酸,在此过程中,CYP7A1是关键的限速酶[31]。体内有多种转录因子来调控CYP7A1,当胆固醇含量低时,SREBP抑制CYP7A1,从而阻止胆固醇变成胆汁酸;当胆固醇含量高时,LXR激活CYP7A1,从而使更多的胆固醇转变为胆汁酸[14]。此外FXR可以通过SHP非直接调节CYP7A1的活性[32]。当胆汁酸含量过高时,FXR可以PPAR或视黄醇类X受体(retinoid X receptor,RXR)结合,负反馈调节胆汁酸的含量,从而控制胆固醇平衡[33]。同时,这些转录因子也与其他脂类的代谢密切相关,如甘油三酯和脂肪酸。所以,在控制脂类的代谢途径中,这几个转录因子是重要关键控制点。
Osada等[34]的实验表明含有85%的苹果寡聚原花青素能够显著提高CYP7A1的mRNA的表达,且降低大鼠中肝脏和血液中的胆固醇含量。大鼠摄入250 mg/kg的葡萄籽原花色素后,血脂指标得到了改善,甘油三酯、ApoB、LDL的水平下降,CYP7A1和SHP的表达上升,血液中更多的胆固醇转变为胆汁酸。此外,del Bas等[30]对FXR缺陷型小鼠和正常小鼠摄入葡萄籽原花色素进行对比,发现FXR缺陷型小鼠在摄入原花色素后,血液中甘油三酯含量没有变化;而正常小鼠在摄入葡萄籽原花色素后,血液中甘油三酯含量降低,FXR被激活,且活性与原花色素剂量成正比,其下游的SHP表达上调,SREBP1表达下调,说明葡萄籽原花色素可通过FXR途径调控胆固醇含量。其中,SREBP1的下调会导致FAS的活性减弱[30],以及其抑制CYP7A1效应也减弱,从而达到减速脂肪酸合成、加速胆固醇转化为胆汁酸的作用。此外,葡萄籽原花色素可以激活胰岛素受体[12],发挥类似胰岛素的作用,胰岛素是调节vLDL组装和分泌重要调节因子,所以原花色素的胰岛素类似作用以及联合激活FXR可抑制vLDL的分泌,从而降低体内胆固醇的含量[35]。
PPAR是一类核转录因子,分为α、β、γ三类,PPARα主要分布于肝脏、肾脏、心、肌肉和脂肪组织中,主要与游离脂肪酸的氧化相关;PPARβ主要位于大脑和脂肪组织中;而PPARγ主要位于白色脂肪组织(white adipose tissue,WAT)中。氯贝特(fibrate)是市面上广泛使用的降血脂药物,它作为PPARα的配体与之结合,随之增强了与脂肪氧化相关的基因表达,从而降低血液和肝脏中的脂类含量[36]。此外,松树皮中的Flavangenol,主要含寡聚原花色素,能够发挥类似氯贝特的作用,显著提高脂肪酸氧化酶,如PPARα、酰基辅酶A氧化酶(acyl-CoA oxidase,ACO)和肉碱脂酰转移酶1-α 的mRNA的表达,而且抑制了SREBP1的表达[37],所以加速了脂肪酸的氧化,抑制了胆固醇的合成,从而达到了降脂的效果。
4 原花色素调节能量消耗
AMPK即AMP依赖的蛋白激酶,是生物能量代谢调节的关键分子和研究肥胖及其他慢性病的核心。AMPK 由3 个亚基组成,包括一个α-催化亚基、一个β-调节亚基和一个γ-调节亚基,并在大脑、肝脏和肌肉等多个器官组织中表达。α-亚基的磷酸化能够激活AMPK,活化了的AMPK能够抑制合成反应,促进分解代谢反应[38]。
在肌肉组织、WAT和棕色脂肪组织(brown adipose tissue,BAT)中,AMPK能够影响葡萄糖的摄入、加速脂肪酸的氧化和线粒体的生物合成。其中,关于BAT的研究是近年来的热点,BAT是哺乳动物体内非颤栗产热的主要来源,对于维持动物的体温和能量平衡起重要作用,它主要分布在肩胛间区、腹部大血管、肌肉、颈部血管、胸部动脉和下腔静脉周围的组织区域[39]。BAT燃烧葡萄糖和甘油三酯衍生的脂肪酸并通过一种特殊的解偶联蛋白(uncoupling protein,UCP)来聚集热量。UCP是一种线粒体内膜蛋白,它能消除线粒体内膜两侧的跨膜质子浓度差,解除了部分正常呼吸链中应有的电子传递与磷酸化两者之间偶联关系,从而使氧化磷酸化过程减慢,阻碍了三磷酸腺苷(adenosine triphosphate,ATP)的正常产生[38]。
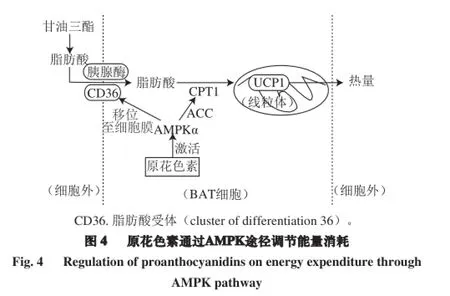
Yamashita等[40]的实验表明,高脂小鼠服用含原花色素的可可汁13 周后,肝脏、肌肉和WAT中的AMPKα均被激活,导致了葡萄糖转运体4(glucose transporter type 4,GLUT4)移位至细胞膜上,使更多的血糖转移至细胞内,从而使血糖含量降低。此外,BAT中的UCP1和肌肉中的UCP3表达都上调。Pajuelo等[41]给小鼠急性注射葡萄籽原花色素提取物,在BAT中,UCP1 和UCP3的表达上升,同时过氧化物酶体增殖活化受体γ共激活因子(peroxisome proliferator-activated receptor gamma coactivator,PGC)1α和CPT1α的表达也上升。PGC1α是调节能量代谢过程中的基因的转录激活剂,是调节线粒体再生和功能的重要调节因子[42];而CPT1则与脂肪酸的氧化密切相关,所以,原花色素的摄入提高了小鼠的线粒体功能和加速了脂肪酸的氧化分解。此外,有文献报道,大鼠摄入25 mg/kg的葡萄籽原花色素提取物21 d后,AMPKα磷酸化激活,且UCP2、CD36、LPL和CPT1b的表达均上调。此外,原花色素可以与其他活性物质产生协同降血脂效应,如葡萄籽原花色素与DHA的协同效应对于大鼠的降血脂和加强线粒体功能的作用更显著[28]。
5 结 语
本文详述了原花色素如何通过调节甘油三酯和胆固醇代谢途径中的关键蛋白,以及如何调节能量消耗,来综合阐述其降血脂机制。但是,原花色素来源广泛、结构复杂,不同聚合度、来源和构型的原花色素在体内的代谢途径不一样,从而调节脂类代谢和能量消耗过程中的信号通路也不一样。所以,不同类型和来源的原花色素如何调节血脂,更值得进一步地研究。其次,原花色素单体和二聚体在体内可以被吸收利用,而原花色素高聚体由于它们分子质量和聚合度较高,不能直接被吸收进入血液循环,而是进入肠道与肠道微生物作用。肠道微生态和疾病的关系也是近年来研究的热点,多聚原花色素与其相互作用的关系,以及肠道菌群对原花色素的代谢产物与疾病的关系值得探索。
参考文献:
[1] HE F, PAN Q H, SHI Y, et al.Biosynthesis and genetic regulation of proanthocyanidins in plants[J].Molecules, 2008, 13(10): 2674-2703.DOI:10.3390/molecules13102674.
[2] ARON P M, KENNEDY J A.Flavan-3-ols: nature, occurrence and biological activity[J].Molecular Nutrition & Food Research, 2008,52(1): 79-104.DOI:10.1002/mnfr.200700137.
[3] GHOSH D , SCHEEPENS A.Vascular action of polyphenols[J].Molecular Nutrition & Food Research, 2009, 53(3): 322-331.DOI:10.1002/mnfr.200800182.
[4] SERRANO J, PUUPPONEN-PIMIA R, DAUER A, et al.Tannins: current knowledge of food sources, intake, bioavailability and biological effects[J].Molecular Nutrition & Food Research, 2009,53(Suppl 2): 310-329.DOI:10.1002/mnfr.200900039.
[5] TERRA X, MONTAGUT G, BUTOS M, et al.Grape-seed procyanidins prevent low-grade inflammation by modulating cytokine expression in rats fed a high-fat diet[J].Journal of Nutritional Biochemistry, 2009, 20(3): 210-218.DOI:10.1016/ j.jnutbio.2008.02.005.
[6] ZHAO C F, LEI D J, SONG G H, et al.Characterisation of watersoluble proanthocyanidins of Pyracantha fortuneana fruit and their improvement in cell bioavailable antioxidant activity of quercetin[J].Food Chemistry, 2015, 169: 484-491.DOI:10.1016/ j.foodchem.2014.07.091.
[7] FU Y, QIAO L P, CAO Y M, et al.Structural elucidation and antioxidant activities of proanthocyanidins from Chinese bayberry (Myrica rubra Sieb.et Zucc.) leaves[J].PLoS ONE, 2014, 9(5): e96162.DOI:10.1371/journal.pone.0096162.
[8] CAIMARI A, del BAS J M, CRESCENTI A, et al.Low doses of grape seed procyanidins reduce adiposity and improve the plasma lipid profile in hamsters[J].International Journal of Obesity, 2013, 37(4): 576-583.DOI:10.1038/ijo.2012.75.
[9] DORENKOTT M R, GRIFFIN L E, GOODRICH K M, et al.Oligomeric cocoa procyanidins possess enhanced bioactivity compared to monomeric and polymeric cocoa procyanidins for preventing the development of obesity, insulin resistance, and impaired glucose tolerance during high-fat feeding[J].Journal of Agricultural and Food Chemistry, 2014, 62(10): 2216-2227.DOI:10.1021/jf500333y.
[10] KIMURA H, OGAWA S, SUGIYAMA A, et al.Anti-obesity effects of highly polymeric proanthocyanidins from seed shells of Japanese horse chestnut (Aesculus turbinata Blume)[J].Food Research International,2011, 44(1): 121-126.DOI:10.1016/j.foodres.2010.10.052.
[11] PALLARES V, FERNANDEZ-IGLESIAS A, CEDO L, et al.Grape seed procyanidin extract reduces the endotoxic effects induced by lipopolysaccharide in rats[J].Free Radical Biology Medicine, 2013,60: 107-114.DOI:10.1016/j.freeradbiomed.2013.02.007.
[12] MONTAGUT G, ONNOCKX S, VAQUE M, et al.Oligomers of grape-seed procyanidin extract activate the insulin receptor and key targets of the insulin signaling pathway differently from insulin[J].Journal of Nutritional Biochemistry, 2010, 21(6): 476-481.DOI:10.1016/j.jnutbio.2009.02.003.
[13] AGOUNI A, LAGRUE-LAK-HAL A H, MOSTEFAI H A, et al.Red wine polyphenols prevent metabolic and cardiovascular alterations associated with obesity in Zucker fatty rats (Fa/Fa)[J].PLoS ONE,2009, 4(5): e5557.DOI:10.1371/journal.pone.0005557.
[14] del BAS J M, FERNANDEZ-LARREA J, BLAY M, et al.Grape seed procyanidins improve atherosclerotic risk index and induce liver CYP7A1 and SHP expression in healthy rats[J].The FASEB Journal,2005, 19(3): 479-481.DOI:10.1096/fj.04-3095fje.
[15] QUESADA H, del BAS J M, PAJUELO D, et al.Grape seed proanthocyanidins correct dyslipidemia associated with a high-fat diet in rats and repress genes controlling lipogenesis and VLDL assembling in liver[J].International Journal of Obesity, 2009, 33(9): 1007-1012.DOI:10.1038/ijo.2009.136.
[16] QUESADA H, DIAZ S, PAJUELO D, et al.The lipid-lowering effect of dietary proanthocyanidins in rats involves both chylomicron-rich and VLDL-rich fractions[J].British Journal of Nutrition, 2012, 108(2): 208-217.DOI:10.1017/S0007114511005472.
[17] LI H, HORKE S, FORSTERMANN U, et al.Vascular oxidative stress,nitric oxide and atherosclerosis[J].Atherosclerosis, 2014.237(1): 208-219.DOI:10.1016/j.atherosclerosis.2014.09.001.
[18] HUSSAIN M M.A proposed model for the assembly of chylomicrons[J].Atherosclerosis, 2000, 148(1): 1-15.DOI:10.1016/ S0021-9150(99)00397-4.
[19] del BAS J M, RICKETTS M L, BAIGES I, et al.Dietary procyanidins lower triglyceride levels signaling through the nuclear receptor small heterodimer partner[J].Molecular Nutrition & Food Research, 2008,52(10): 1172-1181.DOI:10.1002/mnfr.200900476.
[20] BLADE C L, AROLA L, SALVADO M J, Hypolipidemic effects of proanthocyanidins and their underlying biochemical and molecular mechanisms[J].Molecular Nutrition & Food Research, 2010, 54(1): 37-59.DOI:10.1002/mnfr.200900476.
[21] WANG S, DONG S, ZHANG R, et al.Effects of proanthocyanidins on porcine pancreatic lipase: conformation, activity, kinetics and thermodynamics[J].Process Biochemistry, 2014, 49(2): 237-243.DOI:10.1016/j.procbio.2013.10.018.
[22] PAL S, NAISSIDES M, MAMO J C L.Polyphenolics and fat absorption[J].International Journal of Obesity and Related Metabolic Disorders, 2004, 28(2): 324-326.DOI:10.1038/sj.ijo.0802577.
[23] NAISSIDES M, MAMO J C L, JAMES A P, et al.The effect of chronic consumption of red wine on cardiovascular disease risk factors in postmenopausal women[J].Atherosclerosis, 2006, 185(2): 438-445.DOI:10.1016/j.atherosclerosis.2005.06.027.
[24] NAISSIDES M, MAMO J C L, JAMES A P, et al.The effect of acute red wine polyphenol consumption on postprandial lipaemia in postmenopausal women[J].Atherosclerosis, 2004, 177(2): 401-408.DOI:10.1016/j.atherosclerosis.2004.07.025.
[25] VIDAL R, HERNANDEZ-VALLEJO S, PAUQUAI T, et al.Apple procyanidins decrease cholesterol esterification and lipoprotein secretion in Caco-2/TC7 enterocytes[J].The Journal of Lipid Research,2005, 46(2): 258-268.DOI:10.1194/jlr.M400209-JLR200.
[26] RAMSAY R R, GANDOUR R D, van der LEIJ F R.Molecular enzymology of carnitine transfer and transport[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,2001, 1546(1): 21-43.DOI:10.1016/S0167-4838(01)00147-9.
[27] IKARASHI N, TODA T, OKANIWA T, et al.Anti-obesity and antidiabetic effects of acacia polyphenol in obese diabetic KKAy mice fed high-fat diet[J].Evidence-Based Complementary and Alternative Medicine, 2011, 2011: 952031.DOI:10.1093/ecam/nep241.
[28] CASANOVA E, BASELGA-ESCUDERO L, RIBAS-LATRE A, et al.Chronic intake of proanthocyanidins and docosahexaenoic acid improves skeletal muscle oxidative capacity in diet-obese rats[J].Journal of Nutritional Biochemistry, 2014, 25(10): 1003-1010.DOI:10.1016/j.jnutbio.2014.05.003.
[29] CHEN Z Y, MA K Y, LIANG Y, et al.Role and classification of cholesterol-lowering functional foods[J].Journal of Functional Foods,2011, 3(2): 61-69.DOI:10.1016/j.jff.2011.02.003.
[30] del BAS J M, RICKETTS M L, VAQUE M, et al.Dietary procyanidins enhance transcriptional activity of bile acid-activated FXR in vitro and reduce triglyceridemia in vivo in a FXR-dependent manner[J].Molecular Nutrition & Food Research, 2009, 53(7): 805-814.DOI:10.1016/j.jff.2011.02.003.
[31] JIAO R, ZHANG Z, YU H, et al.Hypocholesterolemic activity of grape seed proanthocyanidin is mediated by enhancement of bile acid excretion and up-regulation of CYP7A1[J].Journal of Nutritional Biochemistry, 2010, 21(11): 1134-1139.DOI:10.1016/ j.jnutbio.2009.10.007.
[32] WATANABE M, HOUTEN S M, WANG L, et al.Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c[J].Journal of Clinical Investigation, 2004, 113(10): 1408-1418.DOI:10.1172/JCI21025.
[33] JIAO Y, LU Y, LI X Y, Farnesoid X receptor: a master regulator of hepatic triglyceride and glucose homeostasis[J].Acta Pharmacol Sin,2015, 36(1): 44-50.DOI:10.1038/aps.2014.116.
[34] OSADA K, SUZUKI T, KAWAKAMI Y, et al.Dose-dependent hypocholesterolemic actions of dietary apple polyphenol in rats fed cholesterol[J].Lipids, 2006, 41(2): 133-139.DOI:10.1007/s11745-006-5081-y.
[35] AVRAMOGLU R K, BASCIANO H, ADELI K.Lipid and lipoprotein dysregulation in insulin resistant states[J].Clinica Chimica Acta, 2006,368(1/2): 1-19.DOI:10.1016/j.cca.2005.12.026.
[36] STAELS B, MAES M, ZAMBON A.Fibrates and future PPAR[alpha]agonists in the treatment of cardiovascular disease[J].Nature Clinical Practice Cardiovascular Medicine Journal, 2008, 5(9): 542-553.DOI:10.1038/ncpcardio1278.
[37] SHIMADA T, TOKUHARA D, TSUBATA M, et al.Flavangenol (pine bark extract) and its major component procyanidin B1 enhance fatty acid oxidation in fat-loaded models[J].European Journal of Pharmacology, 2012, 677(1/3): 147-153.DOI:10.1016/ j.ejphar.2011.12.034.
[38] van DAM A D, KOOIJMAN S, SCHILPEROORT M, et al.Regulation of brown fat by AMP-activated protein kinase[J].Trends in Molecular Medicine, 2015, 21(9): 571-579.DOI:10.1016/j.molmed.2015.07.003.
[39] CELI F S.Brown adipose tissue: when it pays to be inefficient[J].The New England Journal of Medicine, 2009, 360(15): 1553-1556.DOI:10.1056/NEJMe0900466.
[40] YAMASHITA Y, OKABE M, NATSUME M, et al.Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet-fed C57BL/6 mice[J].Archives of Biochemistry and Biophysics, 2012, 527(2): 95-104.DOI:10.1016/ j.abb.2012.03.018.
[41] PAJUELO D, DIAZ S, QUESADA H, et al.Acute administration of grape seed proanthocyanidin extract modulates energetic metabolism in skeletal muscle and BAT mitochondria[J].Journal of Agricultural and Food Chemistry, 2011, 59(8): 4279-4287.DOI:10.1021/ jf200322x.
[42] WU Z, PUIGSERVER P, ANDERSSON U, et al.Mechanisms controlling mitochondrial biogenesis and respiration through the thermogenic coactivator PGC-1[J].Cell, 1999, 98(1): 115-124.DOI:10.1016/S0092-8674(00)80611-X.
DOI:10.7506/spkx1002-6630-201613040
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)13-0220-06
收稿日期:2016-02-16
基金项目:国家自然科学基金面上项目(C200501)
作者简介:张妤(1991—),女,博士研究生,研究方向为天然产物。E-mail:11513031@zju.edu.cn
*通信作者:叶兴乾(1962—),男,教授,博士,研究方向为果蔬加工。E-mail:psu@zju.edu.cn
The Hypolipidemic Mechanism of Proanthocyanidins
ZHANG Yu, LI Lanqi, GONG Hui, CHEN Shiguo, YE Xingqian*
(College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Abstract:Proanthocyanidins are a class of polyphenols that consist of flavan-3-ols as their basic unit and exist in various types of plants.In this review, the regulation of proanthocyanidins on the key proteins of the metabolism pathways of triglycerides and cholesterol is summarized.Also, how proanthocyanidins regulate body weight, energy intake and energy expenditure through adenosine 5'-monophosphate-activated protein kinase (AMPK) pathway to exert their hypolipidemic effects is demonstrated with details as well.
Key words:proanthocyanidins; triglyceride; cholesterol; adenosine 5'-monophosphate-activated protein kinase (AMPK); metabolism
