湿热处理多孔玉米淀粉对大鼠脂质代谢的影响
2016-08-10刘庆庆游玉明陆红佳田宝明陈朝军铜仁学院生物与农林工程学院贵州铜仁554300西南大学食品科学学院重庆400715重庆文理学院林学与生命科学学院重庆40160
刘庆庆,游玉明,陆红佳,田宝明,陈朝军,刘 雄,*(1.铜仁学院生物与农林工程学院,贵州 铜仁 554300;.西南大学食品科学学院,重庆 400715;3.重庆文理学院林学与生命科学学院,重庆 40160)
湿热处理多孔玉米淀粉对大鼠脂质代谢的影响
刘庆庆1,2,游玉明2,3,陆红佳2,3,田宝明2,陈朝军2,刘 雄2,*
(1.铜仁学院生物与农林工程学院,贵州 铜仁 554300;2.西南大学食品科学学院,重庆 400715;3.重庆文理学院林学与生命科学学院,重庆 402160)
摘 要:目的:探讨湿热处理多孔玉米淀粉对大鼠脂质代谢的影响。方法:32 只雌性Sprague-Dawley(SD)大鼠随机分为4 组,其中1 组为对照组饲喂基础饲料,另外3 组为高脂组,分别为高脂空白组、多孔淀粉组(porous starch,PS)和湿热处理多孔淀粉组(heat moisture treatment starch,HTMPS),饲喂基础饲料,适应1 周后,对照组饲喂基础饲料,高脂组分别饲喂相应高脂饲料。饲喂4 周后解剖,检测大鼠血脂、肝脂及小肠和粪便中胆汁酸等指标。结果:饲喂多孔淀粉和湿热处理多孔淀粉组大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、非高密度脂蛋白胆固醇(non-high-density lipoprotein cholesterol,non-HDL-C)、抗动脉硬化指数(atherosclerosis index,AI)、甘油三酯/高密度脂蛋白胆固醇(TG/HDL-C)、肝脏TC、肝脏总TC和腹部脂肪含量显著下降(P<0.05),粪便中粪醇、胆固醇等中性固醇排泄量增加,粪便中胆汁酸排泄量显著增加(P<0.05)。PS组与HTMPS组相比,大鼠血浆中TC、AI、腹部脂肪含量、肝脏总脂肪含量较低,粪便中胆汁酸及小肠内容物中胆汁酸较高。结论:多孔淀粉降血脂降胆固醇效果优于湿热处理多孔玉米淀粉,可降低高脂饮食造成的高脂血症风险,对预防心血管疾病有一定的作用。
关键词:多孔玉米淀粉;湿热处理;血脂;中性固醇
引文格式:
刘庆庆, 游玉明, 陆红佳, 等.湿热处理多孔玉米淀粉对大鼠脂质代谢的影响[J].食品科学, 2016, 37(13): 214-219.
LIU Qingqing, YOU Yuming, LU Hongjia, et al.Effect of heat-moisture treated corn porous starch on lipid metabolism in rats[J].Food Science, 2016, 37(13): 214-219.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613039.http://www.spkx.net.cn
高脂血症是体内脂类代谢紊乱导致血脂水平超过正常范围的一种疾病,并引发一系列代谢综合征,如动脉粥样硬化、肥胖症、糖尿病、高血压、冠心病、脂肪肝等,对人类健康产生了巨大的危害,如何有效地通过营养干预降低高脂血症的发病率是当代人们迫切的需求[1-2]。众所周知,科学合理的膳食结构和健康的饮食习惯,对预防心血管系统疾病的发生具有关键作用。
多孔淀粉(porous starch,PS)作为一种新型的变性淀粉,作为一种天然、经济、生物可降解的吸附材料,在食品领域可用作吸附香料、甜味剂、调味料、酶、风味物质的理想缓释材料[3-8]。湿热处理是在低水分含量(<35%),较高温度(高于糊化温度,通常在100 ℃以上)条件下对淀粉进行的处理[9-11]。淀粉的湿热处理过程只涉及到水和热,是一种纯粹的物理变化过程,与化学改性相比是一种天然、安全的方法[12]。目前,对多孔淀粉理化性质、物理改性和化学改性方面的研究较多,而对其降血脂方面的研究尚未见报道。吸附性多孔淀粉及湿热处理后的多孔淀粉摄入体内后是否具有阻滞肠道脂质吸收代谢、血脂效果,本实验将以自制多孔淀粉和湿热处理多孔淀粉(heat moisture treatment starch,HTMPS)为研究对象,对高脂膳食喂养大鼠脂代谢紊乱的干扰效果进行研究,探讨其是否具有降血脂功效,这对寻找一种通过膳食降低高血脂症风险的途径具有重要的意义。
1 材料与方法
1.1 材料与试剂
玉米淀粉 市售。
30%过氧化氢、乙醚、氯仿、甲醇、甲醛、无水乙醇、二甲苯、冰醋酸(分析纯)、甲醇(色谱级)成都市科龙化工试剂厂;苦味酸(分析纯) 鞍山智邦化工试剂厂;乙酸乙酯(色谱级) 天津市福晨化学试剂厂;血清总胆固醇(total cholesterol,TC)测定试剂盒、血清甘油三酯(triglyceride,TG)测定试剂盒、血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、血清低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒 四川迈克生物科技股份有限公司;总胆汁酸测定试剂盒 上海丰翔生物科技有限公司;5α-胆甾烷、胆固醇、粪(甾)醇 美国Sigma公司;苏木精、伊红碧云天生物技术研究所;切片石蜡、中性树胶 徕克医疗仪器有限公司;其他均为常用生化试剂或分析纯试剂。
1.2 仪器与设备
DHG-9070电热恒温鼓风干燥箱 上海齐欣科学有限公司;1-15PK冷冻离心机 美国Sigma公司;ES-315高压蒸汽灭菌锅 日本Seisakusyo公司;7020型全自动生化分析仪 日本日立株式会社制作所;GCMS-2010气相色谱仪 日本岛津公司;DB-1毛细管柱 安捷伦科技(中国)有限公司;SHB-Ⅲ循环水式多用真空泵郑州长城科工贸有限公司;ALPHA1-4LSC真空冷冻干燥机 德国Christ公司;Imark酶标仪 美国Bio-Rad公司;A1130440数码显微镜 德国Leica公司;H550L高分辨率数码成像系统 日本尼康株式会社。
1.3 实验动物
雌性Sprague-Dawley(SD)大鼠,清洁级,4 周龄,体质量(100±10) g,购自重庆市滕鑫比尔实验动物销售有限公司,动物许可证号:SCXK(渝)20070008。
1.4 方法
1.4.1 多孔玉米淀粉及其湿热处理
根据文献[13-15]制备多孔玉米淀粉:称取100 g玉米淀粉,置于1 000 mL的烧杯中,加入pH 5.2的醋酸钠缓冲液配制好的复合酶液(复合酶添加量为2%,葡萄糖淀粉酶与α-淀粉酶的质量比为1∶2)750 mL,置于50 ℃水浴中反应,用磁力搅拌器搅拌,并准确计时,搅拌反应5 h后,用2 mol/L NaOH调节pH值至10,以终止反应。将悬浮液在3 000 r/min条件下离心5 min,弃去上清液,剩余淀粉用蒸馏水洗涤并离心,如此重复3 次,将所得淀粉置于烘箱中干燥,用粉碎机粉碎后,即得多孔淀粉。
湿热处理多孔玉米淀粉的制备:调节多孔淀粉水分含量为15%,室温下平衡24 h,抽真空包装,放入高压灭菌锅中,于115 ℃条件下处理1 h,取出冷却,粉碎,过100 目筛。
1.4.2 动物分组与饲养
32 只清洁级雌性SD大鼠,按体质量随机分为4 组,每组8 只,分别为对照组和高脂组,其中高脂组又分为空白组、多孔淀粉组(PS组)和湿热处理多孔淀粉组(HTMPS组),所有大鼠饲喂基础饲料,自由采食和饮水,适应环境一周后,再分别喂食相应的饲料4 周,饲料配方见表1。饲养期间,动物饲养室采取12 h昼夜交替,室温保持在(25±2)℃,相对湿度维持在55%~65%,换气良好,笼具卫生、安全无毒。每3 d称大鼠体质量并记录每日采食量。
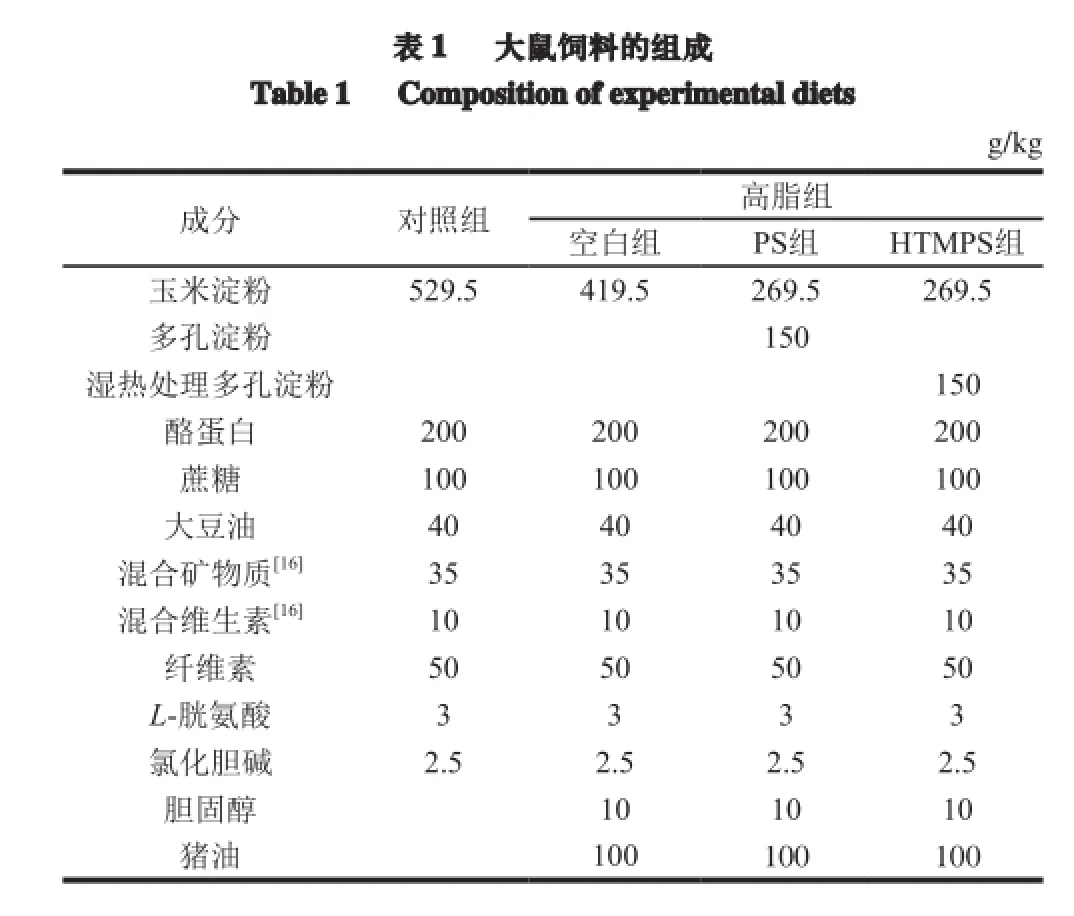
表 1 大鼠饲料的组成Table 1 Compositionof experimental diets g/kg成分 对照组 高脂组空白组 PS组 HTMPS组玉米淀粉 529.5 419.5 269.5 269.5多孔淀粉 150湿热处理多孔淀粉 150酪蛋白 200 200 200 200蔗糖 100 100 100 100大豆油 40 40 40 40混合矿物质[16]35 35 35 35混合维生素[16]10 10 10 10纤维素 50 50 50 50 L-胱氨酸 3 3 3 3氯化胆碱 2.5 2.5 2.5 2.5胆固醇 10 10 10猪油 100 100 100
1.4.3 样本收集
收集大鼠解剖前4 d的粪便,装入样品袋中,于-20 ℃冰箱中保存,真空冷冻干燥后称量粪便干质量、粉碎后贮存于干燥环境下,用于粪便中胆汁酸和中性固醇含量的测定。
实验期最后1 d禁食12 h,乙醚麻醉后将大鼠断头处死,将血液收集在装有抗凝剂的采血管中,于4 000 r/min、4 ℃条件下离心15 min,血清分装在1.5 mL离心管中,于-20 ℃保存待分析。
取血完毕后,将大鼠解剖,完整摘取肝脏,用冰冷的生理盐水冲洗干净,擦干称量并记录肝脏总质量;准确称取(1.00±0.01)g肝脏,用铝箔纸包好装入样品袋,于-20 ℃保存,用于肝脂含量的测定;选取肝脏中部较规则部分,用刀片切取0.5 cm×0.5 cm×0.5 cm的立方体组织,置于配制好的波恩氏(Bouin's)固定液中固定,用于制作肝脏组织的石蜡切片。
取出小肠,用25 mL预冷生理盐水冲洗小肠内容物至预先打孔称质量的离心管中,于-20 ℃冰箱中保存,真空冷冻干燥后称量小肠内容物干质量;贮存于干燥环境下,用于小肠内容物中总胆汁酸含量的测定。
1.4.4 检测指标
1.4.4.1 饲料效率的测定[17]
实验前测定大鼠的体质量,实验期间每天记录采食量,实验结束时测定每只大鼠体质量。计算出4 周的实验期内大鼠体质量增加量和总的饲料采食量。

1.4.4.2 血脂和肝脂含量的测定
将采集的血浆于0 ℃条件下完全解冻,4 000 r/min、4 ℃离心15 s,脱除絮状物,按试剂盒的要求,用全自动生化分析仪测定血浆中TC、TG、HDL-C和LDL-C的浓度。肝脏中总脂肪采用Folch等[18]的方法提取,用质量差法测定总脂肪含量,同时使用试剂盒测定抽提液中TC和TG的浓度。血清中非高密度脂蛋白胆固醇(nonhigh-density lipoprotein cholesterol,non-HDL-C)、动脉硬化指数(atherosclerosis index,AI)和抗动脉硬化指数(anti-atherosclerosis index,AAI)的计算见下式。

1.4.4.3 粪便和小肠内容物总胆汁酸含量的测定
参照文献[19-22]方法,采用大鼠总胆汁酸酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)测定试剂盒测定粪便和小肠内容物总胆汁酸含量。严格按照试剂盒说明书步骤操作。
1.4.4.4 粪便中中性固醇含量的测定
参考Kato等[23]的方法,取0.05 g粉碎后的样品与带螺旋密封盖的试管中,加入氯仿-甲醇(1∶1,V/V)的混合溶剂5 mL,在60 ℃恒温水浴中抽提18 h。取抽提液2.5 mL于离心管中,加入0.01 mol/L 5α-胆甾烷甲醇溶液100 μL作为内标物,真空脱除溶剂;加入100 μL甲醇溶解,然后加入2 mL 5 mol/L NaOH溶液,充分混匀后,放入高压灭菌锅中处理4 h。待处理液冷却后,加入3 mL沸程为30~60 ℃的石油醚混合均匀后,于4 ℃、4 000 r/min条件下离心5 min,移出上层溶液,下层溶液重复萃取2 次,合并上层萃取液,萃取液脱溶剂后加入1 mL乙酸乙酯,充分溶解后,采用气相色谱(gas chromatography,GC)测定中性固醇(主要包括粪醇和胆固醇)含量。
GC条件:色谱柱为DB-1毛细管柱(30 m× 0.53 mm,0.32 μm),载气流速16.9 mL/min,进样量1 μL,不分流进样,柱温箱260 ℃,氢火焰离子化(fame ionization detector,FID)检测器,进样口及检测器温度为280 ℃。
1.4.4.5 肝脏切片染色观察
采用苏木精-伊红(hematoxylin-eosin,HE)染色法,肝脏经固定、脱水、透明及石蜡包埋后,制成5 μm厚的切片,经HE染色处理后采用高分辨率数码成像系统观察切片并拍照。
1.5 数据处理
2 结果与分析
2.1 湿热处理多孔淀粉对饲料效率的影响
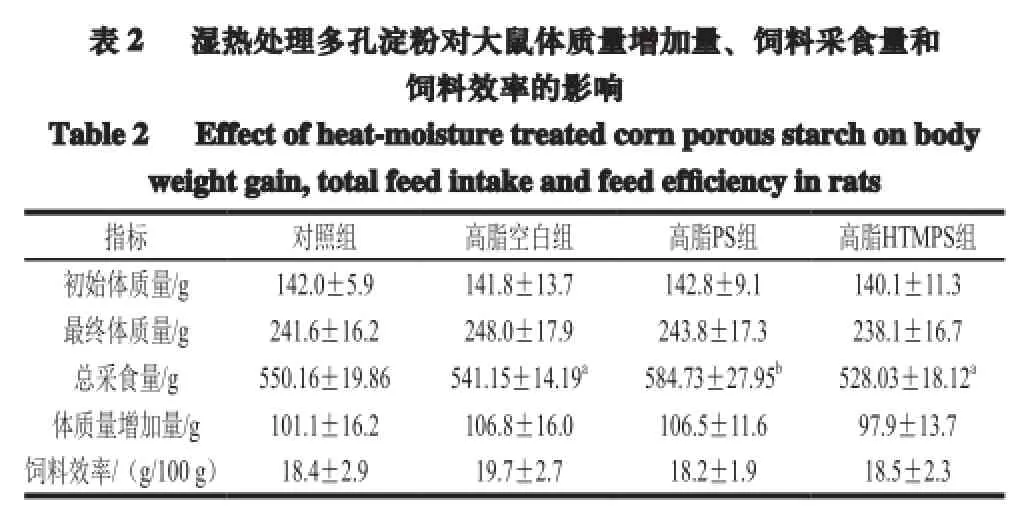
注:同行小写字母不同表示组间差异显著(P<0.05)。
由表2可知,与对照组相比,PS组采食量增加,HTMPS组下降,这可能是由于湿热处理后的多孔淀粉带有不愉快气味,口感较差,导致大鼠食欲下降。与高脂空白组相比,高脂组体质量增加量无显著性,饲料效率无显著差异。
2.2 湿热处理多孔淀粉对大鼠血脂的影响
TC和TG是研究机体胆固醇代谢的重要指标;HDL-C的主要作用是将肝脏外的胆固醇逆向转运回肝脏,LDL-C的主要作用是将肝脏中合成的胆固醇转运到全身各组织。大鼠血浆中TC、TG、HDL-C和LDL-C含量见表3。
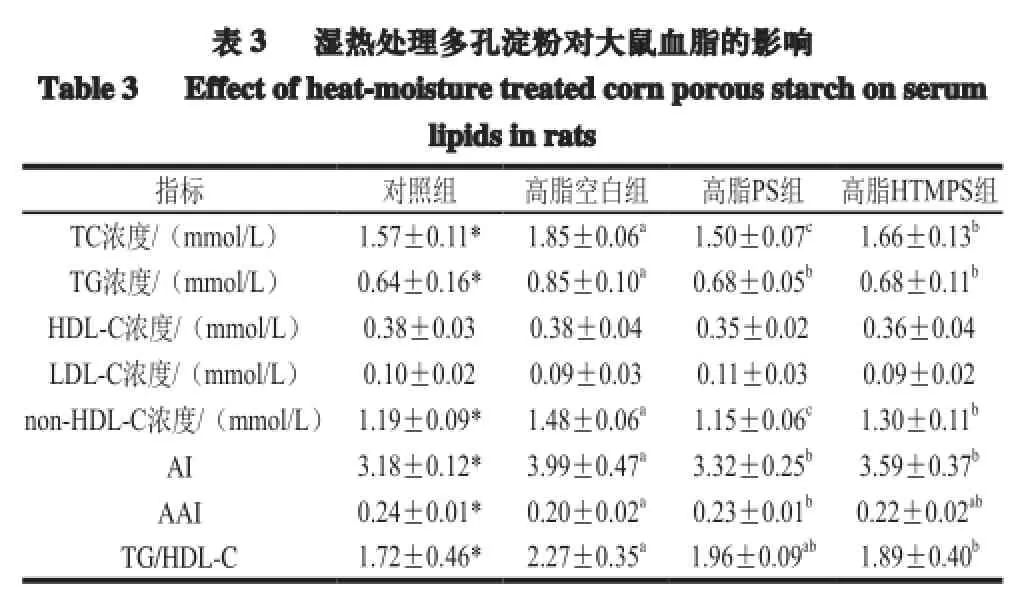
注:*.对照组与高脂空白组相比差异显著(P<0.05);小写字母不同表示组间差异显著(P<0.05)。表4同。
由表3可知,与对照组相比,高脂空白组TC、TG、non-HDL-C、AI和TG/HDL-C显著增加(P<0.05),说明对SD大鼠饲喂高脂高胆固醇饲料相对于饲喂基础饲料更容易引发心血管疾病。PS组与对照组相比TC、TG、HDL-C、LDL-C、non-HDL-C、AI、AAI、TG/HDL-C无显著性差异,PS组与高脂空白组相比TC、TG、non-HDL-C、LDL-C、AI显著下降(P<0.05),TG/HDL-C下降但无显著性差异,AAI显著升高(P<0.05);HTMPS组与空白组相比,TC、TG、non-HDL-C、AI、TG/HDL-C显著下降(P<0.05),说明湿热处理多孔淀粉具有降低患心血管疾病风险的作用。
2.3 湿热处理多孔淀粉对大鼠腹部脂肪及肝脏质量的影响
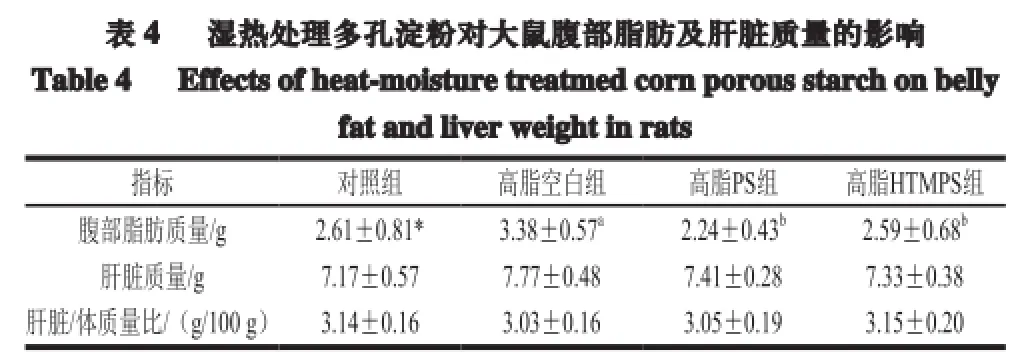
表 4 湿热处理多孔淀粉对大鼠腹部脂肪及肝脏质量的影响Table 4 Effects of heat-moisture treatmed corn porous starch on bellyfat andliverweightin rats指标 对照组 高脂空白组 高脂PS组 高脂HTMPS组腹部脂肪质量/g 2.61±0.81* 3.38±0.57a2.24±0.43b2.59±0.68b肝脏质量/g 7.17±0.57 7.77±0.48 7.41±0.28 7.33±0.38肝脏/体质量比/(g/100 g) 3.14±0.16 3.03±0.16 3.05±0.19 3.15±0.20
由表4可知,与对照组相比,高脂空白组腹部脂肪含量显著增加,饲喂高脂PS组和HTMPS组腹部脂肪则无显著性差异。高脂PS组和高脂HTMPS组与高脂空白组相比,均显著下降(P<0.05),说明在饲料中添加多孔淀粉和经过湿热处理的多孔淀粉能有效降低腹部脂肪堆积,由实验结果可知,多孔淀粉组降低效果较好。高脂空白组肝脏质量高于其他组,各组大鼠肝脏质量没有显著差异,肝脏质量的差异与体质量变化趋势呈现出一致性,可能是由于体质量差异引起的,说明不同处理淀粉对大鼠肝脏质量无显著影响。各组大鼠肝脏质量与体质量比之间无显著性差异。
2.4 湿热处理多孔淀粉对大鼠肝脂的影响
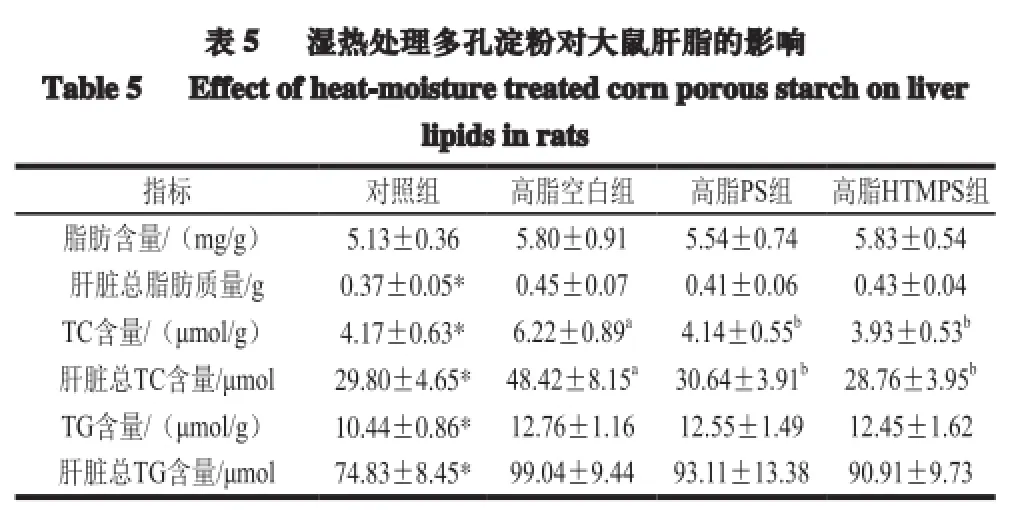
注:不同小写字母表示高脂组间差异显著(P<0.05)。下同。
由表5可知,各组肝脏脂肪含量之间无显著性差异,高脂组与对照组相比有所增加。与对照组相比,高脂空白组肝脏总脂肪含量、TC含量、总TC含量、TG含量、总TG含量均显著增加(P<0.05)。与高脂空白组相比,高脂PS组和高脂HTMPS组TC含量、总TC含量显著下降(P<0.05),总脂肪质量、TG含量和总TG含量呈下降趋势,无显著性。
2.5 湿热处理多孔淀粉对大鼠肝脏组织形态的影响
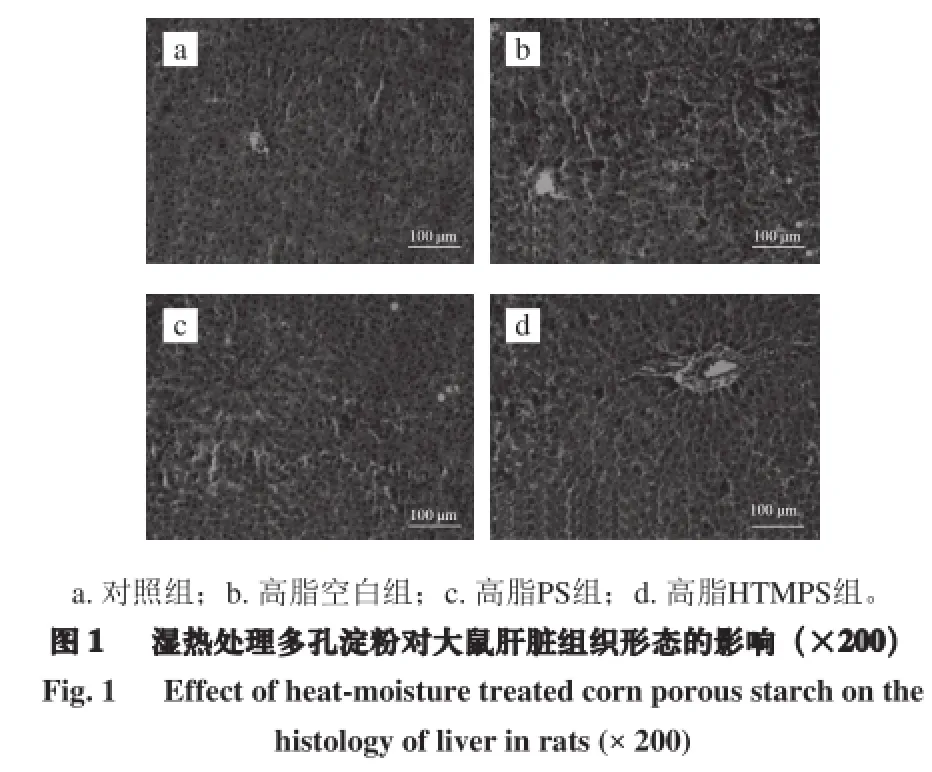
由图1可知,大鼠经过4 周喂养之后,对照组的肝脏组织结构清晰、完整,肝细胞呈圆形大小均匀,分布整齐。而高脂空白组的肝细胞的胞浆当中出现大量的圆形脂滴空泡,有的部分空泡融合后将细胞膜挤到胞膜下,细胞体积与高脂空白组相比明显增加,说明高脂高胆固醇易诱导大鼠肝脏出现脂肝。高脂PS组和高脂HTMPS组也可观察到一定量的脂滴空泡,但与高脂空白组相比脂肪肝的症状已得到很大的减轻。说明多孔淀粉和湿热处理多孔淀粉能减少肝脏中的脂肪堆积,对减轻大鼠的肝脏的脂肪肝症状有较好的效果。
2.6 湿热处理多孔淀粉对大鼠粪便中性固醇含量的影响
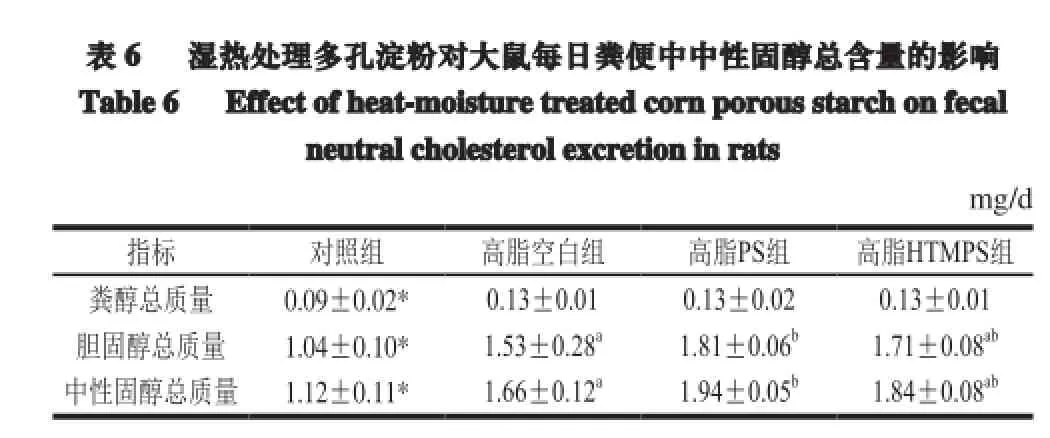
表 6 湿热处理多孔淀粉对大鼠每日粪便中中性固醇总含量的影响Table 6 Effect of heat-moisture treated corn porous starch on fecalneutralcholesterolexcretion inrats mg/d指标 对照组 高脂空白组 高脂PS组 高脂HTMPS组粪醇总质量 0.09±0.02* 0.13±0.01 0.13±0.02 0.13±0.01胆固醇总质量 1.04±0.10* 1.53±0.28a1.81±0.06b1.71±0.08ab中性固醇总质量 1.12±0.11* 1.66±0.12a1.94±0.05b1.84±0.08ab
由表6可知,与对照组相比,高脂空白组粪便中粪醇、胆固醇排泄量显著增加,即中性固醇的排泄量显著增加(P<0.05),高脂PS组较高脂空白组显著增加(P<0.05),高脂HTMPS组较高脂空白组增加,但无显著性。说明饲喂多孔淀粉和湿热处理多孔淀粉可以在一定程度上增加大鼠粪便中中性固醇的排泄。多孔淀粉效果优于湿热处理多孔淀粉。
2.7 湿热处理多孔淀粉对大鼠粪便和小肠内容物胆汁酸含量的影响
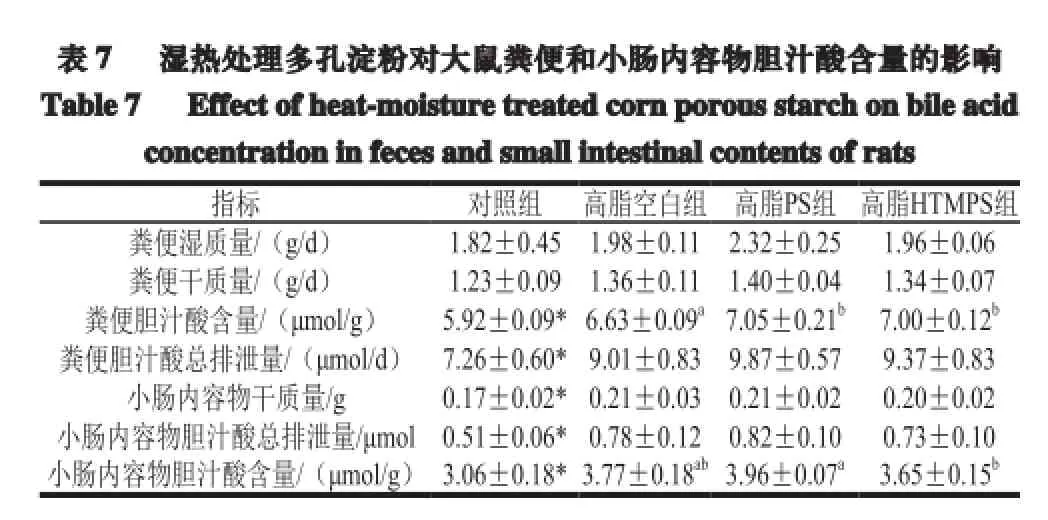
表 7 湿热处理多孔淀粉对大鼠粪便和小肠内容物胆汁酸含量的影响Table 7 Effect of heat-moisture treated corn porous starchon bileacidconcentration in feces and small intestinal contents of rats指标 对照组 高脂空白组 高脂PS组 高脂HTMPS组粪便湿质量/(g/d) 1.82±0.45 1.98±0.11 2.32±0.25 1.96±0.06粪便干质量/(g/d) 1.23±0.09 1.36±0.11 1.40±0.04 1.34±0.07粪便胆汁酸含量/(μmol/g) 5.92±0.09*6.63±0.09a7.05±0.21b7.00±0.12b粪便胆汁酸总排泄量/(μmol/d) 7.26±0.60*9.01±0.83 9.87±0.57 9.37±0.83小肠内容物干质量/g 0.17±0.02*0.21±0.03 0.21±0.02 0.20±0.02小肠内容物胆汁酸总排泄量/μmol0.51±0.06*0.78±0.12 0.82±0.10 0.73±0.10小肠内容物胆汁酸含量/(μmol/g) 3.06±0.18*3.77±0.18ab3.96±0.07a3.65±0.15b
由表7可知,与对照组相比,高脂空白组粪便湿质量、粪便干质量呈上升趋势,粪便中胆汁酸含量及每天粪便中胆汁酸排泄量、小肠内容物干质量及小肠内容物中胆汁酸含量显著增加(P<0.05)。高脂PS组和高脂HTMPS组较高脂空白组粪便中胆汁酸含量显著增加,每日粪便中胆汁酸的总排泄量增加,且高脂PS组每日粪便中胆汁酸排泄量最多。小肠内容物中胆汁酸含量各组间无显著性差异,高脂PS组高于高脂空白组,高脂HTMPS组略低于高脂空白组。
3 结 论
血脂含量升高会增加心血管疾病的发生风险和冠心病患者的死亡率,是冠心病发生的一个独立危险因素[24-25]。本实验主要探讨湿热处理多孔玉米淀粉和多孔玉米淀粉能否降低高血脂相关疾病的发生机率。研究发现:多孔淀粉和湿热处理后的多孔淀粉,能够使高脂饲料大鼠血清TC、TG、AI、TG/HDL-C、肝脏TC含量显著降低。胆固醇的代谢吸收是调节体内脂质代谢的一个重要指标,其中胆汁酸的排泄和中性固醇的排泄量又是衡量胆固醇吸收代谢的一个重要指标。饲喂多孔淀粉和湿热处理多孔淀粉后,粪便中胆汁酸含量显著增加,并能促进粪便粪醇、胆固醇等中性固醇的排泄。综上,饲喂多孔淀粉和湿热处理多孔淀粉具有一定的降血脂、降胆固醇功效,降血脂效果多孔淀粉优于湿热处理多孔淀粉。本研究对合理应用多孔淀粉有一定参考价值,但对其降血脂机理还有待进一步的研究。
参考文献:
[1] BASCIANO H, FEDERICOL L.Fructose, insulin resistance and meta-bolic dyslipidemia[J].Nutrition & Metabolism, 2005, 2(1): 5.DOI:10.1186/1743-7075-2-5.
[2] MARÍA A F, YOLANDA B L, ADRIANA C.The reduction of dietary sucrose improves dyslipidemia, adiposity and insulin secretion in an insulin resistant rat model[J].Nutrition, 2007, 23(6): 489-497.
[3] CHANG P R, YU Jiugao, MA Xiaofei.Preparation of porous starch and its use as a structure-directing agent for production of porous zinc oxide[J].Carbohydrate Polymers, 2011, 83(2): 1016-1019.DOI:10.1016/j.carbpol.2010.08.076.
[4] LUO Zhigang, FU Xiong.Immobilization of urease on dialdehyde porous starch[J].Starch-Stärke, 2010, 62(12): 652-657.DOI:10.1002/ star.201000067.
[5] NAGATA K, OKAMOTO H, DANJO K.Naproxen particle design using porous starch[J].Drug Development and Industrial Pharmacy,2001, 27(4): 287-296.DOI:10.1081/DDC-100103728.
[6] YOSHIMARU T, SHIBATA M, FUKUGOMORI T, et al.Preparation and characteristics of rumen-bypass microcapsules for improvement of productivity in ruminants[J].Journal of Agricultural and Food Chemistry, 1999, 47(2): 554-557.DOI:10.1021/jf980708l.
[7] GLENN G M, KLAMCZYNSKI A P, WOODS D F, et al.Encapsulation of plant oils in porous starch microspheres[J].Journal of Agricultural and Food Chemistry, 2010, 58(7): 4180-4184.DOI:10.1021/jf9037826.
[8] TORRES F G, BOCCACCINI A R, TRONCOSO O P.Microwave processing of starch-based porous structures for tissue engineering scaffolds[J].Journal of Applied Polymer Science, 2007, 103(2): 1332-1339.DOI:10.1002/app.25345.
[9] COLLADO L S, CORKE H.Heat-moisture treatment effects on sweet potato starches differing in amylose content[J].Food Chemistry, 1999,65(3): 339-346.DOI:10.1016/S0308-8146(98)00228-3.
[10] GUNARATNE A, HOOVER R.Effect of heat-moisture treatment on the structure and physicochemical properties of tuber and root starches[J].Carbohydrate Polymers, 2002, 49(4): 425-437.DOI:10.1016/S0144-8617(01)00354-X.
[11] ANDERSON A K, GURAYA H S.Effects of microwave heatmoisture treatment on properties of waxy and non-waxy rice starches[J].Food Chemistry, 2006, 97(2): 318-323.DOI:10.1016/ j.foodchem.2005.04.025.
[12] LAWAL O S.Studies on the hydrothermal modifications of new cocoyam (Xanthosoma sagittifolium) starch[J].International Journal of Biological Macromolecules, 2005, 37(5): 268-277.DOI:10.1016/ j.ijbiomac.2005.12.016.
[13] 林江涛, 刘国琴, 钟洁明, 等.微孔性变性淀粉的研究[J].郑州粮食学院学报, 1999, 20(4): 45-50.DOI:10.3969/j.issn.1673-2383.1999.04.011.
[14] 刘雄, 周琼, 陈宗道, 等.高吸油性微孔淀粉制备技术研究[J].食品与发酵工业, 2004, 30(2): 138-141.DOI:10.3321/j.issn:1003-0174.2005.03.006.
[15] ZHANG Bing, CUI Dapeng, LIU Mingzhu, et al.Corn porous starch: preparation, characterization and adsorption property[J].International Journal of Biological Macromolecules, 2012, 50(1): 250-256.DOI:10.1016/j.ijbiomac.2011.11.002.
[16] REEVES P G, NIELSEN F H, FAHEY G C.AIN-93 purifed diets for laboratory rodents: fnal report of the American Institute of Nutrition ad hoc writing committee on the reformulation of AIN-76A rodent diet[J].Journal of Nutrition, 1993, 123(11): 1939-1951.
[17] le LEU R K, BROWN I L, HU Y, et al.Effect of dietary resistant starch and protein on colonic fermentation and intestinal tumourigenesis in rats[J].Carcinogenesis, 2007, 28(2): 240-245.DOI:10.1093/carcin/bg1245.
[18] FOLCH J, LESS M.A simple method for the isolation and purifcation of total lipids from animal tissue[J].Journal of Biological Chemistry,1957, 226: 497-509.DOI:10.1007/s10858-011-9570-9.
[19] ASH M M, HANG J, DUSSAULT P H, et al.Phytosterol stearate esters elicit similar responses on plasma lipids and cholesterol absorption but different responses on fecal neutral sterol excretion and hepatic free cholesterol in male Syrian hamsters[J].Nutrition Research, 2011, 31(7): 537-543.DOI:10.1016/j.nutres.2011.06.007.
[20] 游玉明, 任文瑾, 刘庆庆, 等.花椒精对卵巢切除大鼠脂质代谢的影响[J].食品科学, 2015, 36(5): 153-157.DOI:10.7506/spkx1002-6630-201505029.
[21] SHELTAWY M J, LOSOWSKY M S.Determination of faecal bile acids by an enzymic method[J].Clinica Chimica Acta, 1975, 64(2): 127-132.DOI:10.1016/0009-8981(75)90194-1.
[22] 唐艳.薛荔籽果胶降血脂效果的评价及其机理的研究[D].重庆: 西南大学, 2014: 17-20.
[23] KATO M, OGAW H, KISHIDA T, et al.The mechanism of the cholesterol-lowering effect of water-insoluble fish protein in ovariectomised rats[J].British Journal of Nutrition, 2009, 102(6): 816-824.DOI:10.1017/S0007114509316153.
[24] PATRICK E.Triglycerides and risk for coronary heart disease[J].The Journal of the American Medical Association, 2007, 298(3): 336-338.DOI:10.1001/jama.298.3.336.
[25] NORDESTGAARD B G, BENN M, SCHNOHR P, et al.Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease,and death in men and women[J].The Journal of the American Medical Association, 2007, 298(3): 299-308.DOI:10.1001/jama.298.3.299.
DOI:10.7506/spkx1002-6630-201613039 10.7506/spkx1002-6630-201613039. http://www.spkx.net.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)13-0214-06
收稿日期:2015-07-31
基金项目:野生动植物保护与利用重点学科建设项目(黔学位合字ZDXK[2013]09号);贵州省教育厅特色实验室建设项目“梵净山特色动植物资源重点实验室”(黔教合KY字[2011]005号);重庆市教委科学技术研究项目(KJ1401101)
作者简介:刘庆庆(1991—),女,助教,硕士,研究方向为食品微生物与发酵工程。E-mail:liuqingqingay@163.com
*通信作者:刘雄(1970—),男,教授,博士,研究方向为碳水化合物功能与利用、食品化学与营养。E-mail:liuxiong848@hotmail.com
Effect of Heat-Moisture Treated Corn Porous Starch on Lipid Metabolism in Rats
LIU Qingqing1,2, YOU Yuming2,3, LU Hongjia2,3, TIAN Baoming2, CHEN Zhaojun2, LIU Xiong2,*
(1.College of Biology and A&F Engineering, Tongren University, Tongren 554300, China; 2.College of Food Science,Southwest University, Chongqing 400715, China; 3.College of Forestry and Life Science,Chongqing University of Arts and Science, Chongqing 402160, China)
Abstract:Objective: To investigate the effect of heat-moisture treated corn porous starch on lipid metabolism in rats.Methods: Totally 32 female Sprague-Dawley rats were randomly divided into 4 groups including control group and three other groups as high-fat blank group, high-fat porous starch (PS) group and high-fat heat-moisture treated corn porous starch (HTMPS) group.After adaptive feeding with a basal diet for a week, the rats from the control group were still fed with the basal diet and those from high-fat groups were given a high fat diet.After 4 weeks, all rats were sacrificed for the analysis of triglyceride (TG), cholesterol (TC) in serum and liver, and bile acid in small intestine and feces.Results: By feeding corn porous starch and heat-moisture treated corn porous starch, the contents of TC, TG and non-HDL-C in serum, atherosclerosis index (AI) and TG/HDL-C ratio in serum as well as TC content in liver and abdominal fat content decreased significantly (P < 0.05); the fecal excretion of neutral steroid and bile acid increased significantly (P < 0.05).Compared with HTMPS group, the rats from PS group revealed a reduction in serum TC level, AI, TG/HDL-C ratio and abdominal fat, and an increase in fecal bile acid excretion and bile acid in small intestinal contents.Conclusion: PS is more successful in reducing cholesterol than HTMPS.Therefore, porous starch can reduce the risk of hyperlipidemia caused by high-fat diet, and has a significant role in preventing cardiovascular diseases.
Key words:corn porous starch; heat-moisture treatment; serum lipids; neutral steroid
