野生蝉花多糖抗肿瘤活性及其作用机制
2016-08-10陈美珍汕头大学理学院广东汕头515063
谢 飞,李 伟,陈美珍*,余 杰(汕头大学理学院,广东 汕头 515063)
野生蝉花多糖抗肿瘤活性及其作用机制
谢 飞,李 伟,陈美珍*,余 杰
(汕头大学理学院,广东 汕头 515063)
摘 要:目的:研究野生蝉花多糖(wild Cordyceps sobolifera polysaccharide,CSP)体内外抗肿瘤活性。方法:以3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法考察不同剂量蝉花多糖体外对HeLa细胞的抑制作用,并以移植性S180实体荷瘤小鼠为模型检测体内抗肿瘤活性,通过机体免疫系统各项生化指标的测定,初步探讨其抗肿瘤作用机制。结果:当蝉花多糖质量浓度为400~800 µg/mL时,对体外培养的HeLa细胞具有抑制作用,并呈量效关系,当作用质量浓度为800 µg/mL时,抑制率达到61%。体内实验表明,蝉花多糖高剂量组(200 mg/(kg·d))、低剂量组(100 mg/(kg·d))均有一定抗肿瘤活性。当多糖给药剂量为200 mg/(kg·d)(以体质量计)时,对S180荷瘤小鼠抑瘤率达到42.9%;同时,荷瘤小鼠免疫器官指数显著增大(P<0.01),并激活淋巴细胞的增殖分化,对抗氧化应激系统具有较好的保护作用。结论:野生蝉花多糖在体内、外均有明显的抗肿瘤活性,其原因可能与增强免疫调节能力及抗氧化活性有关。
关键词:野生蝉花多糖;抗肿瘤活性;免疫调节;抗氧化
引文格式:
谢飞, 李伟, 陈美珍, 等.野生蝉花多糖抗肿瘤活性及其作用机制[J].食品科学, 2016, 37(13): 209-213.DOI:10.7506/ spkx1002-6630-201613038. http://www.spkx.net.cn
XIE Fei, LI Wei, CHEN Meizhen, et al.Antitumor activity and mechanism of action of wild Cordyceps sobolifera polysaccharide[J].Food Science, 2016, 37(13): 209-213.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613038. http://www.spkx.net.cn
蝉花(Cordycep scicadae)俗称大虫草,半翅目、蝉科蛁蟟的蛹被麦角菌科虫草属真菌寄生而形成的结合体[1],虫草属,是一种具有很高药食两用价值的真菌,亦是我国传统的中药材。据报道[2-4],蝉花具有免疫调节、滋补强壮、抗肿瘤、抗衰老、抗氧化应激、降血糖及抗贫血等作用。温鲁等[5]测定了3 种虫草样品中虫草酸、腺苷、虫草多糖及虫草素等活性成分的含量,结果显示蝉花中虫草酸和腺苷含量均高于冬虫夏草,多糖和虫草酸含量高于蛹虫草,属于优质虫草,且具有2 种虫草相近的医疗保健功效[5-6]。芦柏震等[7]研究蝉花粗提物对PAA细胞株的作用发现,蝉花粗提物能选择性杀伤G2(DNA合成后期)/M(细胞分裂期)期细胞,并显著抑制PAA细胞生长。金丽琴[8]研究发现,蝉拟青霉孢子粉能显著抑制体内外宫颈癌的生长。此外,蝉花总多糖对细胞免疫和体液免疫均有促进作用,能直接刺激小鼠脾细胞增殖,明显促进刀豆球蛋白A(concanavalin A,Con A)或脂多糖(lipopolysaccharide,LPS)诱导小鼠T、B淋巴细胞的增殖和免疫球蛋白G(immunoglobulin G,IgG)抗体的生成,增强迟发型超敏反应[9];亦可通过激活腹腔巨噬细胞、肺泡巨噬细胞,增强正常大鼠的吞噬与转化功能,提高机体的免疫能力等[10]。
国内外有关野生蝉花的研究主要集中在有效成分的提取及小分子物质活性等方面,但对其抗肿瘤活性的研究鲜见报道。为此,本研究通过考察蝉花多糖体外对HeLa细胞增殖的影响,以及体内对S180荷瘤小鼠抑瘤作用、免疫功能的影响等,探讨蝉花多糖的抗肿瘤作用,以期为更好地开发蝉花虫草及其相关保健品、药品提供科学依据。
1 材料与方法
1.1 材料、细胞株与试剂
野生蝉花,取自广东省河源市,由汕头大学医学院药理学高分飞博士鉴定。
人宫颈癌HeLa细胞株、人肾上皮293T细胞株,由汕头大学生物医药与先进材料研究中心提供。
高糖培养基(Dulbecco's modified eagle medium,DMEM) 美国Hyclone公司;胎牛血清 杭州四季青科技有限公司;胰酶细胞消化液、青霉素-链霉素溶液碧云天生物技术公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;阳性药物5-氟尿嘧啶(5-fluorouracil,5-FU) 上海源叶生物科技有限公司;Con A 广州市齐云生物技术有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 实验动物
S180腹水瘤小鼠(SPF级),购于厦门大学实验动物中心。
1.3 仪器与设备
WFZ UV-2100紫外-可见分光光度计 尤尼柯仪器有限公司;TDL-5M台式大容量冷冻离心机 长沙湘仪离心机仪器有限公司;JFSD-100型粉碎机 上海嘉定粮油仪器有限公司;ER-12A0型电子天平 日本Tokyo公司;SY-10数显式电热恒温水浴锅 上海跃进医疗器械厂;全波段扫描酶标仪 瑞士Tecan公司;倒置显微镜光学显微镜 日本Olympus公司;3111二氧化碳细胞培养箱 美国Thermo公司;高压灭菌锅 深圳市深安企业有限公司。
1.4 方法
1.4.1 蝉花多糖的微波超声波协同提取
野生蝉花干品除泥,60 ℃烘干粉碎,40 目过筛,95%乙醇70 ℃条件下回流2 次,每次2 h,3 000 r/min离心20 min,弃上清液,沉淀60 ℃真空条件下干燥,得蝉花粉末。取5 g蝉花粉末于55 倍体积蒸馏水中,依次经微波5 min、超声波25 min处理后,4 000 r/min离心10 min取上清液。上清液浓缩后于3 倍体积95%乙醇中醇沉过夜,Sevag法多次除蛋白,依次经自来水、蒸馏水透析,冷冻干燥后得野生蝉花多糖样品(wild Cordyceps sobolifera polysaccharide,CSP)。
1.4.2 CSP对HeLa及人肾上皮293T细胞的体外抑制实验
1.4.2.1 采用MTT法分别测定CSP对HeLa[11]及293T细胞的体外抑制作用
分别取对数生长期的HeLa和293T细胞,胰酶消化后以含体积分数10%的胎牛血清DMEM培养液进行稀释,制成浓度为5×104个/mL的细胞悬液,加入96 孔培养板中,每孔200 μL置于37 ℃体积分数为5%的CO2孵箱中培养过夜。实验设给药组,给予200 μL不同质量浓度(400、500、600、700、800 µg/mL)多糖的蝉花多糖溶液,同时设空白组(含体积分数10%的胎牛血清DMEM培养液)、对照组(细胞、DMEM完全培养基)和5-FU 阳性药物组(25 µg/mL 5-FU),给药后继续培养48 h。培养结束前4 h,每孔加入20 μL 5 mg/mL MTT,37 ℃培养箱中培养4 h,吸出上清液后加二甲基亚砜200 μL,微量振荡器振荡5 min,使深蓝色沉淀物完全溶解,自动酶标仪于490 nm波长处进行检测,分别按下式计算多糖对细胞的抑制率。
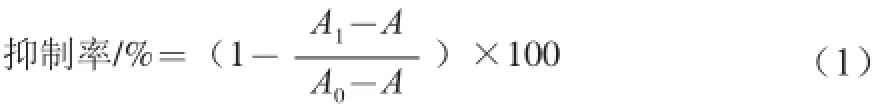
式中:A0为对照组吸光度;A1为给药组吸光度;A 为空白组吸光度。
1.4.2.2 HeLa细胞的形态学观察
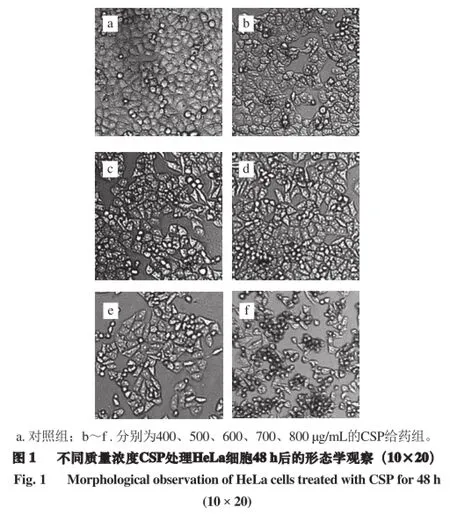
将5×104个/mL的HeLa及293T细胞接种于96 孔板中培养,待细胞贴壁后,小心弃去培养基,用不同质量浓度(400、500、600、700、800 μg/mL)的蝉花多糖作用液200 μL分别处理HeLa细胞48 h,对照组加入等量DMEM完全培养基,48 h后于倒置显微镜下观察HeLa细胞的形态变化,并拍照。
1.4.3 蝉花多糖体内抗肿瘤实验
1.4.3.1 S180荷瘤小鼠模型的建立[12]
S180瘤株在小鼠体内腹水传代3 次,每次7 d。无菌条件下,抽取最后1 次荷瘤小鼠腹水,用预冷的无菌生理盐水调整细胞浓度至1.4×107个/mL,在小鼠左前肢腋下接种0.2 mL瘤细胞悬液。
1.4.3.2 分组与给药
小鼠自由摄食饮水适应喂养3 d后,按体质量随机分为5 组,各组体质量无显著差异,每组12 只,即空白组、模型组、5-FU阳性药物组、蝉花多糖低剂量、高剂量组。
实验第1天,除空白组外,各组小鼠接种0.2 mL S180瘤细胞悬液,以建立肿瘤模型。接种24 h后开始给药,其中阳性药物组腹腔注射20 mg/(kg·d)(以体质量计,下同) 的5-FU;高、低剂量组分别灌胃200、100 mg/(kg·d)的CSP溶液;空白组和模型组灌胃等量生理盐水。连续给药8 d,每天1 次,饲养过程中,小鼠自由摄食饮水,并对小鼠的体质量、精神状态等方面变化进行观察。
1.4.3.3 样本处理及抑瘤率的计算
实验第10天结束给药,小鼠称体质量,眼眶取血脱颈处死,3 800 r/min离心10 min,分离血清,无菌条件下解剖剥离出瘤块、肝、脾、胸腺等器官称质量;血清于-20 ℃冰箱保存;肿瘤组织固定于4%甲醛后,4 ℃冰箱保存。

1.4.4 蝉花多糖对荷瘤小鼠免疫功能的影响
1.4.4.1 免疫器官指数的测定
肝脏、胸腺、脾脏指数的计算见下式。
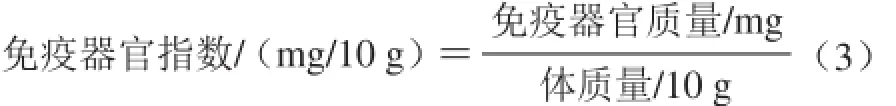
1.4.4.2 荷瘤小鼠脾淋巴细胞增殖能力的测定
采用MTT法检测脾淋巴细胞增殖能力[13]。无菌条件下取脾组织制成单细胞悬液,将其溶于2 mL完全培养基并稀释至2×106个/mL。细胞悬液加入96孔培养板中,每孔200 μL,每样做4 个复孔,3孔分别加入5 μL 200 mg/mL 的Con A(终质量浓度为5 mg/L),剩余孔作为空白组。置于37 ℃培养箱3 d,于培养结束前4 h取出,吸取100 μL上清液,每孔加入20 μL 5 mg/mL经过滤除菌的MTT溶液,继续培养4 h。培养结束吸取液体,每孔加入120 μL 37 ℃预温的DMSO液振荡10 min,酶标仪作双波长检测,检测波长570 nm,参考波长630 nm,按下式计算脾淋巴细胞增殖能力。
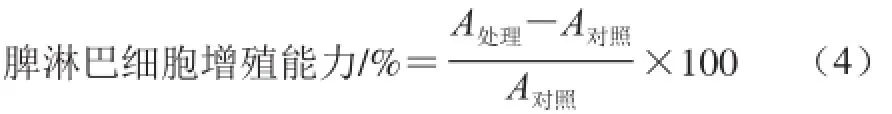
式中:A处理为Con A孔平均吸光度;A对照为空白孔平均吸光度。
1.4.4.3 荷瘤小鼠血清中SOD、CAT活力及MDA含量的测定
血清SOD、CAT酶活力、MDA含量均采用试剂盒测定,具体操作按其说明书进行。
1.5 数据统计分析
2 结果与分析
2.1 蝉花多糖的体外抗肿瘤活性
2.1.1 对HeLa细胞的抑制作用
MTT法检测蝉花多糖对HeLa细胞及细胞293T的作用,结果见表1,蝉花多糖对体外HeLa细胞的增殖有一定的抑制作用,其抑制率最高可达61.0%,并呈现剂量依赖关系。同时蝉花多糖对正常细胞293T的增殖有一定的促进作用,而阳性药物5-FU对HeLa细胞和293T细胞均有较强的杀伤作用。由结果推断,蝉花多糖对细胞的抑制具有选择性,有望作为一种高效、低毒的抗肿瘤制剂。
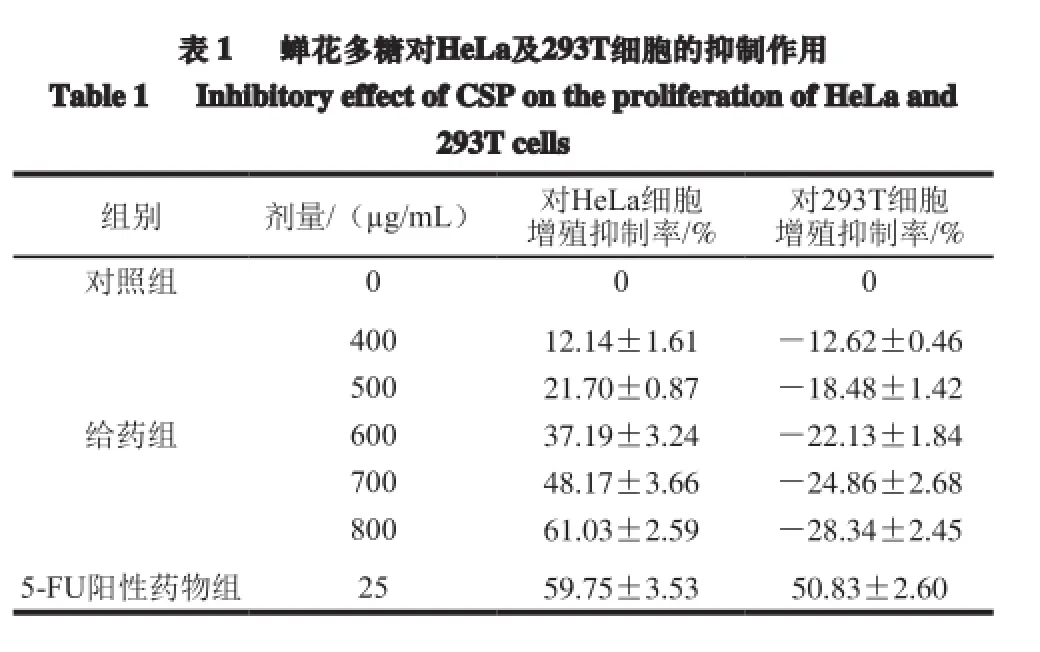
表 1 蝉花多糖对HeLa及293T细胞的抑制作用Table 1 Inhibitory effect of CSP on the proliferation of HeLa and293T cells组别 剂量/(µg/mL) 对HeLa细胞增殖抑制率/% 对293T细胞增殖抑制率/%对照组 0 0 0给药组400 12.14±1.61 -12.62±0.46 500 21.70±0.87 -18.48±1.42 600 37.19±3.24 -22.13±1.84 700 48.17±3.66 -24.86±2.68 800 61.03±2.59 -28.34±2.45 5-FU阳性药物组 25 59.75±3.53 50.83±2.60
2.1.2 对HeLa细胞形态学影响
用不同质量浓度的蝉花多糖分别处理HeLa细胞48 h后,观察细胞的形态变化。由图1可知,对照组细胞排列紧密,胞浆丰富,体积较大,呈多边形,多数细胞呈堆叠生长,有少量漂浮细胞;而给药组随着质量浓度增大,活细胞数量逐渐减少,细胞排列疏松,体积变小,呈长梭形,且有不规则突起,同时部分细胞脱离周围细胞,变圆,胞膜褶皱,形态学上呈现细胞凋亡状态,可见凋亡细胞及凋亡小体形成,显示蝉花多糖对HeLa细胞增殖具有抑制作用,与表1实验结果相一致。
2.2 蝉花多糖对荷瘤小鼠肿瘤的抑制作用
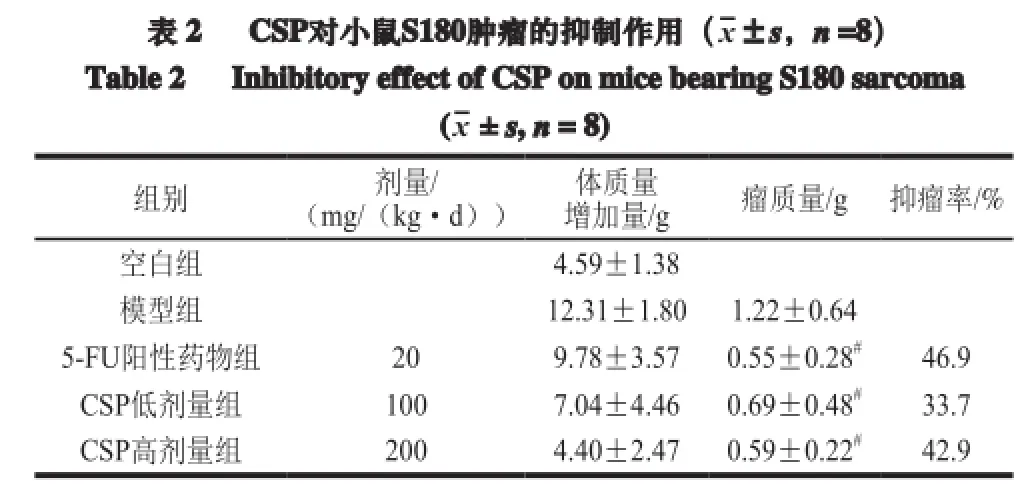
注: #.与模型组比较差异显著(P<0.05)。下同。
由表2可知,CSP对小鼠S180实体瘤有一定的抑制作用,并呈现明显剂量效应,CSP各剂量组与模型组抑瘤率比较差异显著(P<0.05),且高剂量组对小鼠S180抑瘤率达到42.9%。
2.3 CSP对荷瘤小鼠免疫功能的影响
2.3.1 对荷瘤小鼠免疫器官指数的影响
胸腺和脾脏是机体重要的免疫器官,其指数大小直接反映机体免疫水平的高低[14]。由表3可知,造模后模型小鼠的肝脏、胸腺指数均降低,而脾脏指数明显增加,表明移植瘤对机体免疫器官产生一定程度的损伤。阳性药物组荷瘤小鼠对于模型组的脾脏指数、胸腺指数均显著降低,意味着荷瘤小鼠免疫器官受到严重损伤;而CSP给药组小鼠脾脏指数、胸腺指数均有不同程度增加,其中高剂量组胸腺指数升高极显著(P<0.01),同时多糖给药组具有显著保肝作用,呈现剂量依赖关系。以上结果表明,蝉花多糖能较好保护机体免疫器官,抑制免疫器官功能丧失和防止免疫器官萎缩。
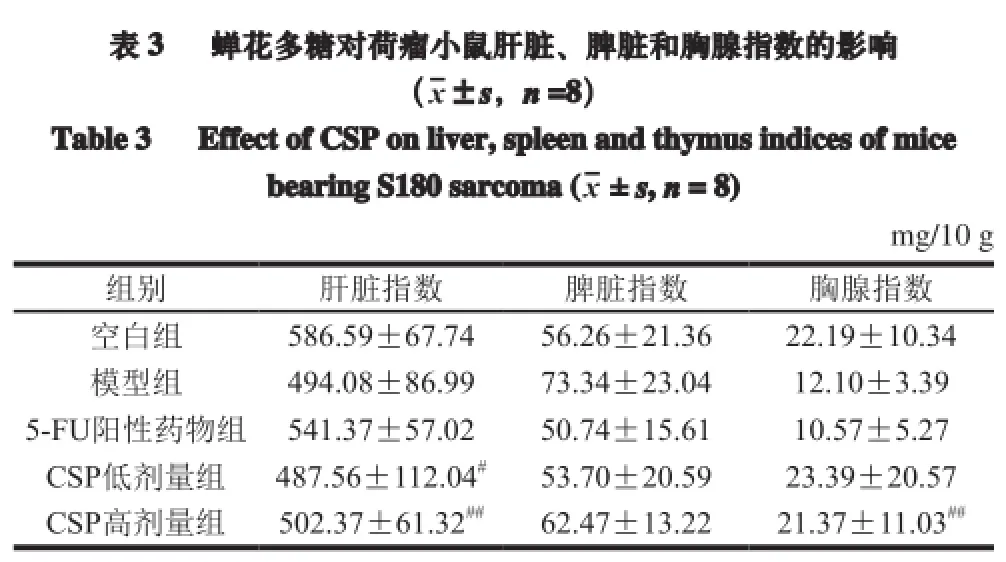
注:##.与模型组比较差异极显著(P<0.01)。下同。
2.3.2 对荷瘤小鼠脾淋巴细胞增殖能力的影响
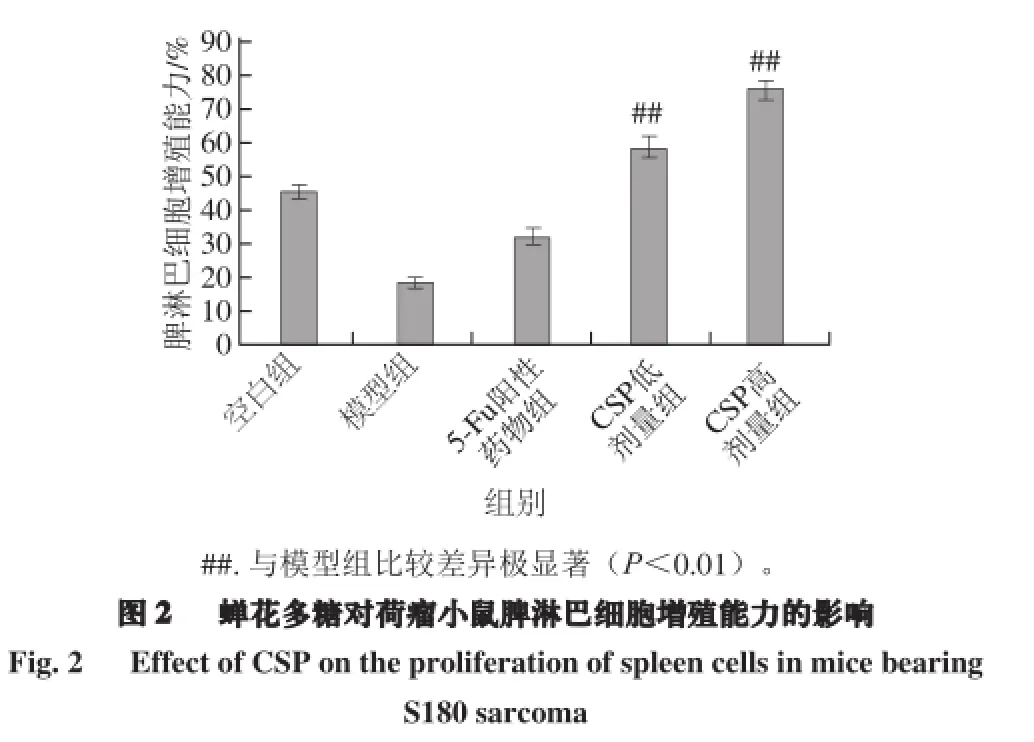
脾脏是机体主要的外周免疫器官,其淋巴细胞增殖能力直接反映机体的免疫功能。由图2可知,同空白组相比,模型组小鼠脾淋巴细胞增殖能力明显降低,表明移植瘤的生长导致机体免疫系统功能降低。而CSP给药组均能极显著提升脾淋巴细胞的增殖能力(P<0.01),且优于5-FU阳性药物组,其中高剂量组淋巴细胞增殖能力达到76%。
2.3.3 对荷瘤小鼠抗氧化能力的影响
自由基学说认为,不少致癌物必须在体内经过代谢活化形成自由基并攻击DNA才能致癌[15-16]。由表4可知,CSP给药组荷瘤小鼠血清中SOD、高剂量组CAT酶的活性均不同程度高于模型组,表明多糖能提高机体自身的抗氧化酶活性;同时,小鼠血清中MDA水平较模型组极显著降低(P<0.01)。以上结果表明,蝉花多糖能提高荷瘤小鼠抗氧化能力,显著减少氧化产物MDA含量。蝉花多糖对S180肿瘤生长的抑制作用可能与其增强机体内抗氧化能力相关。
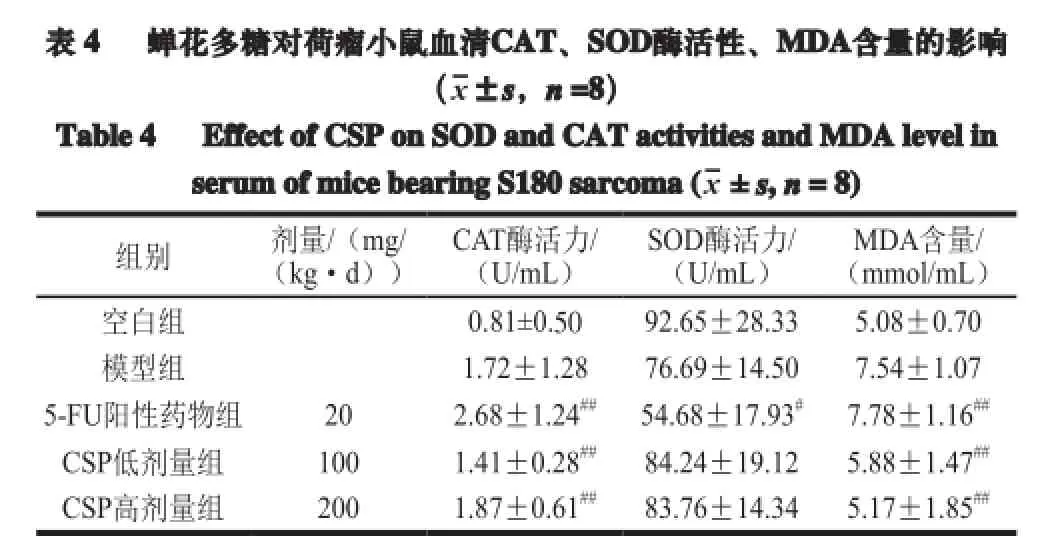
表 4 蝉花多糖对荷瘤小鼠血清CAT、SOD酶活性、MDA含量的影响(x±s,n=8)Table 4 Effect of CSP on SOD and CAT activities and MDA level inserumofmicebearing S180sarcoma (x±s,n= 8)组别 剂量/(mg/ (kg·d))CAT酶活力/ (U/mL)SOD酶活力/ (U/mL)MDA含量/ (mmol/mL)空白组 0.81±0.50 92.65±28.33 5.08±0.70模型组 1.72±1.28 76.69±14.50 7.54±1.07 5-FU阳性药物组 20 2.68±1.24##54.68±17.93#7.78±1.16##CSP低剂量组 100 1.41±0.28##84.24±19.12 5.88±1.47##CSP高剂量组 200 1.87±0.61##83.76±14.34 5.17±1.85##
3 讨 论
真菌多糖具有多种生物活性和保健功能,近年来已成为生命科学、医药和食品科学领域的研究重点。诸多研究发现,真菌多糖多具有较强的抗肿瘤活性,对许多肿瘤细胞均有良好的抑制作用。同时大多数学者认为,其抗肿瘤作用途径并不直接杀灭肿瘤细胞,而是通过增强机体免疫功能及提高机体拮抗氧化应激损伤的能力[17],间接地抑制肿瘤细胞生长[18-19]。
本实验通过对野生蝉花多糖的提取,进一步对多糖的体内、外抗肿瘤活性进行了研究。体外实验表明,CSP 在400~800 µg/mL质量浓度范围内对HeLa细胞均有抑制作用,当质量浓度为800 µg/mL时,HeLa细胞抑制率达到61%,并呈现量效关系;体内以移植性荷瘤小鼠为模型,当以200 mg/(kg·d)灌胃时,能有效抑制荷瘤小鼠肿瘤的生长,抑瘤率达到42.9%,显示出良好的抗肿瘤作用。
胸腺、脾脏均为机体重要的免疫器官,作为淋巴细胞分化和成熟的重要场所,其指数的大小一定程度上直接体现免疫水平的高低,反映机体免疫功能状况[20-22];同时机体内淋巴细胞数量的增加,转化率的提高亦可促进淋巴因子的产生,是反映机体细胞免疫功能的重要指标。实验中肿瘤模型组小鼠由于受到肿瘤细胞的诱导而导致胸腺细胞逐步凋亡、胸腺萎缩,经过多糖处理后,小鼠免疫器官指数显著提高,激活和促进脾淋巴细胞的增殖分化进而增强细胞免疫功能,说明CSP抗肿瘤机制与其促进机体免疫系统的活性有关,对免疫系统有着一定程度的保护及修复作用。
自由基学说认为,肿瘤的发生发展与机体内自由基稳态的破坏有关,其稳态的维持主要靠抗氧化酶系功能的发挥[23]。机体抗氧化酶系活力的大小反映其对自由基的清除能力,而MDA含量的高低直接反映机体的氧化应激损伤程度。本实验结果显示,移植瘤小鼠随着肿瘤的生长,体内抗氧化酶系活力降低、MDA含量升高;而给予蝉花多糖处理后,此种情况得到改善,说明蝉花多糖能够激活或者促进抗氧化酶系的表达,降低机体受自由基损坏的程度。
综上所述,野生蝉花多糖具有较强的抗肿瘤活性,其功能的发挥与提高免疫调节能力及抗氧化活性密切相关。
参考文献:
[1] 吴远征.蝉花: 一种药用真菌[J].生物学通报, 1992(3): 17.
[2] FUJITA T, INOUE K, YAMAMOTO S, et al.Fungal metabolites.Part 11.A potent immunosuppressive activity found in Isaria sinclairii metabolite[J].Journal of Antibiotics, 1994, 47(2): 208-215.DOI:10.1002/chin.199432253.
[3] MIYAKE Y, KOZUTSUMI Y, NAKAMURA S, et al.Serine palmitoyltransferase is the primary target of a sphingosine-like immunosuppressant, ISP-1/myriocin[J].Biochemical and Biophysical Research Communications, 1995, 211(2): 396-403.DOI:10.1006/ bbrc.1995.1827.
[4] 李挺, 宋斌, 林群英.蝉花的研究进展[J].中药材, 2008, 31(9): 1443-1447.DOI:10.3321/j.issn:1001-4454.2008.09.051.
[5] 温鲁, 唐玉玲, 张平.蝉花与有关虫草活性成分检测比较[J].江苏中医药, 2006, 27(1): 45-46.DOI:10.3969/j.issn.1672-397X.2006.01.029.
[6] 官宗华, 宋玉良.蝉花的研究概况[J].中国医药指南, 2012, 10(10): 443-444.DOI:10.3969/j.issn.1671-8194.2012.10.334.
[7] 芦柏震, 姜志明, 牟翰舟.等.蝉花粗提物对肺癌细胞作用的实验研究[J].中国中医药科技, 2006, 9(13): 328-329.DOI:10.3969/ j.issn.1005-7072.2006.05.019.
[8] 金丽琴.蝉拟青霉孢子粉对体内外宫颈癌生长的抑制作用[C].无锡: 长三角科技论坛暨营养科技论坛, 2012: 270-275.
[9] 何晓波, 芦柏震, 周俐斐, 等.蝉花总多糖对细胞免疫和体液免疫反应的促进作用[J].中华中医药学刊, 2010, 28(7): 1465-1468.DOI:10.13193/j.archtcm.2010.07.123.hexb.062.
[10] 金丽琴, 吕建新, 杨介钻, 等.蝉拟青霉总多糖对免疫抑制大鼠巨噬细胞激活作用的实验研究[J].中草药, 2007, 38(8): 1217-1220.DOI:10.3321/j.issn:0253-2670.2007.08.035.
[11] 彭勤, 彭惠, 骆云鹏, 等.MTT比色法测定药物对HeLa细胞作用的实验研究[J].现代妇产科进展, 2000, 9(5): 341-343.DOI:10.13283/j.cnki.xdfckjz.2000.05.009.
[12] 叶明霞, 周顺长, 孔利佳, 等.S180肉瘤, 艾氏腹水瘤肿瘤移植模型建立的研究[J].中国实验动物学杂志, 2002, 12(1): 14-16.DOI:10.3969/j.issn.1671-7856.2002.01.005.
[13] 杨文超, 吴珍红, 缪晓青, 等.蜂毒肽对受照小鼠脾细胞增殖的影响[J].中国蜂业, 2007, 58(10): 5-6.DOI:10.3969/ j.issn.0412-4367.2007.10.001.
[14] KIM J W, FERRIS R L, WHITESIDE T L.Chemokine C receptor 7 expression and protection of circulating CD8+T lymphocytes from apoptosis[J].Clinical Cancer Research, 2005, 11(21): 7901-7910.DOI:10.1158/1078-0432.CCR-05-1346.
[15] TAKEMURA G, ONODERA T, ASHRAF M.Quantification of hydroxyl radical and its lack of relevance to myocardial injury during early reperfusicn after graded ischemia in rat hearts[J].Circulation Research, 1992, 71(1): 96-105.DOI:10.1161/01.RES.71.1.96.
[16] TOQASHI H, SHINZAWA H T, TAKEDA Y, et al.Analysis of hepatic oxidative stress status by electron spin resonance spectroscopy and imaging [J].Free Radical Biology & Medicine, 2000, 28(6): 846-853.DOI:10.1121/1.2734487.
[17] 陈丽芳, 吴文光, 陈国锐.真菌多糖的抗肿瘤作用探讨[J].海峡药学,2002, 14(2): 58.DOI:10.3969/j.issn.1006-3765.2002.02.037.
[18] LIN Z B, ZHANG H N.Anti-tumor and immunoregulatory activities of Ganoderma lucidum and its possible mechanisms[J].Acta Pharmacologica Sinica, 2004, 25(11): 1387-1395.
[19] WANG Y Y, KHOO K H, CHEN S T, et al.Studies on the immunomodulating and antitumor activities of Ganoderma lucidum (Reishi)polysaccharides: functional and proteomic analyses of a fucosecontaining glycoprotein fraction responsible for the activities[J].Bioorganic & Medicinal Chemistry, 2002, 10(4): 1057-1062.DOI:10.1016/S0968-0896(01)00377-7.
[20] CHEN X M, NIE W J, YU G Q, et al.Antitumor and immunomodulatory activity of polysaccharides from Sargassum fusiforme[J].Food and Chemical Toxicology, 2012, 50(3/4): 695-700.DOI:10.1016/j.fct.2011.11.015.
[21] 梁永林, 吴玉泓, 殷银霞, 等.久泻灵对小鼠胸腺、脾脏重量及单核细胞吞噬功能影响的实验研究[J].中国老年学杂志, 2006, 26(1): 85-86.DOI:10.3969/j.issn.1005-9202.2006.01.042.
[22] 王朝兰, 刘向国, 方正清.等.补肺汤对COPD肺气虚证模型大鼠胸腺指数和脾脏指数的影响[J].甘肃中医学院学报, 2011(3): 1-4.DOI:10.3969/j.issn.1003-8450.2011.03.001.
[23] 周国亮, 宋翼升, 辛艳飞.等.灵芝多糖抗氧化和抗肿瘤活性的研究进展[J].中华中医药学刊, 2014, 32(5): 1002-1005.DOI:10.13193/ j.issn.1673-7717.2014.05.013.
DOI:10.7506/spkx1002-6630-201613038
中图分类号:R931
文献标志码:A
文章编号:1002-6630(2016)13-0209-05
收稿日期:2015-08-06
基金项目:2013年汕头大学教改项目;2013年广东省高等学校教学质量与教学改革工程本科类立项建设项目;高水平大学建设项目
作者简介:谢飞(1990—),男,硕士研究生,主要从事活性物质研究与开发。E-mail:14fxie@stu.edu.cn
*通信作者:陈美珍(1956—),女,教授,本科,主要从事活性物质研究与开发。E-mail:chenmz@stu.edu.cn
Antitumor Activity and Mechanism of Action of Wild Cordyceps sobolifera Polysaccharide
XIE Fei, LI Wei, CHEN Meizhen*, YU Jie
(College of Science, Shantou University, Shantou 515063, China)
Abstract:Objective: The antitumor activity of polysaccharides from wild Cordyceps sobolifera (CSP) was investigated in vitro and in vivo.Methods: 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay was used to determine the anti-proliferative effect of CSP at different doses on HeLa cells.S180 sarcoma mouse model was established and used to detect the antitumor activity and the effect on the immune system of CSP.Results: CSP at concentrations of 400-800 µg/mL inhibited the growth of HeLa cells in vitro in a concentration-dependent manner, with a percentage inhibition of 61% at 800 µg/mL.In vivo, CSP at both high (200 mg/(kg·d)) and low (100 mg/(kg·d)) doses had antitumor effects, with a percentage inhibition of 42.9% at 200 mg/(kg·d), and immune organ indices of tumor-burdened mice signifcantly increased (P < 0.01).CSP also activated the proliferation and differentiation of lymphocytes, and had an obvious protection on the antioxidant defense system in the body.Conclusion: CSP has obvious antitumor activity in vitro and in vivo, which may be related to enhancing the immune system adjustment capacity and antioxidant activity.
Key words:Cordyceps sobolifera polysaccharide (CSP); antitumor activity; immune regulation; antioxidant
