水解小麦蛋白肽对大鼠急性酒精性胃黏膜损伤的保护作用
2016-08-10王炎炎潘兴昌朱航榉谷瑞增马永庆唐华丽王少康孙桂菊东南大学公共卫生学院环境医学工程教育部重点实验室营养与食品卫生学系江苏南京0009中国食品发酵工业研究院北京0008
杨 贤,王炎炎,王 锋,夏 惠,潘兴昌,朱航榉,谷瑞增,马永庆,唐华丽,王少康,孙桂菊,*(.东南大学公共卫生学院 环境医学工程教育部重点实验室/营养与食品卫生学系,江苏 南京 0009;.中国食品发酵工业研究院,北京 0008)
水解小麦蛋白肽对大鼠急性酒精性胃黏膜损伤的保护作用
杨 贤1,王炎炎1,王 锋1,夏 惠1,潘兴昌2,*,朱航榉1,谷瑞增2,马永庆2,唐华丽1,王少康1,孙桂菊1,*
(1.东南大学公共卫生学院 环境医学工程教育部重点实验室/营养与食品卫生学系,江苏 南京 210009;2.中国食品发酵工业研究院,北京 100028)
摘 要:目的:研究水解小麦蛋白肽对大鼠急性酒精性损伤模型胃黏膜损伤的保护作用。方法:将60 只Wistar大鼠随机分成空白对照组、胃黏膜损伤模型对照组、水解小麦蛋白肽低、中、高剂量组(剂量分别为167、333、667 mg/(kg·d)(以体质量计,下同))、阳性对照组(甲氰咪胍组65 mg/(kg·d)),每组各10 只。采用酒精灌胃致胃黏膜损伤,给予水解小麦蛋白肽30 d后,观察胃黏膜组织的大体变化和病理组织学改变,测定大鼠血清丙二醛(malondialdehyde,MDA)、血小板活化因子(platelet-activating factor,PAF)、表皮生长因子(epidermal growth factor,EGF)、前列腺素E2(prostaglandin E-2,PGE2)、白细胞介素8(interleukin-8,IL-8)含量及超氧化物歧化酶(superoxide dismutase,SOD)活力,大鼠胃组织半胱氨酸天冬氨酸蛋白酶3(caspase 3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)表达水平。结果:水解小麦蛋白肽能明显改善胃黏膜组织损伤,降低损伤积分(P<0.05),提高损伤抑制率;各剂量组均能提高大鼠血清PGE2含量、EGF含量、SOD活力及胃组织EGFR表达水平,降低大鼠血清MDA含量、IL-8含量及胃组织Caspase 3表达水平(P<0.05),低、中剂量组能降低血清PAF含量(P<0.05)。结论:水解小麦蛋白肽对大鼠急性酒精性胃黏膜损伤具有一定保护作用,其机制可能与增强胃黏膜保护因子、提高抗氧化、抗炎及抗凋亡等作用有关。
关键词:水解小麦蛋白肽;胃黏膜损伤;酒精
引文格式:
杨贤, 王炎炎, 王锋, 等.水解小麦蛋白肽对大鼠急性酒精性胃黏膜损伤的保护作用[J].食品科学, 2016, 37(13): 178-182.DOI:10.7506/spkx1002-6630-201613032. http://www.spkx.net.cn
YANG Xian, WANG Yanyan, WANG Feng, et al.Effect of hydrolyzed wheat protein peptide on ethanol-induced acute gastric mucosal damage in rats[J].Food Science, 2016, 37(13): 178-182.(in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201613032. http://www.spkx.net.cn
胃溃疡是我国的常见病、多发病之一[1]。胃黏膜损伤是胃溃疡发生的早期病变反应,经口摄入高浓度乙醇出现胃黏膜充血、水肿、出血、糜烂及溃疡形成等症状[2]。水解小麦蛋白肽是一类来源于小麦蛋白水解产物的生物活性肽,具有丰富的生物学功能,如阿片活性[3]、抑癌活性[4]、抑制血管紧张素转化酶(angiotensin-converting enzyme,ACE)活性[5]、抗氧化[6]等。本实验前期结果表明小麦活性肽能显著提高机体对食物蛋白质的消化与利用、促进胃肠道上皮的生长、减轻非甾体类药物对胃肠道的损伤、有一定的胃肠道保护作用,且目前小麦活性肽的制备、鉴定技术相对比较成熟[7],拟通过以下实验研究水解小麦蛋白肽粉对大鼠酒精性胃黏膜损伤的保护作用并探讨其作用机制,为小麦活性肽作为功能性食品的开发积累一定的实验基础。
1 材料与方法
1.1 动物、材料与试剂
清洁级Wistar大鼠70 只,雄性,体质量180~220 g,购于北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001);标准鼠粮,购于南京市江宁区青龙山实验动物繁殖场;大鼠饲养于无特定病原体(specific pathogen free,SPF)级动物房(实验动物使用许可证:SYXK(苏)2013-0037)。
水解小麦蛋白肽粉(3 374.5 D),由中国食品发酵工业研究院提供;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、血小板活化因子(platelet-activating factor,PAF)、前列腺素E2(prostaglandin E-2,PGE2)、表皮生长因子(epidermal growth factor,EGF)、白细胞介素-8(interleukin-8,IL-8)试剂盒 上海基尔顿生物科技有限公司;Caspase-3 艾美捷科技有限公司;表皮生长因子受体(epidermal growth factor receptor,EGFR)成都正能生物技术责任有限公司;DAB显色试剂盒(20×)、KIT-9921即用型免疫组化试剂盒(鼠/兔)福州迈新试剂生物技术开发有限公司。
1.2 仪器与设备
722N型可见光分光光度计 上海精密仪器有限公司;VERSAmax酶标仪 美谷分子仪器(上海)有限公司。
1.3 方法
1.3.1 动物分组及样品采集
70 只Wistar大鼠随机取样10 只进行酒精预实验造模,禁食不禁水24 h,给予无水乙醇1.0 mL/只,1 h后处死动物,取材观察,以确定模型是否成立。
造模成功后,将剩余大鼠随机分成6 组,分别是空白对照组、胃黏膜损伤模型对照组、低剂量水解小麦蛋白肽粉组(167 mg/(kg·d))、中剂量水解小麦蛋白肽粉组(333 mg/(kg·d))、高剂量水解小麦蛋白肽粉组(667 mg/(kg·d))和甲氰咪胍组(65 mg/(kg·d))。低、中、高水解小麦蛋白肽粉剂量组大鼠每天用1 mL含不同剂量的水解小麦蛋白肽粉溶液灌胃,空白对照组和胃黏膜损伤对照组大鼠每天按等体积蒸馏水灌胃,连续灌胃30 d。
灌胃30 d后,全部大鼠严格禁食24 h(不禁水),此期间亦禁止给予水解小麦蛋白肽。除空白对照组外,所有实验组动物给予无水乙醇1.0 mL/只,1 h后股动脉采血,采集血清样品,-20 ℃保存备用;然后处死动物,暴露完整胃,结扎幽门,灌注适量10%的甲醛溶液,固定20 min,然后沿胃大弯剪开,洗净胃内容物,展开胃黏膜。
1.3.2 大体观察及评分
用游标卡尺测量出血点或出血带的长度和宽度。因宽度所代表的损伤程度远大于长度,故双倍积分,评分标准见表1。

注:胃黏膜上出血点的个数即为得分。
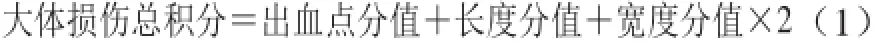
各实验组胃黏膜损伤程度以损伤发生率、损伤积分指数和损伤抑制率表示。各指标计算公式如下。

式中:A、B分别为模型组与实验组的损伤积分指数。
大体观察评分完毕,将每只动物胃黏膜损伤最严重的部位,切下约10 mm×2 mm 的组织块,固定于10%甲醛溶液,常规制片,苏木精-伊红(hematoxylin eosin,HE)染色,镜下观察。注意选择胃黏膜正横切面,包括黏膜全层的区域观察。评分方法:以充血、出血、黏膜细胞变性坏死占整个黏膜上皮层的比例分为5 级。充血权重为1,出血权重为2,上皮细胞变性坏死权重为3,评分标准见表2。按下式计算病变总积分公式。
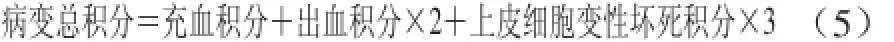
表 2 急性胃黏膜损伤病理观察评分标准Table 2 Scoring criteria for ethanol-induced gastric mucosal damageundermicroscope病变症状 1 分 2 分 3 分 4 分 5 分充血 <1/5 1/5~2/5 2/5~3/5 3/5~4/5上皮全层出血 <1/5 1/5~2/5 2/5~3/5 3/5~4/5上皮全层上皮细胞变性坏死 <1/5 1/5~2/5 2/5~3/5 3/5~4/5上皮全层
1.3.3 生化指标的测定
按照试剂盒说明测定大鼠血清中的SOD活性、MDA含量、PAF含量、EGF含量、IL-8含量和PGE2含量。免疫组化法测定大鼠胃组织中Caspase 3、EGFR表达水平。
1.4 数据处理
2 结果与分析
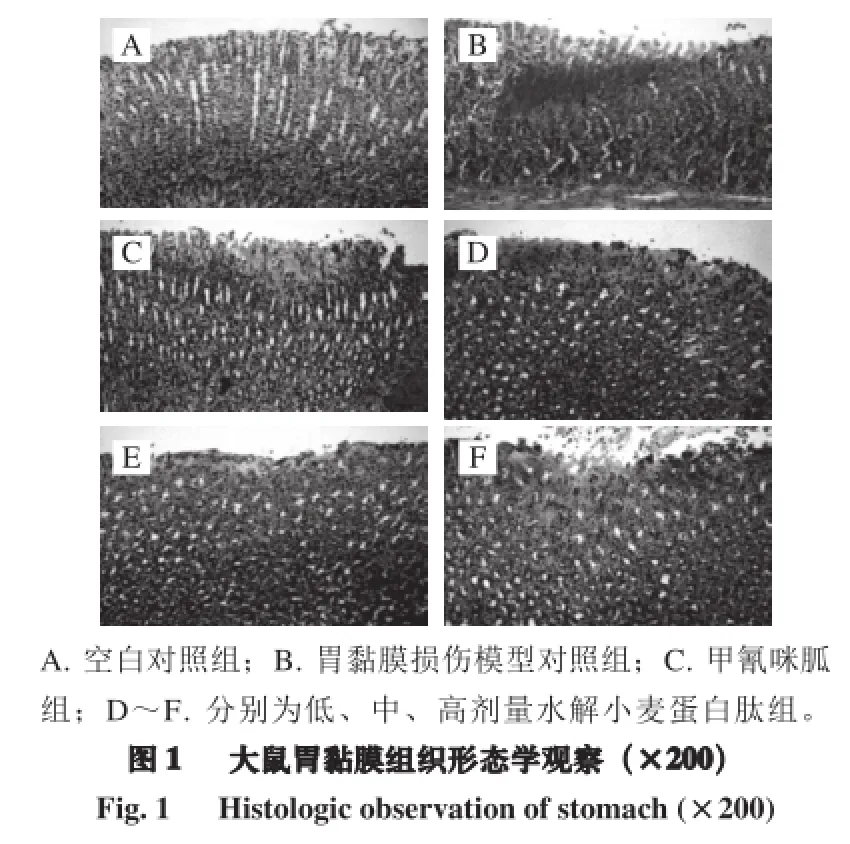
2.1 胃黏膜的组织病理学变化
如图1可知,无水乙醇导致的胃黏膜损伤,主要病变症状为胃黏膜上皮细胞变性、坏死,伴有局部出血和充血。水解小麦蛋白肽的低剂量对胃黏膜损伤有抑制作用,胃黏膜的损伤比较轻微,然而随剂量增加对损伤的抑制作用并未继续增强。通过表3可以得出,灌胃水解小麦蛋白肽有减轻胃黏膜损伤作用,低、中、高剂量水解小麦蛋白肽组与模型组相比均有显著差异(P<0.05)。

注:*.与空白对照组相比差异显著(P<0.05);#.与胃黏膜模型损伤对照组相比差异显著(P<0.05)。下同。
2.2 大鼠血清中氧化应激标志物MDA含量的变化
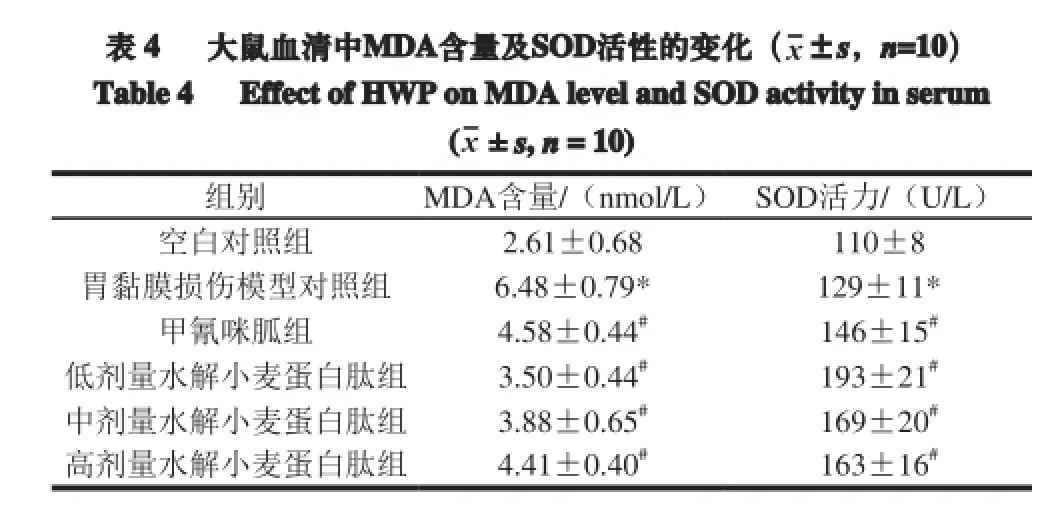
表 4 大鼠血清中MDA含量及SOD活性的变化(x±s,n=10)Table 4 Effect of HWP onMDA level and SOD activity in serum (x± s, n=10)组别 MDA含量/(nmol/L) SOD活力/(U/L)空白对照组 2.61±0.68 110±8胃黏膜损伤模型对照组 6.48±0.79* 129±11*甲氰咪胍组 4.58±0.44#146±15#低剂量水解小麦蛋白肽组 3.50±0.44#193±21#中剂量水解小麦蛋白肽组 3.88±0.65#169±20#高剂量水解小麦蛋白肽组 4.41±0.40#163±16#
由表4可知,灌胃水解小麦蛋白肽30 d后,无水乙醇致大鼠胃黏膜损伤,采集大鼠血清样品,发现与空白组相比,损伤组大鼠血清中MDA含量显著增加(P<0.05),表明大鼠体内氧化应激程度加剧。而灌胃低、中、高剂量的水解小麦蛋白肽,均能显著减少酒精损伤导致的血清中的氧化应激(P<0.05)。
2.3 大鼠血清中抗氧化应激酶活力的变化
当机体的氧化应激程度加剧时,机体主要通过上调抗氧化应激酶的活力来降低机体的氧化应激程度。由表4可知,酒精致大鼠胃黏膜损伤后,大鼠机体的氧化应激程度加剧,同时血清中的SOD的活力显著的代偿性升高(P<0.05),而灌胃低、中、高剂量的水解小麦蛋白肽,均能显著提高血清中SOD的活力(P<0.05),减少急性酒精性胃黏膜损伤后大鼠机体的氧化应激程度,有一定的抗氧化保护作用。
2.4 大鼠血清中PAF、PGE2、EGF及IL-8含量的变化

表 5 大鼠血清中PGE2、EGF、PAF及IL-8含量的变化(x±s,n=10)Table 5 Effect of HWP on PGE2, EGF, PAF and IL-8 levels in serum (x±s,n= 10)组别 PGE2含量/ (ng/L)EGF含量/ (ng/L)PAF含量/ (μg/L)IL-8含量/ (pg/mL)空白对照组 554±39 5 968±497 7.42±1.02 73±12胃黏膜损伤模型对照组 239±32* 2 281±311*18.18±1.07* 188±15*甲氰咪胍组 374±25#3 553±431#15.64±1.18#143±20#低剂量水解小麦蛋白肽组 452±44#4 102±557#11.65±1.09#105±13#中剂量水解小麦蛋白肽组 415±60#3 934±321#14.27±2.04#118±18#高剂量水解小麦蛋白肽组 321±52#3 404±346#17.48±0.84 138±17#
由表5可知,与空白对照组相比,胃黏膜损伤模型对照组的血清中PAF及IL-8的含量显著增加(P<0.05),PGE2、EGF的含量显著降低(P<0.05)。灌胃低、中、高剂量水解小麦蛋白肽,能显著提高大鼠血清中PGE2、EGF的含量,降低大鼠血清中IL-8的含量(P<0.05)。而灌胃低、中剂量水解小麦蛋白肽,能显著降低大鼠血清中PAF的含量(P<0.05)。
2.5 胃组织中Caspase 3及EGFR表达水平的变化
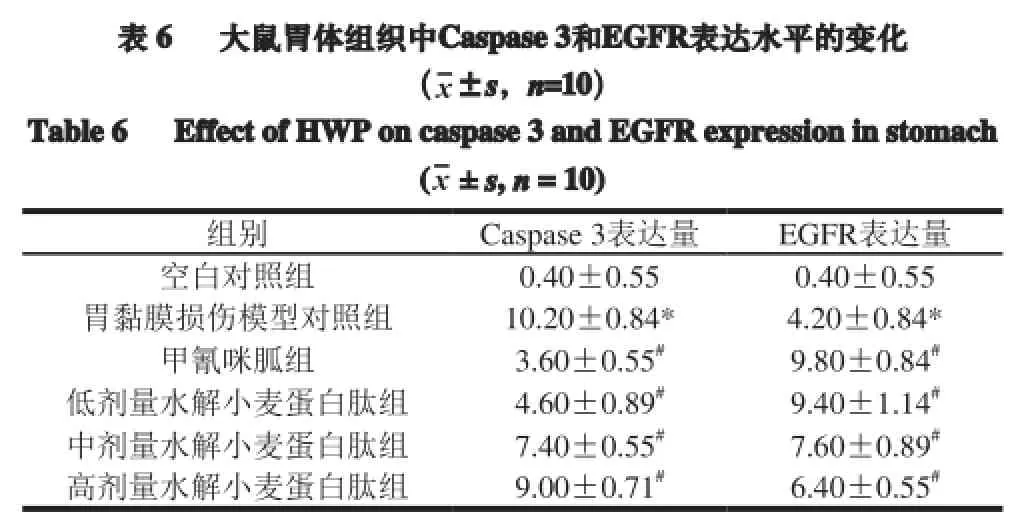
表 6 大鼠胃体组织中Caspase3和EGFR表达水平的变化(x±s,n=10)Table 6 Effect of HWP oncaspase3 andEGFRexpression in stomach (x±s,n= 10)组别 Caspase 3表达量 EGFR表达量空白对照组 0.40±0.55 0.40±0.55胃黏膜损伤模型对照组 10.20±0.84* 4.20±0.84*甲氰咪胍组 3.60±0.55#9.80±0.84#低剂量水解小麦蛋白肽组 4.60±0.89#9.40±1.14#中剂量水解小麦蛋白肽组 7.40±0.55#7.60±0.89#高剂量水解小麦蛋白肽组 9.00±0.71#6.40±0.55#
由表6可知,与空白对照组相比,胃黏膜损伤模型对照组的胃组织中Caspase 3的表达水平显著升高(P<0.05),EGFR的表达水平显著降低(P<0.05)。灌胃低、中、高剂量的水解小麦蛋白肽能显著降低大鼠胃组织中Caspase 3的表达水平(P<0.05),显著提高大鼠胃体组织中EGFR的表达水平(P<0.05)。
3 讨 论
乙醇是常见的致胃黏膜损伤因子,对胃黏膜具有腐蚀性,能够破坏表面黏液层及黏液细胞并削弱胃黏膜防御因子的保护作用[9],大鼠灌胃1 mL无水乙醇后,病理组织切片观察,可见明显的胃黏膜上皮细胞变性、坏死,并伴有局部出血和充血,脂质过氧化程度加剧,细胞凋亡明显增加。
本研究结果表明灌胃不同剂量水解小麦蛋白肽能够显著降低乙醇诱导的大鼠胃黏膜出血损伤,具体表现为大体观察与病理组织损伤积分显著降低,损伤抑制率增加。MDA是脂质过氧化反应中产生的过氧化物,其含量的变化反映了机体组织细胞受自由基攻击的严重程度。SOD是机体清除氧自由基的重要酶,可通过歧化反应清除机体内氧代谢过程中产生的有害超氧负离子自由基,从而达到解毒的目的,它的活性状态对维护黏膜完整性具有重要的影响[10-11]。本实验结果显示水解小麦蛋白肽可以显著提高大鼠血清SOD的活性,并有效抑制MDA水平的增高,表明水解小麦蛋白肽能提高机体抗氧化并清除自由基能力,降低脂质过氧化能力。
PAF是目前发现的促溃疡递质中最强的一种,它可以导致血管收缩,通透性升高,微循环障碍及炎症反应,最终引起胃黏膜损伤,甚至溃疡的形成[12-13],灌胃低、中剂量水解小麦蛋白肽能显著降低血清中PAF的含量。PGE2是胃黏膜重要的调控介质,在组织中的减少与多种因素导致的胃黏膜损伤有关[14-15],PGE2可改善胃黏膜血流量,清除对上皮屏障具有损伤作用的物质,对胃黏膜的完整起到重要的保护作用[16-18]。EGF是一种作用广泛的胃肠道营养多肽,是调节溃疡愈合的重要中介因子,能够降低胃黏膜损伤程度,促进组织损伤修复,促使溃疡愈合的作用[1,19-20]。EGFR是一种具有酪氨酸蛋白激酶活性的细胞表面受体,其与相应配体结合后,通过自身磷酸化而参与细胞的信号转导,经过细胞质中衔接蛋白、酶的级联反应,调节转录因子激活mRNA的转录,指导细胞迁移、黏附、增殖、分化、凋亡[21],溃疡胃黏膜中EGF和EGFR的基因表达上调,可刺激上皮细胞增殖和迁移,加速上皮更新和修复过程[22-23]。灌胃水解小麦蛋白肽能显著提高PGE2及EGF的含量及胃组织中EGFR的表达水平,降低胃黏膜损伤程度,加速胃黏膜的修复。IL-8是目前已知最强的多形核白细胞趋化和激活因子,它可诱导多形核白细胞形态变化、趋化,使细胞内Ca2+浓度短暂性升高,促进多形核白细胞脱颗粒,溶酶体酶释放,黏附蛋白上调,生物活性脂质形成和呼吸爆发,形成超氧化物[24],从而促进炎症反应的发生。IL-8主要生物学效应是趋化中性粒细胞向炎症部位聚集,促进其吞噬作用,但亦造成局部组织炎症和溃疡加剧[25-26]。灌胃水解小麦蛋白肽能显著降低大鼠血清IL-8含量,具有一定的抗炎作用。
Caspase 3是Caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子。它的活化是凋亡进入不可逆阶段的标志[27],应激性胃黏膜损伤后,Caspase 3表达水平显著增加,加剧细胞凋亡。研究表明细胞凋亡是造成急性胃黏膜损伤的重要因素,并由细胞因子诱导[28-29]。细胞凋亡过度而细胞增殖受抑将破坏黏膜的完整性,并最终导致黏膜损伤[30]。灌胃水解小麦蛋白肽能显著降低大鼠胃组织中Caspase 3的表达水平,减少了胃黏膜上皮细胞的凋亡,促进了损伤的愈合。
综上所述,本研究的水解小麦蛋白肽能显著改善大鼠酒精性胃黏膜损伤的程度,增强胃黏膜保护因子,提高抗氧化及清除自由基能力,降低脂质过氧化能力。本实验结果也显示水解小麦蛋白肽可显著减轻大鼠酒精性胃黏膜损伤的炎症反应,减少胃黏膜上皮细胞的凋亡,促进胃黏膜损伤的愈合。因此,水解小麦蛋白肽的作用机制可能与增强胃黏膜保护因子,抗氧化、抗炎及抗凋亡等作用机制有关。
参考文献:
[1] 陈建章, 陈文, 喻菁, 等.半四左方对胃溃疡大鼠表皮细胞生长因子和转化生长因子的影响[J].时珍国医国药, 2014(2): 313-314.DOI:10.3969/j.issn.1008-0805.2014.02.024.
[2] 何绍珍, 任建林.乙醇对胃黏膜作用机制的研究进展[J].世界华人消化杂志, 2005, 13(21): 2591-2596.DOI:10.3969/ j.issn.1009-3079.2005.21.016.
[3] YIN H, CAI H Z, WANG S K, et al.Wheat peptides reduce oxidative stress and inhibit NO production through modulating mu-opioid receptor in a rat NSAID-induced stomach damage model[J].Chinese Journal of Natural Medicines, 2015, 13(1): 22-29.DOI:10.1016/ S1875-5364(15)60003-6.
[4] JEONG H J, JEONG J B, KIM D S, et al.The cancer preventive peptide lunasin from wheat inhibits core histone acetylation[J].Cancer Letters, 2007, 255(1): 42-48.DOI:10.1016/j.canlet.2007.03.022.
[5] MOTOI H, KODAMA T.Isolation and characterization of angiotensin I-converting enzyme inhibitory peptides from wheat gliadin hydrolysate[J].Nahrung-Food, 2003, 47(5): 354-358.DOI:10.1002/ food.200390081.
[6] NIU L Y, JIANG S T, PAN L J.Preparation and evaluation of antioxidant activities of peptides obtained from defatted wheat germ by fermentation[J].Journal of Food Science and Technology-Mysore,2013, 50(1): 53-61.DOI:10.1007/s13197-011-0318-z.
[7] DADZIE R G, MA H L, ABANO E E, et al.Optimization of process conditions for production of angiotensin I-converting enzyme (ACE)inhibitory peptides from vital wheat gluten using response surface methodology[J].Food Science and Biotechnology, 2013, 22(6): 1531-1537.DOI:10.1007/s10068-013-0248-9.
[8] 国家食品药品监督管理局.关于印发抗氧化功能评价方法等9个保健功能评价方法的通知[EB/OL].(2012-04-23)[2016-05-23].http:// www.sda.gov.cn/WS01/CL0847/71257.html.
[9] AMIRSHAHROKHI K, KHALILI A R.The effect of thalidomide on ethanol-induced gastric mucosal damage in mice: involvement of inflammatory cytokines and nitric oxide[J].Chemico-Biological Interactions, 2015, 225: 63-69.DOI:10.1016/j.cbi.2014.11.019.
[10] 问慧娟, 李玉巧, 崔玉英, 等.白藜芦醇对大鼠应激性胃溃疡的保护作用[J].中国医院药学杂志, 2014, 34(1): 15-18.DOI:10.13286/ j.cnki.chinhosppharmacyj.2014.01.05.
[11] CHEN H M, LIAO H J, LIU Y H, et al.Protective effects of pogostone from Pogostemonis herba against ethanol-induced gastric ulcer in rats[J].Fitoterapia, 2015, 100: 110-117.DOI:10.1016/ j.fitote.2014.11.017.
[12] NAKAMURA T, SAKAGUCHI T, UNNO N, et al.Relationship between the platelet activating factor acetylhydrolase gene and intractability of ulcerative colitis[J].Diseases of the Colon & Rectum,2002, 45(3): 389-393.DOI:10.1007/s10350-004-6188-y.
[13] 朱焕金.健脾益气方药调控血小板活化因子对急性胃黏膜损伤修复作用的研究[D].广州: 广州中医药大学, 2009: 10-12.
[14] ARAKAWA T, HIGUCHI K, FUJIWARA Y, et al.15thAnniversary of rebamipide: looking ahead to the new mechanisms and new applications[J].Digestive Diseases and Sciences, 2005, 50(Suppl 1): 3-11.DOI:10.1007/s10620-005-2800-9.
[15] 阮研硕, 赵江燕, 李艳梅, 等.岩藻多糖对急性酒精性胃黏膜损伤的保护作用[J].中国食品学报, 2015, 15(1): 19-24.DOI:10.16429/ j.1009-7848.2015.01.004.
[16] 曲宝戈, 潘锦敦, 王中东, 等.长期饮酒胃黏膜病理改变与PGE2 和EGF的关系[J].胃肠病学和肝病学杂志, 2011, 20(9): 801-803.DOI:10.3969/j.issn.1006-5709.2011.09.006.
[17] 张雅博, 阮研硕, 赵晓红, 等.乙醇性胃黏膜损伤及其保护作用的研究进展[J].食品安全质量检测学报, 2013(4): 1239-1245.
[18] 黄进波, 萧钦, 周佳佳, 等.竹叶黄酮对乙醇诱导小鼠急性胃黏膜损伤的保护作用[J].现代药物与临床, 2015(7): 779-783.DOI:10.7501/ j.issn.1674-5515.2015.07.006.
[19] YANAKA A, SUZUKI H, SHIBAHARA T, et al.EGF promotes gastric mucosal restitution by activating Na+/H+exchange of epithelial cells[J].American Journal of Physiology-Gastrointestinal and Liver Physiology, 2002, 282(5): G866-G876.DOI:10.1152/ ajpgi.00150.2001.
[20] 韦维, 林寿宁, 黄贵华, 等.安胃汤对胃溃疡大鼠溃疡修复及表皮生长因子的影响[J].湖南中医药大学学报, 2008, 28(6): 38-40.DOI:10.3969/j.issn.1674-070X.2008.06.011.
[21] 刘晓玲, 王汝俊, 张千桥.补中益气汤对脾虚大鼠胃黏膜EGFR蛋白表达的影响[J].中药药理与临床, 2012(5): 12-14.DOI:10.13412/ j.cnki.zyyl.2012.05.009.
[22] 文国容, 徐靖宇, 刘雪梅, 等.胃乐散对大鼠胃溃疡黏膜EGF、EGFR和TGFβ1的影响及意义[J].时珍国医国药, 2012, 23(1): 3-4.DOI:10.3969/j.issn.1008-0805.2012.01.002.
[23] YANG Z B, YAN J, ZOU X P, et al.Enhanced expression of epidermal growth factor receptor gene in gastric mucosal cells by the serum derived from rats treated with electroacupuncture at stomach meridian acupoints[J].World Journal of Gastroenterology, 2006,12(34): 5557-5561.DOI:10.3748/wjg.v12.i34.5557.
[24] 于海, 柴剑波, 赵伟国, 等.大黄黄连泻心汤、理中丸对消炎痛型胃溃疡寒热证模型大鼠血清IL-8和TNF-α含量的影响[J].时珍国医国药, 2012(2): 382-383.DOI:10.3969/j.issn.1008-0805.2012.02.058.
[25] 陈建章, 陈文, 王小平, 等.半四左方对乙酸型胃溃疡的愈合作用及IL-8和IL-1β的影响[J].时珍国医国药, 2015(4): 863-864.DOI:10.3969/j.issn.1008-0805.2015.04.036.
[26] YAKABI K, MIMURA H, IWABUCHI H, et al.Neutrophilderived hydroxyl radicals mediate interleukin-8-induced increases in tetragastrin-stimulated acid secretion in rats[J].Digestive Diseases and Sciences, 2003, 48(6): 1081-1087.DOI:10.1023/A:1023708511116.
[27] VISCONTI R, D'ADAMIO L.Functional cloning of genes regulating apoptosis in neuronal cells[J].Methods in Molecular Biology, 2007,399: 125-131.DOI:10.1007/978-1-59745-504-6_9.
[28] SLOMIANY B L, SLOMIANY A.Ghrelin protection against lipopolysaccharide-induced gastric mucosal cell apoptosis involves constitutive nitric oxide synthase-mediated caspase-3 s-nitrosylation[J].Mediators of Inflammation, 2010: 1-7.DOI:10.1155/2010/280464.
[29] 白丽君.心身1号对慢性应激致胃黏膜损伤大鼠c-fos, caspase-3,c-myc的影响[D].天津: 天津医科大学, 2009: 23-27.
[30] LOU L X, GENG B, YU F, et al.Endoplasmic reticulum stress response is involved in the pathogenesis of stress induced gastric lesions in rats[J].Life Sciences, 2006, 79(19): 1856-1864.DOI:10.1016/ j.lfs.2006.06.022.
孙桂菊(1963—),女,教授,博士,研究方向为营养与食品卫生。E-mail:gjsun@seu.edu.cn
DOI:10.7506/spkx1002-6630-201613032
中图分类号:R151
文献标志码:A
文章编号:1002-6630(2016)13-0178-05
收稿日期:2016-01-21
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102205-02);科技北京百名领军人才培养工程项目(Z131110000513026)
作者简介:杨贤(1989—),男,硕士研究生,研究方向为营养与食品卫生。E-mail:1105055484@qq.com
*通信作者:潘兴昌(1966—),男,副主任医师,博士,研究方向为食品营养。E-mail:nutripan@163.com
Effect of Hydrolyzed Wheat Protein Peptide on Ethanol-Induced Acute Gastric Mucosal Damage in Rats
YANG Xian1, WANG Yanyan1, WANG Feng1, XIA Hui1, PAN Xingchang2,*, ZHU Hangju1, GU Ruizeng2,MA Yongqing2, TANG Huali1, WANG Shaokang1, SUN Guiju1,*
(1.Key Laboratory of Environmental Medicine and Engineering, Ministry of Education, Department of Nutrition and Food Hygiene,School of Public Health, Southeast University, Nanjing 210009, China; 2.China National Research Institute of Food and Fermentation Industries, Beijing 100028, China)
Abstract:Objective: The present work was aimed to examine the protective effect of hydrolyzed wheat protein peptide (HWP) in the model rats with acute gastric mucosal damage induced by ethanol.Methods: Hydrolyzed wheat protein peptide (167, 333 or 667 mg/(kg·d) (in body mass), cimetidine (65 mg/(kg·d)), or distilled water were administered daily by gavage for 30 days before the rats were treated with anhydrous ethanol (1 mL) and then euthanized after 1 h.Histological observation was performed to evaluate the antioxidant and anti-inflammatory activity of HWP as well as its impact on serum physiological and biochemical parameters and the expression of caspase-3 and epidermal growth factor receptor (EGFR).Results: Histological observation showed that ethanol-induced gastric mucosal damage was attenuated by hydrolyzed wheat protein peptide pretreatment.Hydrolyzed wheat protein peptide remarkably increased the superoxide dismutase (SOD) activity, epidermal growth factor (EGF) and prostaglandin E-2 (PGE2) levels in serum.Furthermore, it dramatically decreased malondialdehyde (MDA), platelet-activating factor (PAF) and interleukin-8 (IL-8) levels in serum.The expression level of caspase-3 in stomach was significantly decreased in hydrolyzed wheat protein peptide-treated rats when comparedwith the model group; however, the expression level of EGFR was markedly increased.Conclusion: Ethanol-induced gastric mucosal damage in rats can be protected against by hydrolyzed wheat protein peptide.The potential mechanism may be associated with the enhancement of antioxidant, anti-inflammatory and anti-apoptotic functions.
Key words:hydrolyzed wheat protein peptide; gastric mucosal damage; ethanol
