假肠膜明串珠菌甘露醇脱氢酶基因的克隆及表达
2016-08-10程雅韵李官浩崔虎山延边大学农学院吉林延吉3300延边大学附属医院西区吉林延吉33000
程雅韵,王 新,郑 琳,李官浩,崔虎山,金 清,*(.延边大学农学院,吉林 延吉 3300;.延边大学附属医院西区,吉林 延吉 33000)
假肠膜明串珠菌甘露醇脱氢酶基因的克隆及表达
程雅韵1,王 新1,郑 琳1,李官浩1,崔虎山2,金 清1,*
(1.延边大学农学院,吉林 延吉 133002;2.延边大学附属医院西区,吉林 延吉 133000)
摘 要:利用聚合酶链式反应从假肠膜明串珠菌中扩增出甘露醇脱氢酶(mannitol dehydrogenase,MDA)基因的结构基因,克隆入表达载体pETDuet-1,构建了甘露醇脱氢酶表达质粒pETDuet-1-mdh,将其转化进入大肠杆菌BL21(DE3),经异丙基-β-D-硫代半乳糖苷诱导表达。假肠膜明串珠菌甘露醇脱氢酶结构基因长度为1 017 bp,重组甘露醇脱氢酶基因在大肠杆菌内成功表达,其蛋白质分子质量为36.0 kD;重组甘露醇脱氢酶活力为0.15 U/mg pro,高于假肠膜明串珠菌中甘露醇脱氢酶活力0.03 U/mg pro。
关键词:甘露醇;甘露醇脱氢酶;假肠膜明串珠菌;基因克隆;表达
引文格式:
程雅韵, 王新, 郑琳, 等.假肠膜明串珠菌甘露醇脱氢酶基因的克隆及表达[J].食品科学, 2016, 37(13): 153-156.
CHENG Yayun, WANG Xin, ZHENG Lin, et al.Cloning and expression of mannitol dehydrogenase gene from Leuconostoc pseudomesenteroides[J].Food Science, 2016, 37(13): 153-156.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613027. http://www.spkx.net.cn
甘露醇(mannitol),学名己六醇,是六元糖醇的一种,别名D-甘露糖醇、木蜜醇,为山梨醇的同分异构体[1]。甘露醇具有清凉的甜味,甜度为蔗糖的60%,不易吸潮,还具有热量低、无毒、无副作用等特点。甘露醇被人体吸收后的代谢不依靠胰岛素,故不提高血糖值。甘露醇不会作为口腔微生物的营养源,可抑制突变链球菌的生长繁殖。甘露醇没有还原基,不参与美拉德反应,不容易焦化。由于甘露醇具有特殊的物理和化学性质,甘露醇可作麦芽糖、口香糖、糕点等食品的防黏剂,也可作糖尿病、肥胖病人的低热值食品和低糖食品的甜味剂和功能性食品添加剂等,广泛应用于食品工业[2]。
生产甘露醇的方法主要有提取法、化学合成法、酶转化法、微生物发酵法等[3-6]。其中微生物发酵法可以提高甘露醇的产率并且能避免山梨醇等副产物的产生,成为甘露醇生产的主要发展趋势[7]。目前已经报道了多种微生物具有生产甘露醇的能力,包括霉菌、酵母菌和细菌,其中乳酸菌代谢途径中的甘露醇脱氢酶(mannitol dehydrogenase,MDH)可有效转化果糖生成甘露醇[8-12]。目前,已经对短乳杆菌(Lactobacillus brevis)、旧金山乳杆菌(Lactobacillus sanfranciscensis)等乳酸菌所产的甘露醇脱氢酶进行了纯化和特性分析,并探讨了这些乳酸菌作为甘露醇生产菌株的可行性[11-13],结果表明这些菌株因甘露醇转化率低或生长速率缓慢而不适于作生产用菌株。
假肠膜明串珠菌作为异型发酵乳酸菌的一种,其所产的甘露醇脱氢酶是甘露醇生成过程中的关键酶,在烟酰胺腺嘌呤二核苷酸(dihydronicotinamide-adenine dinucleotide,NADH)或烟酰胺腺嘌呤二核苷磷酸(dihydronicotinamide adenine dinuclectide phosphate,NADPH)为辅酶催化果糖生成甘露醇[14]。近年来,假肠膜明串珠菌作为甘露醇生产优良菌株受到广泛关注[15]。为将假肠膜明串珠菌及其所产MDH有效应用于甘露醇生产,必须对其酶学特性进行分析,并提高酶的表达量。
因此,本课题组以遗传及生理机能都被熟知的大肠杆菌作为宿主细胞,利用基因工程技术,将假肠膜明串珠菌的甘露醇脱氢酶结构基因转入其中,通过异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)诱导使其异源表达,提高MDH的表达量和酶活性,为进一步研究MDH酶学特性并将假肠膜明串珠菌MDH应用于甘露醇的生产提供理论依据。
1 材料与方法
1.1 菌株、试剂与培养基
假肠膜明串珠菌KCTC3652(Leuconostoc pseudomesenteroides KCTC3652) 韩国生物资源中心(Korean Collection for Type Cultures,KCTC);表达质粒pETDuet-1 质粒、大肠杆菌(Escherichia coli)Top10菌株和表达菌株E.coli BL21(DE3)为延边大学食品科学系食品科学实验室保存。
核糖核酸酶(RNaseA)、溶菌酶(lysozyme)、IPTG、氨苄青霉素(ampicillin,Amp)、琼脂糖、过硫酸铵、丙烯酰胺、甘氨酸、2-巯基乙醇、四甲基乙二胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷、硼酸、三羟甲基氨基甲烷(Tris(hydroxymethyl)metyl aminomethane,Tris)、考马斯亮蓝、乙二胺四乙酸二钠、甘油、溴酚蓝阿拉丁、核酸染料 北京鼎国昌盛生物技术有限责任公司;磷酸二氢钾 沈阳市华东试剂厂;D-果糖、磷酸氢二钾、冰乙酸、甲醇、无水乙醇、盐酸 天津科密欧化学试剂有限公司;DL15 000 DNA Marker、T4 DNA连接酶、碱性磷酸酶、限制性内切酶SacⅠ和EcoRⅠ、HSTMMix、蛋白质标准Marker 日本TaKaRa公司;NADH 美国Sigma公司;聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒、胶提取试剂盒、DNA提取试剂盒、质粒提取试剂盒 美国Omega公司。
MRS培养基、LB培养基 青岛高科园海博生物技术有限公司。
1.2 仪器与设备
SX-700高压灭菌锅 日本Tomy公司;U3900紫外-可见光分光光度计 日本日立公司;Z400K高速冷冻离心机 德国Hermle公司;JYD-150智能型超声波细胞粉碎机 上海信之仪器有限公司;TU-100恒温金属浴上海一恒科技有限公司;EPS-300电泳仪 上海天能科技有限公司;ZWY-100H/240恒温培养振荡器 上海智城分析仪器制造有限公司;GelDoc2000凝胶成像仪、1658001 SDS-PAGE电泳仪 美国Bio-Rad公司;PTC-225 PCR仪 美国MJ Research公司。
1.3 方法
1.3.1 基因组DNA的提取
假肠膜明串珠菌KCTC3652的基因组DNA提取步骤按DNA提取试剂盒操作步骤进行,提取基因组总DNA经验证后置于-20 ℃条件下保存。
1.3.2 表达载体pETDuet-1-mdh的构建
根据基因组数据库中MDH基因序列信息(该基因序列已经在欧洲分子生物学实验室(The European Molecular Biology Laboratory,EMBL)核苷酸序列数据库中报道,登录号为AJ486977)设计引物Lpmdh-FEcoRⅠ(5′-TTGAATTCAATGGAAGCACTTGTGTTAA CT-3′)和Lpmdh-R-SacⅠ(5′-TTGAGCTCTTATGCCT CTTCGCCAC-3′)后,以假肠膜明串珠菌KCTC3652基因组DNA为模板,进行MDH结构基因的PCR扩增[16]。PCR反应体系如下:HSTMMix 25 μL;Lpmdh-FEcoRⅠ、Lpmdh-R-SacⅠ各1 μL(终浓度1 μmol/L);假肠膜明串珠菌KCTC3652基因组DNA提取液1 μL;加双蒸水至50 μL。反应条件为:95 ℃预变性30 s;95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸60 s,共30 个循环;72 ℃延伸10 min。反应结束后,取5 μL PCR反应液进行1.0%的琼脂糖凝胶电泳检测,并对扩增片段进行胶回收提取纯化后进行EcoR I和SacⅠ双酶切,酶切产物连接到同样双酶切的pETDuet-1载体连接,构建一个新的重组质粒pETDuet-1-mdh。重组质粒转化到E.coli Top10感受态细胞,筛选阳性克隆,并经PCR扩增和酶切进行鉴定,将鉴定正确的重组质粒送生工生物工程(上海)股份有限公司进行测序验证。将基因测序正确的重组质粒pETDuet-1-mdh转化表达宿主E.coli BL21(DE3)。
1.3.3 表达载体pETDuet-1-mdh的诱导表达
将重组质粒pETDuet-1-mdh 2 μL转入E.coli BL21(DE3)进行转化,将转化后的菌株接种于LB液体培养基中(终质量浓度为50 μg/mL的氨苄青霉素),在37 ℃振荡培养,直至OD600 nm值达到0.6时加入1 mmol/L 的IPTG,20 ℃振荡培养16 h,采集菌体悬浮液[17]。将菌体悬浮液在4 ℃、8 000×g条件下离心5 min 收集菌体,用生理盐水清洗菌体2 次,再加入发酵液初始体积的1% pH 7.0 Tris-HCl缓冲液悬浮菌体,超声波裂解菌体细胞直至菌体溶液澄清,得到菌体裂解液。将菌体裂解液在4 ℃、15 000×g离心30 min,对菌体裂解液和离心后上清液蛋白进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析[18]。
1.3.4 MDH活性测定
MDH活性测定溶液包括100 mmol/L pH 6.0磷酸钾缓冲液,200 mmol/L NADH和200 mmol/L D-果糖,加入上述上清液作为重组酶粗提液起始反应。MDH的活性通过测定NADH在340 nm波长处的吸光度变化测得[19]。酶活力单位定义为1 min消耗1 mol NADH所用的酶量。
2 结果与分析
2.1 甘露醇脱氢酶生物学信息
根据EMBL核苷酸序列数据库提供的生物学信息(图1),假肠膜明串珠菌mdh基因片段大小为1 017 bp,编码338 个氨基酸,蛋白质分子质量大小为36.0 kD。

2.2 mdh基因的克隆和表达载体构建
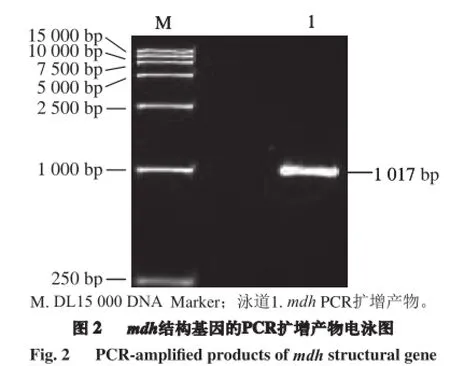
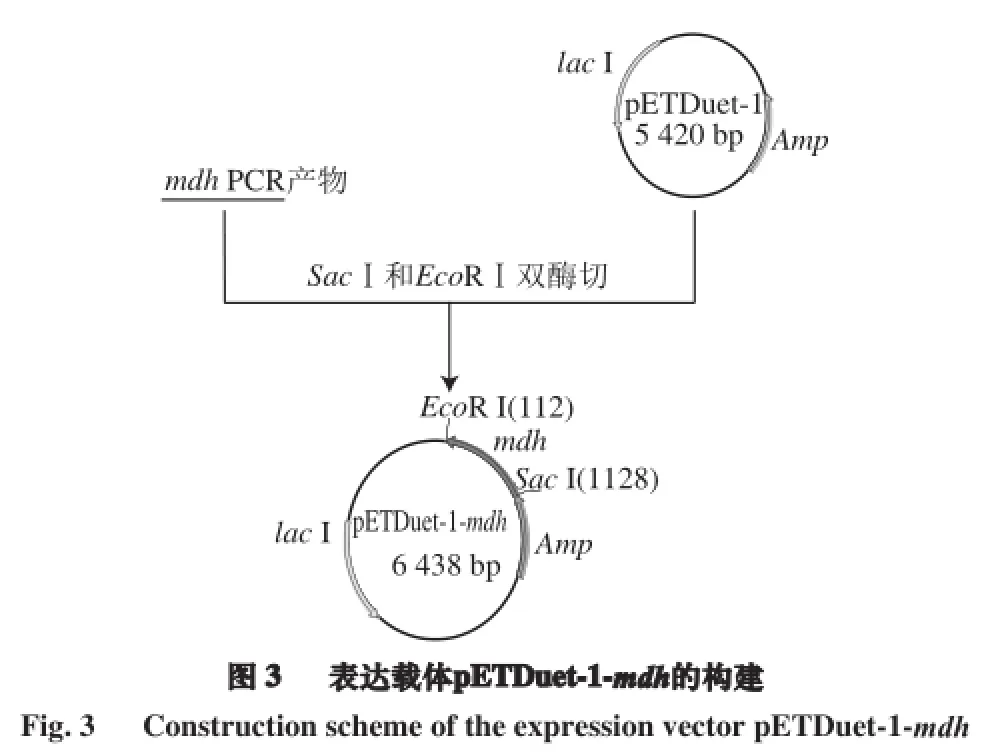
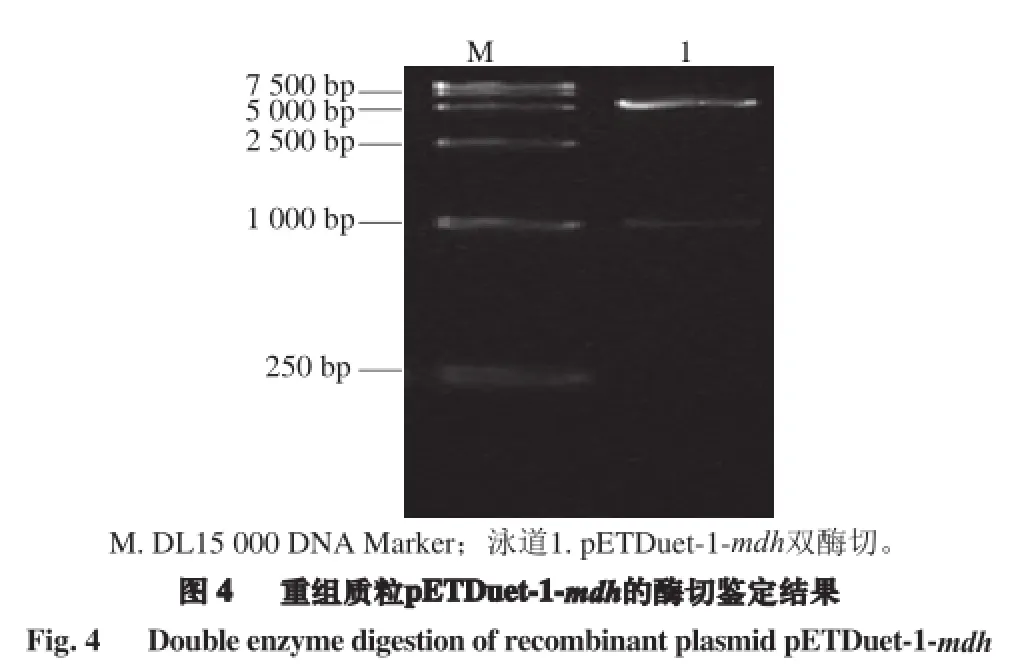
以假肠膜明串珠菌基因组DNA为模板,使用Lpmdh-F-EcoRⅠ和Lpmdh-R-SacⅠ为引物,进行mdh基因的PCR扩增,经琼脂糖凝胶电泳验证,扩增产物在约1 000 bp处有明显的扩增条带,同预期目的片段(1 017 bp)大小相符(图2)。扩增片段胶回收提取纯化后经EcoR Ⅰ和SacⅠ双酶切,酶切产物连接到同样双酶切的pETDuet-1载体连接,构建表达载体pETDuet-1-mdh(图3)。转化E.coli Top10感受态细胞筛选阳性单克隆菌,在LB培养基培养后提取质粒进行EcoR Ⅰ和SacⅠ双酶切鉴定,结果如图4所示,双酶切产生5 420 bp和1 000 bp两条条带,分别对应线性表达载体和插入目的基因大小,且该阳性克隆质粒经生工生物工程(上海)股份有限公司测序验证序列正确、无突变现象,表明mdh基因的表达载体成功构建。将基因测序正确的重组质粒pETDuet-1-mdh转化至表达宿主E.coli BL21(DE3)。
2.3 表达载体pETDuet-1-mdh的诱导表达
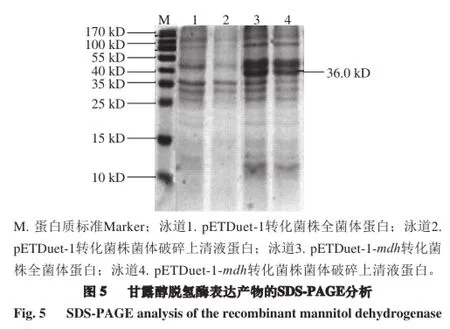
分别将pETDuet-1和pETDuet-1-mdh转入E.coli BL21(DE3)培养,对两种菌株的全菌体蛋白和菌体破碎上清液进行了SDS-PAGE分析,结果如图5所示。泳道1和2的pETDuet-1转化菌株全菌体蛋白和上清液蛋白在36.0 kD处无蛋白条带,而泳道3和4的表达载体pETDuet-1-mdh转化菌株在36.0 kD处有明显的表达蛋白条带且与预测MDH大小相当,破碎液上清液中检测出同样蛋白条带,说明重组菌株表达了MDH且表达可溶。
2.4 MDH的活性分析
重组质粒pETDuet-1-mdh转化菌株粗酶液中MDH活力为0.15 U/mg pro,高于假肠膜明串珠菌中MDH活力(0.03 U/mg pro),而pETDuet-1转化菌株粗酶液中未测定出酶活力,说明重组菌株成功表达了MDH且活性较高。
3 结 论
大肠杆菌是应用最为广泛的蛋白表达系统之一。假肠膜明串珠菌作为异型发酵乳酸菌的一种,产生MDH,在NADH或NADPH为辅酶催化果糖生成甘露醇,是微生物发酵法生产甘露醇的关键酶。本研究采用大肠杆菌表达系统探索了高效表达假肠膜明串珠菌中MDH的方法,首先利用PCR从假肠膜明串珠菌中扩增出mdh的结构基因,然后克隆入表达载体pETDuet-1,构建了MDH表达质粒pETDuet-1-mdh,将其转化进入E.coli BL21(DE3),经异丙基-β-D-硫代半乳糖苷诱导表达。重组甘露醇脱氢酶基因在大肠杆菌内成功表达且表达可溶,其蛋白质分子质量为36.0 kD,活力为0.15 U/mg pro,高于假肠膜明串珠菌中MDH活力0.03 U/mg pro。今后通过对转化pETDuet-1-mdh的重组大肠杆菌菌株培养条件和IPTG诱导条件的优化,进一步提高假肠膜明串珠菌mdh基因在大肠杆菌中的表达量,提高酶的活性,为研究其酶学特性和将假肠膜明串珠菌MDH应用于甘露醇的生产奠定基础。
参考文献:
[2] 王新, 白琴琴, 金清, 等.柠檬明串珠菌甘露醇脱氢酶特性研究[J].食品工业, 2014, 35(10): 174-176.
[3] 夏仙兵.海带工业中甘露醇的纳滤膜渗滤纯化研究[D].杭州: 浙江工商大学, 2010: 4-6.DOI:10.3969/j.issn.1003-2029.2010.02.021.
[4] 魏倩倩.甘露醇的生产与应用研究进展[J].食品工业科技, 2010,31(12): 401-404.DOI:10.13386/j.issn1002-0306.2010.12.009.
[5] 杨立红.蔗糖电解还原制备甘露醇、山梨醇研究[J].青海师范大学学报(自然科学版), 2012, 28(1): 66-69.DOI:10.3969/ j.issn.1001-7542.2012.01.016.
[6] 应伟丽, 韩晓颖, 李媚, 等.电化学法合成甘露醇[J].广西民族学院学报(自然科学版), 2005, 11(3): 91-93.DOI:10.16177/j.cnki.gxmzzk.2005.03.022.
[7] 魏文婷.产甘露醇菌株的筛选及其生物合成的研究[D].无锡: 江南大学, 2014: 11-17.
[8] SMILEY K L, CADMUS M C, ROGOVIN S P.Shortened fermentation process for D-mannitol: US, 3427224[P].1969-02-11.
[9] JUN Y, HIROSHI H, TOMOTAKE M, et al.Production of mannitol from raw glycerol by Candida azyma[J].Journal of Bioscience and Bioengineering, 2014, 117(6): 724-729.DOI:10.1016/ j.jbiosc.2013.11.016.
[10] IWAMOTO H, OZAWA M, MATSUMOTO N.Fermentative production of mannitol: JP, 48096787[P].1973-12-10.
[11] von WEYMAM N, HUJANEN M, LEISOLA M.Production of D-mannitol by heterofermentative lactic acid bacteria[J].Process Biochemistry, 2002, 37(11): 1207-1213.DOI:10.1016/S0032-9592(01)00339-9.
[12] von WEYMAM N, KIVIHARJU K, LEISOLA M.High-level production of D-mannitol with membrane cell-recycle bioreactor[J].Journal of Industry Microbiology and Biotechnology, 2002, 29(1): 44-49.DOI:10.1038/sj.jim.7000262.
[13] KORAKLI M, VOGEL R F.Purification and characterization of mannitol dehydrogenase from Lactobacillus sanfranciscensis[J].FEMS Microbiology Letters, 2003, 220(2): 281-286.DOI:10.1016/ S0378-1097(03)00129-0.
[14] 王芳.甘露醇发酵及甘露醇脱氢酶的克隆表达[D].石家庄: 河北科技大学, 2009: 6-10.DOI:10.7666/d.y1473561.
[15] HELANTO M, AAMIKUNNAS J, von WEYMAM N, et al.Improved mannitol production by a random mutant of Leuconostoc pseudomesenteroides[J].Journal of Biotechnology, 2005, 116(3): 283-294.DOI:10.1016/j.jbiotec.2004.11.001.
[16] AAMIKUNNAS J, RÖNNHOLM K, PALYA A.The mannitol dehydrogenase gene (mdh) from Leuconostoc mesenteroides is distinct from other known bacterial mdh genes[J].Applied Microbiology and Biotechnology, 2002, 59(10): 665-671.DOI:10.1007/s00253-002-1070-0.
[17] JIN Q, JUNG J Y, KIM Y J, et al.Production of L-lactatein Leuconostoc citreum via heterologous expression of L-lactate dehydrogenase gene[J].Journal of Biotechnology, 2009, 44(2): 160-164.DOI:10.1016/j.jbiotec.2009.08.012.
[18] 李冬梅, 郝婷婷, 李玲, 等.SDS-PAGE电泳法分析酸菜中乳酸菌分布[J].食品科技, 2013, 38(9): 258-261.DOI:10.13684/j.cnki.spkj.2013.09.020.
[19] 王小芳, 陈晶, 刘萍萍, 等.利用代谢工程构建D-甘露醇生产菌株[J].生物工程学报, 2013, 29(10): 1450-1462.DOI:10.13345/ j.cjb.2013.10.010.
DOI:10.7506/spkx1002-6630-201613027 10.7506/spkx1002-6630-201613027. http://www.spkx.net.cn [1] 刘芃.D-甘露醇多晶型的研究[D].天津: 天津大学, 2009: 1-4.10.7666/d.y1675629.
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2016)13-0153-04
收稿日期:2016-01-25
基金项目:国家自然科学基金地区科学基金项目(31260362);吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2015第40号])
作者简介:程雅韵(1992—),女,硕士研究生,研究方向为食品微生物发酵。E-mail:1748731183@qq.com
*通信作者:金清(1971—),女,副教授,博士,研究方向为食品微生物发酵。E-mail:jinqing@ybu.edu.cn
Cloning and Expression of Mannitol Dehydrogenase Gene from Leuconostoc pseudomesenteroides
CHENG Yayun1, WANG Xin1, ZHENG Lin1, LI Guanhao1, CUI Hushan2, JIN Qing1,*
(1.Agricultural College of Yanbian University, Yanji 133002, China;2.West District of Affiliated Hospital of Yanbian University, Yanji 133000, China)
Abstract:The structural gene encoding mannitol dehydrogenase (MDH) from Leuconostoc pseudomesenteroides was amplified by PCR and cloned into the vector pETDuet-1.As a result, the plasmid pETDuet-1-mdh was constructed and transformed into E.coli BL21(DE3) for MDH expression induced by isopropyl-β-D-thiogalactoside (IPTG).The length of the mdh structural gene was l 017 bp.The recombinant mdh gene was successfully expressed in Escherichia coli and the molecular weight of the expressed protein was 36.0 kD.The activity of recombinant mannitol dehydrogenase was 0.15 U/mg pro, which was higher than the MDH activity of Leuconostoc pseudomesenteroides (0.03 U/mg pro).
Key words:mannitol; mannitol dehydrogenase; Leuconostoc pseudomesenteroides; gene cloning; expression
