运动对肉鸡肉品质及肌纤维发育的影响
2016-08-10蔡洁琼朱昊鹏陈志强颜培实南京农业大学动物科技学院江苏南京210095
蔡洁琼,郑 月,朱昊鹏,陈志强,颜培实*(南京农业大学动物科技学院,江苏 南京 210095)
运动对肉鸡肉品质及肌纤维发育的影响
蔡洁琼,郑 月,朱昊鹏,陈志强,颜培实*
(南京农业大学动物科技学院,江苏 南京 210095)
摘 要:旨在分析运动对鸡肉品质和肌纤维发育的影响,选用36 只3 周龄爱拔益加(Arbor Acres,AA)肉鸡,按体质量相近分为对照组和运动组,实验从第4周开始训练到第9周后结束,为期6 周。在5、7、9 周龄时对肉鸡白天运动量、肌肉品质和肌纤维特性指标进行测定。结果表明:持续训练运动组,每周肉鸡白天活动量均显著高于对照组(P<0.05),中午休憩,运动组节律清晰。在9 周龄,运动组胸肌肉色L*值和a*值、腿肌肉色a*值、肌纤维直径显著高于对照组(P<0.05),运动组腿肌肌纤维密度显著低于对照组(P<0.05)。结论:强制运动可增加肉鸡白天活动量,在持续6 周后显现改善肉色,促进肉鸡腿肌肌纤维发育的效果。
关键词:运动;实验期;肉品质;肌纤维发育
引文格式:
蔡洁琼, 郑月, 朱昊鹏, 等.运动对肉鸡肉品质及肌纤维发育的影响[J].食品科学, 2016, 37(13): 53-59.DOI:10.7506/ spkx1002-6630-201613010. http://www.spkx.net.cn
CAI Jieqiong, ZHENG Yue, ZHU Haopeng, et al.Effect of exercise on broiler meat quality and muscle fiber development[J].Food Science, 2016, 37(13): 53-59.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613010. http://www.spkx.net.cn
动物跑台被用于大、小鼠和狗等实验动物关于运动训练、运动损伤及其对动物机体能量代谢和生理病理影响的研究,Emter[1]和Chicco[2]等研究发现运动训练改善心脏冠状微血管循环和线粒体能量代谢,期待以此缓解心力衰竭;Bhattacharya等[3]研究表明:运动可降低由于机体糖、脂代谢紊乱所造成的单纯性肥胖及其引发慢性疾病的发生。近年来营养因素、非营养性添加剂、环境因素和不同饲养方式对畜牧生产、产品品质、动物行为影响的研究渐多,而运动对于当下高密度集约化畜牧生产研究却少见。肉用土鸡的圈放养结合比起舍内平养,可降低料重比、腹脂率、胸肌胆固醇含量,腹脂中粪臭素含量,可提高肌肉中肌苷酸和肌内脂肪含量,亦即圈放养结合饲养模式改善土鸡的生长性能和肉质[4]。而白羽肉鸡在高饲养密度、高能量饲养模式下,生长发育快、骨骼和运动机能下降,腹脂率增加、易发脚垫损伤,运动机能障碍[5]。而每日5~15 min的强制运动,可减少肉鸡的腹脂率和暗期的代谢产热量,促进生长发育[6]。
本实验通过10 min/d强制运动训练,剖析提高肉鸡活动量,改善运动能力,可否促使胸、腿肌肌纤维发育,改善肉鸡肉品质,对于确立饲养模式,在养鸡生产中如何进行肉种鸡培育,预防骨骼损伤具有参考价值。从运动对肉质影响角度探讨运动的科学问题,以求为集约化肉鸡生产管理提供参考数据。
1 材料与方法
1.1 材料与试剂
3 周龄爱拔益加(Arbor Acres,AA)肉鸡36 只,体质量为650~700 g 南京市青龙山家禽养殖场。
苏木精伊红(hematoxylin-eosin,HE)染液、4%多聚甲醛溶液(paraformaldehyde,PFA) 上海麦克林生化科技有限公司。
1.2 仪器与设备
微型动物活动量加速度测定仪 美国健康医疗仪器国际公司;HI9125 便携式pH计 意大利Hanna Instruments公司;C-LM3型数显式肌肉嫩度仪 东北农业大学工程学院;CR-400色差仪 日本Konica Minolta Sensing公司;BS200S-WE1电子天平 北京赛多利斯天平有限公司;ZKSY-600恒温水浴锅 南京科尔仪器设备有限公司;RM2016型轮转式石蜡切片机 上海徕卡仪器有限公司;OLYMPUS虚拟显微镜 日本Philippines公司;台式跑步机 浙江启迈斯工贸有限公司。
1.3 方法
将36 只AA肉鸡按体质量相近随机分为运动组和对照组,每组各18 只。各组肉鸡单笼饲养,8:00前喂料,饲粮配方,1~3 周龄AA肉鸡:粗蛋白21.47%,代谢能3.01 MJ/kg;4~9 周龄AA肉鸡:粗蛋白19.57%,代谢能3.15 MJ/kg。每个处理放置相同大小的料槽和水槽,自由采食与饮水。鸡舍24 h光照,定期清理粪便、通风良好。预实验一周后,正式实验从第4周开始训练到第9周后结束,每隔2 周屠宰实验组和对照组各6 只鸡,直到9 周实验结束。宰前12 h停止喂食,自由饮水,运动组肉鸡经10 min运动后,称质量、颈部放血取同侧相同部位的肌肉在1 h内测得肉品质指标。
1.3 方法
1.3.1 运动训练和活动量的测定
实验组AA肉鸡在坡度为0°的台式跑步机上逐一强制进行7 d适应性运动阶段,第1天以6 m/min×10 min运动,此后时间恒定,速率以18、30、42、54、60 m/min逐天进行递增,适应运动训练后,正式实验开始于每天9:30-10:00,实验组AA肉鸡以60 m/min×10 min,坡度恒定为0°进行运动。实验期间,于每天9:00之前,给予对照组和运动组肉鸡佩戴带环胸腹部微型动物活动量加速度测定仪,取9:00-16:00间每分钟活动量(count/min)的数据。
1.3.2 肉色测定
宰后立即选取表面平整肉色均匀的右侧胸肌或腿肌,避开明显色泽缺陷部位(如碰伤、出血斑、表面变色等)。选取3 个不同位点,用校正后色差计紧扣肌肉表面测定肉色指标(L*、a*、b*值)[7]。
1.3.3 pH值测定
取宰后45 min的右侧大胸或腿肌,选择上半部分厚度均匀的肌肉采用校准便携式pH计,将pH探针以45°插入骨豁肌中1 cm左右进行测定,每块肉测定3 个不同位置,取平均值[8]。
1.3.4 蒸煮损失率测定[7]
将肉样置于自封袋内,排除自封袋内的空气,使样品与自封袋紧贴。再将装有肉样的自封袋放置在80 ℃的水浴锅内使样品温度达到75 ℃左右,其取出放置室温后,用滤纸吸干肉样表面水分称质量,并按下式计算蒸煮损失率。
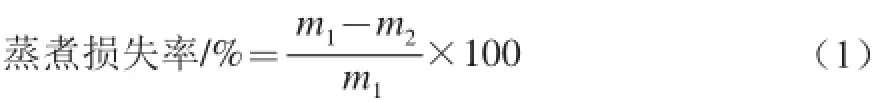
式中:m1为水浴前肌肉样品质量/g;m2为水浴后肌肉样品质量/g。
1.3.5 剪切力值测定
取肉鸡鸡胸、腿肌样品,剔除肌膜和脂肪组织,将样品放置78 ℃水浴锅加热使中心温度达到75 ℃后取出,用滤纸吸干肉样表面水分,冷却至室温,测量时,沿肌纤维发育方向切取3 cm×2 cm×2 cm的肉块样品,用C-LM3型数显式肌肉嫩度仪测量,每块肉块样品重复3 次,取平均值[8]。
1.3.6 石蜡切片包埋及HE染色[9]
取胴体的右侧胸肌和腿肌浸入多聚甲醛溶液中固定24 h之后,沿肌纤维走向切取合适的样本组织包埋于石蜡中,采用5 μm的厚度垂直于肌纤维走向进行切割,经漂片、铺片、烤片后HE染色,并滴加树胶封片,晾干24 h后可在显微镜下观测进行组织数据统计。
1.3.7 肌纤维直径和密度测量方法
在10×40 倍OLYMPUS虚拟显微镜下将HE染色后的组织切片随机选取150 根肌纤维直径拍照,利用Image-Pro Plus 6.0软件量取肌纤维直径;可利用Image-Pro Plus 6.0软件随机选取6 个网格的肌纤维数,每个网格为一定的区域面积[9],每个样品随机测8 个点后计算可得肌纤维密度,再求出平均值和标准差,其计算见下式。
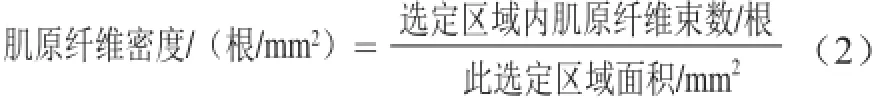
1.4 数据处理
利用Image-Pro Plus 6.0软件对肌纤维直径、肌纤维密度进行分析,将测得数据采用Excel 2007建立数据库,初步整理后,采用SPSS 18.0软件分析统计模型,其中包括运动和周龄双因素,同一周龄不同处理组间的差异显著性检验采用单因素方差分析进行,表中数据均为±s,以P<0.05作为差异显著性判断标准,P<0.01为差异极显著。
2 结果与分析
2.1 不同实验期AA肉鸡活动量变化
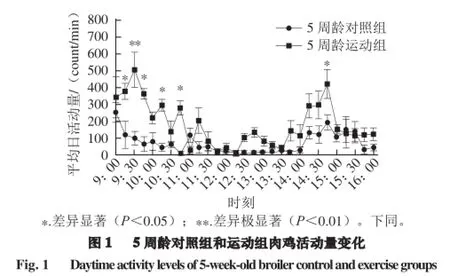
由图1可知,定义安静状态时活动量为0 count/min,每天测定时间7 h(早晨饲喂一次到晚上饲喂之前)内活动量,9:30-9:40给予运动干预10 min,6 只5 周龄运动组肉鸡平均活动量高于对照组,差异极显著(P<0.01),12:00-13:00,运动组和对照组肉鸡活动量相对之前明显减少,特别是下午14:30-15:00,不同处理组活动量较中午有升高趋势,且运动组活动量显著高于对照组(P<0.05)。
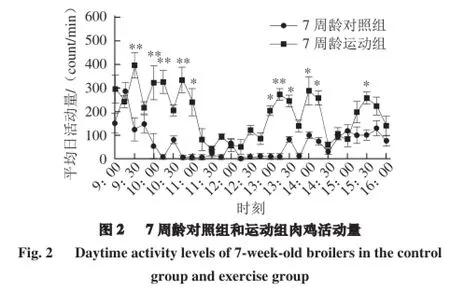
由图2可知,9:30-9:40给予运动干预10 min,6 只运动组7 周龄肉鸡在此时间段前后10 min平均活动量极显著高于对照组(P<0.01),10:00-10:15、10:45-11:0 0,运动组活动量显著高于对照组(P<0.01),直到11:00-13:00,中午休憩运动节律不清晰,运动组与对照组间活动量变化差异不显著(P>0.05),13:15-14:30运动组活动量极显著高于对照组(P<0.01)。
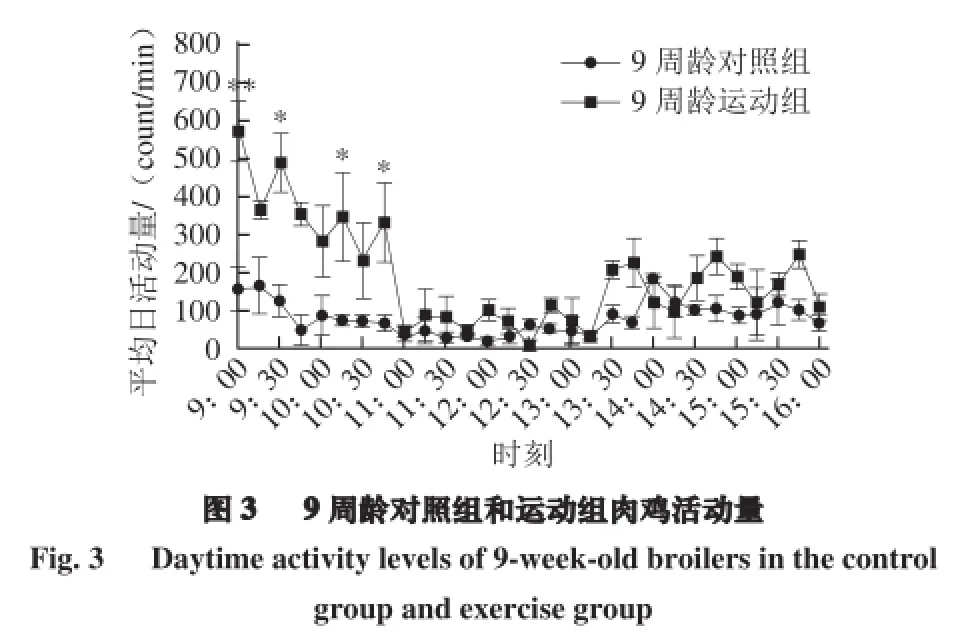
由图3可知,9:30-9:40给予运动干预10 min,6 只9 周龄运动组肉鸡在此时间段前后10 min平均活动量显著高于对照组(P<0.05),10:15-10:45运动组活动量仍然高于对照组(P<0.05),11:00-14:00对照组处于休息状态,而运动组个别有活动量变化,差异不显著(P>0.05),9 周龄不同处理组肉鸡因体质量增加,活动量较早晨减少,15:00-16:00晚上饲喂之前运动组活动量有高于对照组趋势,但差异不显著(P>0.05)。
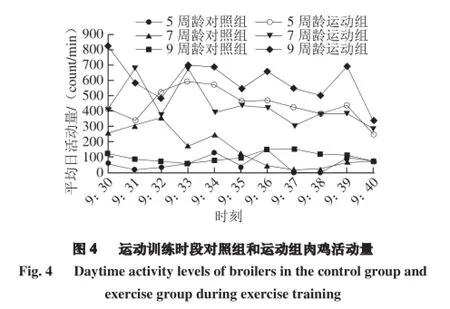
由图4可知,在9:30-9:40运动训练时段内,5、7、9 周龄运动组AA肉鸡平均活动量极显著高于对照组(P<0.01),其中在5、7、9 周龄3 个时段运动组活动量变化中发现,9 周龄运动组的活动量在运动干预10 min阶段,相对处于平稳状态,推测随着肉鸡周龄的增加,肉鸡运动能力及活跃程度升高。
2.2 运动和周龄对肉鸡鸡胸、腿肌肌肉品质的影响
2.2.1 运动和周龄对肉鸡胸肌肉品质的影响
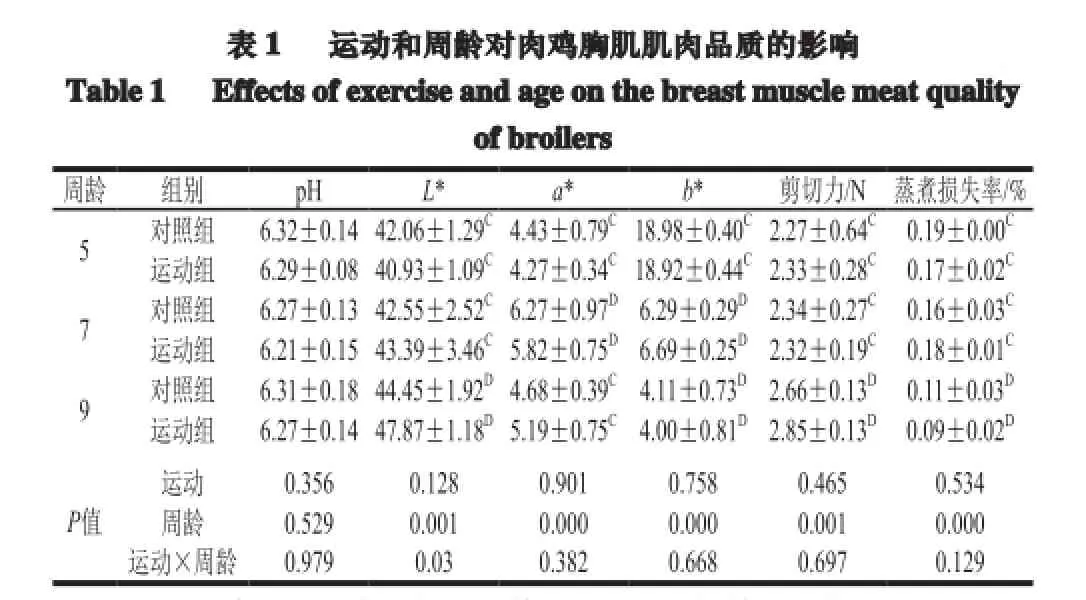
注:同列小写字母不同表示相同周龄不同处理组间差异显著(P<0.05);同列大写字母不同表示不同周龄同一处理组间差异极显著(P<0.01)。下同。
由表1可知,运动对5、7、9 周龄肉鸡胸肌宰后pH值、肉色L*、a*、b*值、蒸煮损失率、剪切力值均未表现出显著差异。但9 周龄胸肌运动组L*值较高于对照组差异不显著(P>0.05);周龄对肉色表面L*、a*、b*值、剪切力值和蒸煮损失率均存在显著影响。9 周龄运动组肉色表面L*值高于5 周龄运动组,差异极显著(P<0.01),7 周龄运动组肉色表面a*值极显著高于5 周龄和9 周龄运动组(P<0.01),9 周龄对照组和运动组肉色表面b*值均低于5 周龄和7 周龄,差异显著(P<0.05);9 周龄剪切力值极显著高于5 周龄和7 周龄(P<0.01);9 周龄对照组和运动组蒸煮损失率均低于5 周龄和7 周龄,差异极显著(P<0.01)。运动和周龄主效应及交互效应对肉鸡胸肌pH值、肉色a*、b*值、剪切力值和蒸煮损失率影响不显著,二者交互作用对肉鸡胸肌肉色L*值影响显著。
2.2.2 运动和周龄对肉鸡腿肌肉品质的影响
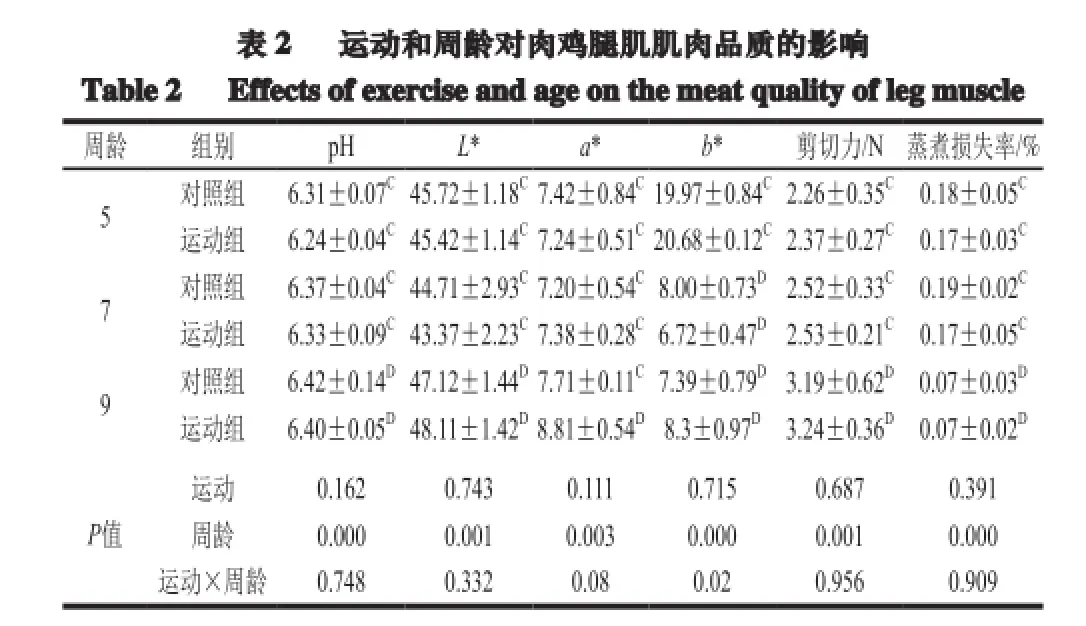
表 2 运动和周龄对肉鸡腿肌肌肉品质的影响Table 2 Effects of exerciseandageon the meatquality of leg muscle周龄 组别 pH L* a* b* 剪切力/N蒸煮损失率/% 5 对照组 6.31±0.07C45.72±1.18C7.42±0.84C19.97±0.84C2.26±0.35C0.18±0.05C运动组 6.24±0.04C45.42±1.14C7.24±0.51C20.68±0.12C2.37±0.27C0.17±0.03C7 对照组 6.37±0.04C44.71±2.93C7.20±0.54C8.00±0.73D2.52±0.33C0.19±0.02C运动组 6.33±0.09C43.37±2.23C7.38±0.28C6.72±0.47D2.53±0.21C0.17±0.05C9 对照组 6.42±0.14D47.12±1.44D7.71±0.11C7.39±0.79D3.19±0.62D0.07±0.03D运动组 6.40±0.05D48.11±1.42D8.81±0.54D8.3±0.97D3.24±0.36D0.07±0.02DP值运动 0.162 0.743 0.111 0.715 0.687 0.391周龄 0.000 0.001 0.003 0.000 0.001 0.000运动×周龄 0.748 0.332 0.08 0.02 0.956 0.909
由表2可知,运动对5、7、9 周龄运动组和对照组宰后pH值、肉色L*、a*、b*值、剪切力值和蒸煮损失率均未表现出显著影响,但9 周龄运动组肉色a*值较高于对照组,差异不显著(P>0.05)。周龄对运动组和对照组肉鸡腿肌肌肉宰后pH值、肉色L*、a*、b*值和蒸煮损失率均存在显著影响。随着周龄的延长宰后pH值均呈升高趋势,9 周龄运动组pH值极显著高于5 周龄(P<0.01),9 周龄运动组肉色表面a*值随着周龄的延长呈升高趋势,9 周龄运动组肉色a*值显著高于5 周龄(P<0.01),5 周龄对照组和运动组肉色b*值高于7 周龄和9 周龄肉色b*值,差异极显著(P<0.01);同一周龄运动组剪切力值有高于对照组的趋势,但差异不显著(P>0.05);5 周龄和7 周龄对照组和运动组蒸煮损失率高于9 周龄,差异极显著(P<0.01)。运动和周龄主效应及交互效应对肉鸡腿肌pH值、肉色L*、a*值、剪切力值和蒸煮损失率影响不显著,二者交互作用对肉鸡胸肉色b*值影响显著。
2.3 肉鸡肌纤维石蜡切片染色结果
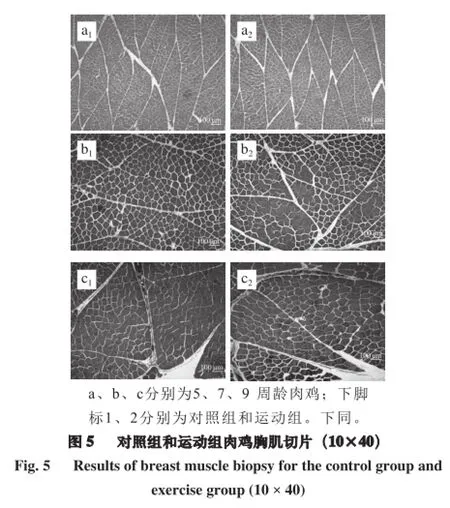
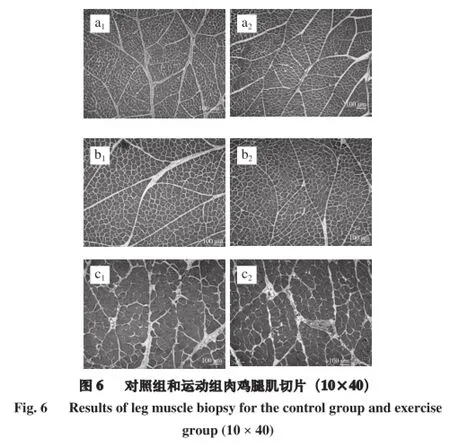
注:同行小写字母不同表示相同周龄不同处理组间差异显著(P<0.05);同行大写字母不同表示不同周龄相同处理组间差异极显著(P<0.01)。
由图5、6可知,肉鸡胸肌和腿肌肌纤维直径均随着肉鸡生长期的延长而增大,肌纤维密度呈下降趋势。也可利用Image-Pro Plus 6.0软件测量得肌纤维直径指标和密度指标。由图5可知,运动组a2、b2、c2肌纤维直径和密度与对照组a1、b1、c1相比,差异不显著(P>0.05),说明运动训练对胸肌肌纤维特性的发育影响不显著。由图6可知,9 周龄运动组(c2)中肌纤维直径高于对照组c1(P<0.05),c2组肌纤维密度低于对照组(c1)(P<0.05)。说明运动训练着重肉鸡腿部做功,运动对肉鸡腿部肌纤维发育具有促进作用。
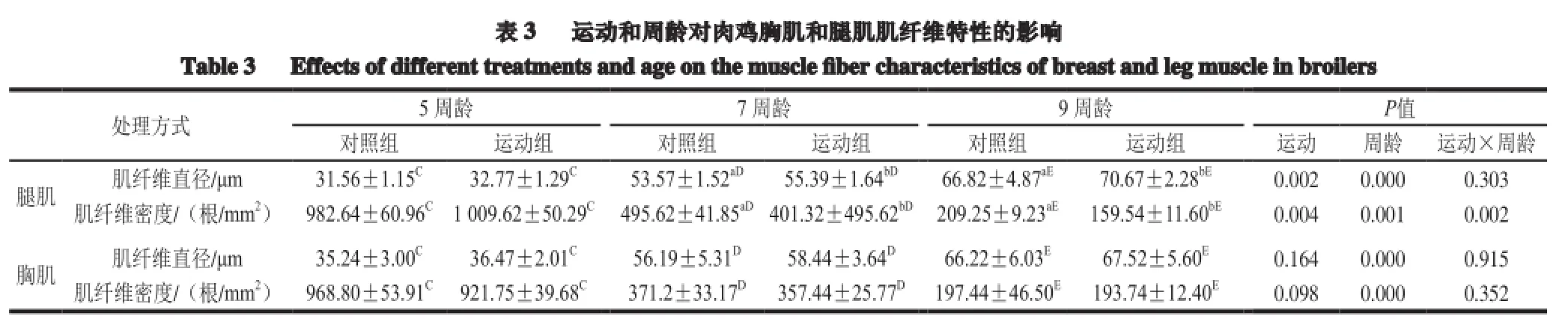
2.4 运动和周龄对肉鸡胸肌和腿肌肌纤维特性指标的影响
由表3可知,同一周龄中胸肌肌纤维直径在运动组和对照组之间差异不显著(P>0.05),7 周龄和9 周龄腿肌肌纤维直径运动组显著高于对照组(P<0.05),腿肌肌纤维密度运动组显著低于对照组(P<0.05)。随着周龄的增加,胸肌和腿肌的肌纤维直径增加,而肌纤维密度减小,9 周龄与5 周龄和7 周龄间差异极显著(P<0.01);各周龄肌纤维直径和肌纤维密度,在胸肌运动组和对照组之间差异不显著(P>0.05),但腿肌肌纤维直径7 周龄和9 周龄运动组显著高于对照组(P<0.05),腿肌肌纤维密度7 周龄和9 周龄运动组极显著低于对照组(P<0.01)。运动和周龄主效应及交互效应对肉鸡胸、腿肌肌纤维直径、胸肌肌纤维密度影响不显著,周龄对肉鸡胸腿肌剪切力和肌纤维直径、肌纤维密度影响极显著(P<0.01);二者交互作用对肉鸡腿肌肌纤维密度影响显著。
3 讨 论
3.1 运动和周龄对肉鸡肌肉品质的影响
目前相对于高密度集约化笼养肉鸡,散养、放养等饲养模式可增加肉鸡运动量,降低饲养密度,扩大活动空间,都有助于改善肉鸡福利状况进而提高生长性能和肉品质[8,10-11]。宰后肌肉内供氧中断,糖酵解供能产生乳酸以及ATP降解产生的无机磷酸,使肌肉pH值下降。待宰3 h,因糖原分解即可使猪肉pH值下降缓慢,宰前绝食24 h组出现极限pH值现象[12]。而敖汉细毛羊在宰前绝食24 h,肌糖原只有些许减少,未出现极限pH值[13],这与绵羊适应干旱气候的脂肪代谢收支关联,而仔羔羊研究表明:绝食12 h,肝糖原含量由38.08 mg/g降低到2.92 mg/g[14],糖代谢为主。在北京油鸡与罗曼褐壳蛋鸡间,宰后45 min,其pH值并无显著差别[15]。41 日龄肉仔鸡的胸大肌在40 ℃高温诱导下,1 h后糖原浓度比起0、20 ℃仅略有降低,4 h后糖酵解依然未见显著差别,蛋白变性为主[16]。卢庆萍[10]和肖小珺[17]等的研究表明:笼养、平养和放养3 种不同的饲养方式对肉鸡宰后胸肌的pH值无显著影响,这与本实验中发现运动对肉鸡宰后胸肌pH值无显著影响结果基本一致。杨烨等[18]研究报道散养肉鸡宰后腿肌pH值显著低于笼养鸡和平养鸡,本实验5、7、9 周龄运动组腿肌宰后pH值较对照组略低,差异不显著。宰前运动组,糖原由无氧酵解释放能量随之腿部肌肉中的乳酸水平受到不同程度的升高[19],乳酸解离H+改变了肌细胞pH值[20]。因肉鸡宰后肌肉糖酵解较慢,运动组与对照组的胸大肌pH值未见显著差异,但腿肌pH值较对照组有降低趋势,推测与活体强制运动时乳酸代谢相关。
蒸煮损失是在蒸煮过程中,肌肉蛋白质氢键结合力与毛细血管力和表面张力参数发生改变,导致部分自由水和结合水的丢失。蒸煮损失越小,肌肉的系水力越强,肌肉具有多汁性,口感更佳。杨会强[8]、王春青[9]等研究结果表明散养肉鸡胸腿肌蒸煮损失有高于笼养组的趋势,本实验中发现随着周龄的延长,胸、腿肌蒸煮损失率均呈下降趋势,且与pH值变化一致,运动组腿肌蒸煮损失与对照组间差异并不显著。
肌肉的肉色亮度(L*)、红度(a*)、黄度(b*),是反映肌肉色泽、肉质优劣的外观评定重要指标,肌肉色泽除了受到肌肉蛋白质分子、不同的肌纤维类型、肌肉中色素含量和宰后pH值等影响因素之外,还受到肌肉表面渗出液和环境光线的影响。本研究中发现9 周龄运动组和对照组胸肌肉色L*值均高于5 周龄和7 周龄,并且实验9 周龄中运动组肉色L*值存在高于对照组这一趋势,腿肌肉色a*值也存在这一趋势。Castellini等[21]的研究发现草场放牧组肉鸡因营养问题使肌肉系水力下降,肌肉内部水分渗出其表面,亮度L*值高于笼养组,本研究蒸煮损失率无显著差异,并非吸水力降低的缘由。红度a*值受到肌肉内肌红蛋白、血红蛋白含量以及色素含量的影响,随着肉鸡周龄的增加,胸肌肉色a*值呈增大趋势,Hoffman等[22]研究不同饲养条件对散养猪和室内饲养在肉质性状上没有显著差异。本实验中9 周龄运动组腿肌肉色a*值显著高于对照组,可能由于运动组肉鸡每天运动着重是腿肌在做功,其运动强度大于胸肌,并且腿肌中含有较多的氧化型红肌纤维,运动促使肌纤维中血红蛋白和肌红蛋白含量增加,肌内脂肪和肌间脂肪含量相对减少,因此腿肌运动组肉色a*值高于对照组。肌肉黄度值b*随着周龄的增加,其运动组和对照组均呈下降趋势,然而9 周龄胸肌肉色黄度值b*显著高于对照组,这与许月英等[23]研究结果相似。以上结果表明适量运动对改善肉色,提高肉质有显著效果。
3.2 运动对肉鸡剪切力值及肌纤维组织特性的影响
国内有关肉鸡肌纤维的研究报告多围绕着嫩度问题,实际上剪切力值是直观反映肉质嫩度的指标,剪切力值越大表明肉质较差、口感欠佳[24]。影响嫩度的因素首先受到肌纤维直径和密度主因素的影响,其次受到肌间脂肪含量和结缔组织等因素的影响[25]。Vestergaard等[25]报道放牧肉牛的肌内脂肪少,需要较大剪切力值,剪切力值也因体质量增加而提高。本实验得出肉鸡胸、腿肌肌纤维直径和剪切力值均随周龄的延长呈增大趋势、肌纤维密度随着周龄的延长而变小。杨烨等[26]研究表明散养或放养肉鸡因户外活动运动量大,肌纤维直径大于笼养肉鸡,肌纤维密度低于笼养肉鸡。本实验HE切片观察结果和测量肌纤维直径和密度得出7 周龄和9 周龄运动组腿肌肌纤维直径均显著高于对照组,7 周龄和9 周龄运动组腿肌肌纤维密度显著低于对照组。同样AA肉鸡在半舍饲,地面散养和网上平养相比,肌纤维直径依次显著减少,肌纤维密度依次显著增加[10],与本研究相似,但是,剪切力值唯有半舍饲组显著增加,地面散养和网上平养的剪切力值相同,本研究腿肌的剪切力值有增加趋势。可见地面平养较网上平养,增加肌纤维直径,却未增加剪切力值,适度运动值得继续探讨。
近年,研究者关心肉鸡肌纤维与肉质关系,从肌纤维直径和肌纤维密度来看,北方黄鸡的肌肉品质要优于芦花鸡和青脚麻鸡[27]。AA肉鸡嫩度高,但白肌比例高达46%,风味物质肌苷酸含量低,专家评分最低[28]。用剪切力值判断嫩度在本品种,或者商品化白羽肉鸡评价更具优势。在哺乳动物方面获得公认的是有氧运动可塑造肌纤维类型,围绕赛马的研究较多。D'angelis等[29]研究阿拉伯马,运动与补充肌酸对臀肌肌纤维发育的影响,发现在无氧阈强度负荷为80%摄氧量时,有氧运动3 个月训练后,发现臀部各类型肌纤维面积显著增加,但未证实补饲肌酸的益处。Serrano等[30-31]在研究42 月龄赛马时发现当训练强度达到血乳酸为无氧阈值的一半时,只有红肌纤维发生肥大,琥珀酸脱氢酶增加。本实验染色切片图片中可看出随着运动期的延长,特别在9 周龄的运动组腿肌的肌纤维直径显著高于对照组。李肖梁等[4]研究发现圈放结合饲养组土鸡肌肉中肌红蛋白含量比舍内散养组高33%。因此,运动促进肌红蛋白和血红蛋白的合成、提高骨骼肌代谢机能、促使骨骼肌肌纤维发育,从而起到改善肌肉品质的效果。
4 结 论
运动增加了商品肉鸡日活动量,提高胸肌肌肉色泽度L*、a*值,降低腿肌黄度b*值,改善肉鸡胸、腿肌肉色,随着周龄的延长,肉鸡胸、腿肌蒸煮损失呈下降趋势,运动对肉质有所改观。
肉鸡胸肌、腿肌剪切力值和肌纤维直径随着周龄的增加呈增大趋势,肌纤维密度呈减小趋势,9 周龄运动组腿肌肌纤维直径高于对照组,肌纤维密度低于对照组,运动促进肉鸡腿肌肌纤维发育。
参考文献:
[1] EMTER C A, MCCUNE S A, SPARAGNA G C, et al.Low-intensity exercise training delays onset of decompensated heart failure in spontaneously hypertensive heart failure rats[J].American Journal of Physiology Heart & Circulatory Physiology, 2005, 289(5): H2030-H2038.DOI:10.1152/ajpheart.00526.2005.
[2] CHICCO A, MCCUNE S, EMTER C, et al.Low-intensity exercise training delays heart failure and improves survival in female hypertensive heart failure rats[J].Hypertension, 2008, 51(4): 1096-1102.DOI:10.1161/HYPERTENSIONAHA.107.107078.
[3] BHATTACHARYA A, RAHMAN M M, SUN D X, et al.The combination of dietary conjugated linoleic acid and treadmill exercise lowers gain in body fat mass and enhances lean body mass in high fat-fed male Balb/C mice[J].Journal of Nutrition, 2005,135(5): 1124-1130.
[4] 李肖梁, 尹兆正, 朱华.圈放养结合对土鸡生长性能和肉质影响的研究[J].饲料工业, 2003, 24(10): 37-38.DOI:10.3969/j.issn.1001-991X.2003.10.013.
[5] 孙作为, 吕明斌, 燕磊.饲养密度和饲粮赖氨酸水平对公母分饲肉鸡生长性能、胴体组成和健康状态的影响[J].动物营养学报, 2011,23(4): 578-588.DOI:10.3969/j.issn.1006-267x.2011.04.008.
[6] 王靖宇, 伊藤敏男.ブロイラーの行動と熱産生量に及ぼす強制運動の影響[J].日本家禽学会誌, 2001, 38(5): J72-J76.DOI:10.2141/ jpsa.38.J72.
[7] 魏心如, 赵颖, 韩敏义, 等.冷却鸡肉保水性评定指标标准化及其与肉色、嫩度和pH(24 h)相关性研究[J].食品科学, 2014, 35(21): 50-56.DOI:10.7506/spkx1002-6630-201421011.
[8] 杨会强, 唐辉.不同饲养方式对文昌鸡肉质特性的影响[J].家畜生态学报, 2007, 28(4): 62-64.DOI:10.3969/ j.issn.1673-1182.2007.04.015.
[9] 王春青, 李侠, 张春晖, 等.肌原纤维特性与鸡肉原料肉品质的关系[J].中国农业科学, 2014, 47(10): 2003-2012.DOI:10.3864/ j.issn.0578-1752.2014.10.014.
[10] 卢庆萍, 张宏福, 姜旭明, 等.不同饲养方式对肉鸡生产性能, 肉质性状及肌肉组织学特性的影响[J].动物营养学报, 2010, 22(5): 1237-1242.DOI:10.3969/j.issn.1006-267x.2010.05.017.
[11] 耿爱莲, 赵芙蓉, 李保明.规模饲养环境条件对肉鸡健康、福利以及鸡肉品质的影响[J].中国家禽, 2007, 29(4): 57-63.DOI:10.3969/ j.issn.1004-6364.2007.04.021.
[12] ZHEN S B, LIU Y R, LI X M, et al.Effects of lairage time on welfare indicators, energy metabolism and meat quality of pigs in Beijing[J].Meat Science, 2013, 93(2): 287-291.DOI:10.1016/ j.meatsci.2012.09.008.
[13] 夏安琪, 李欣, 陈丽, 等.不同宰前禁食时间对羊肉品质影响的研究[J].中国农业科学, 2014, 47(1): 145-153.DOI:10.3864/ j.issn.0578-1752.2014.01.015.
[14] DÍAZ M T, VIEIRA C, PÉREZ C, et al.Effect of lairage time (0 h,3 h, 6 h or 12 h) on glycogen content andmeat quality parameters in suckling lambs[J].Meat Science, 2014, 96(2): 653-660.DOI:10.1016/ j.meatsci.2013.10.013.
[15] 张剑, 初芹, 张尧, 等.鸡宰后屠体 pH 值影响因素及其变化规律的研究[J].中国家禽, 2014, 36(11): 26-29.DOI:10.3969/ j.issn.1004-6364.2014.11.008.
[16] ZHU X S, RUUSUNEN M, GUSELLA M, et al.High post-mortem temperature combined with rapid glycolysis induces phosphorylase denaturation and produces pale and exudative characteristics in broiler Pectoralis major muscles[J].Meat Science, 2011, 89(2): 181-188.DOI:10.1016/j.meatsci.2011.04.015.
[17] 肖小珺, 陈国宏, 王克华, 等.不同饲养方式对鸡肉品质和屠宰性能的影响[J].中国畜牧杂志, 2004, 40(8): 44-45.DOI:10.3969/ j.issn.0258-7033.2004.08.019.
[18] 杨烨, 方贵友, 李忠荣, 等.饲养方式对河田鸡肉质性状的影响[J].安徽农业科学, 2008, 36(1): 209-210.DOI:10.3969/ j.issn.0517-6611.2008.01.080.
[19] 洪平, 赵鹏, 杨奎生.不同强度运动时大鼠骨骼肌能量代谢产物的变化[J].中国运动医学杂志, 2002, 21(3): 261-267.DOI:10.3969/ j.issn.1000-6710.2002.03.009.
[20] 卢昌亚.运动性肌肉疲劳和细胞pH[J].山东体育学院学报, 2001,17(3): 26-27.DOI:10.3969/j.issn.1006-2076.2001.03.008.
[21] CASTELLINI C, MUGNAI C, dal BOSCO A.Effect of organic production system on broiler carcass and meat quality[J].Meat Science, 2002, 60(3): 219-225.DOI:10.1016/S0309-1740(01)00124-3.
[22] HOFFMAN L, STYGER E, MULLER M, et al.The growth and carcass and meat characteristics of pigs raised in a free-range or conventional housing system[J].South African Journal of Animal Science, 2003, 33(33): 166-175.DOI:10.4314/sajas.v33i3.3770.
[23] 许月英, 钱坤, 苏世广, 等.不同饲养方式对淮南麻黄鸡肉品质的影响[J].家畜生态学报, 2013, 34(4): 49-52.DOI:10.3969/ j.issn.1673-1182.2013.04.011.
[24] 王修启, 代发文, 张常明, 等.AA肉鸡与岭南黄肉鸡的部分肉品质指标比较[J].华南农业大学学报, 2006, 27(3): 76-80.DOI:10.3969/ j.issn.1001-411X.2006.03.021.
[25] VESTERGAARD M, THERKILDSEN M, HENCKEL P, et al.Infuence of feeding intensity, grazing and fnishing feeding on meat and eating quality of young bulls and the relationship between muscle fibre characteristics, fibre fragmentation and meat tenderness[J].Meat Science, 2000, 54(2): 187-195; 189.DOI:10.1016/S0309-1740(99)00098-4.
[26] 杨烨, 方桂友, 李忠荣, 等.不同饲养方式对肉鸡肌纤维组织学特性及肌肉嫩度影响的研究[J].安徽农业科学, 2009, 37(27): 13101-13102.
[27] 赵衍铜, 马倩, 柏明娜, 等.三种优质肉鸡肌纤维特性与肉质关系的研究[J].家畜生态学报, 2012, 33(1): 43-46.DOI:10.3969/ j.issn.1673-1182.2012.01.009.
[28] 陈宽维, 李慧芳, 张学余, 等.肉鸡肌纤维与肉质关系研究[J].中国畜牧杂志, 2002, 38(6): 6-7.DOI:10.3969/ j.issn.0258-7033.2002.06.002.
[29] D'ANGELIS F H F, FERRAZ G C, BOLELI I C, et al.Aerobic training, but not creatine supplementation, alters the gluteus medius muscle[J].Journal of Animal Science, 2005, 83(3): 579-585.
[30] SERRANO A L, QUIROZ-ROTHE E, RIVERO J L L.Early and long-term changes of equine skeletal muscle in response to endurance training and detraining[J].Pflügers Archiv European Journal of Physiology, 2000, 441(2): 263-274.DOI:10.1007/s004240000408.
[31] SERRANO A L, RIVERO J L L.Myosin heavy chain profile of equine gluteus medius muscle following prolonged draught-exercise training and detraining[J].Journal of Muscle Research & Cell Motility, 2000,21(3): 235-245.DOI:10.1023/A:1005642632711.
DOI:10.7506/spkx1002-6630-201613010
中图分类号:S815.5
文献标志码:A
文章编号:1002-6630(2016)13-0053-07
收稿日期:2015-10-22
基金项目:公益性行业(农业)科研专项(201003011)
作者简介:蔡洁琼(1989—),女,硕士研究生,研究方向为动物营养与饲料科学。E-mail:2013105034@njau.edu.cn
*通信作者:颜培实(1960—),男,教授,博士,研究方向为动物环境控制与营养调节。E-mail:yanps@njau.edu.cn
Effect of Exercise on Broiler Meat Quality and Muscle Fiber Development
CAI Jieqiong, ZHENG Yue, ZHU Haopeng, CHEN Zhiqiang, YAN Peishi*
(College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:This study aims to analyze the impact of exercise on meat quality and muscle fiber development in broilers.Totally 36 3-week-old Arbor Acres (Arbor Acres, AA) broilers were selected and divided into two groups according to similar body weight: control and exercise groups.The experiment lasted 6 weeks (from 4 to 9 weeks of age).The amount of daytime exercise, muscle quality and muscle fiber characteristics were measured at 5, 7 and 9 weeks of age.The results showed that the amount of daytime exercise per week of the continuous exercise group was significantly higher than that of the control group (P < 0.05).The broilers in the continuous exercise group followed a clear rhythm, having a rest at noon.At the age of 9 weeks, breast muscle L* and a* values, leg muscle a* value and muscle fiber diameter of the exercise group were significantly higher those of the control group (P < 0.05); meanwhile, leg muscle fiber density of the exercise group was significantly lower than that of the control group (P < 0.05).Therefore, forced exercise can increase broiler daytime activity level to improve meat color, and promote the development of broiler leg muscle fiber.
Key words:exercise; trial period; meat quality; muscle fiber development
