蜂胶醇提物脂质体制备及表征
2016-08-10郭夏丽蓝雅惠邹艺红罗丽萍南昌大学生命科学学院江西南昌330031
郭夏丽,蓝雅惠,邹艺红,李 熊,罗丽萍*(南昌大学生命科学学院,江西 南昌 330031)
蜂胶醇提物脂质体制备及表征
郭夏丽,蓝雅惠,邹艺红,李 熊,罗丽萍*
(南昌大学生命科学学院,江西 南昌 330031)
摘 要:以大豆卵磷脂和胆固醇为膜材,采用薄膜分散-动态高压技术制备蜂胶醇提物(ethanol extract of propolis,EEP)脂质体,通过粒度分析仪、透射电子显微镜、清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、低温贮存实验等进行性状表征。结果表明:制备的蜂胶脂质体为大小均匀的球形,粒径为(78±14) nm,包埋率和稳定性分别达到(97.80±5.21)%和(2.53±0.05)%。4 ℃条件下保存90 d和180 d后,包埋率分别下降了16.74%和28.77%,分散系数分别增加了6.61%和14.32%,DPPH自由基清除指数分别为2.78和2.71;高效液相色谱法(high performance liquid chromatography,HPLC)分析贮存180 d后EEP脂质体中7 种物质变化分别为1.08%~6.63%,低于EEP的5.55%~19.42%,说明脂质体对EEP中的活性物质具有一定的保护作用。
关键词:蜂胶醇提物;脂质体;表征;稳定性
引文格式:
郭夏丽, 蓝雅惠, 邹艺红, 等.蜂胶醇提物脂质体制备及表征[J].食品科学, 2016, 37(13): 47-52.DOI:10.7506/spkx1002-6630-201613009. http://www.spkx.net.cn
GUO Xiali, LAN Yahui, ZOU Yihong, et al.Preparation and characterization of ethanol extract of propolis liposomes[J].Food Science, 2016, 37(13): 47-52.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613009.http://www.spkx.net.cn
蜂胶是蜜蜂采集植物幼芽、树皮与树干裂缝处的树脂,混入其上颚腺分泌物和蜂蜡咀嚼后加工而成的具芳香气味的胶状固体物[1]。其含有丰富的营养素和生物活性成分,如多糖、维生素、多酚类化合物、芳香酸及芳香酸酯、醛及酮类化合物、萜类化合物等[2-4]。蜂胶具有抗菌消炎、抗病毒、抗肿瘤、抗氧化、调节血脂与血糖、促进组织再生等广泛的生物学作用[5-8]。近年来,食品行业对天然产物越来越感兴趣,一方面可以从天然原料获得生物活性化合物,另一方面可以利用天然产物生产稳定的功能产品[9]。蜂胶易因黄酮等活性物质氧化变性而失去活性[10],气味浓烈影响产品气味[11],目前主要采取乙醇提取法对蜂胶活性物质进行提取,得到的蜂胶醇提物(ethanol extract of propolis,EEP)由于在水相或油中不易分散[9],从而影响其在日化产品、食品、药物中的广泛应用。脂质体是一种由磷脂在水中自组装形成双层膜小囊泡,对细胞膜亲和性良好[12],作为药物载体具有靶向、高效、缓释、副作用小等特点,已被广泛应用于医药领域[5]。蜂胶中极性较强的物质包裹在脂质体的水相中,而一些极性较弱的脂溶性物质则包裹在脂质膜内,很好的阻止光、热、氧气和金属离子等环境因素对蜂胶活性成分的破坏[13]。
关于蜂胶脂质体的制备研究,国内外都鲜有报道,仅有Fan Yunpeng等[14]将蜂胶黄酮、大豆卵磷脂、胆固醇、VE溶于乙醇-氯仿中,采用薄膜超声法制备淫羊藿多糖-蜂胶黄酮脂质体,蜂胶黄酮最大包封率为85.48%,粒径<200 nm;汤志勇等[15]采用薄膜超声法、逆向蒸发法、乙醇注入法3 种方法制备蜂胶脂质体,薄膜超声法获得最高包埋率85.7%的脂质体;吴亚妮等[16]采用乙醇注入法进行研究,发现制备得到的脂质体粒径大、包封药物易变性、乙醇难以除去等问题。动态高压微射流技术(dynamic high pressure microfluidization,DHPM)是一种新型连续化处理技术,它可将液体在极小空间进行强烈的垂直撞击,形成持续高速的剪切力,从而将液体粒径有效减小到分布均匀的纳米级[17],利用DHPM法和传统的薄膜法结合来制备EEP脂质体,目前还未见到有类似报道。
为了阻止外界环境因素对蜂胶活性成分的破坏,本实验以大豆卵磷脂和胆固醇为膜材,采用薄膜分散-动态高压技术制备EEP脂质体,考察EEP脂质体的理化性质和稳定性,包括形态学观察、粒径分布、包封率、贮藏稳定性等,通过清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力对EEP脂质体的保护能力进行评价和验证。
1 材料与方法
1.1 材料与试剂
EEP浸膏:南昌大学生命科学学院自制。以1∶20(m/V)比例将青海大通蜂胶粉末溶于60%无水乙醇,于60 ℃水浴提取3 次,合并上清液后真空条件50 ℃旋转蒸发至无水状态。
大豆卵磷脂 荷兰Lipoid Gmbh公司;碳支撑膜(铜网) 北京中镜科仪技术有限公司;吐温-80阿拉丁试剂(上海)有限公司;咖啡酸、表儿茶素、芦丁中国药品生物制品检定所;山奈酚、p-香豆酸、阿魏酸 中药固体制剂制造技术国家工程研究中心;3,4-二甲氧基肉桂酸、白杨素(纯度≥95%)、胆固醇、DPPH美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JEM-2100透射电子显微镜 日本电子株式会社;Microfluidizer Processor M-700微射流仪 美国Microfluidics公司;1200型高效液相色谱仪(high performance liquid chromatography,HPLC)(包括光电二极管阵列检测器和G2170BALC化学工作站) 美国Agilent公司;Nicomp380 ZLS超细微粒粒度分析仪美国PSS粒度仪公司;紫外-可见分光光度计 北京普析通用仪器有限责任公司;JAC-300超声波振荡仪 济宁市奥波超声电气有限公司;RE52-05旋转蒸发仪、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;B13-3型磁力加热搅拌器 上海司乐仪器有限公司;KQ-50E型超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 薄膜分散-动态高压微射流技术(dynamic high pressure microfuidization,DHPM)[13]制备EEP脂质体
将大豆卵磷脂与胆固醇(总壁材368 mg)以质量比20∶3的比例溶解在20 mL无水乙醇中,45 ℃旋转蒸发。加入20 mL pH 5.4的磷酸盐缓冲溶液(phosphate buffer saline,PBS),蒸馏水稀释至50 mL旋转蒸发40 min。将得到的脂质体悬液,用微射流均质机140 MPa条件下处理2 次,即得空白脂质体。
取一定量EEP与大豆卵磷脂(质量比280∶1)、胆固醇混合溶解于乙醇中,步骤同上,制备EEP脂质体。
1.3.2 EEP脂质体性质的测定
1.3.2.1 EEP脂质体形态及其粒径和ζ电位、Ke值、包封率的测定
取蒸馏水稀释适当倍数(卵磷脂终质量浓度为1 mg/mL)的EEP脂质体,滴加在培养皿中,将铜网浸入脂质体液滴中,4 min后滤纸吸干,用pH 6.0的磷钨酸溶液对铜网进行染色4 min,室温自然干燥,透射电子显微镜200 kV条件下观察[18]。
采用NICOMP380/ZLS激光纳米粒度分析仪,角度90 °,温度为(25±0.1) ℃,光波长为632.8 nm。样品在测试前用去离子水稀释10 倍。ζ电位的测量需每个样品读取10 次取平均值[19]。
将脂质体悬浮液于5 000 r/min离心10 min,用分光光度法测定脂质体悬浮液离心前后在415 nm波长处的吸光度,以蒸馏水为空白。按下面的公式计算稳定性参数Ke值[20]。

式中:A0和A分别为脂质体悬液离心前和离心后在415 nm波长处的吸光度。
芦丁标准曲线绘制[21]:精密称取干燥至恒质量的芦丁标准品0.005 g于25 mL容量瓶中,用无水乙醇溶解并定容,配成0.2 mg/mL的标准溶液。准确吸取0.1、0.2、0.8、1.6、3.2、6.4 mL标准液于25 mL容量瓶中,加入无水乙醇至10 mL。各瓶加入0.5 mL 100 g/L氯化铝水溶液,混匀,蒸馏水定容,室温静置15 min。以芦丁空白溶液作对照,于415 nm波长处测定吸光度,以吸光度为横坐标,芦丁终质量浓度为纵坐标绘制标准曲线。
总黄酮含量的测定:准确吸取50 μL 10 mg/mL EEP于25 mL容量瓶中,加入无水乙醇至10 mL,0.5 mL 100 g/L氯化铝水溶液,蒸馏水定容,室温静置15 min,于415 nm波长处测定吸光度,结果以芦丁质量计,单位为mg/g。
包封率的测定[17]:取一定量EEP脂质体悬浮液置于透析袋中,以pH 6.8的PBS为外液透析8 h。吸取透析内液加甲醇,超声波振荡充分破乳,离心后取上清液,测定其吸光度,通过芦丁标准曲线计算总黄酮含量。取等量EEP脂质体悬浮液不经透析,直接加甲醇,超声波振荡破乳,离心后取上清液同上法计算总黄酮含量。

式中:m为EEP脂质体中总蜂胶的总黄酮含量/(mg/g);n为包封的蜂胶总黄酮含量/(mg/g)。
1.3.2.2 HPLC法检测180 d贮存期EEP脂质体中7 种物质的含量变化
取180 d贮存期的EEP脂质体用甲醇充分破乳后,4 000 r/min离心10 min取上清液,稀释一定倍数过滤后,采用课题组之前研究HPLC的条件在280 nm波长处检测咖啡酸、表儿茶素、p-香豆酸、阿魏酸、3,4-二甲氧基肉桂酸、山奈酚、白杨素7 种物质的含量变化[22]。
1.3.2.3 EEP脂质体清除DPPH自由基能力[23]及其稳定性的测定
将EEP和包埋等量EEP的脂质体用甲醇分别释成100、200、300、400、500、600 μg/mL样液。取样液0.1 mL,加入3.9 mL 0.1~0.2 mmol/L DPPH-甲醇溶液(现配现用),0.1 mL甲醇作空白。室温黑暗条件下静置90 min,于517 nm波长处测定吸光度。DPPH自由基清除率的计算见下式。
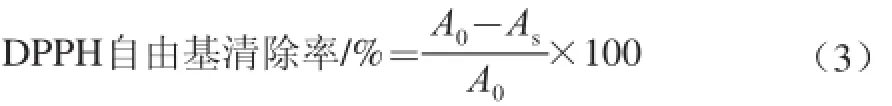
式中:A0为空白体系在517 nm波长处的吸光度;As为样品体系在517 nm波长处的吸光度。
IC50可通过DPPH自由基清除活性与样品质量浓度的线性关系计算出,其抗氧化活性指数(antioxidant activity index,AAI)的计算见公式(4)。

式中:ρ为DPPH终质量浓度/(μg/mL);IC50为50%抑制浓度/(μg/mL)。
将制备好的EEP脂质体置于离心管中,4 ℃条件下分别冷藏90 d和180 d,然后检测脂质体粒径大小、尺寸分布、包封率和多分散系数参数变化。
1.4 数据处理
利用Excel绘制各对照品标准曲线,获得线性回归方程及相关系数。所有实验平行3 次,取平均值。
2 结果与分析
2.1 EEP脂质体的包封率
根据芦丁标准曲线,得出新鲜制备的EEP脂质体包封率为(97.80±5.21)%。汤志勇等[15]使用了3 种不同方法制备的蜂胶脂质体包封率为85.7%,张冰慧[24]制备的蜂胶脂质体包封率最高为90.69%。脂质体内包埋药物量多少是衡量脂质体性能的最关键因素,而根据薄膜分散-DHPM法制备得到的EEP脂质体包埋蜂胶能力强,蜂胶在制备过程中损失极少,有利于蜂胶脂质体在保健药物、食品添加剂等产品上的大规模应用。
2.2 EEP脂质体的形态
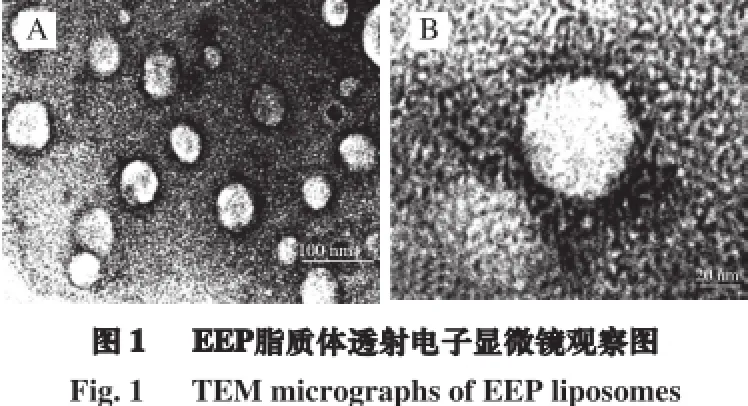
与蒸馏水对比,制得的EEP脂质体溶液为乳白色透明状。由图1可知,EEP脂质体外观呈分散、单一的圆球形球粒,大小分布较均匀,粒径<100 nm,脂质体球体无明显不规则结构及大规模聚集现象,这一特性有助于EEP脂质体添加至日化用品中生产中。
2.3 脂质体的粒径和ζ电位
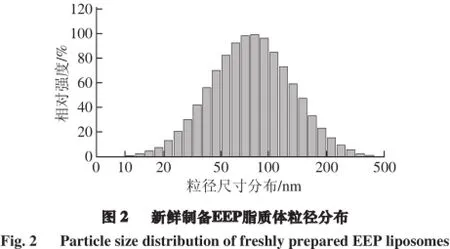
由图2可知,制备的EEP脂质体粒径主要分布在68~82 nm之间,EEP脂质体平均粒径为78.60 nm,多分散系数(polydispersity index,PDI)即EEP脂质体粒径方差,其平均值为0.353,ζ电位为-22.69 mV,以上结果验证了透射电子显微镜的观察结果,所制得的EEP脂质体粒径较小,分散性好。ζ电位的绝对值越大,体系中颗粒之间的排斥力越大,则体系越稳定,绝对值越趋于零,颗粒之间可发生凝聚,生成比较大的絮体。但不能认为粒径越小的脂质体就意味着该脂质体性能越好,而需要考虑在有较高包封率的前提下,制备有较高稳定性的EEP脂质体。
2.4 稳定性参数Ke值
离心过程中,比重小于分散介质的粒子将上浮,大于分散介质的粒子将下沉,从而引起稳定性参数Ke值的变化。Ke值越小,则体系的物理稳定性越好,反之则越差。本实验制得的EEP脂质体Ke值为(2.53±0.05)%之间,小于张冰慧[24]通过优化实验制得蜂胶脂质体的Ke值((9.70±1.13)%),由此可见本实验制得的EEP脂质体稳定性良好,说明EEP脂质体对包埋物质具有保护能力,防止EEP被氧化从而保持其活性能力。
2.5 清除DPPH自由基能力
注:y.DPPH自由基清除活性/%;x.样品质量浓度/(μg/mL)。
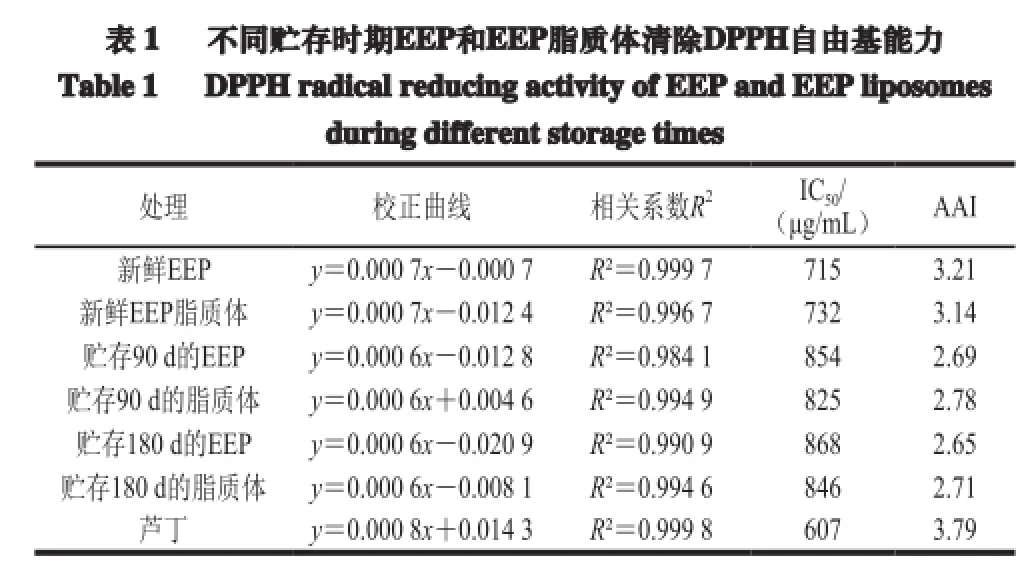
Scherer等[25]指出当AAI<0.5时,说明清除DPPH自由基活性不强,0.5<AAI<1.0时,活性适中,1.0<AAI<2.0时,活性较强,当AAI>2.0时,则说明其活性很强。由表1可知,所有EEP和EEP脂质体都具有很强的清除DPPH自由基活性。通过比较新鲜的EEP和EEP脂质体,新鲜EEP的清除活性较强,可能是由于在制备脂质体的过程中EEP出现少量损失原因所致;贮存90 d和180 d的EEP和EEP脂质体中,均发现被脂质体包埋的EEP具有更强的清除DPPH自由基能力,从而验证了脂质体对包埋物质的保护能力,防止EEP被氧化从而保持其活性能力。
2.6 HPLC检测贮存180 d的EEP脂质体中7 种物质的含量变化
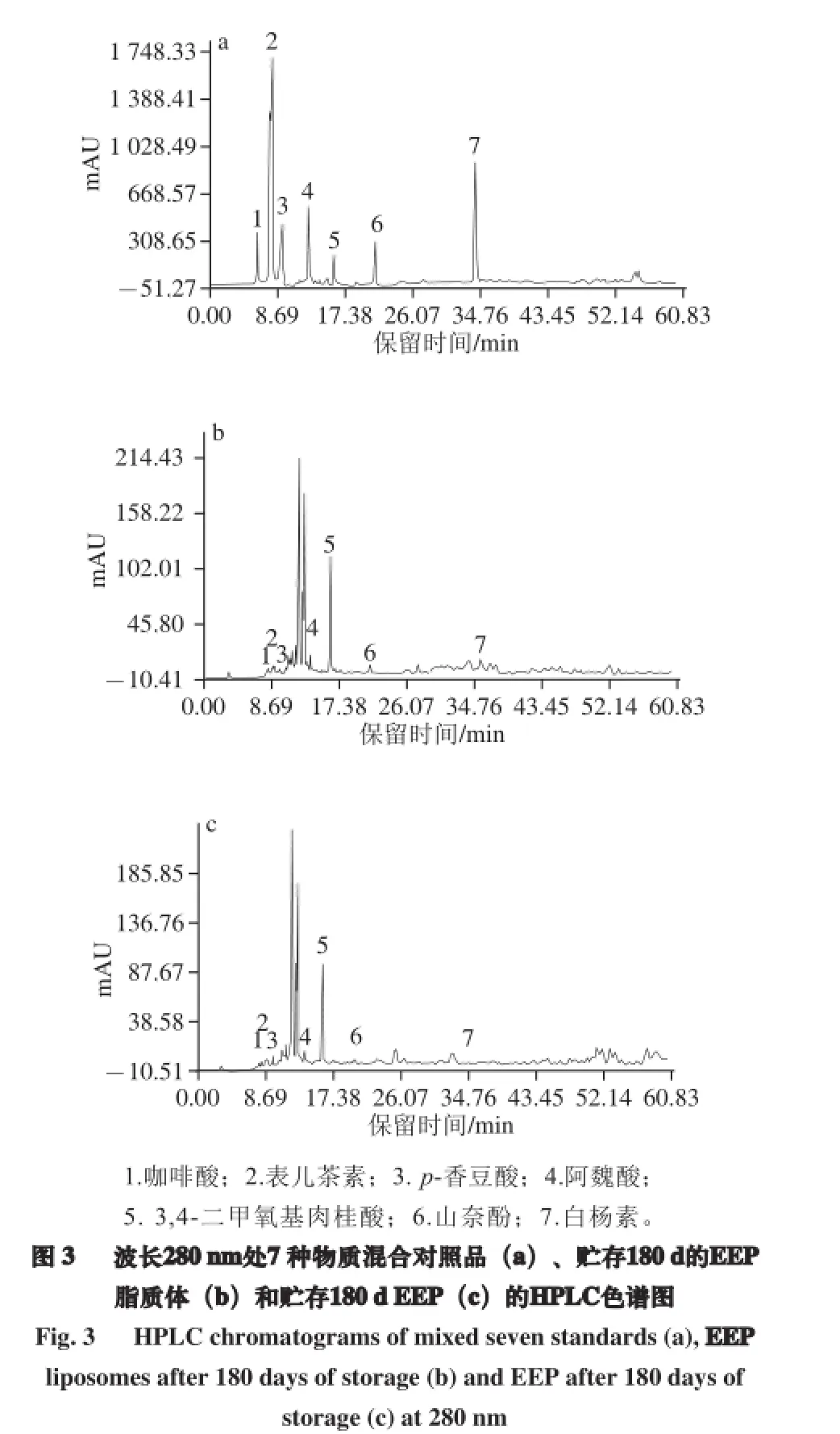
由图3可知,贮存180 d的EEP脂质体中咖啡酸、表儿茶素、p-香豆酸、阿魏酸、3,4-二甲氧基肉桂酸、山奈酚、白杨素含量较混合对照品分别下降了2.61%、3.43%、6.63%、1.47%、6.05%、1.08%和4.27%,而180 d 的EEP中相对应的物质含量分别下降了5.55%、11.35%、15.54%、15.38%、19.42%、9.32%和6.80%。对比两者的物质含量变化,发现贮存180 d的EEP脂质体中物质含量明显高于180 d的EEP,说明脂质体对包埋的EEP起保护作用,EEP脂质体中物质在贮存期间的含量损失比裸露EEP少。
2.7 脂质体的稳定性
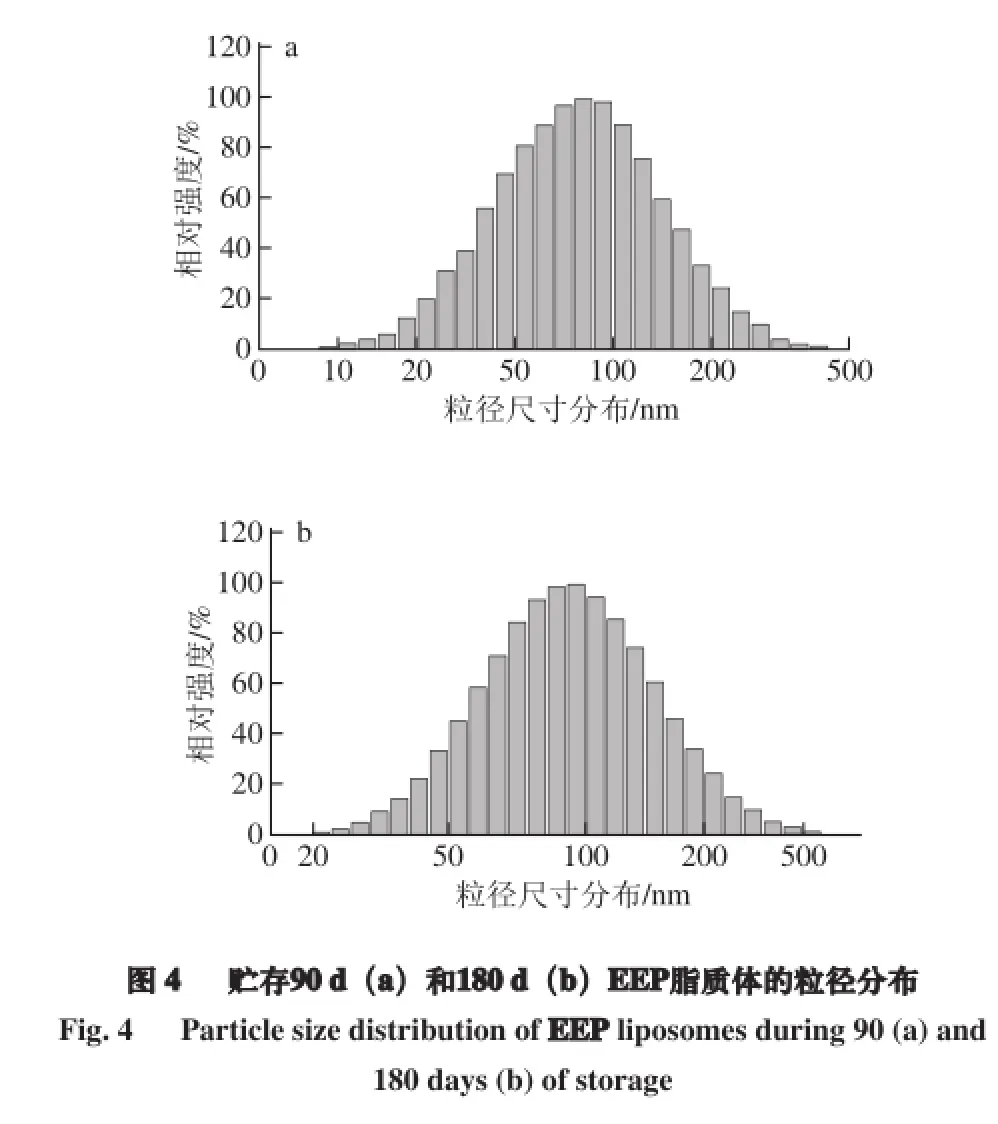
贮存在4 ℃条件下90 d和180 d的EEP脂质体的包封率分别为(81.42±6.78)%和(69.66±10.01)%,平均粒径分别为89.22 nm和97.63 nm(图4),PDI值分别为0.378和0.412,ζ电位分别为-20.62 mV和-20.15 mV。结果发现,脂质体粒径和PDI有所增大,可能是因为脂质体在贮存过程中,粒子之间发生相互碰撞而倾向于黏着在一起,进而团聚成更大的脂质体微粒,使得脂质体的分散系数变得更大,ζ电位绝对值降低,造成不均一性。经过90 d和180 d的贮存,EEP脂质体的包封率、粒径、分散系数变化不大,显示出薄膜分散-DHPM法制得的脂质体具有较好的稳定性。
3 结 论
本实验采用薄膜分散-DHPM法成功制备蜂胶醇提物脂质体,制备的EEP脂质体粒径在68~82 nm之间,包埋率高达(97.80±5.21)%,透射电镜观察结果为大小均匀的球体,且证明了4 ℃条件下贮存180 d的EEP脂质体都具有很强的DPPH自由基清除活性,HPLC分析EEP脂质体中的咖啡酸、表儿茶素、p-香豆酸、阿魏酸、山奈酚、白杨素7 种物质含量减少低于7%。蜂胶中黄酮类化合物是其主要成分和主要的抗肿瘤活性成分,脂质体作为抗肿瘤药物的载体,能够将抗肿瘤药物选择性地分布于体内癌变部位,既可提高癌变部位药物浓度,从而提高药效和药物利用率,又可降低其对正常组织的毒副作用。EEP脂质体的成功制备克服了EEP稳定性差、水溶性差、气味强烈等缺点,为蜂胶在保健食品中的应用提供了新原料。
参考文献:
[1] KASOTE D, SULEMAN T, CHEN W Y, et al.Chemical profiling and chemometric analysis of South African propolis[J].Biochemical Systematics and Ecology, 2014, 55: 156-163.DOI:10.1016/ j.bse.2014.03.012.
[2] LUIS-VILLAROYA A, ESPINA L, GARCIA-GONZALO D, et al.Bioactive properties of a propolis-based dietary supplement and its use in combination with mild heat for apple juice preservation[J].International Journal of Food Microbiology, 2015, 205(16): 90-97.DOI:10.1016/j.ijfoodmicro.2015.03.020.
[3] 崔庆新, 刘国富.蜂胶乙醇提取物化学成分的GC/MS研究[J].天然产物研究与开发, 2001, 13(6): 36-38.DOI:10.3969/ j.issn.1001-6880.2001.06.011.
[4] 蒋春红, 吕武清, 胡裳洪.蜂胶的药理作用研究概况[J].中国医药指南, 2011, 9(17): 42-43.DOI:10.3969/j.issn.1671-8194.2011.17.023.
[5] GABRIELA V, CONSUELO C, CATALINA F, et al.Antiinflammatory activity and phenolic profile of propolis from two locations in Región Metropolitana de Santiago, Chile[J].Journal of Ethnopharmacology, 2015, 168: 37-44.DOI:10.1016/ j.jep.2015.03.050.
[6] CHEN Y F, LI Y, WANG Y W, et al.Berberine improves free-fattyacid-induced insulin resistance in L6 myotubes through inhibiting peroxisome proliferator-activated receptor γ and fatty acid transferase expressions[J].Metabolism, 2009, 58(12): 1694-1702.DOI:10.1016/ j.metabol.2009.06.009.
[7] 谢国芳, 刘春梅, 曹长靓, 等.基于响应面分析方法蜂胶总黄酮提取条件的优化[J].粮油加工, 2010(8): 156-160.
[8] 曹小燕, 杨海涛.蜂胶中黄酮的提取及其自由基清除活性研究[J].粮油食品科技, 2015, 23(5): 45-49.DOI:10.3969/ j.issn.1007-7561.2015.05.011.
[9] da SILVA F C, da FONSECA C R, de ALENCAR S M, et al.Assessment of production efficiency, physicochemical properties and storage stability of spray-dried propolis, a natural food additive,using gum Arabic and OSA starch-based carrier systems[J].Food and Bioproducts Processing, 2013, 91(1): 28-36.DOI:10.1016/ j.fbp.2012.08.006.
[10] YUAN J, LIU J G, HU Y L, et al.The immunological activity of propolis flavonoids liposome on the immune response against ND vaccine[J].International Journal of Biological Macromolecules, 2012,51(4): 400-405.DOI:10.1016/j.ijbiomac.2012.06.002.
[11] NORI M P, FAVARO-TRINDADE C S, MATIAS D A S, et al.Microencapsulation of propolis extract by complex coacervation[J].LWT-Food Science and Technology, 2011, 44(2): 429-435.DOI:10.1016/j.lwt.2010.09.010.
[12] de PAZ E, MARTIN Á, COCERO M J.Formulation of β-carotene with soybean lecithin by PGSS (Particles from Gas Saturated Solutions)-drying[J].The Journal of Supercritical Fluids, 2012, 72: 125-133.DOI:10.1016/j.supflu.2012.08.007.
[13] 单良, 汤志勇, 刘元法, 等.蜂胶黄酮萃取物脂质体制备工艺的优化及体外缓释特性[J].食品科学, 2008, 29(8): 232-237.DOI:10.3321/ j.issn:1002-6630.2008.08.048.
[14] FAN Y P, LIU J G, WANG D Y, et al.The preparation optimization and immune effect of epimedium polysaccharide-propolis flavone liposome[J].Carbohydrate Polymers, 2013, 94: 24-30.DOI:10.1016/ j.carbpol.2012.12.071.
[15] 汤志勇, 王兴国, 金青哲, 等.蜂胶脂质体的制备[J].食品工业科技,2005, 26(3): 136-138.DOI:10.3969/j.issn.1002-0306.2006.03.044.
[16] 吴亚妮, 徐云龙, 孙文晓.木瓜蛋白酶纳米脂质体的制备及其粒度控制[J].上海交通大学学报(农业科学版), 2007, 25(2): 105-109.DOI:10.3969/j.issn.1671-9964.2007.02.005.
[17] 杨水兵, 刘伟, 刘成梅, 等.VC纳米脂质体的制备研究[J].食品与机械, 2011, 27(6): 222-225.DOI:10.3969/j.issn.1003-5788.2011.06.060.
[18] ZOU L Q, PENG S F, LIU W, et al.Improved in vitro digestion stability of (-)-epigallocatechin gallate through nanoliposome encapsulation[J].Food Research International, 2014, 64: 492-499.DOI:10.1016/j.foodres.2014.07.042.
[19] ZOU L Q, LIU W, LIU W L, et al.Characterization and bioavailability of tea polyphenol nanoliposome prepared by combining an ethanol injection method with dynamic high-pressure microfluidization[J].Journal of Agricultural and Food Chemistry, 2014, 62(4): 934-941.DOI:10.1021/jf402886s.
[20] XIONG F, XIONG C, YAO J, et al.Preparation, characterization and evaluation of breviscapine lipid emulsions coated with monooleate-PEG-COOH[J].International Journal of Pharmaceutics, 2011, 421: 275-282.DOI:10.1016/j.ijpharm.2011.10.008.
[21] 丽艳.中国不同地区蜂胶醇提物化学组成及抗氧化活性[D].南昌:南昌大学, 2008: 18-20.DOI:10.7666/d.y1540006.
[22] GUO X L, CHEN B, LUO L P, et al.Chemical compositions and antioxidant activities of water extracts of Chinese propolis[J].Journal of Agricultural and Food Chemistry, 2011, 59: 12610-12616.DOI:10.1021/jf202818p.
[23] 张茜, 罗丽萍, 陈滨, 等.不同来源中国蜂胶水提物的化学组成及抗氧化性[J].天然产物研究与开发, 2012, 24(4): 444-449.DOI:10.3969/j.issn.1001-6880.2012.04.005.
[24] 张冰慧.蜂胶脂质体的制备及其对高血糖小鼠降糖作用的研究[D].合肥: 合肥工业大学, 2009: 9-19.DOI:10.7666/d.y1507864.
[25] SCHERER R, GODOY H T.Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J].Food Chemistry, 2009,112(3): 654-658.DOI:10.1016/j.foodchem.2008.06.026.
DOI:10.7506/spkx1002-6630-201613009
中图分类号:S896.6
文献标志码:A
文章编号:1002-6630(2016)13-0047-06
收稿日期:2015-10-11
基金项目:“十二五”农村领域国家科技计划课题(2012BDA29B01-3);江西省科技支撑计划项目/江西省国际合作项目(20121BDH80020)
作者简介:郭夏丽(1986—),女,助教,硕士,研究方向为植物资源开发与利用。E-mail:guoxiali2520@sina.com
*通信作者:罗丽萍(1972—),女,教授,博士,研究方向为植物资源开发与利用。E-mail:lluo2@126.com
Preparation and Characterization of Ethanol Extract of Propolis Liposomes
GUO Xiali, LAN Yahui, ZOU Yihong, LI Xiong, LUO Liping*
(School of Life Sciences, Nanchang University, Nanchang 330031, China)
Abstract:The thin film evaporation-dynamic high pressure microfluidization method was used to prepare ethanol extract of propolis (EEP) liposomes with soybean lecithin and cholesterol as membrane materials.The characterization of EEP liposomes was examined by dynamic light scattering particle size analyzer, transmission electron microscopy, DPPH radical scavenging activity assay, and low temperature storage test.The results showed that the average size of the liposomes obtained, evenly spherical in appearance, was (78 ± 14) nm, the encapsulation efficiency (97.80 ± 5.21)%, and the stability parameter Kevalue (2.53 ± 0.05)%.After the liposomes were incubated at 4 ℃ for 90 and 180 days, their encapsulation efficiency was reduced by 16.74% and 28.77%, along with a simultaneous increase in polydispersity index (PDI) of 6.61% and 14.32%, respectively.Moreover, antioxidant activity index (AAI) values for DPPH radical scavenging activity of the stored liposomes were 2.78 and 2.71, respectively.The contents of 7 compounds in the liposomes changed by 1.08%-6.63% after 180 days storage as revealed by HPLC analysis compared to 5.55%-19.42% in EEP.This study highlights the protection of liposome on EEP.
Key words:ethanol extract of propolis; liposome; characterization; stability
