缺氧微环境下人肺腺癌A549细胞的microRNA基因芯片结果分析*
2016-08-10耿莹鲍永霞肖景滨葛冬杰梁铮
耿莹,鲍永霞,肖景滨,葛冬杰,梁铮
(1.哈尔滨医科大学附属二院 呼吸科,黑龙江 哈尔滨 150081;2.黑龙江省军区医院 首长保健室,黑龙江 哈尔滨 150009;3黑龙江省哈尔滨市第一医院 呼吸科,黑龙江 哈尔滨 150010)
论著
缺氧微环境下人肺腺癌A549细胞的microRNA基因芯片结果分析*
耿莹1,鲍永霞1,肖景滨2,葛冬杰3,梁铮1
(1.哈尔滨医科大学附属二院 呼吸科,黑龙江 哈尔滨 150081;2.黑龙江省军区医院 首长保健室,黑龙江 哈尔滨 150009;3黑龙江省哈尔滨市第一医院 呼吸科,黑龙江 哈尔滨 150010)
摘要:目的研究缺氧对肺腺癌A549细胞中microR NA(miR NA)表达谱的影响,分析靶基因参与的生物学功能和通路。方法基于miR NA芯片技术和生物信息学分析方法,分析缺氧条件和正常氧条件下培养的A549细胞中差异表达的miR NA,并预测该miR NA的靶基因,分析靶基因参与的生物学功能和通路。结果本研究共筛选出14个差异表达miR NA,包括9个在缺氧细胞中上调miR NA和5个下调miR NA。上调和下调miR NA的靶基因都参与DNA转录、核染色质修饰等功能,并且都参与Wnt信号、转化生长因子-β信号和丝裂原活化蛋白激酶信号通路。结论缺氧的肺腺癌A549细胞中miR NA表达谱发生显著改变,一些差异表达miR NA对某些基因具有调控作用。
关键词:肺腺癌;A549细胞;芯片;缺氧;差异表达microR NA
肺癌是世界人口中最常见的恶性肿瘤之一,位居肿瘤死亡率之首,尽管其发生的蛋白和基因组图谱已经部分阐明,但是其发病率仍逐年升高,缺乏有效的早期诊断和治疗手段是主要原因。MicroRNAs (miRNA)是近年来生命科学领域的一个研究热点[1-2],其广泛存在于真核生物体中,是一类高度保守、长度很短的非编码调控单链小分子RNA,约18~24个碱基,通过抑制mRNA的翻译和降解靶mRNA来调控生物体中基因的表达,在肿瘤发生、发展过程中起至关重要的作用。miRNA具有组织特异性,与肺组织相关的包括Let-7、Let-34、Let-21、Let-143、Let-145、Let-31、Let-146等40余种,其在肺癌组织表达中降低或升高,以癌基因或抑癌基因样作用调解转录后翻译,促进或抑制肿瘤发生、发展。
有研究表明,缺氧可以引起肺癌中一些基因和miRNA表达水平的变化[3-4]。尽管人们对肺癌细胞缺氧引起的分子生物学变化已经有一定的了解,但是其中的分子机制错综复杂,还有很多可能发生重大变化的基因、miRNA和相关的生物学通路等还未被发现。因此,还需进一步的深入研究,而目前还没有关于缺氧对肺癌细胞中miRNA表达谱影响的报道。
本研究利用缺氧培养箱对肺腺癌细胞系A549进行缺氧处理,采用miRNA芯片技术分析缺氧处理的A549细胞和正常氧状态下的A549细胞中差异表达的miRNA,并利用公共数据库预测差异表达miRNA的靶基因,分析靶基因所参与的生物学功能和通路。
1 材料与方法
1.1细胞系
本研究选取人肺腺癌A549细胞为研究材料,该细胞系购自于中国科学院上海细胞库。
1.2细胞培养
肺癌A549细胞系冷冻存于液氮中,取出后置于37℃电热恒温水浴箱中快速解冻复苏。1 000 r/min离心10 min,弃上清液,更换新鲜的培养基。细胞在含有胎牛血清的培养基中培养,正常条件下的培养条件为37℃、5%二氧化碳CO2;缺氧条件则使用缺氧细胞培养箱,培养条件为37℃、5%CO2、1%氧气O2。选择缺氧状态下(1%O2)和正常条件下培养8 h的A549细胞用于miRNA芯片分析。
1.3芯片数据分析
将上述培养好的两组A549细胞交给哈尔滨欣科瑞经贸有限公司做miRNA芯片分析。
1.4差异表达miRNA的筛选
基于倍数法筛选两组样本的差异表达miRNA。计算两组间芯片miRNA表达值的差异倍数,将满足差异倍数>2的miRNA识别为差异表达的miRNA。
1.5预测差异表达miRNA的靶基因
利用数据库Target Scan,预测得到差异表达miRNA调控的所有靶基因。该数据库是目前利用理论方法预测miRNA靶基因较为理想的数据库。
1.6统计学方法
分别使用基因本体(gene ontology,GO)数据库和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路数据库,对差异表达miRNA调控的靶基因进行GO功能和KEGG通路富集分析,利用Fisher精确检验和多重比较检验计算每个功能的显著性水平(P值),并用Benjamini-Hochberg法[5]校正P值,P<0.05为差异有统计学意义。
2 结果
2.1差异表达miRNA的统计分析
根据筛选标准,本研究共筛选14个在缺氧A549细胞和正常A549细胞之间差异表达的miRNA。其中,9个在缺氧组中上调的miRNA(如hsa-miR-301b、hsa-miR-769-5p等)和5个下调的miRNA(如hsamiR-622、hsa-miR-181a-3p等)(见表1)。hsa-miR-301b上调的差异倍数最大,hsa-miR-622下调的差异倍数最大。
2.2差异表达miRNA的靶基因分析
为研究差异表达的miRNA在缺氧条件下对哪些基因产生调控作用,本研究利用Target Scan数据库来预测差异表达miRNA的靶基因。共有4个上调的miRNA(hsa-mir-301b、hsa-mir-148b-3p、hsa-mir-769-5p和hsa-mir-1180)和2个下调的miRNA(hsamir-622和hsa-mir-202-3p)预测到靶基因,靶基因数目总共3259个,例如,上调表达的hsa-miR-301b调控的靶基因包括FOXF2、CRE5B、MARK3和MYB等;hsa-mir-148b-3p调控NOG、WNT10B等基因;hsa-miR-769-5p调控ARID1A、PTCH1、GRAMD3等基因;hsa-mir-1180调控SCN5A、ISOC2等基因。而下调表达的hsa-mir-622调控G3BP1、CELF2等基因;hsa-mir-202-3p调控TFAP2B、CLCN5等基因。见表2。

表2 差异表达miRNA调控的靶基因
2.3差异表达miRNA靶基因的生物学功能分析
为进一步研究差异表达miRNA所涉及的生物学功能,本研究对预测到的miRNA靶基因进行GO功能和KEGG通路富集分析,间接揭示差异表达miRNA所参与的生物学功能。
在上调miRNA靶基因富集的GO功能中,DNA转录、多细胞有机体发育、离子转运、核染色质修饰、代谢过程和细胞周期等功能被富集到。其中DNA转录、多细胞有机体发育、离子转运、核染色质修饰与代谢过程功能也被下调miRNA靶基因富集到,另外,下调miRNA靶基因还富集在血液凝固等GO功能上。见表3。
在上调miRNA和下调miRNA靶基因富集的显著通路中,有很多通路是一样的,比如Wnt信号通路、转化生长因子-β(transforming growth factorβ,TGF-β)信号通路、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路、黏着斑等。见表4。

表3 miRNA靶基因富集到的排名前10的GO功能 (按P值由小到大)

续表3
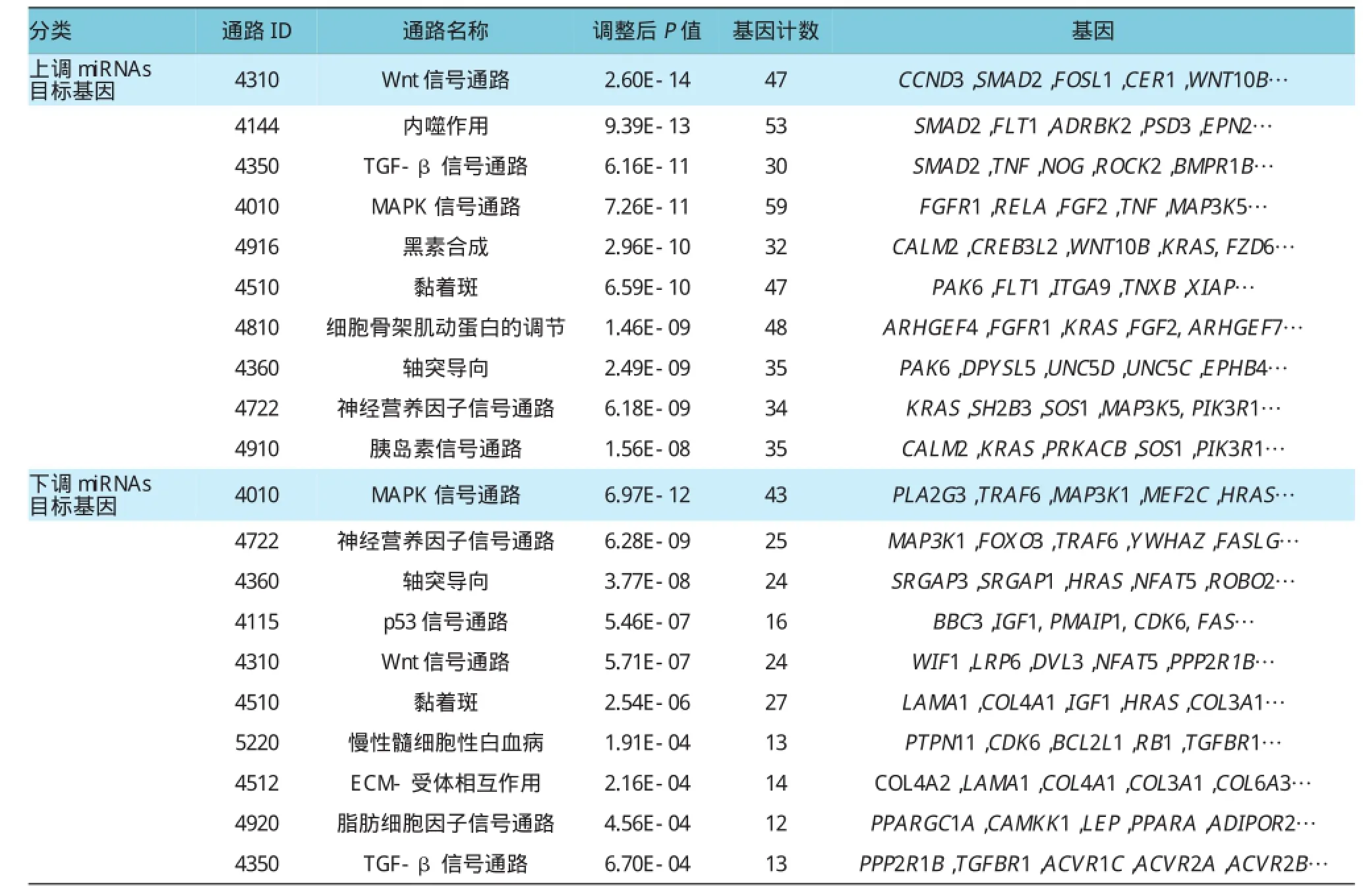
表4 miRNA靶基因富集到的排名前10的KEGG通路 (按P值由小到大)
3 讨论
在肿瘤中,细胞快速增殖,但新生血管的生成速度相对较慢,来不及为实体瘤内部和肿瘤周围细胞供应血氧,所以这些细胞就会产生缺氧状态。有研究表明,几乎所有的实体瘤中都存在缺氧细胞[6]。缺氧对于肿瘤的发展具有十分重要的意义[7]。①缺氧会直接导致细胞凋亡或者坏死;②缺氧会激活与细胞代谢和蛋白质合成等相关基因的转录,从而减缓增殖速度,增加无氧糖酵解,使细胞能适应缺氧环境,抑制细胞的凋亡;③缺氧可以刺激肺癌细胞中血管内皮细胞生长因子和碱性成纤维细胞生长因子的表达,促进移植瘤中新血管的生成,提高肿瘤的生长能力;④缺氧还会刺激缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达,激活转录调节因子核转录因子-κB(nuclear transcription factor-κB,NF-κB)通路[8]。
本研究利用miRNA芯片技术和生物信息学方法,分析缺氧对肺腺癌A549细胞中miRNA表达谱的影响,并预测差异表达miRNA的靶基因,分析靶基因所参与的生物学功能和通路。
本研究共筛选出14个在缺氧A549细胞和正常A549细胞之间差异表达的miRNA,包括9个在缺氧组中上调的miRNA和5个下调的miRNA。在上调表达的miRNA中,hsa-miR-769-5p调控ARID1A 和SMAD2等基因。ARID1A基因编码SWI/SNF家族蛋白,该蛋白具有解旋酶和腺苷三磷酸酶活性。本研究发现,ARID1A被富集到染色质修饰功能上。有研究报道,ARID1A可以通过改变核染色质结构来调控某些基因的转录[9]。有研究报道称,SWI/SNF家族蛋白可以结合到缺氧诱导因子HIF-1α的启动子上,通过HIF-1α的表达来调控细胞缺氧应答[10]。目前,还没有研究报道ARID1A基因与缺氧肺癌的关系。笔者推测,ARID1A可能是通过其染色质修饰功能来调节某些与缺氧相关基因的转录和表达,从而对肺腺癌细胞的缺氧应答产生影响。
SMAD2基因编码的蛋白是信号传感器和转录调节器,调节多个信号通路。在本研究中,SMAD2被富集在Wnt信号通路和TGF-β信号通路上。已有很多文献报道,Wnt信号与缺氧之间的关系,例如,Wnt信号通路中的β-连环蛋白可以与缺氧诱导因子HIF-1α相互作用,增强细胞对缺氧的适应能力[11]。HIF-1α可以通过抑制β-连环蛋白的活性来阻碍Wnt信号通路,该机制可能与缺氧诱导的肿瘤细胞生长抑制有关[12]。上述研究表明,Wnt信号通路在细胞缺氧应答过程中具有非常重要的作用。另外,目前也有很多关于缺氧与TGF-β信号关系的研究报道,例如缺氧(1%O2)可以诱导TGF-β1的表达和SMAD2磷酸化,激活肝星状细胞的活性[13]。TGF-β信号通路还可以调节缺氧诱导的新生小鼠肺血管重建过程[14]。上述研究结果显示,TGF-β信号通路与缺氧关系密切。缺氧会诱导SMAD2蛋白的磷酸化,这是细胞缺氧应答过程中一个十分重要的机制[15-16]。但目前还没有文献报道hsa-miR-769-5p与缺氧的关系。笔者推测,hsa-miR-769-5p可能通过调节ARID1A和SMAD2等基因的表达,间接调控Wnt信号通路和TGF-β信号通路,从而在肺腺癌细胞的缺氧应答中发挥重要功能。
本研究发现,在上调miRNA和下调miRNA靶基因富集的GO功能和KEGG通路中,有些功能和通路是一样的,例如在GO功能富集结果中,DNA转录、多细胞有机体发育、离子转运、核染色质修饰与代谢过程等功能均被上调miRNA和下调miRNA的靶基因富集到。该研究结果表明,在肺腺癌细胞的缺氧应答中,该功能可能受上调miRNA和下调miRNA的共同调控。在KEGG通路富集结果中,Wnt信号通路、TGF-β信号通路、MAPK信号通路和黏着斑等通路均被上调miRNA和下调miRNA的靶基因富集到。心肌缺氧导致细胞内pH降低,促进P38 MAPK的磷酸化,从而激活该信号通路,而抑制该通路则会使心肌细胞免于缺氧导致的细胞凋亡[17]。还有研究报道,缺氧可以激活MAPK信号通路[18]。另外,缺氧也会激活黏着斑激酶的活性和亚细胞迁移,促进黏着斑蛋白的磷酸化[19]。
综上所述,本研究利用miRNA芯片技术和相关生物信息学分析手段,在经缺氧处理的人肺腺癌A549细胞中筛选出14个差异表达的miRNA,包括9个上调miRNA和5个下调miRNA。而且差异表达的miRNA及其靶基因可能在肺腺癌A549细胞的缺氧反应中具有十分重要的功能。另外,靶基因参与的一些生物学功能以及一些通路功能可能在肺腺癌细胞的缺氧反应中发挥重要作用。该miRNA和靶基因的表达水平变化,以及对肺腺癌细胞的一些功能影响还需后续实验进一步验证。本研究结果为深入探索缺氧对肺癌细胞在分子层面的影响提供理论基础和实验依据,也为临床治疗肺癌提供一些潜在药物靶点。
参考文献:
[1]SHENOUDA S K,ALAHARI S K.MicroRNA function in cancer: oncogene or a tumrosuppressor[J].Cancer Metastasis Rev,2009, 28(3/4):369-378.
[2]KULSHRESHTHA R,DAVULURI R V,CALIN G A,et al.A microRNA component of the hypoxicresponse[J].Cell Death Differ, 2008,15(4):667-671.
[3]BABAR I A,CZOCHOR J,STEINMETZ A,et al.Inhibition of hypoxia-induced miR-155radiosensitizes hypoxiclung cancer cells[J].Cancer Biology Therapy,2011,12(10):908-914.
[4]GROSSO S,DOYEN J,PARKS S K,et al.MiR-210 promotes a hypoxic phenotype and increases radioresistance in human lung cancer cell lines[J].Cell Death Disease,2013,4(3):544.
[5]BENJAMINI Y,HOCHBERG Y.Controlling the false discovery rate:a practical and powerful approach to multiple testing[J]. Journal of the Royal Statistical Society,1995,57(57):289-300.
[6]TALKS K L,TURLEY H,GATTER K C,et al.The expression and distribution of the hypoxia-inducible factors HIF-1α and HIF-2α in normal human tissues,cancers,and tumor-associated macrophages[J].the American Journal of Pathology,2000,157(2): 411-421.
[7]DEHDASHTI F,MINTUN M A,LEWIS J S,et al.In vivo assessment of tumor hypoxia in lung cancer with 60Cu-ATSM[J]. European Journal of Nuclear Medicine and Molecular Imaging,2003,30(6):844-850.
[8]YANG C,YANG Z,ZHANG M,et al.Hydrogen sulfide protects against chemical hypoxia-induced cytotoxicity and inflammation in HaCaT cells through inhibition of ROS/NF-κB/COX-2 pathway[J]. PLoS one,2011,6(7):DOI:10.1371/journal.pone.0021971.
[9]NIE Z,XUE Y,YANG D,et al.A specificity and targeting subunit of a human SWI/SNF family-related chromatin-remodeling complex[J].Mol Cell Biol,2000,20(23):8879-8888.
[10]KENNETH N S,MUDIE S,VAN UDEN P,et al.SWI/SNF regulates the cellular response to hypoxia[J].Journal of Biological Chemistry,2009,284(7):4123-4131.
[11]KAIDI A,WILLIAMS A C,PARASKEVA C.Interaction between β-catenin and HIF-1 promotes cellular adaptation to hypoxia[J].Nature Cell Biology,2007,9(2):210-217.
[12]LIM J H,CHUN Y S,PARK J W.Hypoxia-inducible factor-1α obstructs a Wnt signaling pathway by inhibiting the hARD1-mediated activation of β-catenin[J].Cancer Research,2008,68(13): 5177-5184.
[13]SHI Y F,FONG C C,ZHANG Q,et al.Hypoxia induces the activation of human hepatic stellate cells LX-2 through TGF-β signaling pathway[J].FEBS Letters,2007,581(2):203-210.
[14]AMBALAVANAN N,NICOLA T,HAGOOD J,et al.Transforming growth factor-βsignaling mediates hypoxia-induced pulmonary arterial remodeling and inhibition of alveolar development in newborn mouse lung[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2008,295(1):86-95.
[15]ZHANG H,AKMAN H O,SMITH E L,et al.Cellular response to hypoxia involves signaling via smad proteins[J].Blood,2003, 101(6):2253-2260.
[16]TAKAHASHI T,TAKAHASHI I,KOMATSU M,et al.Mutations of the NOG gene in individuals with proximal symphalangism and multiple synostosis syndrome[J].Clin Genet,2001, 60(6):447-451.
[17]ZHENG M,REYNOLDS C,JO S H,et al.Intracellular acidosis-activated p38 MAPK signaling and its essential role in cardiomyocyte hypoxic hypoxia and reoxygenation stimulates MAP kinase signaling injury[J].The FASEB Journal,2005,19(1): 109-111.
[18]MILLAR T M,PHAN V,TIBBLES L A.ROS generation in endothelial and kinase-dependent neutrophil recruitment[J].Free Radical Biology and Medicine,2007,42(8):1165-1177.
[19]SEKO Y,TAKAHASHI N,SABE H,et al.Hypoxia induces activation and subcellular translocation of focal adhesion kinase (p125 FAK)in cultured rat cardiac myocytes[J].Biochemical and Biophysical Research Communications,1999,262(1):290-296.
(童颖丹编辑)
中图分类号:R 734.2
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.13.007
文章编号:1005-8982(2016)13-0037-06
收稿日期:2015-12-21
*基金项目:黑龙江省自然科学然基金(No:D201230)
[通信作者]鲍永霞,E-mail:baoyongxia@126.com;Tel:13936196255
MicroRNA gene chip analysis of human lung adenocarcinoma A549 cells in anoxic microenvironment*
Ying Geng1,Yong-xia Bao1,Jing-bin Xiao2,Dong-jie Ge3,Zheng Liang1
(1.Department of Respiratory Diseases,the Second Affiliated Hospital,Harbin Medical University,Harbin,Heilongjiang 150081,China;2.Director Healthcare Room,the Military Region Hospital of Heilongjiang Province,Harbin,Heilongjiang 150009,China;3.Department of Respiratory Diseases,the First Hospital of Harbin,Harbin,Heilongjiang 150010,China)
Abstract:Objective To analyze the effect of hypoxia on miRNA expression in lung adenocarcinoma A549 cells.Methods Based on miRNA chip technology and bioinformatic analysis methods,differential expression of miRNAs between hypoxia-treated A549 cells and normoxia-treated A549 cells were identified,and their target genes were predicted.Besides,biological functions and pathways of target genes were analyzed. Results In total,14 differentially-expressed miRNAs were screened,including 9 upregulated miRNAs and 5 downregulated miRNAs in the hypoxia-treated A549 cells.Target genes of both upregulated and downregulated miRNAs were enriched in GO terms,such as DNA transcription,chromatin modification,as well as a set of pathways,such as Wnt signaling,TGF-beta signaling and MAPK signaling.Conclusions In the hypoxic A549 cells,miRNA expressions have significantly changed.A series of differentially-expressed miRNAs regulate certain genes.
Keywords:lung adenocarcinoma;A549 cell;chip;hypoxia;differentially-expressed microRNA
