水稻脆秆突变体bc16的鉴定和基因精细定位
2016-08-09舒亚洲曾冬冬秦冉金晓丽郑希石春海
舒亚洲 曾冬冬 秦冉 金晓丽 郑希 石春海
(浙江大学 农业与生物技术学院 农学系, 杭州310058; *通讯联系人, E-mail:chhshi@zju.edu.cn)
水稻脆秆突变体bc16的鉴定和基因精细定位
舒亚洲曾冬冬秦冉金晓丽郑希石春海*
(浙江大学 农业与生物技术学院 农学系, 杭州310058;*通讯联系人, E-mail:chhshi@zju.edu.cn)
SHU Yazhou, ZENG Dongdong, QIN Ran, et al. Identification and gene fine mapping of abrittleculm16 (bc16) mutant in rice. Chin J Rice Sci, 2016, 30(4): 345-355.
舒亚洲, 曾冬冬, 秦冉, 等. 水稻脆秆突变体bc16的鉴定和基因精细定位. 中国水稻科学, 2016, 30(4): 345-355.
摘要:脆秆突变体是一类研究植物机械强度的重要材料。利用EMS(甲基磺酸乙酯)诱变粳稻品种日本晴,筛选获得一个脆秆突变体,命名为bc16(brittle culm16)。与野生型植株相比,bc16茎秆、叶片和根明显变脆,而株高、穗粒数降低,穗长和主根长变短。茎秆细胞壁成分分析表明,bc16纤维素含量显著低于野生型植株,半纤维素含量则显著增加,而木质素含量差异不显著。突变体bc16薄壁细胞形状无规则、排列紊乱,表皮层下厚壁细胞次生壁和薄壁细胞壁变薄。遗传分析表明bc16突变体由隐性单基因控制,位于水稻第2染色体长臂端InDel标记2-F和2-H间66.6 kb的区间内。该区间共有7个候选基因,其中Os02g0738900是bc3脆秆基因的等位基因。测序结果表明,bc16突变体中的Os02g0738900基因从ATG开始第5113位,在第13内含子近末端发生了T→A的置换,导致转录过程中该内含子末端6个核苷酸被剪切到mRNA中,最终导致翻译提前终止。实时荧光定量PCR结果表明Os02g0738900基因在bc16脆秆突变体根、茎、叶中的表达量降低。bc16基因可能通过调控厚壁组织次生细胞壁和薄壁细胞初生壁的合成来影响水稻茎秆机械强度。
关键词:水稻; 脆秆; 基因定位; 细胞壁合成
植物机械强度是一种重要的农艺性状,直接影响着作物的抗倒性。研究表明,引起水稻倒伏的主要原因是茎秆机械强度不足[1]。植物细胞壁是由多糖、蛋白质等成分组成的复杂网状结构,支撑着植株形态的建成[2,3]。作为植株骨架的细胞壁,其主要成分是纤维素、半纤维素和木质素,这些成分含量的高低密切影响着植株的机械强度。植物机 械组织主要对植株起支撑和保护作用,可分为厚壁组织和厚角组织两类,其中位于维管组织周围和表皮层以下的几层厚壁细胞起着主要的支持作用,是影响水稻茎秆强度的主要结构因子。脆秆突变体是一类茎秆机械强度降低、脆性增加的材料。一般而言,水稻脆秆突变体在细胞壁成分上通常会表现出纤维素含量降低,在结构上表现为厚壁组织次生细胞壁变薄[4,5]。
脆秆突变体是一类比较常见的突变体,拟南芥[6]、大麦[7,8]、小麦[9,10]和水稻[11]等植物中均已发现该类突变体。目前,发现并命名的水稻脆秆突变体有20多个,如bc9311-1、NBC(t)、dbc1等[12-14],已精细定位或克隆了BC1~BC8、BC10~BC12、BC14和BC15等基因,并对BC1、BC3、BC6、BC7、BC12、BC14、BC15等基因的功能进行了研究,研究表明多数脆秆基因参与了纤维素的代谢[15]。Li等[16]克隆了可编码COBRA蛋白的基因BC1,该基因突变后会引起水稻细胞壁的次生壁变薄,纤维素含量降低,半纤维素和木质素含量增加等。Hirano等[17]和Zhang等[18]发现水稻脆秆突变体bc3,该突变体表现出根、茎、叶变脆易折断,根长变短,厚壁组织细胞壁和薄壁细胞壁变薄等特点,进一步研究表明水稻脆秆基因BC3编码1个经典的发动蛋白家族OsDPR2B蛋白,参与水稻次生壁的合成。Kotake等[19]对位于第9染色体上的不完全显性基因BC6进行研究,结果表明该基因参与了编码纤维素合酶催化亚基,其突变后能够显著降低纤维素含量。Yan等[20]从60Co-γ射线诱导粳稻品种中花11中获得脆秆突变体bc7(t),将编码纤维素合酶亚基突变基因定位于水稻第1染色体长臂8.4 kb的区域内。Zhang等[21]在粳稻品种C418发现的脆秆突变体bc12,其纤维素含量变化不明显,而半纤维素含量增加了50%,纤维素微纤丝方向发生改变和木质素含量显著增加引起植株茎秆变脆;进一步研究发现编码水稻驱动蛋白BC12是一个双靶向驱动蛋白,在细胞核和细胞质中均有分布,主要参与了细胞分裂中微管的排列。Zhang等[22]研究显示,BC14编码的水稻核苷酸糖转运蛋白OsNST1位于高尔基体上,该基因突变可导致细胞壁纤维素含量降低,从而引起植物机械强度的下降而表现脆性。Wu等[23]在中花8号胚性愈伤组织中获得了一个稳定遗传的脆秆突变体bc15,其纤维素含量较野生型降低23%,而阿拉伯糖和木糖分别增加58%和77%;该基因已定位于第9染色体标记M2和M3之间114 kb内,序列分析发现Os09g0494200基因编码区发生了一个错义突变,导致213位丙氨酸突变成亮氨酸;蛋白功能研究表明BC15编码了一个膜相关的类几丁质酶蛋白,其突变会导致纤维素含量的降低,进而导致茎秆机械强度的下降。虽然已有的水稻脆秆突变体和基因对于茎秆机械强度分子机理的揭示起到了重要的作用,但是其分子机理有待进一步深入研究。发掘新的脆秆突变体,定位和克隆新的脆秆基因,有助于进一步揭示茎秆机械强度的分子机理。
本实验室通过EMS诱变粳稻品种日本晴,获得了一个脆秆突变体bc16,从表型、生理、遗传等方面对该突变体进行鉴定,明确了相应的遗传特性,并对该突变基因进行了精细定位;同时采用实时荧光定量PCR对bc16基因在根、茎、叶中表达量进行了分析。通过对该突变体的研究,有利于进一步了解水稻茎秆机械强度的分子机理,为水稻抗倒育种提供理论依据和材料基础。
1材料与方法
1.1材料
利用EMS诱变粳稻品种日本晴(Nipponbare),从中筛选到一个脆秆突变体,经多代连续自交,突变性状能够稳定遗传,命名为bc16(brittleculm16)。遗传分析和定位群体分别为突变体与日本晴和明恢63杂交形成的F2。
1.2突变体表型分析
2015年5月将脆秆突变体bc16和野生型日本晴种植于浙江大学实验农场,各个材料种植8行,每行6株,株行距为17 cm×17 cm。成熟时随机选取10株野生型和突变体,分别统计株高、主穗长度、剑叶长、节间长度、总粒数、结实率等性状。
1.3纤维素、半纤维素、木质素含量测定
采用van Soest等[24]的方法测定成熟期茎秆纤维素、半纤维素和木质素含量,稍有改进(消泡剂使用n-辛醇代替十氢化萘)。采用上海新嘉电子有限公司CXC-06粗纤维测定仪测定中性洗涤纤维和酸性洗涤纤维含量,用意大利公司生产的VELP CSF膳食纤维测定仪测定纤维素含量。3次重复,利用EXCEL分析实验结果。
1.4细胞学观察
1.4.1石蜡切片观察
切取成熟期突变体bc16和日本晴茎秆倒一节间中间部位1 cm组织,将样品用FAA固定液(38%甲醛5 mL,冰醋酸5 mL,70%酒精90 mL)固定24 h。样品经脱水、包埋、切片、脱蜡后用间苯三酚染色,倒置荧光显微镜拍照(NIKON ECLIPSE TI-SR)。
1.4.2透射电镜观察
取成熟期突变体bc16和日本晴倒一节中间部位1 cm组织,用刀片纵切成5~6个小片。样品于2.5%戊二醛溶液中4℃下固定过夜,经漂洗、包埋等处理后利用Reichert超薄切片机切取70~90 nm薄片。切片在柠檬酸铅溶液、醋酸双氧铀50%乙醇饱和溶液中各染色15 min,之后采用透射电镜(Hitachi H-7650)观察、拍照。
1.5bc16突变体基因定位和测序
采用Michelmore等[25]提出的BSA(Bulk Segregation Analysis)法,在定位群体中分别取突变和正常单株各12株,利用CTAB法提取单株DNA,将其浓度均调至200 ng/μL。突变株和正常单株的DNA分别取50 μL构成突变池和正常池。利用本实验室在日本晴和明恢63中筛选到的334对多态引物对两个池进行连锁标记筛选,对得到的连锁标记用F2群体突变单株进行验证。利用Gramene(http://www.gramene.org)数据库和NCBI序列匹配数据库(http://blast.ncbi.nlm.nih.gov/Blast.
cgi?PAGE=MegaBlast&PROGRAM=blastn&
BLAST_PROGRAMS=megaBlast&PAGE_TYPE
=BlastSearch&BLAST_SPEC=blast2seq&
QUERY=&SUBJECTS=)以及DNASTAR等软件设计新引物,进一步进行精细定位。根据水稻基因组注释计划数据库(http://rice.plantbiology.msu.edu/cgi-bin/gbrowse/rice)和水稻注释计划数据库(http://rapdb.dna.affrc.go.jp/index.html)对候选基因进行功能注释,并对其测序,最终确定目的基因及其突变位点。
1.6RT-PCR
采用Trizol法提取bc16脆秆突变体和野生型3叶期根、茎、叶部位总RNA,随后将总RNA反转录合成cDNA第一条链。利用实时荧光定量PCR分析目的基因在野生型和突变体根、茎、叶中的表达量。每个样品中各基因的相对表达量以野生型为对照用内参照基因OsActin1进行归一化处理,相对表达量计算方法为2-△△CT[26]。荧光定量操作步骤参照Takara去除基因组逆转录试剂盒[Primer ScripttmRT reagent Kit with gDNA Eraser (Perfect Real Time)]说明书。实验所用试剂为Takara公司的定量PCR试剂盒(SYBR Premix ExTaqTM),所用仪器为CFX96TM荧光定量PCR仪。实时qPCR体系包括cDNA模板2 μL、SYBRPremix ExTaq12.5 μL、正反向引物各1 μL、超纯水8.5 μL。每个样品重复4次。PCR扩增采用两步法,程序如下:95℃下30 s;95℃下5 s,60℃下30 s,39个循环。溶解曲线分析:95℃下10 s,65℃下5 s,95℃下5 min。
2 结果与分析
2.1bc16表型特征和农艺性状分析
突变体bc16茎秆、叶片、根从苗期就开始表现脆性,直至成熟期(图1-A、B)。与野生型相比,突变体bc16的株高降低、穗长变短、每穗粒数明显减少(图1-C、D、E),而结实率和千粒重的差异则不明显(表1)。同时,突变体bc16还表现出主根长(图1-F),剑叶、倒2叶、倒3叶叶片变短,抽穗、灌浆、成熟时间推迟。此外,各节间长度统计表明,突变体bc16倒1节间、倒2节间、倒3节间、倒5节间长度明显低于野生型植株,而倒4节间长度有明显增加,差异都达到了极显著水平(表1)。
2.2bc16细胞壁主要组分含量分析
成熟期野生型和突变体bc16细胞壁纤维素、半纤维素和木质素等主要组成成分含量的测定结果表明,突变体bc16的茎秆纤维素含量要比野生型植株降低36.9%,而半纤维素含量则提高了23.6%,均达到极显著水平,但木质素含量差异不明显(图2)。
2.3茎秆横切面细胞学观察
倒置荧光显微镜观察发现突变体bc16的薄壁细胞表现为近圆形、细胞规则且排列均匀,而野生型薄壁细胞的形状无规则、排列紊乱(图3-A、B黑色箭头所示);突变体bc16和野生型表皮层下的厚壁组织细胞壁厚度(图3-A、B方框所示)有明显差异。透射电镜观察发现突变体bc16的厚壁组织细胞壁厚度明显变薄(图3-C、D)、次生细胞壁变窄,而初生细胞壁厚度差异不明显;此外bc16次生壁分层较为明显,而野生型则完全未分层(3-E、F);突变体bc16薄壁细胞壁明显薄于野生型,细胞结合方式不规则(图3-G、H)。上述结果表明,脆性基因bc16可导致表皮层下厚壁细胞次生壁和薄壁细胞壁变薄,薄壁细胞结合方式发生改变。

A-苗期; B-成熟期; C-拔节期; D-成熟期; E-稻穗; F-苗期根长比较。标尺=12.0 cm(C)、15.0 cm(D)、3.0 cm(E)、2.5 cm(F)。
A, Seedling stage; B, Mature stage; C, Wild type andbc16 mutant at the elongation stage; D, Wild type andbc16 mutant at the mature stage; E, Panicles; F, Root length at seedling stage. Bar=12.0 cm (C), 15.0 cm (D), 3.0 cm (E) and 2.5 cm (F).
图1野生型和突变体bc16表型
Fig. 1. Phenotype of wild type and bc16 mutant.
表1野生型和突变体bc16的农艺性状比较
Table 1. The comparison of agronomic traits between wild type and bc16.
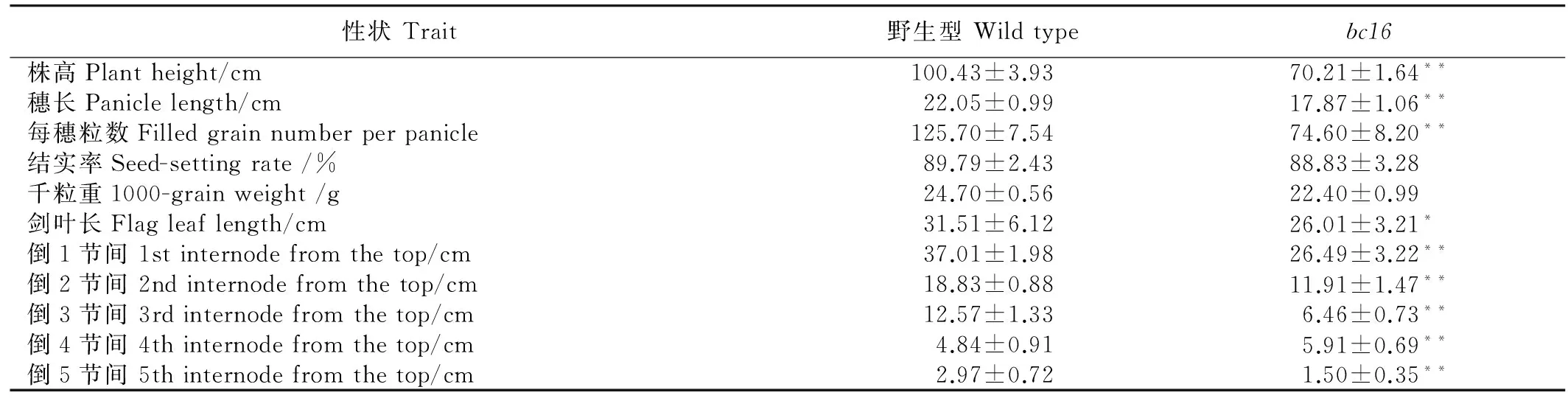
性状Trait野生型Wildtypebc16株高Plantheight/cm100.43±3.9370.21±1.64**穗长Paniclelength/cm22.05±0.9917.87±1.06**每穗粒数Filledgrainnumberperpanicle125.70±7.5474.60±8.20**结实率Seed-settingrate/%89.79±2.4388.83±3.28千粒重1000-grainweight/g24.70±0.5622.40±0.99剑叶长Flagleaflength/cm31.51±6.1226.01±3.21*倒1节间1stinternodefromthetop/cm37.01±1.9826.49±3.22**倒2节间2ndinternodefromthetop/cm18.83±0.8811.91±1.47**倒3节间3rdinternodefromthetop/cm12.57±1.336.46±0.73**倒4节间4thinternodefromthetop/cm4.84±0.915.91±0.69**倒5节间5thinternodefromthetop/cm2.97±0.721.50±0.35**
数据为平均值±标准差(n=10,其中千粒重n=3)。*,**表示t-测验在0.01水平上差异显著,*表示t-测验在0.05水平上差异显著。
Figures are mean ±SD(n=10, for 1000-grain weight,n=3).*,**indicate significant difference atP<0.05 andP<0.01 between wild type andbc16 mutant, respectively. The same as below.
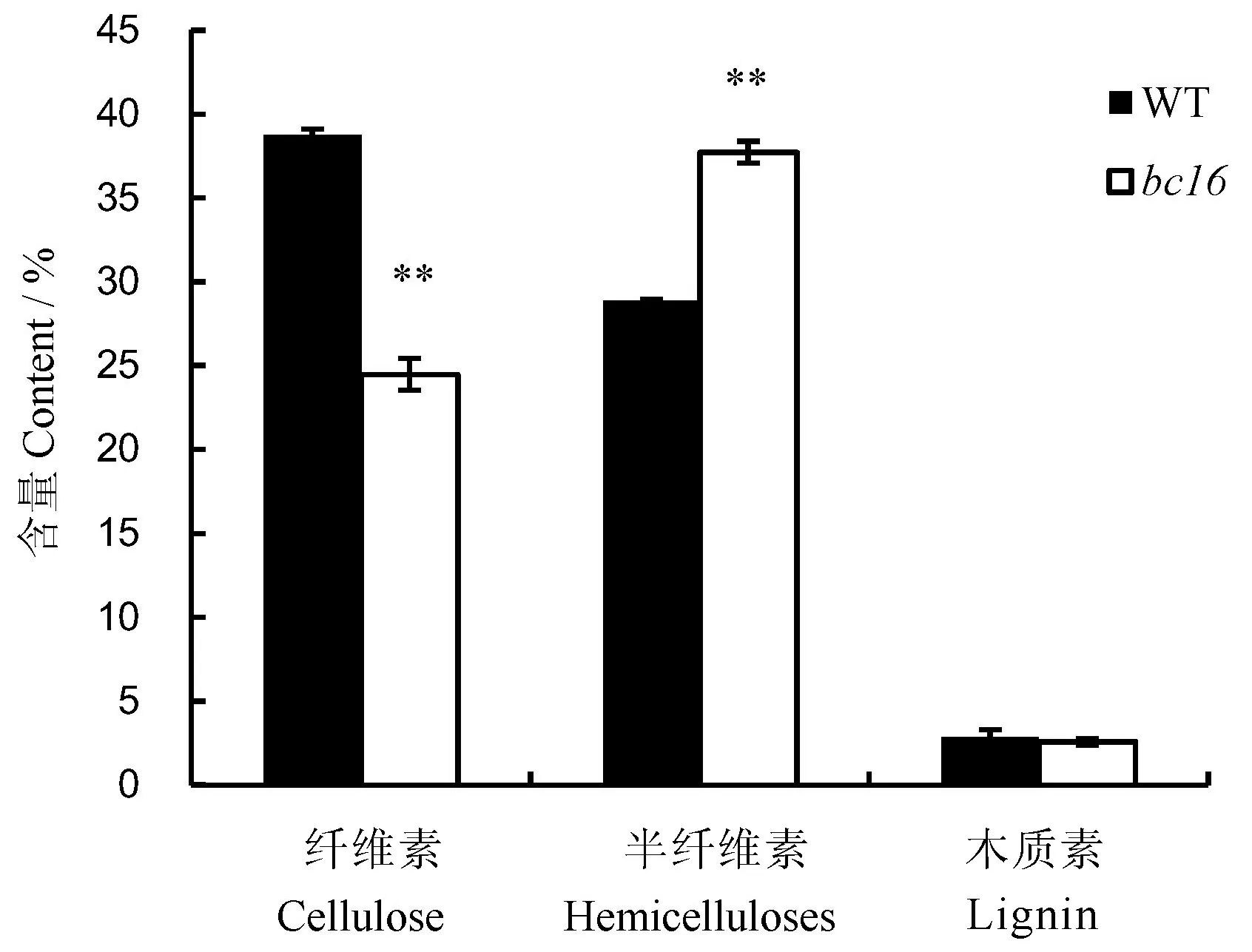
图2野生型和突变体bc16植株细胞壁的主要成分含量
Fig.2. Contents of main ingredients in cell wall of WT and bc16.
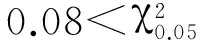
2.4突变体bc16的遗传分析
2.5bc16基因定位
利用在亲本间筛选到的334对多态性引物对突变池和正常池进行多态性条带筛选,结果发现第2染色体SSR标记RM64、RM66、RM5607、RM14099在两池间有多态性(表2)。利用12个F2单株验证这些标记,只有RM66存在一个单交换,其他标记没有单交换,这表明这些标记与目的基因连锁。采用另外21个F2单株扩增RM64、RM5607、RM66,发现交换单株在这些标记间均相同,交换单株数目分别为4、4、6,根据标记在染色体上的位置可以推知目的基因位于标记的左侧(图4-A)。通过扩大F2群体和设计新的InDel标记,将目的基因进一步定位于标记2-C和2-D之间(图4-B);随后利用871个单株最终将bc16基因精细定位于2-F和2-H之间66.6 kb的候选区间内(图4-C)。在该区间里存在7个候选基因(图4-D),其中Os02g0738900是bc3脆秆基因的等位基因,编码一个经典的发动蛋白OsDRP2B,该蛋白是次生壁形成所必需的[17,27]。因此,推测Os02g0738900基因可能就是目的基因。
表2bc16基因定位部分引物
Table 2. Part of primers for bc16 gene mapping.

标记Marker正向引物(5'→3')Forwardprimer反向引物(5'→3')Reverseprimer用途PurposeRM64GGTTCAAACCAAGCTGATCAGATGAAGGCCTTCCACGCAG定位MappingRM66GGTCCTGGGTCAATAATTGGGTTACCTTGCTGCATGATCCTAAACCGG定位MappingRM68CCATTCGTGAGAAGATCTGACACCTCATCCTCGTAACGCC定位MappingRM5607TTTCTTGCCCACACGACTACGGTACGTGGCCAACTGGCTATACATACG定位MappingRM1405CGGCTTGTTTATGCTACCAGAGGCGAGGAGACTAACCAAATTGATCG定位MappingRM14099GGTAGCTGAGCAATTGGCATGGGATGATCAGGAACTCATCCATCTCC定位Mapping2-BATGGTTCTTGTTTCTCTGCTGATGTGGATACTGATGTTGCTGGCTAAG定位Mapping2-CATATGCATGCAAATCGACCAACTCCAGCATAAGCACCGCCATCA定位Mapping2-DTCCTCGCCCTTCCGCCTCCTTATCACCGCCATTCCCCTCACCAT定位Mapping2-FCGACGATGGTTGGTGGGATAGCAGAGTGTGTTGGGTAATGCTAATG定位Mapping2-JATAAAAGCCGGCTTGATACTGT CCCGATGAAAAGGATGAGC定位Mapping2-LAGCATACGCGCACAGAAAAGGCGGCGCAGTTGGCATGAAAAGG定位Mapping2-HTTTGCTGGGCTCGGGGTTTACGCTGCCACGTTGCTTGATGATG定位Mapping2-1CACAAAGAAGAATGGAAAGGCAACGACCACCAGGCCCAGCAACC定位Mapping2-ETTGGCCTTCGCTTGTTTTGGAGTGCGAATATTTGGGGTCCTG定位Mapping2-CFTGGAAAGGCAACGTCGTGAGGATGTTCACCACCAGGCCCAGCAACC测序Sequencing2-CCGCTCTAGAATGGAGGCCATGGACGAGCTGCTCTAGATTAATATTTTTGCCCTGGAG测序Sequencing2-CC-2TTCAGGCTATCTTGTCTAACGGAGTATTTAAACCCTTCAC测序Sequencing2-1DGGCAGGCTGAAGCGGAGACACTGCCCGGACAAAAGGTTAGGTAGCRT-PCROsActin1GTGGTCGCCCCTCCTGAAAGGGCTTAGCATTCTTGGGTCCGRT-PCR
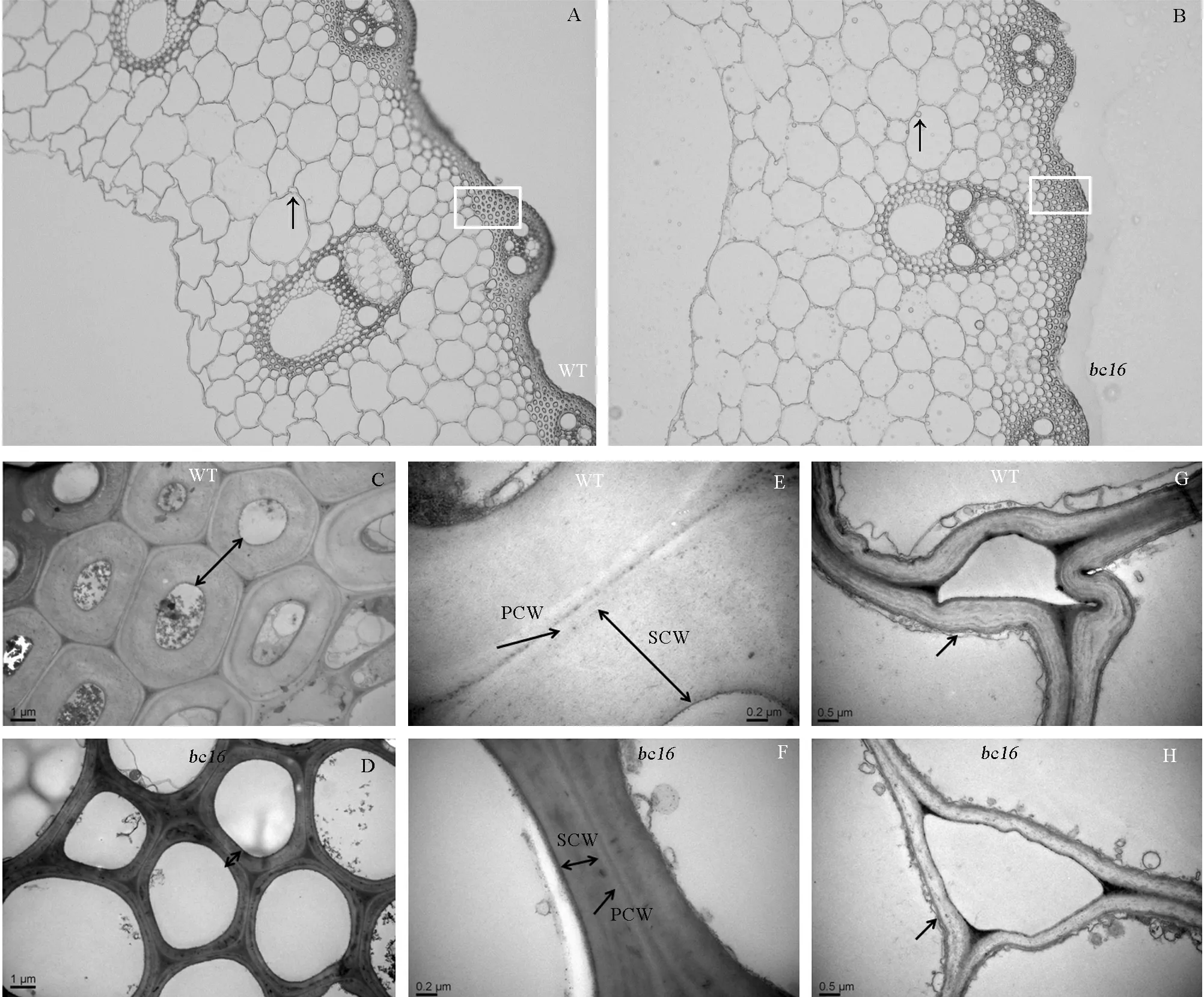
A-野生型日本晴部分横切面; B-突变体bc16部分横切面; C-野生型日本晴表皮层下厚壁组织细胞; D-突变体bc16表皮层下厚壁组织细胞; E-野生型日本晴厚壁组织细胞壁,PCW(初生壁)、SCW(次生壁); F-突变体bc16 厚壁组织细胞壁,PCW(初生壁)、SCW(次生壁); G-野生型日本晴薄壁细胞壁; H-突变体bc16薄壁细胞壁。标尺=1 μm(C和D)、0.2 μm(E和F)、0.5 μm(G和H)。
A, Part of cross section of the wild type; B, Part of cross section ofbc16; C, The wild type sclerenchyma cells below the epidermis layer (bar=1μm); D, Thebc16 mutant sclerenchyma cells below the epidermis layer (bar=1μm); E, The wild type sclerenchyma cell wall, PCW(Primary Cell Wall), SCW(Secondary Cell Wall) (bar=0.2 μm); F, Thebc16 mutant sclerenchyma cell wall, PCW(Primary Cell Wall), SCW(Secondary Cell Wall) (bar=0.2 μm); G, The wild type parenchyma cell wall (bar=0.5 μm); H, Thebc16 mutant parenchyma cell wall (bar=0.5 μm).
图3日本晴野生型和突变体bc16茎秆倒1节间中间部位横切面组织学和细胞学观察
Fig. 3. Stem cross-sections histology and cytology observation of wild type and bc16 mutant at the middle of the first internode from the top.
将日本晴和bc16突变体Os02g0738900基因进行PCR扩增和测序。DNA测序结果表明Os02g0738900基因第13内含子从ATG开始5113位碱基位置发生了T→A的置换,造成剪切位点前移,该内含子末端6个核苷酸(TATTAG)被剪切到mRNA中,造成翻译提前终止(图4-D)。为进一步验证突变位点,对野生型和bc16突变体目的基因全长cDNA进行扩增,并在bc16基因序列发生突变的位点两端设计引物PCR扩增目的片段,电泳结果证实了测序结果(图4-E)。以上结果表明基因Os02g0738900第13内含子剪切位点前移,内含子的一部分被剪切到mRNA中,进而导致蛋白序列和结构发生了改变,功能发生了缺失。
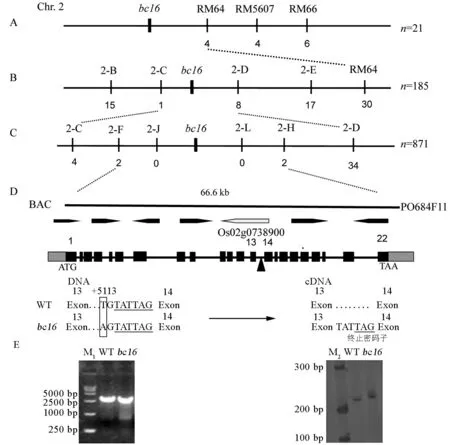
A-bc16基因初定位于第2染色体SSR标记RM64、RM5607、RM66左侧; B-bc16基因初定位于InDel标记2-C、2-D两侧; C-bc16基因精细定位于InDel标记2-F、2-H之间66.6 kb的区域; D-突变体bc16和野生型DNA和cDNA测序目标基因序列结果比较。E-野生型和突变体bc16全长cDNA以及发生突变的部分cDNA电泳结果比较,M1为DL15000,M2为DL500。
A,bc16 gene was primarily mapped on the left side of SSR markers RM64, RM5607, RM66 on chromosome 2; B,bc16gene was mapped between InDel markers 2-C and 2-D; C,bc16gene was fine mapped between InDel markers 2-F and 2-H; D, Target DNA and cDNA sequencing results comparison betweenbc16 and wild type; E, The electrophoresis results comparison of full length cDNA, partial cDNA with mutation sites between wild type andbc16, M1and M2are markers DL15000 and DL500, respectively.
图 4bc16基因定位以及突变体bc16和野生型日本晴序列匹配
Fig. 4. Gene mapping of bc16 and the sequence alignment between bc16mutant and wild type.
2.6bc16 基因RT-PCR分析
RT-PCR分析结果表明,bc16基因在根、茎、叶中均有表达,以茎中的表达量为最高,其次是叶和根,且脆秆突变体的表达量均低于野生型(图5)。说明Os02g0738900基因突变导致其表达量降低,引起植株根、茎、叶机械强度降低,导致脆性增加。
3讨论
在已发现的水稻脆秆基因中,至少有两个脆秆基因,即bc6、bc7会导致细胞壁纤维素含量降低、半纤维素含量升高[19,20]。BC6和BC7都是编码纤维素合酶基因,其中BC6编码OsCesA9,是一个不完全显性基因,而BC7是OsCesA4的等位基因。本研究发现的bc16是一个编码动力蛋白的基因,可能参与到细胞内吞作用和高尔基体转膜过程。这表明茎秆机械强度的调控是一个很复杂的过程,许多不同类型的基因共同作用参与调节茎秆机械强度。Xiong等[27]和Hirano等[17]采用不同材料发现BC3基因,该基因编码一个经典的发动蛋白家族成员,启动子GUS分析表明该基因的表达和次生壁的形成是直接相关的。bc16基因和bc3基因均来源于Os02g0738900基因,两者在结构和功能上存在不少异同点,如两个基因都能引起水稻茎秆、叶片、根变脆、植株变矮、主根长缩短、厚壁组织次生细胞壁和薄壁细胞初生壁变薄等。但两者之间的差异也非常明显:一是两个基因发生突变的位置不同,bc3基因第3内含子缺失了156个核苷酸,而bc16基因是在第13内含子近末端发生了T→A的置换(图4);二是bc3基因只能使细胞壁纤维素含量降低,而bc16基因不仅可使纤维素含量降低,还能使半纤维素含量明显升高。
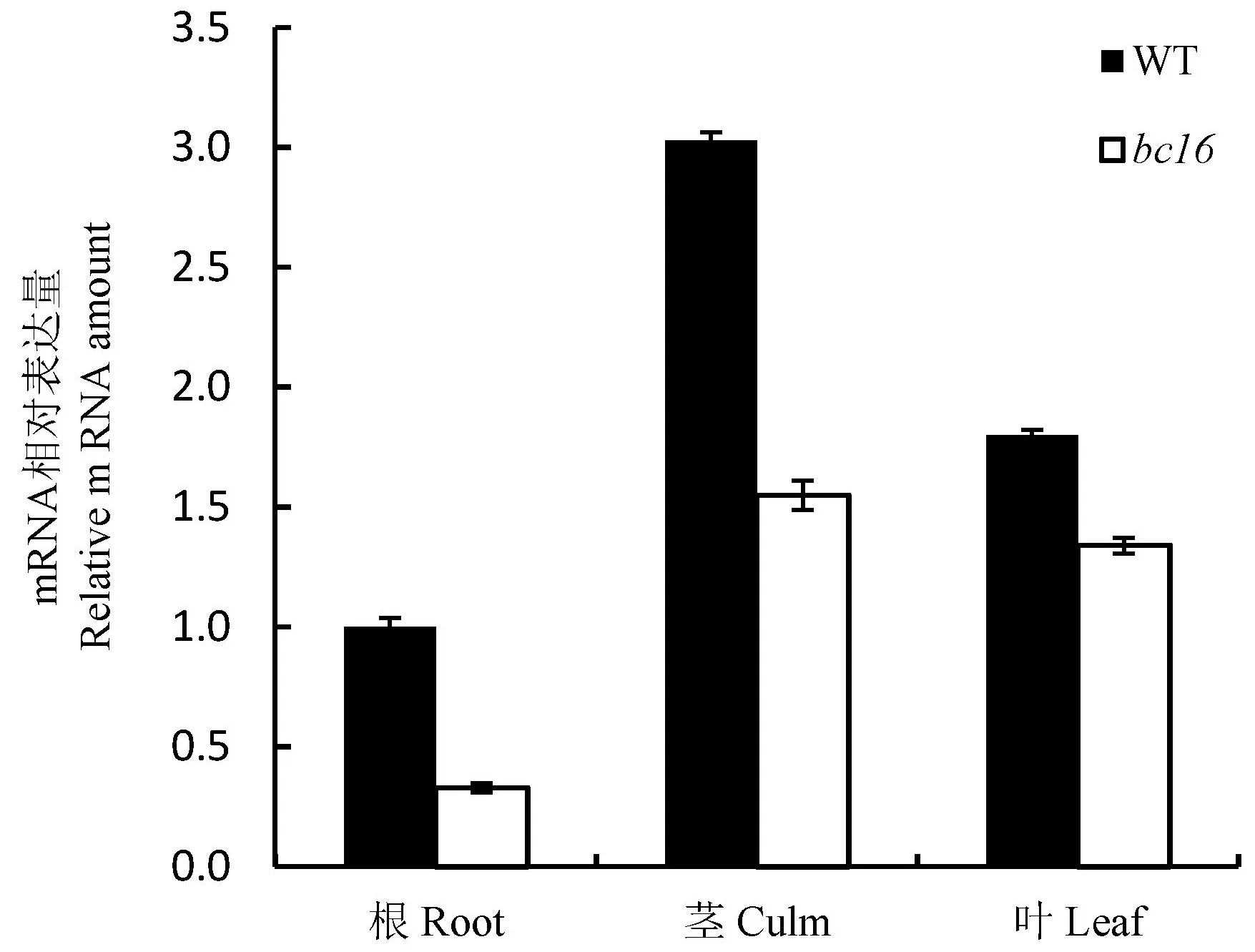
图5bc16(Os02g0738900)基因在水稻不同组织的表达情况
Fig. 5. Expression analysis of the bc16 (Os02g0738900) gene in different tissues of rice.
发动蛋白与发动蛋白相关蛋白(DRPs)是一类大的GTP酶,与细胞壁的合成紧密相关。该类蛋白不仅存在于细胞膜和囊泡中,而且还存在于反面囊膜网中[17]。除了纤维素和胼底质外,细胞壁绝大部分成分如半纤维素等是由高尔基体装配和运输到细胞外。半纤维素由位于高尔基体膜上的糖基转移酶合成[28]。糖基转移酶是专门负责催化糖基化反应的酶类,主要包括GT-A和GT-B两类,它们将活性糖基从糖基供体转移到糖基受体,形成糖苷键。核苷酸糖是糖基供体最主要的化合物,包括 UDP-葡萄糖、UDP-半乳糖、UDP-木糖和UDP-葡萄糖醛酸[29]。水稻OsDRP2B蛋白由位于N端的GTPase结构域、保守的中间结构域、PH结构域、PR结构域和C端GED结构域五部分组成。王海峰[30]认为具有多个结构域的基因产生的不同剪切体形成的是有功能的蛋白。体外生化实验研究表明OsDRP2B蛋白N端GTPase结构域可以结合和水解GTP[27]。就bc16突变体而言,由于其翻译的蛋白具有完整的GTPase结构域,在体内纤维素含量合成量不足的诱导下,其水解GTP形成的GDP可作为合成核苷酸糖的底物,生成的核苷酸糖从而可以产生更多的半纤维素。Kotake等[19]认为水稻茎秆在纤维素含量降低的情况下,植株体内可能存在的某种机制会使半纤维素含量升高,从而补偿纤维素含量降低对植株生活能力的不利影响。虽然不少水稻脆秆突变体细胞壁纤维素含量显著降低,但并非所有突变体半纤维素含量都升高。这表明这种补偿机制的发生需要一定的条件。核苷酸糖可能是诱发这种机制的一种重要的物质。bc16突变体半纤维素含量升高也可能是由于诱发了这种机制导致的。虽然bc3和bc16基因翻译的蛋白功能缺失,但bc16基因翻译的蛋白具有完整的GTPase。这可能是bc16突变体半纤维素含量升高而bc3突变体半纤维素保持不变的原因。
目前,对于植物次生细胞壁在茎秆机械强度的研究相对较多,而初生细胞壁在茎秆机械强度发挥的作用,相关研究还比较缺乏。Didi等[31]发现虽然厚壁组织主要决定茎秆机械强度,初生细胞壁也可以为植物提供机械支撑功能。目前水稻中发现的脆性基因绝大部分都会使厚壁组织次生细胞壁变薄,而本研究发现的突变体bc16除了使厚壁组织次生细胞壁变薄外,薄壁细胞壁同时出现了变薄的现象(图3-G、3-H),这说明bc16基因不仅可以调控厚壁组织次生细胞壁的合成,还能影响薄壁细胞壁的合成。虽然薄壁细胞在植物机械支撑方面的作用不如厚壁组织那么明显,但由于薄壁组织细胞数目多且分布广,其在影响机械强度的作用方面也不容忽视。目前在水稻中发现的脆性突变体和野生型薄壁细胞大多没有什么变化,因此突变体bc16可能是一个深入研究薄壁细胞壁机械强度的好材料。
脆秆水稻由于具有独特的机械特性和细胞壁组成,可用于抗倒伏品种和稻饲两用特种稻的选育[32]。一方面,脆秆水稻由于细胞壁主要成分如纤维素、半纤维素、木质素含量改变,使脆秆水稻抗倒伏能力变弱。通过研究水稻脆性基因的功能,可以了解水稻茎秆强度增加的分子机理,为培育抗倒伏新品种提供理论依据和基础材料。另一方面常规品种水稻秸秆不易断裂,会影响口感,牲畜不喜食,应用于饲料加工中有一定的困难,但是脆秆水稻的粗纤维含量高,牲畜饲用口感相对较好,具有良好的饲料利用前景。汪海峰等[33]将脆秆全株水稻应用到生长肥育猪日粮的试验中,发现饲喂含16%脆秆全株水稻日粮补饲大豆油替代玉米,对猪的生长性能没有显著影响,并且可显著提高胴体中不饱和脂肪酸含量和促进猪肠道中乳酸菌的增生。吕宗友等[34]通过比较脆秆全株水稻和中花11在瘤胃内的降解特性,认为全株脆秆水稻可作为优质饲料稻的选育中间材料。生物能源是利用生物质为原料生产的能源,包括生物乙醇、生物柴油、生物氢气、生物沼气等能源产品[35]。木质纤维素是潜在的低成本、可再生的生物质原料,可以经水解发酵产生生物乙醇[36]。木质纤维素是经过人工处理获得的有机絮状纤维物质,主要由纤维素(约占1/3~1/2)、半纤维素(1/4~1/3)和木质素(1/5~1/4)组成,其中纤维素和半纤维素可经过糖化和发酵生成乙醇,而木质素则不能[37]。我国木质纤维素资源非常丰富,其原料来源广泛,如农作物秸秆、木本植物、芒草等,但多数没有被很好的利用。我国每年农业生产可产生大约7亿t秸秆,利用秸秆生产纤维乙醇不仅有利于环境的保护,而且对于能源安全具有重要的战略意义[38]。杨涛等[39]利用二级串联式生物反应器,使水稻纤维素发酵40 h,可获得乙醇浓度达到25.5g/L,纤维素转对乙醇的转化率达到43%。脆性水稻秸秆由于具有易粉碎、纤维素含量少、容易厌氧降解等特点,在生物乙醇生产上具有一定的优势。黄峰等[40]利用脆秆水稻生产乙醇,经过葡萄糖、酸处理后,每1 g脆性秸秆总还原糖含量[(541.2±8.0)mg]比普通水稻秸秆高41.9 mg,采用EscherichiacoliSZ470处理72 h,脆性秸秆乙醇产量为(10.9±0.4) g/L,是普通秸秆的1.1倍。刘晨娟[41]利用白腐菌6号预处理的材料进行同步糖化发酵,在接种量为5%,发酵温度为40℃,纤维素酶添加量为20 FPU/g的条件下发酵48h,结果使处理后的脆性秸秆发酵乙醇产量比未处理的脆性秸秆提高了1.51倍,而传统水稻秸秆产量仅提高0.81倍。洪解放等[42]认为,充分利用木质纤维素中半纤维素,有望使纤维乙醇在原有基础上产量提高25%。Wen等[43]研究发现复合菌系WSD-5对半纤维素具有高效的酶解能力,其酶解转化率与半纤维素含量呈显著的正相关关系。这表明,利用脆性水稻秸秆生产生物乙醇具有较大的研究价值和利用情景。本研究发现的脆秆突变体bc16是来源于粳稻日本晴的突变体,纤维素含量降低,半纤维素含量显著升高,可应用于水稻秸秆转化生物乙醇研究。
参考文献:
[1]饶玉春, 李越, 董国军, 等. 水稻抗倒伏研究进展. 中国稻米, 2009, 15(6): 15-18.
Rao Y C, Li Y, Dong G J, et al. The research development of rice lodging-resistant.ChinaRice, 2009, 15(6): 15-18. (in Chinese with English abstract)
[2]陈曦, 郝怀庆, 彭励. 植物细胞壁中纤维素合成的研究进展. 热带亚热带植物学报, 2011, 19 (3): 283-290.
Chen X, Hao H Q, Peng L. Recent progress on cellulose synthesis in cell wall of plants.JTropSubtropBot, 2011, 19(3): 283-290. (in Chinese with English abstract)
[3]宋东亮, 沈君辉, 李来庚. 高等植物细胞壁中纤维素的合成. 植物生理学通讯, 2008, 44(4): 791-796.
Song D L, Shen J H, Li L G. Cellulose synthesis in the cell walls of higher plants.PlantPhysiolComm, 2008, 44(4): 791-796. (in Chinese with English abstract)
[4]Xu J D, Zhang Q F, Zhang T, et al. Phenotypic characterization, genetic analysis and gene-mapping for a brittle mutant in rice.JIntegrPlantBiol, 2008, 50(3): 319-328.
[5]Tsutomu A, Toshihisa K, Yasuko K, et al. Rice Brittle CULM 5(BRITTLE NODE) is involved in secondary cell wall formation in the sclerenchyma tissue of nodes.PlantCellPhysiol, 2009, 50(11): 1886-1897.
[6]Hao Z Y, Mohnen D. A review of xylan and lignin biosynthesis: Foundation for studyingArabidopsisirregular xylem mutants with pleiotropic phenotypes.CriticRevBiochemMolBiol, 2014, 49(3): 212-241.
[7]Kokubo A, Kuraishi S, Sakurai N. Culm strength of barley-correlation among maximum bending stress, cell wall dimensions and cellulose content.PlantPhysiol, 1989, 91(3): 876-882.
[8]Kokubo A, Sakurai N, Kuraishi S, et al. Culm brittleness of barley (HordeumVulgareL.) mutants is caused by smaller number of cellulose molecules in cell wall.PlantPhysiol, 1991, 97(2): 509-514.
[9]Ansari M J, Kumar R, Singh K, et al. Characterization and molecular mapping of EMS-induced brittle culm mutants of diploid wheat (TriticummonococcumL.).Euphytica, 2012, 186(1): 165-176.
[10]Javed Ansari M, AI-Ghamdi A, Usmani S, et al. Characterization and gene mapping of a brittle culm mutant of diploid wheat (TriticummonococcumL.).ActaPhysiolPlant, 2013, 35(8): 2407-2419.
[11]李文丽, 吴先军. 一个水稻脆性突变体的遗传分析和基因定位. 核农学报, 2006, 20(6): 500-502.
Li W L, Wu X J. Genetic analysis and gene mapping of a fragile rice mutant.JNuclAgricSci, 2006(6): 500-502. (in Chinese with English abstract)
[12]刘斌美, 叶亚峰, 章忠贵, 等. 一个籼稻脆性突变体的生物学特性及基因定位研究. 植物遗传资源学报, 2011, 12(5): 259-264.
Liu F M, Ye Y F, Zhang Z G, et al.Characterizations and gene mapping of a brittle culm and leaf mutant in indica rice.JPlantGenetResour, 2011, 12(5): 259-264. (in Chinese with English abstract)
[13]王川丽, 王令强, 牟同敏. 水稻脆性突变体nbc(t)的主要特性和脆性基因的初步定位. 华中农业大学学报, 2012, 31(2): 159-164.
Wang C L, Wang L Q, Mou T M. The main characteristics of brittle rice mutantnbc(t) and gene primary mapping.JHuazhongAgricUniv, 2012, 31(2): 159-164. (in Chinese with English abstract)
[14]桑贤春, 杜川, 王晓雯, 等. 水稻矮秆脆秆突变体dbc1的鉴定与基因定位. 作物学报, 2013, 39(4): 626-631.
San X C, Du C, Wang X W, et al. Identification and gene mapping of dwarf and brittle culm mutantdbc1 inOryzasativa.ActaAgronSin, 2013, 39(4): 626-631. (in Chinese with English abstract)
[15]童川, 童杰鹏, 孙出, 等. 水稻脆性基因的功能研究进展. 分子植物育种, 2013, 11(2): 286-292.
Tong C, Tong J P, Sun C, et al. Reseach progress on functions of brittle culm genes in rice.MolPlantBreed, 2013, 11(2): 286-292. (in Chinese with English abstract)
[16]Li Y H, Qian Q, Zhou Y H, et al.BRITTLECULM1, which encodes a COBRA-like protein, affects tthe mechanical properties of rice plants .PlantCell, 2003, 15(9): 2020-2031.
[17]Hirano K, Kotake T, Kamihara K, et al. RiceBRITTLECULM3(BC3) encodes a classical dynamin OsDRP2B essential for proper secondary cell wall synthesis.Planta, 2010, 232(1): 95-108.
[18]Zhang B C, Zhou Y H. Rice brittleness mutants: A way to open the “Black Box” of monocot cell wall biosynthesis.PlantBiol, 2010, 53(2): 136-142.
[19]Kotake T, Aohara T, Hirano K, et al. Rice brittle culm 6 encodes a dominant-negative form of CesA protein that perturbs cellulose synthesis in secondary cell walls.JExperBot, 2011, 62(6): 2053-2062.
[20]Yan C J, Yang S, Zeng X H, et al. Fine mapping and isolation ofBc7(t), allelic to OsCesA4. J Genet Genom, 2007, 34(11): 1019-1027.
[21]Zhang M, Zhang B C, Qian Q, et al. Brittle Culm 12, a dual-targeting kinesin-4 protein, controls cell-cycle progression and wall properties in rice.PlantJ, 2010, 63(2): 312-328.
[22]Zhang B C, Liu X L, Qian Qian, et al. Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice. P N A, 2011, 108(12): 5110-5115.
[23]Wu B, Zhang B C, Dai Y, et al. Brittle Culm15 encodes a membrane-associated chitinase-like protein required for cellulose biosynthesis in rice. Plant Physiology, 2012, 159(4): 1440-1452.
[24]Van Soest PJ, Robertson J B, Lewis B A. Methods for dietary Fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition.JDailySci, 1991, 74(10): 3583-3597.
[25]Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: A rapid method to detect makers in specific genomic regions by using segregating population. PNAS, 1991, 88(21): 9828-9832.
[26]Liao L, Shi C H, Zeng D D, et al. Morphogenesis and molecular basis on the unclosed glumes, a novel mutation related to the floral organ of rice.PlantMolBiolRep, 2014, 33(3): 1-10.
[27]Xiong G Y, Li R, Qian Q, et al. The rice dynamin-related protein DRP2B mediates membrane trafficking, and thereby plays a critical role in secondary cell wall cellulose biosynthesis.PlantJ, 2010, 64(1): 56-70
[28]Henri K Vibe S, Peter U. Hemicelluloses.AnnRevPlantBiol, 2010, 61(4): 263-289.
[29]田鹏,刘占林.糖基转移酶超家族.生命的化学, 2011, 31(5): 732-736.
Tian P, Liu Z L. Glycosyl transferase superfamily. Chemistry of Life, 2011, 31(5): 732-736. (in Chinese with English abstract)
[30]王海峰. 利用高通量测序技术研究基因组复制与关系以及可变剪切.上海: 复旦大学, 2014.
Wang H F. Analyses of genome duplication and relationships and alternative splicing using high throughput sequencing technology.Shang Hai: Fudan University, 2014. (in Chinese with English abstract)
[31]Vojtěch Didi, Phil Jackson, Jan Hejátko. Hormonal regulation of secondary cell wall formation.JExperBot, 2015, 66(16): 5015-5027.
[32]张水金, 郑轶, 朱永生, 等. 水稻脆性突变体研究进展. 福建农业学报, 2011, 26(5): 895-898.
Zhang S J, Zheng Z, Zhu Y S, et al. Advance in research on brittleness mutant of rice.FujianJAgricuSci, 2011, 26(5): 895-898. (in Chinese with English abstract)
[33]彭应财, 甘朝洪, 王鹤潼, 等. 显性脆秆水稻不育系中脆A的选育. 杂交水稻, 2010, 25(4): 9-13.
Peng Y C, Gan C H, Wang H T, et al. Breeding of dominant brittle culm CMS line Zhongcui A in rice.HybridRice, 2010, 25(4): 9-13. (in Chinese with English abstract)
[34]吕宗友, 苏衍菁, 赵国琪, 等. 全株脆性水稻在奶牛瘤胃内降解特性的研究.中国奶牛, 2011, 18(4): 7-11.
Lu Z Y, Su Y J, Zhao G Q, et al. The research of degradation characteristics of whole brittle rice in cattle remen.ChinaDairyCattle, 2011, 18(4): 7-11. (in Chinese with English abstract)
[35]蔡小艳, 赖志强, 易显凤, 等. 生物能源的利用现状及发展方向: 能源草产业发展战略暨学术研讨会, 南宁, 2014.
Wang X Y, Lai Z Q, Yi X F, et al. The recent application and development direction of bioenergy. Energy of Grass industry development strategy & Academic conference, Nanning, GuangXi, 2014. (in Chinese with English abstract)
[36]Gomez L D, Steele-King C G, Mcqueen-Mason S J.Sustainable liquid bio-fuels from biomass: The writing's on the walls.NewPhytol, 2008, 178(3): 473-485
[37]陈介南. 木质纤维生物转化乙醇技术. 生物质化学工程, 2006, 40(12): 69-77.
Chen J N. Bioconversion of lignocelluloses to ethanol.BiomassChemEngine, 2006, 40(12): 69-77. (in Chinese with English abstract)
[38]姚秀清,张全. 植物纤维原料发酵生产燃料乙醇研究进展. 可再生能源, 2011,29(2): 59-63.
Yao X Q, Zhang Q. Status of fuel ethanol production by fermentation of vegetable cellulosic material.RenewEnerResour, 2011, 29(2): 59-63. (in Chinese with English abstract)
[39]杨涛. 水稻秸秆纤维素发酵转化燃料乙醇的研究. 长沙: 湖南农业大学, 2008.
Yang T. Studies on the production of the fuel ethanol by the fermentation of rice straw cellulose. Changsha: Hunan Agricultural University, 2008. (in Chinese with English abstract)
[40]黄峰, 王永泽, 周胜德, 等. 水稻脆性秸秆发酵产纤维乙醇的研究. 可再生能源, 2014, 32(2): 211-215.
Huang F, Wang Y Z, Zhou S D, et al. Study on cellulosic ethanol fermentation of brittle rice straw.RenewEnerResour, 2014, 32(2): 211-215. (in Chinese with English abstract)
[41]刘晨露. 脆性水稻秸秆的生物预处理和发酵. 武汉: 华中农业大学, 2010.
Liu C L. The biological pretreatment of brittle rice straw and its fermentation. Wuhan: HuaZhong Agricultural University, 2010. (in Chinese with English abstract)
[42]洪解放, 张敏华, 刘成, 等. 代谢木糖生产乙醇的基因工程菌研究进展. 食品与发酵工业, 2005, 31(1): 114-118.
Hong J F, Zhang M H, Liu C, et al. Progress in metabolic engineering of xylose-utilizing recombinant strains to produce ethanol. food fermen Indus, 2005, 31(1): 114-118. (in Chinese with English abstract)
[43]Wen B T, Yuan X F, Cao Y Z, et al. Optimization of liquid fermentation of microbial consortium WSD-5 followed by saccharification and acidification of wheat straw.BioresourTechnol, 2012, 118: 141-149.
收稿日期:2015-12-14; 修改稿收到日期: 2016-02-26。
基金项目:国家科技支撑计划资助项目(2011BAD35B02);浙江省科技厅水稻产业科技创新服务平台;高等学校学科创新引智计划资助项目(Grant B14027);浙江省重大科技攻关专项(2012C12901-2);教育部创新团队资助项目(IRT1185)。
中图分类号:Q343.5; Q754
文献标识码:A
文章编号:1001-7216(2016)04-0345-11
Identification and Gene Fine Mapping of aBrittleCulm16 (bc16) Mutant in Rice
SHU Ya-zhou, ZENG Dong-dong, QIN Ran, JIN Xiao-li, ZHENG Xi, SHI Chun-hai*
(CollegeofAgricultureandBiotechnology,ZhejiangUniversity,Hangzhou310058,China;*Corresponding author, E-mail: chhshi@zju.edu.cn)
Abstract:Brittle culm mutants are one of the important materials to study plant mechanical strength. A brittle culm mutant named as bc16 (brittle culm 16) was isolated from Nipponbare through EMS (Ethyl Methane Sulphonate) treatment. Compared with wild type, bc16 featured fragile and easily broken stems,leaves,roots, lower plant height and filled grains per panicle, shorter panicle length and main root length. The components analysis of stem cell wall showed that the cellulose content in bc16 mutant was sharply decreased, while hemi-cellulose content was evidently increased and no significant difference had been found in the lignin content between bc16 mutant and wild type. The cell shape and arrangement of parenchyma cells in bc16mutant became irregular and disordered. Moreover, the parenchyma cell walls and the secondary cell walls of sclerenchyma cells in bc16 mutant under the epidermis layer were thinner than those in wild type. The results of genetic analysis revealed that the mutant trait was controlled by a single recessive gene, which was mapped in a 66.6-kb region between InDel (insertion-deletion) markers 2-F and 2-H on chromosome 2 with 7 candidate genes. Among these genes, Os02g0738900, which is allelic to BC3 gene, was specially focused on. There was a T to A substitution at the very end of the 13th intron of Os02g0738900 which was at the 5113thbase location from initiation codon by sequencing, which led an splicing forward mutation in the process of transcription, and six nucleotides were cut into mRNA as a result, which finally cause the stop of translation. Additionally, in the mutant, there were significant decrease in the expression of bc16 gene in roots, culms and leaves by real-time PCR method. The bc16 might affect the synthesis of sclerenchyma secondary cell wall and parenchyma primary cells wall, which could affect the mechanical strength of rice stem.
Key words:rice; brittle culm; gene mapping; cell wall synthesis
