嗜热裂孢菌木聚糖酶在毕赤酵母中的表达及酶学性质
2016-08-08卢桂义邬敏辰黄卫宁CourtinChristopher
卢桂义,邬敏辰,黄卫宁*,张 峦,李 宁,Courtin Christopher
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡214122;3.南京百合贝可生物科技有限公司,江苏南京210000)
嗜热裂孢菌木聚糖酶在毕赤酵母中的表达及酶学性质
卢桂义1,邬敏辰2,黄卫宁1*,张峦3,李宁3,Courtin Christopher3
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡214122;3.南京百合贝可生物科技有限公司,江苏南京210000)
将优化后的来自嗜热裂孢菌的木聚糖酶基因在毕赤酵母中进行异源表达并分析了其表达产物的酶学性质。对来源于嗜热裂孢菌的木聚糖酶基因催化域进行密码子优化,人工合成优化后的木聚糖酶成熟肽基因xyl11M,构建重组表达质粒pPIC9K-xyl11M,将其经SalⅠ线性化后电击转化毕赤酵母GS115,经G418筛选得到重组工程菌GS115/xyl11M,甲醇诱导表达重组蛋白。表达的重组蛋白reXyl11M经SDS-PAGE分析,其相对分子质量约34 000,酶活性可达到105.3 U/mL,最适反应温度为70℃,并在30~75℃温度内较稳定;最适反应pH为6.0,在pH 6.5~7.5范围内稳定;Co2+、Ba2+、Cu2+、Li+对酶活性有强烈的激活作用,Fe3+有明显的抑制作用,其它金属离子及EDTA对reXyl11M酶活性影响不大。结果表明xyl11M成功在毕赤酵母GS115中实现表达,且reXyl11M的酶学特性优良。
耐热木聚糖酶;毕赤酵母;合成基因;基因表达;酶学性质
利用生物技术提高面包品质及延长货架期有着重要的意义。大量研究表明,添加适量木聚糖酶能够提高面团的操作性能及改善产品的营养与品质,如提高面团的弹性、机械操作性及稳定性,增加面包的比容,改善面包瓤的组织结构,降低面包的硬度,延长面包的货架期等[1-3]。
木聚糖酶 (Xylanase)是指能专一降解半纤维素木聚糖为低聚木糖和木糖的一组酶的总称,主要包括三类:1)β-1,4-D-内切木聚糖酶(EC 3.2.1.8),从木聚糖主链的内部切割β-1,4-糖苷键,使木聚糖溶液的粘度迅速降低;2)β-1,4-D-外切木聚糖酶(EC 3.2.1.92),以单个木糖为切割单位作用于木聚糖的非还原性末端,使反应体系的还原性不断增加;3)β-木糖苷酶(EC 3.2.1.37),切割低聚木糖和木二糖,有助于木聚糖彻底降解为木糖。通过酶分子一级结构的序列比对和疏水簇分析,大多数木聚糖酶属于糖苷水解酶10和11家族[4]。
目前,已经有来源于黑曲霉[5]、枯草芽孢杆菌[6]、绵毛嗜热丝孢菌[7]等微生物的木聚糖酶应用于面包中,但其均属于中温木聚糖酶,在面包烘焙阶段便迅速失活。xyl11(GenBank登录号:AY795559)是从Thermobifide fusca NTU22基因文库中筛选出的表达木聚糖酶活性最高的基因,表达的木聚糖酶在70℃保温3 h,残余酶活仍保留70%,表观相对分子质量为36 000。但该基因编码区由1 014个碱基对组成,编码338个氨基酸[8],包含一个不具木聚糖酶活性的纤维素结合结构域,取xyl11的催化域基因(586 bp)在Pichia pastoris GS115中进行表达。由于它来源于细菌,其密码子偏好性与毕赤酵母有较大差异,于是对该耐热基因中的稀有密码子进行优化,有效提高外源蛋白质的表达量[9],并且该基因命名为xyl11M。人工合成xyl11M后克隆至pMD19-T质粒,构建重组克隆质粒pMD19-T-xyl11M和重组表达质粒pPIC9K-xyl11M,实现重组木聚糖酶reXyl11M在P.pastoris GS115中的表达,并分析reXyl11M的酶学性质。
1材料与方法
1.1菌株和质粒
E.coli JM 109、E.coli DH5α为克隆宿主菌,P.Pastoris GS115为表达宿主菌,pPIC9K为真核表达质粒:均由江南大学无锡医学院分子生物学研究室保存。
1.2工具酶和主要试剂
各种限制性内切酶、rTaq DNA聚合酶、T4 DNA连接酶、250 bp DNA Ladder Marker和低相对分子质量蛋白质Marker:大连TaKaRa公司;YNB、生物素、酵母提取物、蛋白胨、G418、Tryptone:上海Sangon公司;标准木糖、桦木木聚糖:Sigma公司;SnCl2、CaCl2、FeCl3、FeCl2、CoCl2、LiCl2、ZnCl2、NaCl、MgCl2、MnCl2、EDTA:国药集团化学试剂有限公司;其他试剂均为国产或进口分析纯。
1.3培养基
LB、YPD、MD、BMGY、BMMY培养基的配制参考Multi-Copy Pichia Expression Kit(Invitrogen公司)操作手册。
1.4重组克隆质粒的构建
对照毕赤酵母密码子偏好性表xyl11中的稀有密码子进行优化,并在基因两端分别加入EcoRⅠ、NotⅠ酶切位点,该基因命名为xyl11M,合成后克隆至pMD19-T质粒,转化感受态E.coli JM 109细胞,经蓝白斑筛选和PCR鉴定筛选阳性克隆,送上海Sangon公司测序,鉴定正确的重组克隆质粒命名为pMD19-T-xyl11M。
1.5重组表达质粒的构建
将测序验证正确的 pMD19-T-xyl11M和pPIC9K质粒同时用EcoRⅠ和NotⅠ双酶切,割胶回收目的基因xyl11M和pPIC9K质粒片段,具体操作参见EZ-10 Spin Column DNA Gel Extraction Kit说明书。用T4 DNA连接酶16℃连接4 h,转化E.coli DH5α感受态细胞,经通用引物(5'-AOX和3'-AOX)PCR筛选鉴定后,测序正确的重组质粒命名为pPIC9K-xyl11M。
1.6重组P.pastoris GS115的筛选及诱导表达
pPIC9K和重组表达质粒pPIC9K-xyl11M经SalⅠ酶切线性化后,用电穿孔法导入GS115中,涂布MD平板上筛选重组子;将MD平板上生长良好的菌落用牙签点种至含0.5、1.0、2.0 mg/mL G418的YPD平板上,筛选抗2.0 mg/mL G418的毕赤酵母重组子,分别命名为GS115/9K和GS115/xyl11M;参照《分子克隆实验指南》的方法提取重组GS115基因组DNA,利用通用引物5'-AOX和3'-AOX PCR鉴定目的基因是否整合GS115基因组内。GS115/9K和GS115/xyl11M的常规诱导表达参照 Multi-Copy Pichia Expression Kit操作手册。
1.7重组木聚糖酶的活性测定与SDS-PAGE分析
木聚糖酶酶活测定采用改良的DNS试剂法[10]:移取2.4 mL 0.5 g/dL桦木木聚糖溶液 (0.2 mol/L,pH 4.6磷酸盐缓冲液配制)于25 mL具塞管中,40℃保温10 min,加入0.1 mL适当稀释的酶液,准确反应10 min后煮沸7 min终止反应,用可见分光光度计在540 nm下测定其OD值。酶活定义为:在此测定的条件下,每分钟释放1 μmol还原糖所需的酶量定义为1个酶活单位(U)。采用SDS-PAGE对表达产物进行分析,确定其表观相对分子质量。用在线软件ProtParam(http://web.expasy.org/ protparam)预测重组蛋白质的理论相对分子质量。用在线软件 NetNGlyc1.0(http://www.cbs.dtu.dk/ services/NetNGlyc/)和NetOGlyc4.0(http://www.cbs. dtu.dk/services/NetOGlyc/)预测N-和O-糖基化位点。
1.8reXyl11M酶学性质的测定
1.8.1reXyl11M的最适温度及温度稳定性按照1.7的测定方法,在30~100℃下每隔5℃测定reXyl11M的酶活,以酶活性最高者为100%,作温度-相对酶活性曲线;将酶液于不同温度下保温1 h后,测定残余酶活性,以未经保温酶液的酶活性为100%,作温度-相对酶活性曲线。当残余酶活性达到85%以上,即定义为稳定。
1.8.2reXyl11M的最适pH及pH稳定性按照1.7的方法在最适温度下分别测定木聚糖酶在不同pH值(4.0~9.0)下的酶活性。以酶活性最高者为100%,作pH-相对酶活性曲线;将酶在不同的pH值条件下于40℃保温1 h,测定残余酶活性,以酶活性最高者为100%,作pH-相对酶活性曲线。当残余酶活达到85%以上,即定义为稳定。反应所用的缓冲液为0.1 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH 4.0~8.0)和0.05 mol/L甘氨酸-氢氧化纳缓冲液(pH 8.0~9.0)。
1.8.3金属离子和EDTA对reXyl11M酶活性的影响向重组木聚糖酶酶液中分别加入SnCl2、CaCl2、FeCl3、FeCl2、CoCl2、LiCl2、ZnCl2、NaCl、MgCl2、MnCl2、EDTA等至终浓度为2 mmol/L,40℃保温 1 h,按1.7的方法在最适温度和pH值下测定残余酶活性,以不加金属离子和EDTA时所测的酶活性定义为100%。
2结果与讨论
2.1pPIC9K-xyl11M的构建
质粒pMD19-T-xyl11M的双酶切 (EcoRⅠ/NotⅠ)产物经1 g/dL琼脂糖凝胶电泳分析,可见约600 bp和3 000 bp的特异性条带,分别为目的基因xyl11M和线性化的pMD19-T,见图1。将xyl11M与经同样双酶切的质粒pPIC9K割胶回收并连接,转化E.coli DH5α感受态细胞中,经通用引物鉴定后,送上海Sangon公司测序,结果显示测序结果与预期相符。测序基因长586 bp,与xyl11M同源性达到100%。测序正确的重组质粒命名为pPIC9K-xyl11M。
2.2重组毕赤酵母GS115的构建及鉴定
提取重组毕氏酵母GS115/xyl11M基因组进行PCR扩增鉴定,PCR产物经1.0 g/dL琼脂糖凝胶电泳分析,见图2。GS115/xyl11M的PCR产物在约1 100 bp和2 100 bp处可见两条清晰的条带 (图2泳道2-5),2 100 bp的产物为GS115本身的AOX1基因,1 100 bp的产物包括约为600 bp的目的基因(586 bp)和500 bp pPIC9K质粒上的5'-AOX和3'-AOX引物序列之间的片段,而对照组GS115/9K PCR产物的两条条带大小分别约为 500 bp和2 100 bp(图2泳道1),表明reXyl11M已整合入毕赤酵母GS115基因组内。从PCR验证正确的重组毕赤酵母中随机挑取 4株重组毕赤酵母GS115/ xyl11M-1、-2、-3、-4和1株毕赤酵母GS115进行诱导表达。

图1 质粒pMD19-T-xyl11M的双酶切电泳图Fig.1 Double digestionof pMD19-T-xyl11M

图2 毕赤酵母重组子基因组PCR验证Fig.2 Verification of P.pastoris transformants by PCR
2.3重组蛋白的表达与鉴定
重组毕赤酵母经诱导表达后,8 000 r/min离心10 min后收集发酵上清液,取上清液按照1.7的方法测定木聚糖酶活性。结果表明,GS115/xyl11M发酵上清液木聚糖酶酶活性最高可达到105.3 U/mL,而GS115/9K并未检测到木聚糖酶活性。SDS-PAGE结果见图3。GS115/xyl11M的表达产物在相对分子质量34 000处有一条明显的蛋白质条带 (图3泳道1-2),而对照GS115/9K在该处无条带 (图3泳道3)。reXyl11M相对分子质量比前期预测的理论相对分子质量大 (24 845),分析其原因可能是由于reXyl11M氨基酸序列在酵母GS115表达过程中发生了糖基化修饰[11]。用在线软件NetNGlyc1.0(http:// www.cbs.dtu.dk/services/NetNGlyc/)和 NetOGlyc4.0 (http://www.cbs.dtu.dk/services/NetOGlyc/)分别对N-糖基化位点及O-糖基化位点进行预测,结果表明xyl11M氨基酸序列中含有3个N-糖基化位点和1个O-糖基化位点。
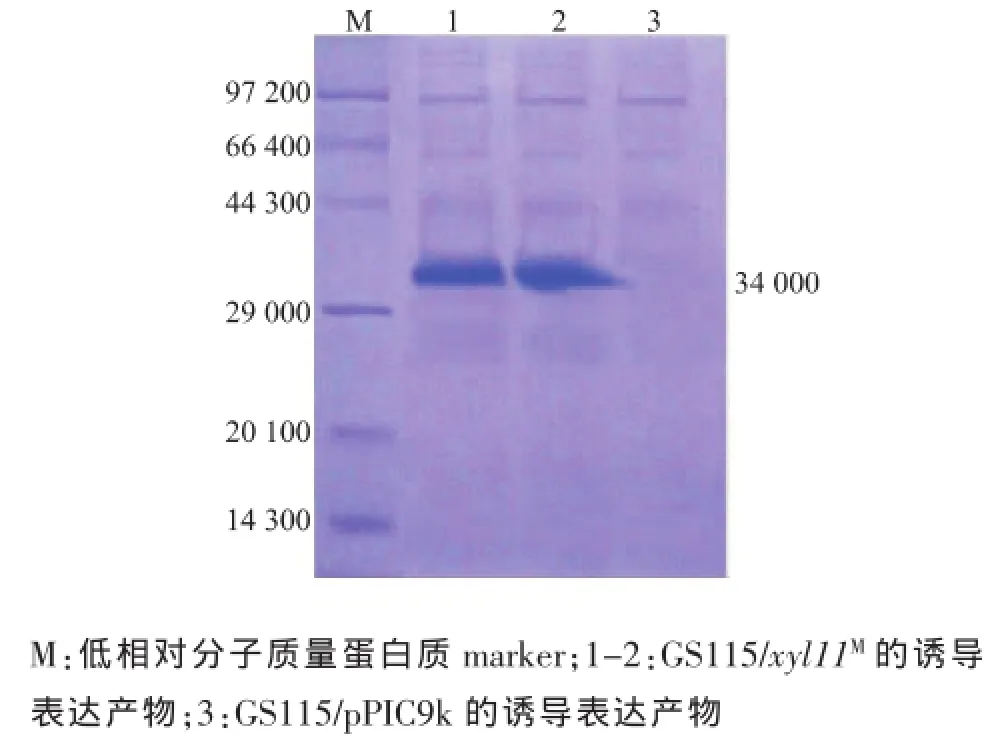
图3reXyl11M的SDS-PAGE分析Fig.3 SDS-PAGE analysis of reXyl11M
2.4reXyl11M的酶学性质分析
2.4.1酶的最适反应温度及热稳定性在50~80℃范围内,reXyl11M酶活性较高,相对酶活性可达95%以上,其中最适反应温度为70℃;reXyl11M在50~75℃范围内残余酶活性在85%以上。在75℃保存1 h后,酶活性仅损失4.62%。说明该酶的热稳定性好,在高温下可保持稳定,见图4。

图4 温度对reXyl11M酶活性的影响Fig.4 Effect of temperature on the activity of the reXyl11M
2.4.2酶的最适pH及pH稳定性在不同pH值下进行酶活性检测,结果见图5。该酶的最适反应pH为6.0,pH在5.5~6.5范围内相对酶活性均在99%以上,在当pH>7.5时,酶活性下降较快,但相对酶活性仍在50%以上;该重组酶在pH 6.5~7.5范围内稳定,当pH值低于6.5或高于7.5时,该酶的稳定性较差,残余酶活性在55%~83%之间。可见该酶为中性木聚糖酶,适用于烘焙产品。

图5 pH对reXyl11M酶活性的影响Fig.5 Effect of pH on the activity of the reXyl11M
2.4.3金属离子对酶活性的影响Fe3+对reXyl11M酶活性有明显的抑制作用,使reXyl11M酶活性降低23.7%,Co2+、Ba2+、Cu2+、Li+对酶有强烈的激活作用,分别使reXyl11M酶活性提高54.1%,47.7%,40.5%,36.9%,可能是Co2+、Ba2+、Cu2+、Li+对酶与底物的结合和解离状态有影响,具体机制还有待进一步的研究[17];EDTA和其它离子对reXyl11M酶活性影响不大,见图6。

图6 金属离子和EDTA对reXyl11M酶活性的影响Fig.6 Effects of various metal ions and EDTA on the activity of the reXyl11M
3结语
耐热木聚糖酶有着重要的工业应用价值,通过基因工程技术实现耐热木聚糖酶的异源高效表达是降低其工业应用成本、适应工业应用条件的有效手段。毕赤酵母是一个优良的表达体系,具有操作简便、可高水平地胞外表达、可进行糖基化、二硫键形成等真核翻译后修饰等优点[13]。目前,已经有耐热木聚糖酶基因在毕赤酵母中实现了分泌表达。
作者成功实现了11家族耐热木聚糖酶密码子优化基因xyl11M在P.pastoris GS115中的分泌表达。以桦木木聚糖为底物,reXyl11M酶液的酶活性可达到105.3 U/mL,明显高于其它在毕赤酵母表达的耐热木聚糖酶,如张慧敏等[12]克隆了来自于细菌的耐热木聚糖酶基因Syxyn11,并在P.pastoris GS115中进行了表达,其最高酶活性为 17.74 U/mL;Ghaffar等克隆了来自于Chaetomium thermophilum的耐热木聚糖酶基因xyn11A,在P.pastoris GS115中表达最高酶活性为15.6 U/mL[14];Berrin等[15]将黑曲霉的xynA基因在巴斯德毕赤酵母中表达,分泌量仅为15.6 U/mL;杨梦华等克隆了海栖热袍MSB8菌的XylB基因在P.pastoris中表达,培养液上清液木聚糖酶比活为50 U/mL[16]。经SDS-PAGE分析reXyl11M的表观相对分子质量约为34 000。初步的酶学性质研究表明,该酶的最适反应温度为70℃,并在30~75℃较稳定;最适反应pH为6.0,在pH 6.5~7.5范围内稳定;Co2+、Ba2+、Cu2+、Li+对酶活性有强烈的激活作用;Fe3+有明显的抑制作用,其它金属离子及EDTA对reXyl11M酶活性影响不大。这些优良的酶学特性表明了该酶在烘焙体系以及其他领域具有广泛的应用潜力。
[1]Santala O,Lehtinen P,Nordlund E,et al.Impact of water content on the solubilisation of arabinoxylan during xylanase treatment of wheat bran[J]. Journal of Cereal Science,2011,54(2):187-194.
[2]Caballero P A,Gmez M,Rosell C M.Improvement of dough rheology,bread quality and bread shelflife by enzymes combination [J]. Journal of Food Engineering,2007,81(1):42-53.
[3]Jia C L,Huang W N,Mohamed A S,et al.Dough rheological,mixolab mixing,and nutritional characteristics of almond cookies with and without xylanase[J].Journal of Food Engineering,2011(105):227-232.
[4]Polizeli M L T M,Rizzatti A C S,Monti R,et a1.Xylanases from fungi:properties and industrial applications[J]. Applied Microbiology and Biotechnology,2005(67):577-591.
[5]Courtin C M,Delcour.Arabinoxylans and endoxylanases in wheat flour bread-making[J].Cereal Science,2002(35):225-243.
[6]Courtin C M,Gelders G G,Delcour J A.Use of two endoxylanases with different substrate selectivity for understanding arabinoxylan functionality in wheat flour bread making[J].Cereal Chemistry,2001(5):564-571.
[7]Jiang Z Q,Yang S Q,Tan S S,et al.Characterization of xylanase from the newly isolated thermophilic Thermomyces lanuginosus CAU44 and its application in bread making[J].Letters in Applied Microbiology,2005(41):69-7.
[8]Cheng Y F,Yang C F,Liu W H.Cloning and expression of thermobifida xylanase gene in the methylotrophic yeast Pichia pastoris [J].Enzyme and Microbial Technology,2005(37):541-546.
[9]Jin G Z,Duan Z Y,Zhang L F,et al.Expression of the fusion protein human serumalbum/mutant human interleukin 2C125A in Pichia pastoris[J]. Journal of Food Science and Biotechnology,2010(29):595-601.
[10]Zhou C Y,Bai J Y,Deng S S,et al.Cloning of a xylanase gene from Aspergillus usamii and its expression in Escherichia coli[J]. Bioresource Technology,2008(99):831-838.
[11]Zachary J M,Eugenia M,Wei L,et al.Crystal structure of human inerferon-λ1 in complex with its high-affinity receptor interferon-λR1[J]. Journal of Molecular Biology,2010,404(4):650-664.
[12]张慧敏,李剑芳,邬敏辰,等.耐热木聚糖酶基因在毕赤酵母中的表达及酶学性质[J].食品与生物技术学报,2013,32(2):124-128. ZHANG Huiming,LI Jianfang,WU Mingcheng,et al.Expression of a thermostable xylanase gene in Pichia pastoris and its enzymatic characterization[J]. Journal of Food Science and Biotechnology,2013(32):124-128.(in Chinese)
[13]谌斌,唐雪明,沈微,等.粗糙脉孢菌漆酶基因的克隆及在毕赤酵母中的初步表达[J].食品与生物技术学报,2012,23(4):43-47. CHEN Bin,TANG Xueming,SHEN Wei,et al.Cloning of a laccase gene from Neurospora crassa and it's preliminary expression in Pichia pastoris[J].Journal of Food Science and Biotechnology,2012,23(4):43-47.(in Chinese)
[14]Ghaffar A,Khan S A,Mukhtar Z,et al.Heterologous expression of a gene for thermostable xylanase from Chaetomium thermophilum in Pichia pastoris GS115[J]. Molecular Biology Reports,2011(38):3227-3233.
[15]Berrin J G,Williamson G,Puigserver A,et al.High-level production of recombinant fungal endo-beta-1,4-xylanase in the methylotrophic yeast Pichia pastoris[J].Protein Expression and Purification,2000(1):179-187.
[16]杨梦华,李颖,关国华,等.极端耐热木聚糖酶基因在大肠杆菌和毕赤酵母中的高效表达[J].微生物学报,2005(2):236-240. YANG Menghua,LI Ying,GUAN Guohua,et al.Efficient expression of therostable xylanase gene in E.coli and in Pichia pastoris[J].Acta Microbiologica Sinica,2005(2):236-240.(in Chinese)
[17]邹永龙,桑月婵,彭建新,等.β-l,4-内切木聚糖酶的分离纯化及其性质[J].植物学报,1999,41(11):1212-1216. ZOU Yonglong,SANG Yuechan,PENG Jianxin,et al.Purification and properties of β-1,4-endoxylanase[J].Acta Botanica Sinica,1999(41):1212-1216.(in Chinese)
Expression of A Xylanase from Thermobifide fusca in Pichia pastoris And Its Characterization Analysis
LU Guiyi1,WU Minchen2,HUANG Weining1*,ZHANG Luan2,LI Ning3,Courtin Christopher3
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China;3.Nanjing BaihoBake Biotechnology International,Inc.Nanjing 210000,China)
A codon-optimized mature peptide gene encoding a thermostable xylanase from Thermobifidefusca has been cloned into the expression plasmid pPIC9K and named as pPIC9K-xyl11M.The pPIC9K-xyl11Mwas linearized with SalⅠand integrated into the genome of Pichia pastoris GS115 by electroporation.The recombinant P.pastoris GS115/xyl11Mwas screened by G418 and then was induced with methanol to express reXyl11M.The reXyl11Mactivity expressed by P.pastoris transformant reached 105.3 U/mL.The molecular weight of reXyl11Mwas estimated to be 34 000 by SDS-PAGE.The reXyl11Mdisplayed the highest activity at 70℃and pH 6.0.It wasstable at a temperature range of 30~75℃,and at a pH range of 6.5~7.5.Co2+,Ba2+,Cu2+,Li+had a strong enzyme activation effect,Fe3+had obvious inhibitory effect,its activity was not significantly affected by other metal ions and EDTA.This revealed that reXyl11Mwas successfully expressed in P.pastoris and had good enzymatic characterizations.
thermostable xylanase,Pichiapastoris,synthetic gene,gene expression,enzymatic characterization
Q 78
A
1673—1689(2016)05—0492—06
2014-10-12
国家863计划项目(2012AA022207C);江苏省产学研联合创新基金——前瞻性联合研究项目(BY2014023-16);国家自然科学基金项目 (31071595,20576046);张家港市科技支撑计划项目 (ZKN1301);江苏省科技支撑计划项目 (BE2012310,BE2011380);苏州市科技支撑计划项目(SNG201401)。
*
黄卫宁(1963—),男,江苏南通人,工学博士,教授,博士研究生导师,主要从事烘焙科学与发酵技术、谷物食品化学方面的研究。E-mail:wnhuang@jiangnan.edu.cn
