樱桃大苗培育过程中土壤微生物功能多样性与酶活性的变化
2016-08-08于会丽乔宪生高登涛王志强
司 鹏,邵 微,于会丽,乔宪生,高登涛,王志强,杨 健
(中国农业科学院郑州果树研究所,河南 郑州 450009)
樱桃大苗培育过程中土壤微生物功能多样性与酶活性的变化
司鹏,邵微,于会丽,乔宪生,高登涛,王志强,杨健①
(中国农业科学院郑州果树研究所,河南 郑州450009)
摘要:以樱桃苗圃行间土壤为试材,采用Biolog-Eco板技术与酶活性测定方法,研究樱桃大苗培育过程中土壤微生物功能多样性和酶活性的变化规律。结果表明,樱桃苗圃中育苗年限的增长不仅能够提高土壤微生物功能多样性,改变土壤微生物的碳源利用比例,而且能够显著提高土壤中过氧化氢酶、脲酶、碱性磷酸酶以及蔗糖酶活性。双因子方差分析以及冗余分析表明,土壤微生物功能多样性和酶活性受土层深度(过氧化氢酶除外)和生长年限的显著影响;微生物碳源的平均吸光值与育苗年限呈正相关关系,与土层深度呈负相关关系;微生物多样性与4种土壤酶活性呈正相关关系。在樱桃大苗培育过程中,樱桃土壤微生物功能多样性以及酶活性得到改善。
关键词:樱桃苗;育苗年限;微生物功能多样性;土壤酶活性
樱桃(Cerasuspseudocerasus)属蔷薇科落叶果树,因其果实营养丰富,味美香甜,广受喜爱[1]。利用大苗建园,使果树童期最大程度地在苗圃中度过,可极大地提高建园效率和土地利用率。按照现在的樱桃生产技术,成品苗定植4 a后开始见果,5 a可正常结果,利用三年生苗木建园,可极大地缩短樱桃从定植到结果所需年限。但是,樱桃大苗培育对土壤环境的影响还不清楚。
Biolog-Eco板技术以碳源利用为基础,简单快捷地反映土壤微生物代谢群落水平的生理代谢情况[2]。土壤酶活性能够表征土壤微生物学活性和肥力状况[3-4]。在多年生植物生长前期,随着生长年限的增加,土壤微生物功能多样性更加丰富[5-6],同时酶活性水平提高[7-8];随着土壤深度的增加,微生物功能多样性和酶活性则趋于降低[9]。笔者研究分析了苗圃地樱桃育苗年限对土壤微生物功能多样性和酶活性的影响,旨在阐明樱桃大苗培育过程中土壤微生物和酶活性的变化规律及其相关关系,为樱桃苗木科学繁育提供理论基础。
1材料与方法
1.1试验地基本情况
试验在河南省祥符区范村乡谢湾村樱桃苗圃(34°42′45″ N,113°41′57″ E)进行。该地区位于惠济河流域(为涡河的最大支流),属暖温带大陆性季风气候区,冬季寒冷干燥,春季干旱多风,夏季高温多雨,秋季天高气爽,四季分明。年均气温为14.52 ℃,年均无霜期为221 d,年均降水量为627.5 mm,降水多集中在7—8月,近3 a无重大气象变化。
1.2试验材料
7月将樱桃脱毒砧木苗(品种为“ZY-1”)栽植到苗圃土壤中,9月底嫁接樱桃品种“红灯”。分别于2011—2014年7月在苗圃中取行间土壤。取样方法为梅花形布点法,选5个点,每个点用土钻分别取0~20、>20~40 cm深度各处理行间土壤样品,剔除石块、植物残根等杂物后装入塑封保鲜袋带回实验室,过1 mm孔径土筛,均匀分成4份,1份保存,3份待测(4 ℃保存)。土壤理化性质:pH值为6.5,铵态氮含量为20.2 mg·kg-1,硝态氮含量为3.8 mg·kg-1,速效磷含量为23.23 mg·kg-1,有效钾含量为44.47 mg·kg-1。
1.3试验设计
试验设置4个处理。对照处理:空白土(育苗前);处理1(T1):2012年取样土壤;处理2(T2):2013年取样土壤;处理3(T3):2014年取样土壤。每个试验小区面积为12 m2,栽种100棵樱桃幼苗,设置2 m保护行,重复3次,随机区组排列。每个处理均取自樱桃树苗行间。采样苗圃于每年3、5和7月下旬施肥,每次施用氮磷钾复合肥10 kg(N、P2O5、K2O含量w均为15%,施肥方式为溶解冲施),并参照当地农田进行日常统一管理。0~20 cm土层土样编码为对照(A)、处理1(B)、处理2(C)和处理3(D);>20~40 cm土层土样编码为对照(E)、处理1(F)、处理2(G)和处理3(H)。
1.4测定项目与方法
1.4.1微生物功能多样性分析方法
取相当于1 g烘干土的新鲜土壤加入到盛有99 mLw=0.85%灭菌生理盐水的100 mL锥形瓶中,于28 ℃、200 r·min-1条件下振荡培养20 min,使土样与生理盐水充分混匀,在4 ℃冰箱内静置30 min,然后加样于Biolog-Eco微孔板中,每孔加入150 μL,25 ℃条件下培养192 h,每24 h读数1次。
1.4.2微生物群落功能多样性的计算
用平均吸光值(average well color development,AWCD,IAWCD)表示土壤微生物群落利用碳源的整体能力,其计算公式[10]为:
IAWCD=∑(Ci-R)/n。
(1)
式(1)中,Ci为第i个碳源孔吸光值;R为对照孔吸光值;n为培养基碳源总数,该研究取值31。
McIntosh指数(U)是基于群落物种多维空间距离的多样性指数,可利用第i孔的相对吸光值(ni)计算得到,其计算公式为
(2)
丰富度指数(S)代表被利用的碳源总数。Shannon-Wiener指数(H′)用于评估丰富度,其计算公式为
H′=-∑(PilnPi),
(3)
Pi=(Ci-R)/∑(Ci-R)。
(4)
式(3)~(4)中,Pi为有培养基的孔和对照孔的吸光值差与整板总差的比值。
Simpson指数(D)又称优势度指数,是对多样性的集中性度量,其计算公式为
D=1-∑Pi2。
(5)
Pielou均匀度指数(E)是群落实测多样性与最大多样性的比率,其计算公式为
E=H′/lnS。
(6)
1.4.3土壤酶活性测定
土壤脲酶活性测定采用苯酚钠-次氯酸钠比色法[11]124-129,以24 h内催化1 g底物产生的NH3-N量(mg)计;土壤碱性磷酸酶活性测定采用磷酸苯二钠比色法[12],以24 h内催化1 g底物产生的苯酚量(mg)计;土壤蔗糖酶活性测定采用3,5-二硝基水杨酸比色法[13],以24 h内催化1 g底物产生的C6H12O6量(mg)计;土壤过氧化氢酶活性测定采用KMnO4滴定法[11]124-129,以20 min内催化1 g底物消耗0.02 mol·L-1KMnO4溶液的体积(mL)计。3种酶活性测定均在37 ℃条件下进行。
1.5数据处理分析
采用Microsoft Excel 2007进行数据处理;采用Canoco 4.5进行冗余分析(redundancy analysis,RDA);采用SPSS 17.0统计软件进行方差分析(将樱桃种植年限和土层深度各分为2组进行双因子方差分析);采用SigmaPlot 10.0软件进行绘图。
2结果与分析
2.1樱桃苗圃土壤微生物群落功能多样性
2.1.1土壤微生物平均吸光值(IAWCD)变化特征
由图1可见,24 h内土壤微生物代谢较慢,而后增强。144 h时IAWCD值变化缓慢,至192 h时趋于平稳,微生物活性由高到低依次为D>H>B>G>F>B>A>E。这表明IAWCD值随樱桃苗育苗年限的增加而升高;就同一处理不同土层IAWCD值而言(除B土样外),0~20 cm土层高于>20~40 cm土层。

A、B、C、D分别为0~20 cm土层对照(育苗前),2012、2013和2014年取样土壤;E、F、G、H分别为>20~40 cm土层对照,2012、2013和2014年取样土壤。
2.1.2土壤微生物群落功能多样性指数分析
选取培养96 h时的土样数据对土壤微生物群落代谢的多样性进行分析。结果(表1)显示,微生物群落功能多样性指数因樱桃育苗年限与土层深度的不同而不同。双因子方差分析表明,育苗年限对土壤微生物群落多样性指数均有显著影响;土层深度对U、H′、D和S有显著影响;2个因子交互对5个多样性指数的影响均达显著水平。
2.1.3土壤微生物对6类碳源的利用特征
如表2所示,处理2(C与G土样)和处理3(D与H土样)能够利用6种碳源;处理1(B与F土样)胺类碳源利用比例为0,F土样酚类碳源的利用比例为0;对照(A与E)酚类的利用比例为0,A土样胺类利用比例为0.06,E土样胺类利用比例为0。这与Biolog-Eco板技术的局限性有关,该技术只能用来研究能够利用31种特定碳源且易培养的微生物[14],而其他土壤微生物在培养过程中不能存活。育苗年限与土层的双因子方差分析表明,育苗年限能够显著影响土壤微生物对碳水化合物、酚类、羧酸和胺类碳源的利用比例,土层深度能够显著影响聚合物、碳水化合物、酚类、羧酸以及氨基酸类碳源的利用比例,两者交互对碳水化合物和酚类碳源利用比例的影响达显著水平。
表1培养96 h时樱桃苗圃土壤微生物群落多样性指数
Table 1Microbial functional diversity index of the soil of the cherry nursery after 96 h of incubation

处理McIntosh指数UShannon-Wiener指数H'Simpson指数DPielou均匀度指数E丰富度指数SA1.65±0.17d2.29±0.12c0.83±0.02a1.39±0.04b5.00±0.58dB0.83±0.13e3.75±0.33a0.39±0.11b5.13±0.38a1.33±0.67eC2.28±0.22c2.63±0.12bc0.89±0.01a1.20±0.01bc9.00±1.00bcD4.67±0.15a2.89±0.01b0.94±0.00a1.01±0.00bc17.67±0.33aE0.32±0.25f0.97±0.14d0.46±0.05b—0.33±0.33eF1.51±0.04d2.46±0.17bc0.88±0.02a1.28±0.03bc7.00±1.00cdG3.30±0.14b2.47±0.07bc0.88±0.01a0.88±0.01c8.67±1.45bcH3.09±0.16b2.60±0.05bc0.91±0.01a1.08±0.035bc11.33±1.20bF(育苗年限)131.68***32.18***69.35***25.24***142.92***F(土层深度)5.97*48.13***4.90*0.50203.24***F(育苗年限×土层深度)31.08***8.11**17.51***33.27***83.85***
A、B、C、D分别为0~20 cm土层对照(育苗前),2012、2013和2014年取样土壤;E、F、G、H分别为>20~40 cm土层对照,2012、2013和2014年取样土壤。同一列数据后英文小写字母不同表示处理间某指标差异达0.05显著水平。*表示P<0.05,**表示P< 0.01,***表示P<0.001。“—”表示无数据。
2.1.4土壤微生物群落碳代谢与育苗年限及土层深度的关系分析
冗余分析结果(图2,培养96 h时取样数据)表明,生长年限与土层的综合作用对土壤微生物群落功能多样性的影响显著(P<0.005),4轴的累计特征值达81.1%,其中第1、第2排序轴的特征值分别为0.477和0.037;对于微生物功能多样性或环境因子指标而言,前2个排序轴之间的相关关系为0,表明第1、第2排序轴相互垂直,冗余分析的排序结果可信。从排序结果可知,土壤微生物群落功能多样性的年限和土层变化差异非常明显,对照和处理1、处理2和处理3分别位于第1排序轴的负端和正端,0~20 cm土层和>20~40 cm土层分别位于第2排序轴的正端和负端。第1轴排序与育苗年限呈正相关(相关系数为0.89),与土层深度呈负相关(相关系数为-0.09);第2排序轴与育苗年限呈负相关(相关系数为-0.08),与土层深度呈负相关(相关系数为-0.81)。另外,育苗年限与大多数碳源所指方向构成锐角,表明育苗年限与大多数碳源呈正相关;而土层深度与大多数碳源所指方向构成钝角,表明土层深度与大多数碳源呈负相关。研究表明,在0~3 a内,樱桃育苗地土壤微生物群落功能多样性具有显著的年际变化特征,与土层深度具有显著相关性。
表2樱桃苗圃土壤微生物对碳源的利用比例
Table 2Carbon source utilization rate of the soil microbes in the soil of the cherry nursery
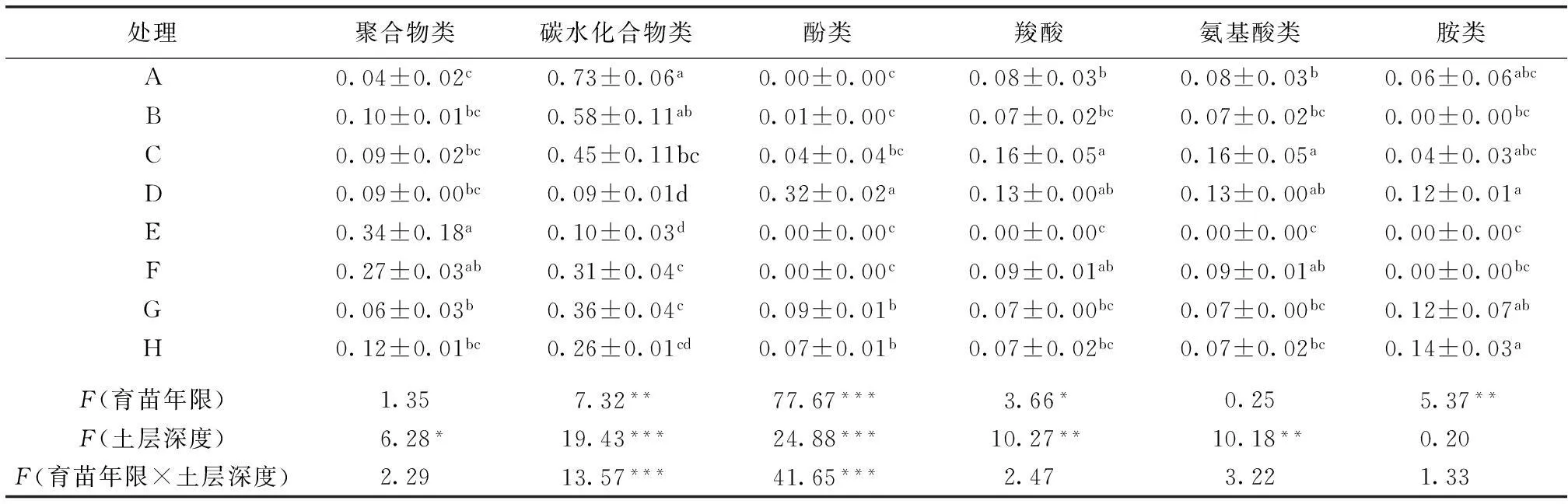
处理聚合物类碳水化合物类酚类羧酸氨基酸类胺类A0.04±0.02c0.73±0.06a0.00±0.00c0.08±0.03b0.08±0.03b0.06±0.06abcB0.10±0.01bc0.58±0.11ab0.01±0.00c0.07±0.02bc0.07±0.02bc0.00±0.00bcC0.09±0.02bc0.45±0.11bc0.04±0.04bc0.16±0.05a0.16±0.05a0.04±0.03abcD0.09±0.00bc0.09±0.01d0.32±0.02a0.13±0.00ab0.13±0.00ab0.12±0.01aE0.34±0.18a0.10±0.03d0.00±0.00c0.00±0.00c0.00±0.00c0.00±0.00cF0.27±0.03ab0.31±0.04c0.00±0.00c0.09±0.01ab0.09±0.01ab0.00±0.00bcG0.06±0.03b0.36±0.04c0.09±0.01b0.07±0.00bc0.07±0.00bc0.12±0.07abH0.12±0.01bc0.26±0.01cd0.07±0.01b0.07±0.02bc0.07±0.02bc0.14±0.03aF(育苗年限)1.357.32**77.67***3.66*0.255.37**F(土层深度)6.28*19.43***24.88***10.27**10.18**0.20F(育苗年限×土层深度)2.2913.57***41.65***2.473.221.33
A、B、C、D分别为0~20 cm土层对照(育苗前),2012、2013和2014年取样土壤;E、F、G、H分别为>20~40 cm土层对照,2012、2013和2014年取样土壤。同一列数据后英文小写字母不同表示处理间某指标差异达0.05显著水平。*表示P<0.05,**表示P<0.01,***表示P<0.001。

A、B、C、D分别为0~20 cm土层对照(育苗前),2012、2013和2014年取样土壤;E、F、G、H分别为>20~40 cm土层对照,2012、2013和2014年取样土壤。P=0.002。
2.2樱桃苗圃土壤酶活性变化特征
由表3可知,除B土样的脲酶和H土样的碱性磷酸酶之外,随育苗年限的增加,樱桃苗圃土壤过氧化氢酶、脲酶、碱性磷酸酶和蔗糖酶活性逐渐升高;随土层深度的增加,土壤脲酶、碱性磷酸酶以及蔗糖酶活性逐渐降低。大苗培育过程中,樱桃育苗年限与土层深度的双因子方差分析(表3)发现,育苗年限显著影响4种酶活性,土层深度显著影响脲酶、碱性磷酸酶以及蔗糖酶活性,两者交互对脲酶、碱性磷酸酶以及蔗糖酶活性水平造成显著影响。
2.3樱桃苗圃土壤微生物功能多样性及其碳源利用率与土壤酶活性之间的相关分析
如图3所示,土壤酶活性主要与土壤微生物群落U、H′、S和D关系密切。其中过氧化氢酶、脲酶活性与U(相关系数为0.82和0.79)、S(相关系数为0.85和0.83)以及D(相关系数为0.64和0.76)呈线性显著相关;碱性磷酸酶与H′和S呈线性正相关(相关系数为0.53和0.41);蔗糖酶与U、H′及S呈线性相关(相关系数分别为0.50、0.53和0.57)。土壤酶活性与土壤微生物对酚类、羧酸以及胺类的利用有关。4种酶均与微生物功能多样性(除碳水化合物类、氨基酸类以及聚合物的利用率比例和指数E外)变化方向相同,即呈正相关关系。总之,土壤酶活性能够在一定程度上表征土壤微生物功能多样性。
3讨论
随着樱桃育苗年限的增长,微生物功能多样性指数随之提高,即土壤微生物群落的碳代谢能力提高。这是因为樱桃根系分泌物营养丰富[15],能优化土壤微生物群落结构[16],提高土壤肥力,这与FU等[5]和林生等[6]对猕猴桃和茶树的研究结论一致。另外,育苗年限与微生物对酚类物质及羧酸类碳源的利用比例呈线性正相关关系(表3),说明随着育苗年限的增长,土壤中酚类物质含量逐年增多。这主要是因为樱桃根系分泌物中含大量酚酸类物质,而酚酸类物质是化感物质之一[17],其在土壤中含量过高会对土壤微生物功能多样性产生抑制,同时影响树体生长[18]。但在该研究中微生物功能多样性随酚酸类物质碳源利用比例的升高而增加,这可能与樱桃育苗年限短,根系分泌的酚酸类物质在土壤中积累量少有关。综上,0~3 a内,培育樱桃大苗显著丰富了土壤微生物多样性,对于土壤微生物群落结构具有一定的改善作用。
表3樱桃不同育苗年限土壤酶活性
Table 3Soil enzyme activity in cherry nursery soil relative to cultivating age

处理过氧化氢酶活性/[mL·g-1·(20min)-1]脲酶活性/(mg·g-1·d-1)碱性磷酸酶活性/(mg·g-1·d-1)蔗糖酶活性/(mg·g-1·d-1)A0.57±0.05d0.46±0.04c0.19±0.01cd0.96±0.12cdB0.69±0.01c0.18±0.00e0.48±0.02b3.52±0.51bC0.91±0.03b0.59±0.01b0.57±0.04b6.20±0.18bD1.06±0.02a0.69±0.03a0.68±0.04a5.80±1.32aE0.52±0.02d0.05±0.00f0.09±0.07de0.03±0.03deF0.80±0.01b0.30±0.03d0.20±0.02c1.71±0.12cG0.85±0.04b0.32±0.02d0.21±0.01c1.80±0.05cH1.06±0.06a0.47±0.03c0.05±0.01e2.16±0.10eF(育苗年限)78.93***101.44***22.97***20.86***F(土层深度)0.01148.33***198.38***55.68***F(育苗年限×土层深度)2.4747.97***20.47***4.90*
A、B、C、D分别为0~20 cm土层对照(育苗前),2012、2013和2014年取样土壤;E、F、G、H分别为>20~40 cm土层对照,2012、2013和2014年取样土壤。同一列数据后英文小写字母不同表示处理间某指标差异达0.05显著水平。*表示P<0.05,**表示P<0.01,***表示P<0.001。
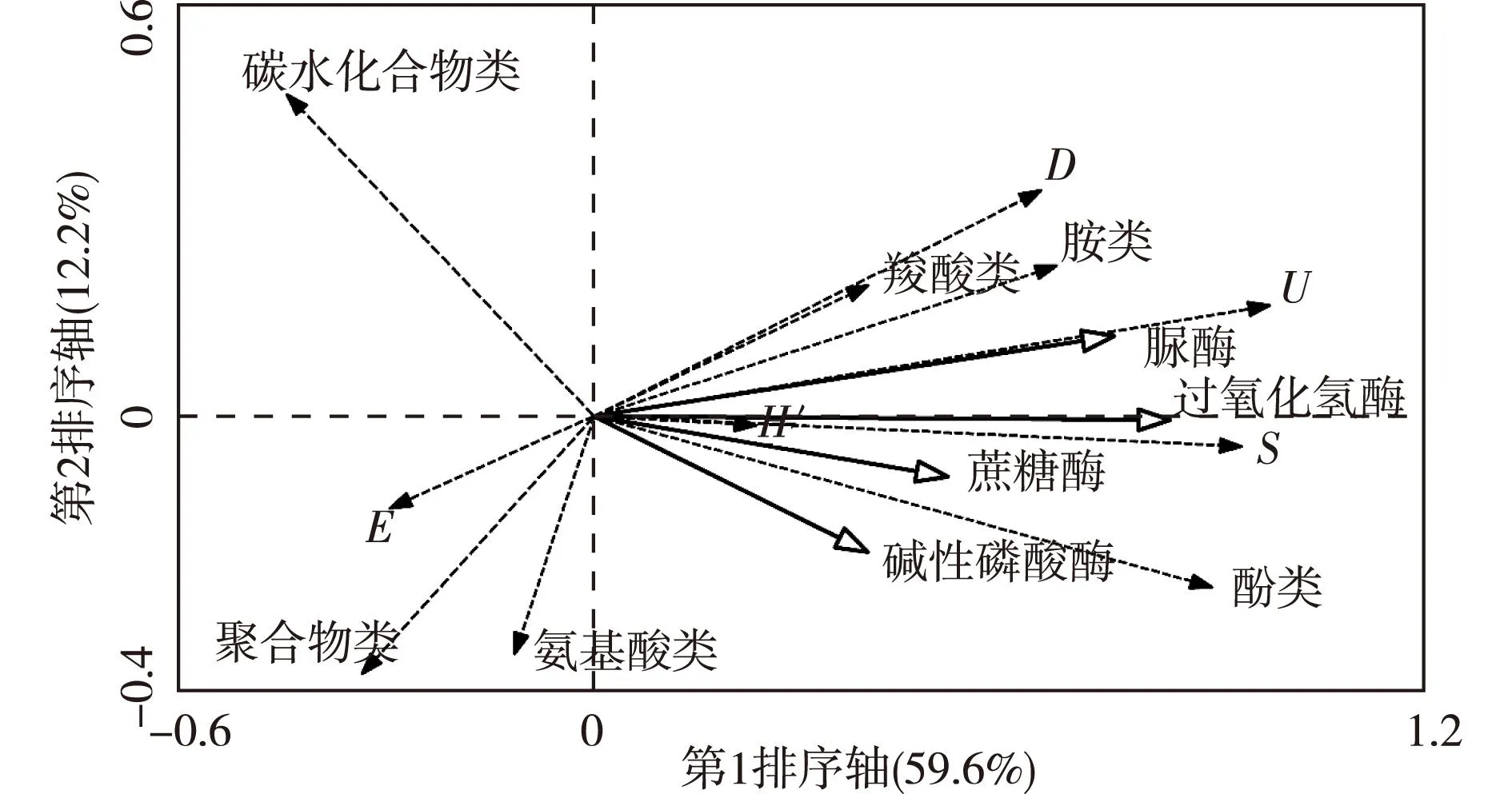
U、S、D、E和H′分别为McIntosh指数、丰富度指数、Simpson指数、Pielou均匀度指数和Shannon-Wiener指数。P=0.002。
当土壤环境变化时,与有机质相比,土壤酶活性反应更为迅速[19],更能准确表征土壤肥力水平[4]。该试验检测的4种酶活性均随着樱桃育苗年限的增长而增强(表3),这与张晋爱等[20]对柠条林的研究结果一致。但陈金星[7]与杜静静[8]发现,随着苹果生长年限的增长,土壤酶活性呈先升高后降低的变化趋势,在酶活性下降时,土壤肥力下降,树体生长受到抑制。从樱桃生长周期来看,樱桃育苗年限与土壤酶活性可能也存在类似的互作关系,但育苗多少年后会对土壤酶活性造成抑制,不同土壤表现是否相同,有待进一步研究。
在研究年限与土层对土壤微生物功能多样性与酶活性的影响时发现,处理1的B土样(一年生,0~20 cm土层)IAWCD值及脲酶活性低于F土样(一年生,>20~40 cm土层)。发生这种现象可以归结于以下原因:一方面,樱桃根耕作土层加深,显著改善了>20~40 cm土层微生物群落营养环境,丰富了土壤微生物群落多样性;另一方面,根系通过分泌各种次生代谢物质对土壤微生物群落有选择塑造作用[21],在塑造土壤微生物群落结构的过程中,根系分泌物能够抑制某些微生物的生长[22]。由于以往作物以草本为主,浅土层微生物丰富,而深土层微生物相对较少,樱桃苗的栽种会对浅土层微生物有选择塑造作用,同时丰富了深土层微生物多样性。
土壤酶活性受土壤微生物直接影响[23],与微生物功能多样性密切相关[24]。两者均参与土壤各生化过程以及养分的循环与转化[25],可以作为土壤肥力的生物指标之一[4,26]。笔者研究结果发现,随着育苗年限的增加,土壤酶活性升高(表3),微生物功能多样性更加丰富(表1),且多样性指数与多种土壤酶活性呈线性正相关关系,这与YIN等[3]对红壤植被恢复的研究结果一致。这说明随着育苗年限的增加,土壤肥力水平提升。另外,马云华等[27]发现,黄瓜连作土壤中,随着酚酸类含量的升高,酶活性先上升后下降。笔者研究取样时并未发现樱桃苗生长受到抑制,且试验数据表明,微生物对酚酸类物质的相对利用率与土壤酶活性呈线性正相关,说明试验年限内,樱桃苗圃中酚酸类物质尚未达到抑制樱桃苗生长和抑制酶活性的程度,没有对土壤肥力造成负面影响。但樱桃土壤中酚酸类物质与土壤互作是否像黄瓜一样存在阈值,如果存在,阈值是多少,还有待进一步研究。
4结论
0~3 a内,随着育苗年限的增长,樱桃苗圃中土壤微生物功能多样性逐渐丰富,土壤过氧化氢酶、脲酶、碱性磷酸酶以及蔗糖酶活性也显著提高。土壤微生物碳源的平均吸光值与育苗年限呈正相关关系,与土层深度呈负相关关系。同时,土壤微生物功能多样性与酶活性呈线性正相关关系。
参考文献:
[1]焦中高,刘杰超,王思新.甜樱桃采后生理与贮藏保鲜[J].果树学报,2003,20(6):498-502.
[2]区余端,苏志尧,彭桂香,等.车八岭山地常绿阔叶林冰灾后土壤微生物群落功能多样性[J].生态学报,2009,29(11):6156-6164.
[3]YIN R,DENG H,WANG H L,etal.Vegetation Type Affects Soil Enzyme Activities and Microbial Functional Diversity Following Re-Vegetation of a Severely Eroded Red Soil in Sub-Tropical China [J].Catena,2014,115(3):96-103.
[4]耿玉清,白翠霞,赵铁蕊,等.北京八达岭地区土壤酶活性及其与土壤肥力的关系[J].北京林业大学学报,2006,28(5):7-11.
[5]FU Q X,GU J,LI Y D,etal.Analyses of Microbial Biomass and Community Diversity in Kiwifruit Orchard Soils of Different Planting Ages[J].Acta Ecologica Sinica,2015,35(3):22-28.
[6]林生,庄家强,陈婷,等.福建安溪不同年限茶树土壤养分与微生物Biolog功能多样性的差异分析[J].中国生态农业学报,2012,20(11):1471-1477.
[7]陈金星.不同种植年限苹果园土壤特性比较[D].杨陵:西北农林科技大学,2010.
[8]杜静静.不同种植年限果园土壤理化性质与酶活性研究[D].临汾:山西师范大学,2013.
[9]司鹏,乔宪生.清耕和生草对沙地葡萄园土壤酶活性的空间影响[J].果树学报,2014,31(2):238-244.
[10]徐秋芳,姜培坤,王奇赞,等.绿肥对集约经营毛竹林土壤微生物特性的影响[J].北京林业大学学报,2009(6):43-48.
[11]严昶升.土壤肥力研究方法[M].北京:农业出版社,1988.
[12]鲁如坤.土壤农业化学分析方法 [M].北京:中国农业科技出版社,2000:249-255.
[13]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:274-276.
[14]JULIET P M,LYNNE B,PETER F R.Analysis of Microbial Community Functional Diversity Using Sole-Carbon-Source Utilisation Profiles:A Critique[J].FEMS Microbiology Ecology,2002,42(1):1-14.
[15]张秋英.植物根系分泌物的作用及其意义[J].作物杂志,1992(3):37-39.
[16]刘峰,温学森.根系分泌物与根际微生物关系的研究进展[J].食品与药品,2006,8(10):37-40.
[17]秦嗣军,吕德国,赵德英,等.本溪山樱桃根系酚酸类分泌物及其化感效应研究[J].沈阳农业大学学报,2008,39(2):156-160.
[18]谢洪刚,李坤.果树连作障碍机理及控制途径[J].辽宁农业职业技术学院学报,2008,10(4):6-8.
[19]CARAVACA F,MASCIANDARO G,CECCANTI B.Land Use in Relation to Soil Chemical and Biochemical Properties in a Semiarid Mediterranean Environment [J].Soil & Tillage Research,2002,68(2):23-30.
[20]张晋爱,张兴昌,邱丽萍,等.黄土丘陵区不同年限柠条林地土壤质量变化[J].农业环境科学学报,2007,26(增刊1):136-140.
[21]吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,26(3):298-310.
[22]WU H W,HAIG T,PRATLEY J,etal.Allelo-Chemicals in Wheat (TriticumaestivumL.):Cultivar Difference in the Exudation of Phenolic Acids[J].Journal of Agricultural and Food Chemistry,2001,49(8):3742-3745.
[23]刘善江,夏雪,陈桂梅,等.土壤酶的研究进展[J].中国农学通报,2011,27(21):1-7.
[24]柴强,黄鹏,黄高宝.间作对根际土壤微生物和酶活性的影响研究[J].草业学报,2005,14(5):105-110.
[25]张海燕,肖延华,张旭东,等.土壤微生物量作为土壤肥力指标的探讨[J].土壤通报,2006,37(3):422-425.
[26]陈琦,尹粉粉,曹靖,等.秦岭西部不同发育阶段油松和日本落叶松人工林土壤酶活性变化和分布特征[J].生态与农村环境学报,2010,26(5):466-471.
[27]马云华,王秀峰,魏珉,等.黄瓜连作土壤酚酸类物质积累对土壤微生物和酶活性的影响[J].应用生态学报,2005,16(11):2149-2153.
(责任编辑: 许素)
收稿日期:2015-08-25基金项目: 中国农业科学院科技创新工程专项(CAAS-ASTIP-2015-ZFRI)
通信作者①E-mail: yangjian@caas.cn
中图分类号:Q939.96
文献标志码:A
文章编号:1673-4831(2016)04-0609-06
DOI:10.11934/j.issn.1673-4831.2016.04.015
作者简介:司鹏(1983—),男,河北深泽人,助理研究员,硕士,研究方向为果树营养与施肥技术。E-mail: sipeng@caas.cn
Changes in Microbial Functional Diversity and Enzyme Activity in Soil During Cherry Sapling Cultivation.
SI Peng, SHAO Wei, YU Hui-li, QIAO Xian-sheng, GAO Deng-tao, WANG Zhi-qiang, YANG Jian
(Zhengzhou Institute of Fruit Research, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, China)
Abstract:Little information is available in the literature about functional diversity of the soil microbial communities in cherry nurseries during the sapling cultivation period. Investigations were carried out on variation rules of soil microbial functional diversity and enzyme activity in the soil of a cherry nursery with the Biolog-Eco plate technique and enzymologic methods. Results show that with the cultivation of cherry saplings going on, soil microbial functional diversity increased, soil microbes improved their use of soil carbon sources, and the activities of catalase, urease, alkaline phosphatase and invertase were also significantly enhanced. The two-way ANOVA and RDA analysis show that soil microbial functional diversity and soil enzymes activities, except catalase′s, were significantly affected by cultivating ages and soil depth; AWCD of the carbon sources for soil microbes were positively related to cultivating age and negatively to soil depth; and soil microbial functional diversity was positively related to activities of soil enzymes. In short, cultivation of cherry saplings improves soil microbial functional diversity and enzyme activity in the soil of the nursery.
Key words:cherry sapling; cultivation age; microbial functional diversity; soil enzyme activity
