氟尿嘧啶联合姜黄素纳米剂型抑制肝癌细胞的研究*
2016-08-08董伟刘福晨倪俊声李鹏鹏郭兴刚刘辉
董伟,刘福晨,倪俊声,李鹏鹏,郭兴刚,刘辉
(第二军医大学东方肝胆外科医院 肝外三科,上海 200438)
氟尿嘧啶联合姜黄素纳米剂型抑制肝癌细胞的研究*
董伟,刘福晨,倪俊声,李鹏鹏,郭兴刚,刘辉
(第二军医大学东方肝胆外科医院 肝外三科,上海 200438)
目的探究纳米层状双氢氧化物(LDH)共载氟尿嘧啶(Fu)姜黄素(Cur)混合剂型对肝癌细胞的抑制作用。方法通过共沉淀法合成纳米LDH混合剂型,并对其进行详细表征,如电镜(TEM)、X射线衍射(XRD)及动态光散射技术(DLS)检测,细胞计数试剂盒(CCK8)测定Fu组、Fu+Cur组及纳米剂型组对7721、Hep G2和LM3细胞的增殖抑制作用,同时凋亡试剂盒检测各组对7721细胞的凋亡效应,Western blot检测各组对细胞抗凋亡相关基因Bcl-2蛋白的表达及下游Caspase的活化情况。结果合成的纳米LDH混合剂型具有较好的均一性,DLS检测提示其粒径约为400nm,XRD提示Fu及Cur通过水平方式插入LDH层间;CCK8结果提示,相对于单纯的Fu组、Fu+Cur组和LDH-Fu组,LDH-Fu-Cur组对LM3、Hep G2和7721细胞具有更强的增殖抑制作用(P<0.05)。相对于单纯的Fu组、Fu+Cur组和LDH-Fu组,LDH-Fu-Cur组对LM3、Hep G2和7721细胞具有更强的促凋亡效应作用(P<0.05),35μg/ml浓度的Fu纳米混合剂型组凋亡率高达(87.0±4.7)%,而单纯Fu仅为(23.0±2.3)%;Western blot检测结果显示,纳米混合剂型能够下调7721细胞Bcl-2水平。结论纳米LDH混合剂型具有良好的抗肿瘤效应,其机制可能为下调肿瘤抗凋亡基因Bcl-2从而引起下游Caspase活化。
层状双氢氧化物;肝细胞癌;氟尿嘧啶;姜黄素;细胞凋亡
原发性肝癌(hepatocellular carcinoma,HCC)位于肿瘤发病率的第5位,其死亡率在肿瘤中居第3位[1]。早期HCC患者的最佳治疗措施是手术切除,然而HCC起病隐匿,确诊时多属晚期,已丧失手术机会。有数据显示,早期进行手术切除的肿瘤患者,其术后也具有较高的复发率[2],因此临床上化学治疗对于上述患者具有重要的治疗意义。
单一化疗药物,如氟尿嘧啶(Fluorouracil,Fu),存在治疗窗口窄、毒副作用大等缺点。临床上常采取的多种化疗药物联用治疗也存在不足,如多种药物之间可能存在相互作用,多种药物副作用的叠加效应等[3-5]。近年来,传统中药的抑制肿瘤作用越来越受到关注,中药辅助临床常用的化疗药物不仅存在经济上的优势,还因中药的毒副作用小而具有相对安全性。姜黄素(Curcumin,Cur)是来源于食物的天然药物,具有廉价、安全等诸多优点。研究表明,大剂量的姜黄素对于人体没有明显的毒副作用,基础实验也证实姜黄素具有抗炎、抗氧化及抗肿瘤等多重作用[6]。同时文献报道显示,联合化疗药物与姜黄素能够抑制肿瘤生长[7]。但是姜黄素具有水溶性差、体内代谢快等不足,如何充分发挥姜黄素的强大功能值得探究。
纳米技术的发展为肿瘤药物剂型提供新方向,纳米技术具有诸多优点:纳米载体的pH敏感性、温度敏感性,以及修饰的不同配体可以实现主动及被动靶向至肿瘤部位,基于纳米技术的联合用药不仅局限于两种药物机械混合使用,还可以实现化疗药物的时序性、协同性作用[8-9]。层状双氢氧化物(layered double hydroxide,LDH)是一类具有双层板状结构的阴离子型黏土,因具有无毒、高载药量和pH敏感性等优点,而受到广泛关注。LDH板间带负电荷,可用于阴离子物质交换,可附载电离为阴离子的药物及小分子的核酸,如LI等[10]采用LDH附载尿嘧啶和siRNA可用于肿瘤的药物、基因联合疗法,为逆转肿瘤耐药提供新思路。
基于文献报道以及前期的实验结果,本实验利用LDH附载氟尿嘧啶、姜黄素纳米混合剂型,并对其进行一系列的表征,采用7721、LM3和Hep G2细胞为模型,研究纳米剂型对肝癌多细胞系的抑制作用,并对其作用机制进行初步探讨。
1 材料与方法
1.1实验材料
六水硝酸镁[Mg(NO3)2·6H2O,分析纯]、九水硝酸铝[Al(NO3)3·9H2O,分析纯]、氢氧化钠(NaOH,分析纯)及二甲基亚砜[(dimethyl sulfoxide,DMSO),分析纯]购自上海化学试剂公司,高纯氮购自上海比欧西气体工业有限公司,1640培养液、小牛血清、胰酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、活细胞计数法试剂盒(cell counting kit 8,CCK8)及凋亡试剂盒购自南京凯基生物科技发展有限公司,氟尿嘧啶购自大连美仑生物有限公司,姜黄素购自阿拉丁试剂,7721、LM3、Hep G2和LO2细胞株购自中科院上海细胞库,同济大学生命科学院冷冻保存,所有抗体均购自美国Cell Signaling Technology (CST)公司。
1.2纳米材料的合成
LDH的合成依据实验室前期基础。称取NaOH 0.272 g溶于40 ml除二氧化碳CO2去离子水,于三口烧瓶中氮气氛围下充分搅拌5 min,10 ml溶解0.796 g Mg(NO3)2·6H2O和0.372 g Al(NO3)3·9H2O快速加入三口烧瓶中,60℃水浴快速搅拌,1 h后离心收集,除二氧化碳CO2去离子水清洗3遍。用40ml 0.15 mol NaOH溶液,其中溶解氟尿嘧啶或氟尿嘧啶加姜黄素,重悬上述离心收集的浆液。三口烧瓶60℃水浴快速搅拌1 h后,除CO2去离子水清洗3遍,70 ml除CO2去离子水重悬,放置于水热釜中100℃、16 h后室温冷却,去离子水清洗3次即得LDH-Fu(LF)和LDH-Fu-Cur(LFC)。
1.3纳米材料的表征
通过电镜观察LF和LFC的形貌,动态激光散射仪测定其粒径,X射线衍射观察其晶型结构。紫外分光光度测定纳米材料的载药量。分别测定氟尿嘧啶在265 nm处及姜黄素在425 nm处的药物标准曲线,根据标准曲线和待测样品紫外吸收光密度(optical density,OD)值计算其相对应的浓度。
1.4细胞培养
7721、LM3、Hep G2及LO2细胞培养于含10%小牛血清及1%双抗的1640培养基中,37℃、5%CO2培养,细胞的传代消化选用含EDTA的胰酶。
1.5增殖抑制试验
7721、LM3和Hep G2细胞消化后重悬,接种于96孔板,接种数目约为每孔5 000个。待细胞增殖至约板底50%时,加入不同Fu浓度的Fu、LF、LFC及Fu+Cur组,每孔100μl(Fu浓度分别为15、20、25、30和35μg/mL)。37℃、5%CO2细胞培养箱内培养24 h,吸去上清液培养基,用磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗细胞2次后加入含10% CCK8的新鲜培养基。37℃、5%CO2环境下培养,孵育适当时间,用酶标仪450nm测定OD值。根据对照组计算细胞存活率,每组3个复孔。LDH安全性评价采取不同浓度的LDH悬液作用于正常LO2肝脏细胞,步骤同上。
1.6凋亡实验
7721细胞消化后重悬,接种于12孔板,计数约为10万个/孔。待细胞长至板底约60%时,换1 ml新鲜培养基,设分别包含不同Fu浓度的Fu、LF、LFC 及Fu+Cur组(Fu浓度分别为25、30和35μg/ml,LDH采取最高LFC对应的LDH浓度评价LDH的促凋亡效应),24 h后消化收集细胞,用无菌PBS清洗细胞2次,细胞凋亡双染试剂盒膜联蛋白-别藻蓝素/7-氨基放线菌素D(annexin V-allophycocyanin/ 7-amino-actinomycinD,AnnexinVAPC/7-AAD)固定液500μl重悬,依次加入5μl APC和5μl 7-AAD,于流式细胞仪检测。
1.7Western blot检测
7721细胞消化离心后接种于6孔板,约15万个/孔。分别加入LDH、Fu、LF、LFC及Fu+Cur(各组Fu为25μg/ml,LDH为LFC相对应的LDH浓度),蛋白提取试剂盒提取全蛋白后采取二喹啉甲酸(bicinchoninic acid,BCA)法定量,分组点样于10%聚丙烯酰胺凝胶进行十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)电泳,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转膜后加封闭液室温封闭1 h,分别加入Bcl-2、Caspase-3、Caspase-9和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗4℃孵育过夜后加入二抗,室温轻摇1 h,加入增强化学发光法(enhanced chemiluminescence,ECL)发光剂,置于凝胶成像仪中观察结果,并拍照记录。
1.8统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,双因素多水平方差分析,两两比较用SNK(Student-Newman-Keuls)法,P<0.05为差异有统计学意义。
2 结果
2.1纳米材料的表征
根据实验室前期基础,成功制备LF和LFC,结果显示,LF具有较为均一的正六面体形貌(见图1A),而LFC出现显著的形貌变化(见图1B);XRD检测用于评估氟尿嘧啶和姜黄素载入LDH的方式,各组材料均出现003和006特征峰(见图1C);动态激光散射测定LF平均半径为(94.0±5.5)nm,LFC平均半径为(200.0±6.4)nm(见图1D),提示LDH具有良好的晶体结构。LF的2θ角(003)发生在11.28°,晶面间距d为0.78 nm;LFC的2θ角(003)发生在10.64°,晶面间距d为0.84 nm,减去LDH板层的0.48 nm,剩余间距均非常接近氟尿嘧啶和姜黄素的层面高度,分别为0.34和0.32 nm,提示两者是水平被插入LDH层间。另外结果还显示,LFC特征峰显著变弱变宽,提示姜黄素晶体结构差,有利于药物的释放;LF中Fu的载药量为(19.56±0.32)%,LFC 中Fu和Cur的载药量分别为(18.32±0.27)%和(15.64±0.25)%。
2.2肝癌细胞的增殖抑制试验
增殖抑制结果显示,各浓度下单纯的LDH对正常肝脏细胞LO2的细胞存活率>80%,提示LDH生物安全性良好(见图2A)。相对于单纯的Fu组,纳米剂型对LM3、Hep G2和7721不同肝癌细胞系均有不同程度的增殖抑制效应(见图2B~D),从柱状图可以看出LFC各浓度下细胞存活率均小于Fu组,且在最高浓度下(Fu浓度为35μg/ml),LFC组7721细胞的存活率<10%(见图2D),LF及LFC组细胞存活率随着药物浓度的增加而下降。采取析因设计资料的方差分析比较浓度(检验值和P值为F1,P1)、组别(检验值和P值为F2,P2)对LM3、Hep G2、7721细胞存活率差异的影响,结果显示,在给定的5%显著性水平下,组别和浓度对LM3(F1=732.12,P1=0.000;P2=460.09,P2=0.000)、Hep G2(F1=604.87,P1=0.000;F2=1487.48,P2=0.000)和7721(F1=3401.73,P1=0.000;F2=4497.85,P2=0.000)细胞存活率的抑制作用比较,差异有统计学意义,且组别与浓度间存在交差效应(LM3:F=119.75,P=0.000;Hep G2:F=110.61,P= 0.000;7721:F=651.89,P=0.000)。各浓度间LM3、Hep G2和7721细胞存活率比较,差异有统计学意义。SNK多重比较结果显示,随着药物浓度的提高,细胞致死率明显增加,35μg/ml组药物处理后,细胞存活率低于其他组;SNK多重比较分别对LM3、Hep G2和7721细胞存活率差异进行组间两两比较,结果提示,3种细胞中Fu+Cur与Fu、LF与Fu、LFC与Fu、LF与Fu+Cur、LFC与Fu+Cur、LFC与LF两组间细胞存活率比较,差异具有统计学意义(P<0.05),说明Fu+Cur、LF、LFC较Fu均能降低LM3、Hep G2 及7721细胞存活率,而LFC组最强,即LFC组较其他组对于LM3、Hep G2和7721细胞具有明显的增殖抑制作用。笔者采取7721细胞进行下一步实验。

图1LF及LFC的表征
2.3凋亡实验
从流式凋亡结果图可以看出,最高LFC浓度组的LDH浓度对于7721细胞的诱导凋亡率低,仅约为9%,提示LDH生物安全性良好。LFC组各浓度下的细胞凋亡率均高于单纯Fu组,Fu浓度为35μg/ml时Fu、Fu+Cur、LF及LFC对应的凋亡率分别为(23.5±2.3)%、(40.0±3.5)%、(74.0±2.5)%和(87.0±4.7)%(见图3)。采取析因设计资料的方差分析比较浓度、组别对7721细胞凋亡率差异的影响,结果提示,不同处理浓度对7721细胞凋亡率比较差异有统计学意义(F=18.27,P=0.000),说明各浓度药物处理后诱导细胞的凋亡率存在差异,经SNK法比较,得出35μg/ml组促进细胞凋亡率最明显(P<0.05)。不同组别处理7721细胞后细胞凋亡率比较差异有统计学意义(F=52.56,P=0.000),提示各组间细胞的凋亡率比较差异有统计学意义,组间和浓度间无交差效应。进一步采用SNK法对7721细胞进行组间两两比较,结果提示,Fu+Cur与Fu、LF 与Fu、LFC与Fu、LF与Fu+Cur、LFC与Fu+Cur、LFC 与LF两组间7721细胞的凋亡率比较,差异有统计学
意义(P<0.05),两组间7721细胞凋亡率比较差异有统计学意义,说明Fu+Cur、LF、LFC较Fu都能促进7721细胞凋亡,而LFC组促凋亡率最高,即LFC较其他组对于7721细胞具有明显的促凋亡效应。

图2 细胞增殖抑制试验
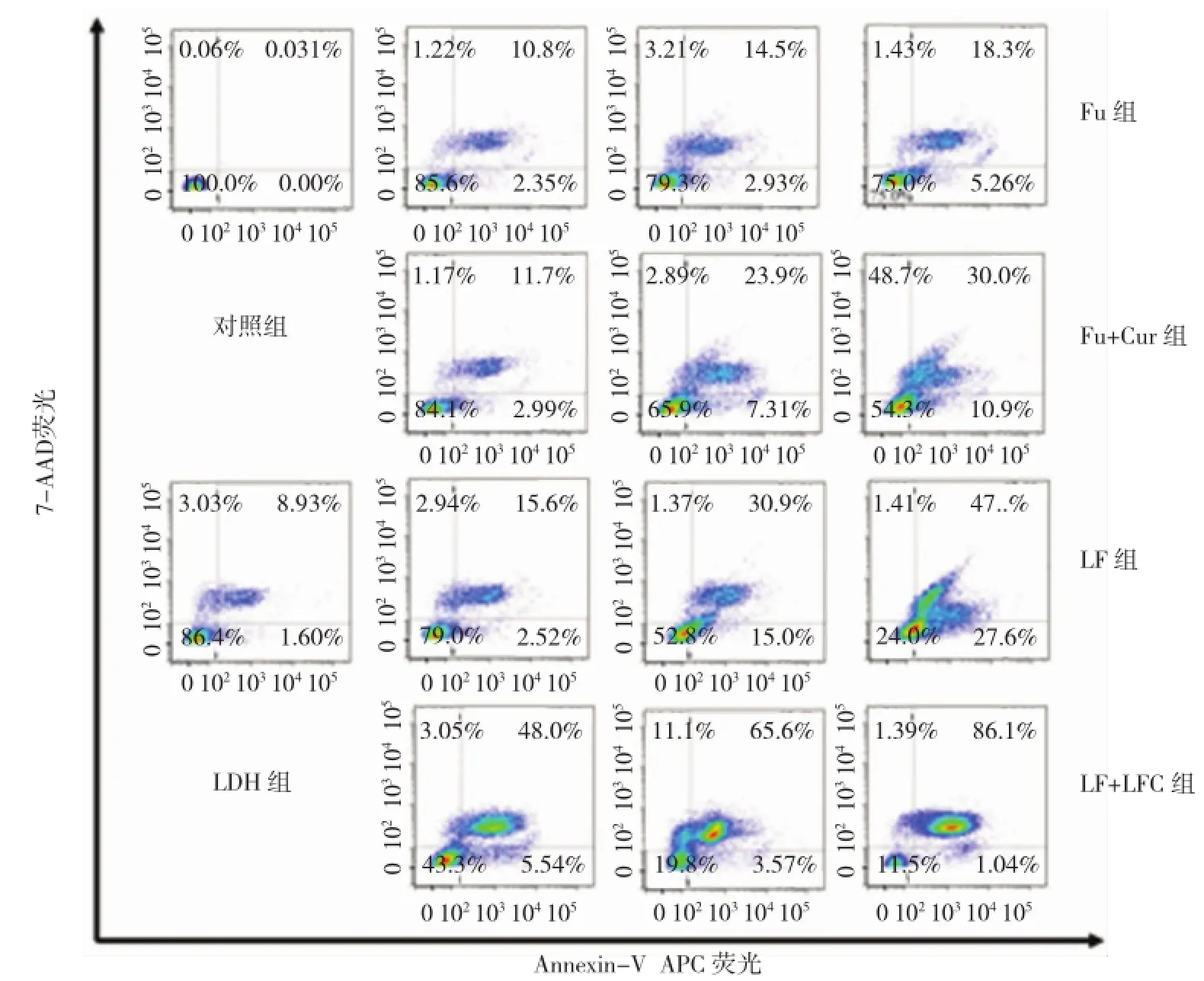
图3 7721细胞凋亡实验
2.4Western Blot检测
Bcl-2是调节细胞凋亡的重要基因,在细胞发生损伤时,可以使细胞逃逸死亡,下调Bcl-2可以引起下游Caspase活化,有效诱导细胞凋亡。Western blot检测结果显示,LFC组Bcl-2较其他组明显下调,同时Caspase-3、Caspase-9较其他组明显上调(见图4),提示LFC具有较强的促凋亡效应。

图4 Western blot检测
3 讨论
肝癌起病隐匿且恶性程度高,发现多属晚期,化学药物在肝癌治疗中必不可少,然而化疗药物的毒副作用常导致剂量降低或患者放弃治疗,临床上常采取的多种化疗药物联合应用也存在诸多不确定因素[3,5]。传统中药具有较强的抗肿瘤效果,且安全性高,却存在生物利用度低等缺陷,本实验成功制备LDH附载氟尿嘧啶和姜黄素的混合剂型,改善姜黄素水溶性差、生物利用度低等缺陷,充分发挥其抗肿瘤效果。
LDH是一类具有pH敏感性的双层片状结构的纳米载体,因其具有低毒、高细胞摄取率及高载药量而被广泛关注[11],与本实验结果相一致。实验中LFC 中Fu和Cur的载药量分别高达18.32%和15.64%,同时250μg/ml LDH对于正常肝脏LO2细胞没有明显的抑制作用,显示其优越的生物安全性。课题组前期报道显示,LDH很容易被MDDCs细胞摄取,归因于其Zeta电位为正电,容易被带负电的肿瘤细胞获取[12]。
有文献报道,联合应用氟尿嘧啶和姜黄素能够实现更好地抗肿瘤效果[13]。而本实验中,单纯的氟尿嘧啶及氟尿嘧啶和姜黄素的机械混合剂型对于7721细胞无明显的增殖抑制效果,而LF和LFC均有明显的增殖抑制效果,且LFC明显强于LF,可能归结于LDH的特殊作用。有文献报道指出,纳米材料能更大程度的被肿瘤细胞摄取,而纳米载体本身具有缓释性能,同时不易被细胞泵出,从而实现药物在肿瘤内的聚集,达到更好的抗肿瘤效应[14]。
凋亡结果提示,低浓度的氟尿嘧啶、氟尿嘧啶和姜黄素机械混合剂型均表现出有限的诱导细胞凋亡率。而引入LDH后的LF及LFC均对照组有明显的促凋亡效果,且LFC明显强于LF,这不仅从另一方面显示LDH的特殊作用,还可能与姜黄素相关。姜黄素是一类植物提取的天然性药物,具有多重药理活性[15]。文献报道显示,姜黄素能够显著下调Bcl-2水平,而Bcl-2是调节细胞凋亡的重要基因,在细胞发生损伤时,可以使细胞逃逸死亡,下调Bcl-2可以有效诱导细胞凋亡[16-18]。在本实验中,Western Blot检测结果显示,LFC能够显著下调Bcl-2,从而激活Caspase信号通路,进而促进细胞凋亡。
综上所述,笔者合成共载氟尿嘧啶及姜黄素的层状双氢氧化物纳米剂型,增殖抑制及凋亡结果显示其优越的抗肝癌效果,其机制可能与LDH纳米材料的特殊性能及姜黄素的多重药理活性相关,其重要机制可能是下调Bcl-2水平促进细胞凋亡。层状双氢氧化物共载氟尿嘧啶姜黄素实现传统中药的老药新用及中、西药的联用,为肝癌的化学治疗提供新思路。
[1]JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics[J].CA Cancer J Clin,2009,59(4):225-249.
[2]MANCUSO A,PERRICONE G.Hepatocellular carcinoma and liver transplantation:state of the art[J].Journal of clinical and translational hepatology,2014,2(3):176-181.
[3]SHAKADO S,IWATA K,TSUCHIYA N,et al.Pilot study of hepatic arterial infusion chemotherapy with Interferon-beta and 5-fluorouracil:a new chemotherapy for patients with advanced hepatocellular carcinoma[J].Hepato-gastroenterology,2014,61(131):557-562.
[4]SONG M J,BAE S H,CHUN H J,et al.A randomized study of cisplatin and 5-Fu hepatic arterial infusion chemotherapy with or without adriamycin for advanced hepatocellular carcinoma[J]. Cancer Chemotherapy and Pharmacology,2015,75(4):739-746.
[5]乔彬彬,虞希祥,王舒婷,等.TACE术中灌注氟尿嘧啶、奥沙利铂及吡柔比星治疗原发性肝癌的临床效果分析 [J].介入放射学杂志,2015,24(4):349-353.
[6]HEGER M,VAN GOLEN R F,BROEKGAARDEN M,et al. The molecular basis for the pharmacokinetics and pharmacodynamics of curcumin and its metabolites in relation to cancer[J]. Pharmacological Reviews,2014,66(1):222-307.
[7]张莉鑫.姜黄素联用5-Fu对人结肠癌细胞凋亡的影响[J].中国现代医学杂志,2010,20(15):2298-2301.
[8]YOKOYAMA M.Polymeric micelles as drug carriers:their lights and shadows[J].Journal of Drug Targeting,2014,22(7):576-583. [9]ZHU Y,WU Y,ZHANG H,et al.Enhanced anti-metastatic activity of etoposide using layered double hydroxide nano particles[J]. Journal of Biomedical Nanotechnology,2015,11(12):2158-2168.
[10]LI L,GU W,CHEN J,et al.Co-delivery of siRNAs and anti-cancer drugs using layered double hydroxide nanoparticles[J]. Biomaterials,2014,35(10):3331-3339.
[11]RIAZ U,ASHRAF S M.Double layered hydroxides as potential anti-cancer drug delivery agents[J].Mini Reviews in Medicinal Chemistry,2013,13(4):522-529.
[12]WANG J,ZHU R,GAO B,et al.The enhanced immune response of hepatitis B virus DNA vaccine using SiO2 LDH nanoparticles as an adjuvant[J].Biomaterials,2014,35(1):466-478.
[13]SADZUKA Y,NAGAMINE M,TOYOOKA T,et al.Beneficial effects of curcumin on antitumor activity and adverse reactions of doxorubicin[J].International Journal of Pharmaceutics,2012,432(1/2):42-49.
[14]CHEN Y,CHEN H,SHI J.Inorganic nanoparticle-based drug codelivery nanosystems to overcome the multidrug resistance of cancer cells[J].Molecular Pharmaceutics,2014,11(8):2495-2510.
[15]刘红艳,王海燕,叶松,等.姜黄素药理作用及其机制研究进展[J].中国现代医学杂志,2012,22(6):48-51.
[16]董伟,刘辉.姜黄素抗肿瘤新剂型研究进展[J].第二军医大学学报,2015,36(7):771-775.
[17]YANG J,NING J,PENG L,et al.Effect of curcumin on Bcl-2 and Bax expression in nude mice prostate cancer[J].International Journal of Clinical and Experimental Pathology,2015,8 (8):9272-9278.
[18]WENG Q,FU L,CHEN G,et al.Design,synthesis,and anticancer evaluation of long-chain alkoxylated mono-carbonyl analogues of curcumin[J].European Journal of Medicinal Chemistry,2015,103(20):44-55.
(童颖丹 编辑)
Co-delivery of fluorouracil and curcumin by nano-layered double hydroxide for inhibition of hepatocellular carcinoma cellsin vitro*
Wei Dong,Fu-chen Liu,Jun-sheng Ni,Peng-peng Li,Xing-gang Guo,Hui Liu
(The Third Department of Hepatic Surgery,Eastern Hepatobiliary Surgery Hospital,the Second Military Medical University,Shanghai 200438,China)
Objective To evaluate the effects of fluorouracil and curcumin co-loaded nano-layered double hydroxide(NLDH)on proliferation and apoptosis of hepatocellular carcinoma cell lines.Methods NLDH was synthesized by co-precipitation method.Detailed characterizations of NLDH such as its morphology,structure and particle size were performed by electron microscopy,X-ray diffraction(XRD)and dynamic light scattering technique(DLS).The function of pure fluorouracil,fluorouracil and curcumin,fluorouracil loaded NLDH (LDH-Fu),fluorouracil and curcumin co-loaded NLDH(LDH-Fu-Cur)on cell viability of 7721,LM3 and Hep G2 cell lines was measured by CCK-8 kit.Meanwhile,apoptosis kit was applied to detect apoptosis of 7721 cells in the aforementioned groups.In order to explore the mechanism of apoptosis induced by fluorouracil and curcumin co-delivered NLDH,Western blot was used to detect the expression levels of apoptotic proteins such as Bcl-2,Caspase-3 and Caspase-9.Results NLDH,with a size of 400 nm,presented a good uniformity under electron microscope.XRD results indicated that fluorouracil and curcumin were horizontally inserted intothe interlayer of NLDH.CCK8 results indicated that LDH-Fu-Cur more efficiently inhibited the growth of 7721,LM3 and Hep G2 cell lines compared with pure fluorouracil,fluorouracil plus curcumin,and LDH-Fu (P<0.05).Similarly,LDH-Fu-Cur was more effective in promoting apoptosis than pure fluorouracil,fluorouracil plus curcumin,and LDH-Fu,as was evidenced by the apoptosis rate of LDH-Fu-Cur which was(87.0± 4.7)%with the fluorouracil concentration of 35 μg/ml while the apoptosis rate of pure fluorouracil was only (23.0±2.3)%with that concentration(P<0.05).Western blot results showed that NLDH could significantly down-regulate the Bcl-2 gene expression of 7721 cells and induce cell apoptosis by activating Caspase-3 and Caspase-9.Conclusions NLDH presents as a good carrier for anti-cancer drugs such as fluorouracil and curcumin and exhibits a potent anti-tumor effect,which make it a promising candicate for cancer therapy.
nano-layered double hydroxide;hepatocellular carcinoma;curcumin;fluorouracil;cell apoptosis
R735.7
A
10.3969/j.issn.1005-8982.2016.09.004
1005-8982(2016)09-0016-07
2015-11-26
*
国家自然科学基金面上项目(No:NSFC81271694);科技部国际合作专项(No:010S2012ZR0058、2011DFA32980)
刘辉,E-mail:happyehbh@163.com;Tel:021-81875524
