蓝莓酒渣中多酚提取工艺的研究
2016-08-07刘文静徐婉蒙王成玉李丹丹王超郭德军阮长青
刘文静,徐婉蒙,王成玉,李丹丹,王超,郭德军,阮长青
(1.黑龙江八一农垦大学食品学院,大庆163319;2.九三集团天津大豆科技有限公司)
蓝莓酒渣中多酚提取工艺的研究
刘文静1,徐婉蒙1,王成玉1,李丹丹1,王超2,郭德军1,阮长青1
(1.黑龙江八一农垦大学食品学院,大庆163319;2.九三集团天津大豆科技有限公司)
为充分利用蓝莓酒渣中的多酚资源,在单因素试验基础上,采用溶剂提取法对蓝莓酒渣中多酚的提取工艺进行了研究。结果表明,蓝莓酒渣中多酚的最优提取工艺为:提取剂0.1%盐酸的60%乙醇水溶液,料液比1∶40(g∶mL),提取温度80℃,提取时间3 h。此条件下蓝莓酒渣中多酚提取量为8.89 mg·g-1,粗提取物得率22.1%,总酚纯度为5.69%。为蓝莓酒渣的利用及生物活性成分研究提供了依据。
蓝莓;酒渣;多酚;提取
蓝莓是杜鹃花科的越橘属植物,起源于北美,多年常绿灌木或生落叶。我国野生蓝莓资源丰富,主要分布在东北、华北、西南等地区,大兴安岭地区年产量10~20万t[1]。蓝莓中含有丰富的维生素,蛋白质和矿物质等营养元素,每100 g新鲜蓝莓中含有花色苷100~200 mg,多酚类物质400~500 mg[2],具有保护视力、防止脑神经老化、预防癌症、软化血管、增强人体免疫力以及很强的抗氧化性等多种功效[3-4]。
蓝莓酒加工过程中会产生大量的酒渣,通常被当作废弃物处理。其中富含酚酸、黄烷醇、花色苷等生物活性成分[5-7],探究酒渣中包含上述成分的各种多酚类物质,研究其成分以及抗氧化等生物活性,开发新型天然食品成分,是蓝莓酒生产企业急需解决的问题。王超等[8]关于野生蓝莓酒渣中花色苷的提取方法及抗氧化活性的研究,为蓝莓酒渣中其他活性成分的深入研究提供了参考。
现以野生蓝莓酒渣为原料,对多酚提取工艺进行优化,望为蓝莓酒渣中多酚的生物活性研究及开发利用提供依据。
1 材料与方法
1.1 材料与试剂
野生蓝莓酒渣,野生蓝莓酿酒后废弃酒渣,40℃干燥,粉碎,过60目筛,4℃冷藏备用。
没食子酸标准品,纯度≥99.0%,中科院成都生物研究所;Follin-Ciocalteu试剂,Merck公司;其他试剂均为分析纯。
1.2 仪器与设备
SHA-C型水浴恒温振荡器,荣华仪器制造有限公司;722s型可见光分光光度计,上海精密科学仪器有限公司;RE-52型旋转蒸发器,上海博通化学科技有限公司;SHZ-D(Ⅲ)型循环水式真空泵,巩义市英峪予华仪器厂;ALPHA1-2 LD plus型冷冻干燥机,德国Christ公司。
1.3 试验方法
1.3.1 蓝莓酒渣中多酚的提取方法
蓝莓酒渣经40℃干燥至恒重,粉碎,过筛(60目),4℃冷藏备用。取一定量干燥的酒渣粉在不同浓度盐酸-乙醇水溶液、不同料液比、提取温度及时间下,水浴振荡(200 r·min-1)提取,抽滤,滤液备用。根据单因素试验结果设计正交试验。
1.3.2 多酚的测定
采用Follin-Ciocalteu比色法测定样品中多酚含量[9-10],略加改动,方法如下:分别取0、1、2、3、4、5 mL 0.1 mg·mL-1没食子酸标准溶液于10 mL容量瓶中,酒渣提取液稀释一定倍数,各加2 mL 0.2 mol·L-1Follin-Ciocalteu试剂,摇匀,4 min后,加入2 mL 7.5%Na2CO3溶液,定容,混合,避光反应2 h后在760 nm波长下,以零管调节零点,测定吸光值(A),绘制吸光值-浓度标准曲线,同时做试剂空白。蓝莓酒渣中多酚提取量按式(1)计算。
在优化的提取条件下,将提取物在旋转蒸发仪上浓缩至尽干,洗涤、转移至表面皿中冻干,称重,为提取物的质量(m1),按上述方法测定并计算其中多酚的质量(m2),按式(2)、(3)分别计算提取物中多酚的得率及纯度。

式中,C:蓝莓酒渣中多酚提取量(mg·g-1);A、A0:样液、试剂空白液的吸光值;V:提取液体积;f:稀释倍数;k:标准曲线斜率;m0:蓝莓酒渣质量(g);m1:多酚提取物质量(g);m2:提取物中多酚的质量(g);Y:蓝莓酒渣中多酚的得率(%);P:提取物中多酚的纯度(%)。
2 结果与分析
2.1 总酚测定标准曲线
系列浓度没食子酸溶液与Follin-Ciocalteu试剂发生显色反应,反应液吸光值(A)与浓度(c)的线性方程为A=9.731 7c-0.027 2,相关系数R2=0.999,浓度线性范围:0.02~0.10 mg·mL-1,吸光值范围:0.173~0.940。
2.2 乙醇浓度对多酚提取的影响
用含0.2%盐酸的0%、20%、40%、60%、80%、100%的乙醇水溶液,料液比1∶20,30℃水浴振荡(200 r·min-1)1 h,乙醇浓度对多酚提取量的影响见图1。
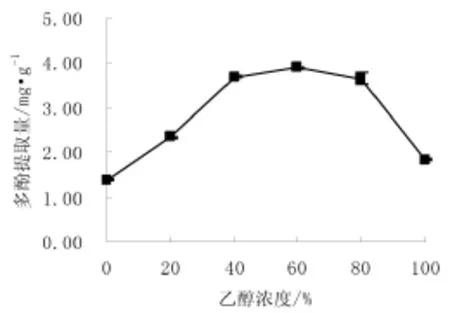
图1 乙醇浓度对蓝莓酒渣中多酚提取的影响Fig.1 Effect of ethanol concentration on extraction of polyphenols in blueberry wine pomace
由图1可知,在乙醇浓度为0%~60%范围内,随着乙醇浓度的增加,多酚提取量呈增加趋势,当乙醇浓度达到60%时,提取量最大。当乙醇浓度大于60%时,多酚提取量呈下降趋势。乙醇浓度过高时会溶出较多的醇溶性色素、杂质、亲脂性强的成分,这些成分可与多酚形成氢键,同时高浓度提取液会导致组织的通透性下降,导致多酚提取量下降[11]。提取液浓度为40%、60%时,总酚提取量差异无显著意义(P>0.05),因此,选择浓度40%乙醇水溶液为提取剂进行后续单因素试验。
2.3 盐酸的浓度对多酚提取的影响
分别以含0.00%、0.10%、0.20%、0.30%、0.40%、0.50%盐酸的40%乙醇水溶液为提取剂,料液比1∶20,30℃水浴振荡(200 r·min-1)1 h,盐酸浓度对多酚提取量的影响见图2。

图2 盐酸浓度对蓝莓酒渣中多酚提取的影响Fig.2 Effect of hydrochloric acid concentration on extraction of polyphenols in blueberry wine pomace
由图2可知,以不同浓度的盐酸-40%乙醇水溶液为提取剂时,盐酸浓度的变化对多酚提取量的影响较小,变化规律并不明显(P>0.05),但少量的酸利于花色素的的溶出[12],有利于多酚的提取及稳定。因此,选择浓度为含0.1%盐酸的40%乙醇水溶液为提取剂进行后续单因素试验。
2.4 料液比对多酚提取的影响
以含0.1%盐酸的40%乙醇水溶液为提取剂,料液比为1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL),30℃水浴振荡(200 r·min-1)1 h。料液比对多酚提取量的影响见图3。

图3 料液比对蓝莓酒渣中多酚提取的影响Fig.3 Effect of material-solvent ratio on extraction of polyphenols in blueberry wine pomace
由图3可知,多酚提取量随料液比的增加而提高。其中在料液比1∶40时达到较高值,之后趋于平缓。这是因为溶剂用量的增加达一定程度,多酚的溶出近于饱和,提取量不再增加;此外,溶剂用量较大时,体系振荡过程中溶剂含氧量增加,多酚易于被氧化,从经济角度考虑料液比增大会提高提取剂成本[13]。因此,选择料液比为1∶30进行后续单因素试验。
2.5 时间对多酚提取的影响
以含0.1%盐酸的40%乙醇水溶液为提取剂,料液比为1∶30(g∶mL),30℃水浴振荡(200 r·min-1)。提取时间对多酚提取量的影响见图4。

图4 提取时间对蓝莓酒渣中多酚提取的影响Fig.4 Effect of time on extraction of polyphenols in blueberry wine pomace
由图4可知,在提取时间1~4 h范围内,随时间的增加,多酚提取量呈增加趋势,4 h时提取量最大,此后,开始降低。这是因为随着提取时间的延长多酚充分溶解于溶剂中,使多酚提取量增加。而4 h后使多酚提取量降低可能有两方面原因,一方面可能是提取时间的增加引起蓝莓酒渣细胞基质中的其他组分的溶出量的增加,使溶剂的粘度变大,溶质中总酚的输出速率受到阻碍而减小;另一方面原因可能是时间过长会因温度的影响使多酚的分子结构破坏[14],例如被氧化成醌类化合物,从而使多酚提取量下降。提取2 h与4 h时,提取量相差不大,因此,选择提取时间为2 h进行后续单因素试验。
2.6 温度对多酚提取的影响
以含0.1%盐酸的40%乙醇水溶液为提取剂,料液比1∶30(g∶mL),水浴振荡(200 r·min-1)2 h。提取温度对多酚提取量的影响见图5。

图5 温度对蓝莓酒渣中多酚提取的影响Fig.5 Effect of temperature on extraction of polyphenols in blueberry wine pomace
由图5可知,随着温度的升高,多酚提取量在30℃~80℃之间逐渐上升,80℃达到最大(9.03 mg·kg-1),此后明显下降。这是由于升高温度能提高总酚的溶解度和扩散系数,利于细胞破碎、提高细胞膜的通透性。但过高的温度会加速多酚的氧化,降低总酚含量[15-16]。
2.7 提取工艺的正交试验
由单因素试验结果,选择对多酚影响较大的乙醇浓度、提取温度、提取时间和料液比4个因素,设计L43(9)正交试验,优化蓝莓酒渣中多酚的提取工艺。因素水平设计及结果分别见表1、表2。

表1 正交试验因素与水平Table 1 Factor and level of orthogonal experiment

表2 正交试验直观分析Table 2 Intuitive analysis of orthogonal experiment

表3 正交实验方差分析Table 3 Variance analysis of orthogonal experiment
由表2可知,影响蓝莓渣多酚提取量的因素依次为有乙醇浓度、提取温度、提取时间、料液比,提取时间最佳工艺条件为A2B3C3D3,即最佳提取工艺为乙醇浓度60%、提取温度80℃、提取时间3 h、料液比1∶40。在此条件下进行三次平行验证试验,提取量为8.89±0.08 mg·g-1。
2.8 蓝莓酒渣多酚粗提物得率和总酚纯度
在上述条件下,将提取液浓缩、冻干后,根据公式(2)计算出提取液粗提物得率为22.1%,根据公式(3)计算出多酚纯度为5.69%。安晓婷报道的蓝莓果渣多酚在AB-8树脂纯化前纯度为11.05%[17-18],高于试验获得的多酚产品纯度,是因为发酵过程中多酚的含量呈现先上升后下降的趋势[7],酒渣中多酚含量较低;另外,因发酵工艺的需要,提取物中可能含有一定量可溶于60%乙醇的蔗糖及发酵后的单糖等产物,导致其冻干后的固体中多酚纯度较蓝莓果渣提取物中多酚低。
3 结论
蓝莓酒渣中多酚在醇溶液中的溶解性比较好,在酸性条件下较稳定,以蓝莓酒渣为原料提取多酚的优化工艺为:以含0.1%盐酸的60%乙醇水溶液为提取剂,料液比1∶40(g∶mL),80℃提取3 h。此时蓝莓酒渣中多酚提取量为8.89 mg·g-1,提取物得率为22.1%,提取物多酚纯度为5.69%。
蓝莓酒渣中多酚提取的方法研究,能够为下一步开展蓝莓多酚的纯化提供原料和技术支持,为蓝莓酒渣中生物活性成分的基础研究提供指导。对于拓展蓝莓鲜果资源的综合利用领域,减少废物排放,降低生产成本,提高生产效率,具有一定的应用意义。
[1]孙志健.对蓝莓产业化发展的思考[J].食品工业科技,2005,26(12):183-184.
[2]胡雅馨,李京,惠伯棣.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2006,27(10):600-603.
[3]Sellappan S,Akoh C C,Krewer G.Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries[J].Journal of Agricultural and Food Chemistry,2002,50(8):2432-2438.
[4]顾姻,贺善安.蓝浆果与蔓越橘[M].北京:中国农业出版社,2001.
[5]翁芳华,陈建业,温鹏飞,等.蓝莓酒中11种酚酸的高效液相色谱测定[J].食品科学,2006,27(9):223-226.
[6]翁芳华,温鹏飞,黄卫东,等.蓝莓酒中5种黄烷-3-醇单体高效液相色谱检测研究[J].中国酿造,2006,115(2):61-64.
[7]黄晓杰,柴哲,杨钟燕,等.蓝莓酒发酵过程中抗氧化物质变化规律研究[J].食品工业科技,2013,34(17):103-105.
[8]王超.蓝莓酒渣花色苷的提取及抗氧化活性研究[D].大庆:黑龙江八一农垦大学,2015.
[9]Cai Y Z,Luo Q,Sun Mei S,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J].Life Sciences,2004,74(17):2157-2184.
[10]GB/T 8313-2008.茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008.
[11]石碧,狄莹.植物多酚[M].北京:科学出版社,1992.
[12]刘海军,孙井坤.萝卜红色素的提取工艺研究[J].黑龙江八一农垦大学学报,2014,26(1):55-58.
[13]崔泰花,沙迪,申玉,等.桔梗茎叶多酚提取工艺的优化[J].延边农业大学学报,2015(3):221-225.
[14]安晓婷,王兴娜,周涛,等.响应曲面法优化蓝莓渣多酚提取工艺[J].食品工业科技,2012,33(15):269-273.
[15]李颖畅,孟宪军.酶法提取蓝莓果中花色苷的研究[J].食品工业科技,2008,29(4):215-218.
[16]徐美玲,赵德卿.蓝莓花青素的提取及理化性质的研究[J].食品研究与开发,2008,29(9):187-189.
[17]安晓婷,周涛,李春阳,等.大孔树脂纯化蓝莓果渣多酚及其组成分析[J].食品科学,2013,34(20):1-6.
[18]李浩,贺帮亮,洪松,等.大蒜渣中多酚物质的提取研究[J].安徽农业科学,2014,42(30):10669-10672.
Extraction Process of Polyphenols from Blueberry W ine Pomace
Liu W enjing1,Xu W anmeng1,W ang Chengyu1,Li Dandan1,W ang Chao2,Guo Dejun1,Ruan Changqing1
(1.College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Jiusan Group Tianjin Soybean Science and Technology Company Limited)
To take full advantage of polyphenols resources in blueberry wine pomace,solvent extraction process of polyphenols from blueberry wine pomace was studied on the basis of single factor test.The results showed that the optimum extraction process of polyphenols in blueberry wine pomace included 60%ethanol aqueous solution containing 0.1%hydrochloric acid as extraction solvent,solid-liquid ratio of 1∶40(g∶mL),extraction temperature of 80℃,and extraction time of 3 hours.Under these conditions,the extraction amount of polyphenols was 8.89 mg·g-1,the yield of crude extract was 22.1%and total phenols purity was 5.69%.It provided the basis for the research and utilization of bioactive constituents in blueberry wine pomace.
blueberry;wine pomace;polyphenols;extraction process
TS261.9
A
1002-2090(2016)03-0082-05
10.3969/j.issn.1002-2090.2016.03.017
2015-06-03
黑龙江省大学生创新创业训练计划项目(201410223012);黑龙江省农垦总局科技局技术开发项目(HNK13KF-15-01)。
刘文静(1992-),女,黑龙江八一农垦大学食品学院食品科学与工程专业2011级本科生。
阮长青,男,教授,硕士研究生导师,E-mail:cqruan@163.com。
