Sidt2 基因剔除小鼠的肺部形态学改变
2016-08-05王李卓夏礼斌陈月平高家林
蒋 雪,章 尧,王李卓,王 云,夏礼斌,陈月平,王 莹,高家林
(1.皖南医学院第一附属医院 弋矶山医院 呼吸内科,安徽 芜湖 241001;2.皖南医学院 活性生物大分子安徽省重点实验室,安徽 芜湖 241002;3.皖南医学院 生物化学教研室,安徽 芜湖 241002 ;4.皖南医学院第一附属医院 弋矶山医院 内分泌科,安徽 芜湖 241001)
·基础医学·
Sidt2 基因剔除小鼠的肺部形态学改变
蒋雪1,2,章尧2,3,王李卓2,3,王云1,夏礼斌4,陈月平4,王莹1,高家林4
(1.皖南医学院第一附属医院 弋矶山医院呼吸内科,安徽芜湖241001;2.皖南医学院活性生物大分子安徽省重点实验室,安徽芜湖241002;3.皖南医学院生物化学教研室,安徽芜湖241002 ;4.皖南医学院第一附属医院 弋矶山医院内分泌科,安徽芜湖241001)
【摘要】目的:观察Sidt2基因剔除小鼠的肺组织超微结构,探讨Sidt2基因在肺脏形态发育过程中的作用。方法:将利用基因打靶及同源重组技术获得的Sidt2基因全身剔除小鼠和野生型B129品系小鼠合笼交配,鼠尾提取DNA进行基因型鉴定,挑选出子代Sidt2-/+小鼠,同笼交配,再挑选出子代Sidt2-/-小鼠为实验组,以同窝野生型小鼠为对照,进行DNA、RNA和Western鉴定,并行肺组织光镜和电镜形态学观察。结果:通过DNA、RNA、蛋白质水平验证模型构造成功。光镜下对照鼠肺泡壁光滑,仅有少量粒细胞浸润;模型鼠肺泡间质内毛细血管扩张、充血,多处炎症细胞呈灶状分布。电镜下对照鼠的肺组织形态较规则;模型鼠可见肺泡上皮细胞崩解,毛细血管充血及基底膜增厚。结论:Sidt2基因剔除可影响小鼠肺组织形态,表现为细胞坏死,毛细血管充血及基底膜增厚,大量炎症细胞浸润,造成肺损伤。
【关键词】溶酶体膜蛋白;Sidt2;肺部形态;炎症;肺损伤
【DOI】10.3969/j.issn.1002-0217.2016.04.001
溶酶体(lysosome)是负责细胞内蛋白降解的主要细胞器[1],参与营养物质和一些无机电解质输入细胞,代谢产物排出细胞以及细胞膜内外信号的传递等作用。目前已经发现的溶酶体膜蛋白有50余种。溶酶体膜蛋白广义上可包括溶酶体相关膜蛋白(lysosome-associated membrane proteins,LAMP)和溶酶体全膜蛋白(lysosome-integral membrane proteins)。最新的蛋白质组学研究发现,Sidt2是新型的溶酶体候选蛋白,832个氨基酸,分子量为94.5 kU,是Sidt1横跨膜转运蛋白家族的候选成员[2]。Sidt2是高度糖基化的溶酶体膜蛋白,生物信息学研究表明,Sidt2是多通道跨膜结构,10个N型糖基化位点和两个依赖络氨酸的溶酶体胞质靶点,此蛋白具有溶酶体膜蛋白的多种特性:①单个或多种跨膜结构;②溶酶体细胞器分选信号;③适度的糖基化修饰;④一定的疏水特性[3]。符合作为溶酶体全膜蛋白的分子特征。Sidt2蛋白具有组织表达特异性,在细胞亚结构层面,Sidt2只表达于周围神经系统和溶酶体,并且在溶酶体中高表达[4]。根据推断,Sidt2可能与维持溶酶体膜的完整性和转运降解产物有关。目前已发现,溶酶体与矽肺[5]、肿瘤有关[6],据研究报道LAMP1/2作为溶酶体的全膜蛋白,不仅参与膜的组成,还参与细胞自噬/凋亡途径的调控[7]。溶酶体酸性脂肪酶基因敲除(LAL-/-)的老鼠出现巨噬细胞和肺泡Ⅱ型细胞内中性脂质的累积,影响肺泡内稳态,导致肺泡内大量炎症细胞浸润和肺组织结构的重塑[8]。本实验中,Sidt2基因剔除小鼠的肺脏有多处肺泡上皮细胞的坏死和大量炎症细胞的浸润。那么,Sidt2作为溶酶体膜蛋白在肺脏中起什么作用?是否参与肺脏的正常形态和生理功能的维持?本文就Sidt2基因剔除对小鼠肺脏的形态学影响进行探讨。
1材料和方法
1.1实验动物动物实验室温度22~25 ℃,湿度50%~60%,基础饲养状态下不限食水,鼠龄6~8周。野生型B129小鼠购自上海必凯实验动物中心。本实验动物处置方法符合动物伦理学标准。
1.2小鼠繁育已经通过基因打靶及同源重组技术获得了Sidt2基因全身剔除模型(Sidt2-/-)小鼠,将Sidt2-/-雄鼠与B129品系的野生型同种雌鼠 1∶3合笼交配,子代小鼠基因型鉴定,8周龄时获得Sidt2-/+小鼠,按雌雄比3∶1同笼交配,子代小鼠基因型鉴定,挑选出体质量(21±1)g,8周龄Sidt2-/-小鼠为实验组,以同窝野生型小鼠为对照组。
1.3基因型鉴定(包括DNA、RNA和蛋白水平鉴定)①鼠尾中抽提DNA进行基因型鉴定,严格按照试剂盒要求操作。②取小鼠肺脏进行RNA水平验证小鼠基因型。引物序列:上游引物,5′-ATGTGGTGGTGGTAGTGAAG-3′;下游引物,5′-AGATACACCACCACCATCAC-3′。引物由上海生工生物技术工程有限公司合成。 ③取小鼠肺脏提取蛋白进行Western试验从蛋白质水平验证小鼠基因型。
1.4HE染色和光镜观察取材和固定:麻醉动物,迅速打开胸腔将整个肺脏取出。随机将一侧肺组织投入 4%甲醛固定液固定,4 ℃保存;将另一侧肺组织固定于2.5%戊二醛磷酸缓冲液,4 ℃保存。将固定后的组织脱水透明、浸蜡包埋、切片粘片、脱蜡染色、分化漂洗、脱水复染、脱水透明,最后封藏于倒置相差显微镜(日本Olympus公司)下进行观察。
1.5透射电镜分析取出固定于2.5%戊二醛磷酸缓冲液的肺组织,修成体积不超过1 mm×1 mm×1 mm后进行前固定、漂洗,后固定、漂洗、脱水、置换、浸透、包埋、切片后染色,在PHILIP(CM-120)透射电镜下观察。
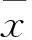
2结果
2.1Sidt2基因剔除小鼠DNA水平基因型鉴定由图1可见,1号的第一、二条带DNA大小分别为200 bp、280 bp,为杂合子;2号的第一条没有条带,第二条条带DNA大小为280 bp,为野生型;3号的第一条条带DNA大小为200 bp,第二条没有条带,为纯合子。

1号为杂合子;2号为野生型;3号为纯合子。
图1Sidt2基因剔除小鼠DNA水平的基因型鉴定
2.2Sidt2基因剔除小鼠RNA水平基因型鉴定由图2可见,GAPDH条带大小为150 bp,1号为野生型,目的条带大小为750 bp;2号为纯合子,没有条带;3号为杂合子,目的条带大小为750 bp,1号野生型目的条带浓度为3号杂合子的近两倍。

1号为野生型;2号为纯合子;3号为杂合子。
图2Sidt2基因剔除小鼠的RNA水平基因型鉴定图
2.3Western鉴定结果 各组小鼠肺组织Sidt2蛋白含量检出率分别为:野生型(1.81±0.57)、杂合子(0.64±0.15)、纯合子(0.21±0.02),采用单因素方差分析(F=41.4,P<0.01), 3组间两两比较差异有统计学意义(P<0.05)。
蛋白质水平鉴定结果:1号条带为野生型;2号条带为纯合子;3号条带为杂合子。由图3可见野生型Sidt2蛋白浓度大于杂合子,纯合子几乎没有蛋白浓度。Sidt2蛋白大小为120~130 kU。Sidt2蛋白的预测大小是94.5 kU,但是通过Western blot检测小鼠的各个组织,Sidt2的分子量大小在120~130 kU,因为许多溶酶体膜蛋白,包括多重跨膜蛋白都是糖基化蛋白,这些蛋白检测出的分子量都不是统一的,并且大于它们原本的分子序列量。
野生型小鼠的Sidt2蛋白含量最高,纯合子含量最少,但也有少量的表达, 3组间表达有差异。

*表示与野生型比较P<0.05;#表示与杂合子比较P<0.05。
图3Sidt2基因剔除小鼠蛋白质水平基因型鉴定图
2.4小鼠一般情况对照组小鼠毛发有光泽,无呼吸频率加快,进食正常,对刺激反应能力无下降。模型组小鼠毛发直立无光泽,呼吸频率加快,进食差,对刺激的反应能力下降,活动少。存活的模型小鼠在生长发育期病死率较野生型明显增高。在生长期,模型鼠的生长发育落后于野生小鼠(图4)。

A:模型鼠,B:对照鼠。
图4野生型小鼠与Sidt2基因剔除小鼠的对照图
2.5Sidt2剔除小鼠肺组织光镜下表现正常对照组小鼠肺组织 HE 染色光镜下可见肺结构完整,各处肺泡间隔厚度正常均一,肺泡壁光滑,肺泡腔内无痰栓,肺间质内仅有少量粒细胞浸润。模型组可见肺内过度、失控的炎症反应,肺泡间隔内毛细血管扩张、充血,支气管腔内可见痰栓,见图5。

A(×40)、B(×400)为正常对照组小鼠肺组织 HE 染色光镜下肺组织结构,肺泡壁光滑,无炎症浸润。C(×40)、D(×400)为模型组小鼠肺组织结构,可见大量炎症细胞浸润,支气管腔内可见痰栓。
图5Sidt2基因剔除小鼠与对照组小鼠肺组织光镜图
2.6Sidt2剔除小鼠模型肺脏超微结构改变利用透射电镜技术,进一步在超微结构水平对Sidt2剔除小鼠肺脏组织进行观察,电镜下正常对照小鼠的肺泡上皮细胞可见形态较规则,呈立方形或圆形,表面有很多长短不一的微绒毛。模型鼠:可见肺泡上皮细胞相对不规则,线粒体肿胀,胞质内大量空泡,细胞表面微绒毛减少,并发现细胞崩解。肺间质可见毛细血管充血,肺泡间隔增宽,纤维组织增生,基底膜增厚,见图6。

A、B示正常对照小鼠的肺组织细胞形态较规则。C、D示模型鼠:C可见肺泡上皮细胞崩解(黑、白箭头所指);D可见毛细血管充血(黑色箭头所指),肺泡间隔增宽,间质胶原沉积,基底膜增厚(白色箭头所指)。
图6透视电镜下两组小鼠肺组织模型超微结构
3讨论
研究发现,溶酶体酸性脂肪酶(LAL)基因敲除(LAL-/-)的小鼠出现肺泡Ⅱ型细胞和巨噬细胞内中性脂质的累积,破坏肺泡表面活性物质的构成,导致肺泡内大量的炎症和肺组织结构的重塑[8]。同时溶酶体膜蛋白和自噬又有着千丝万缕的联系,例如:在小鼠体内溶酶体膜蛋白LAMP1和LAMP2[9]的缺失,可导致自噬现象的增加。另LAPTM4B等蛋白则可对自噬产生直接的抑制作用。自噬被认为在炎症反应中起着关键调控作用,自噬缺陷(Atg4b-null)型败血症老鼠相较野生型败血症老鼠的肺部炎症反应增强,表现为炎症因子白介素6(IL-6)、白介素12p40(IL-12p40)等的上升[10]。本实验发现,Sidt2基因的缺失引起肺组织的炎症浸润和肺泡上皮细胞的坏死而造成肺损伤。
Sidt2作为一个新的转运蛋白/通道蛋白,起到物质转运的作用,其转运对象可能是一些氨基酸或是一些其他小分子物质。Sidt2的作用可能包括以下方面:①保护溶酶体膜不被降解,维持溶酶体膜的完整性;②作为膜上的蛋白或跨膜受体起到物质转运作用;③可能介导内吞噬和自噬;④参与细胞内凋亡信号的调控。那么,Sidt2作为溶酶体膜蛋白在溶酶体和肺损伤的关联中起到什么样的作用呢?是影响肺泡内稳态还是抑制自噬而导致炎症反应的失控呢?为进一步弄清Sidt2所起的作用,我们将在后续的实验中以肿瘤细胞株为研究对象,分别利用过表达和干扰的生物技术研究方式探讨Sidt2在肺上皮细胞生长过程中的影响,在肺损伤机制中扮演的角色及其对细胞基本生物机制的作用。
【参考文献】
[1]RAPOSO G,MARKS MS,CUTLER DF.Lysosome-related organelles:driving post-Golgi compartments into specialisation[J].Curr Opin Cell Biol,2007,19(4):394-401.
[2]SCHIEWECK O,DAMME M,SCHROEDER B,etal.NCU-G1 is a highly glycosylated integral membrane protein of the lysosome[J].Biochemical Journal,2009,422(1):83-90.
[3]LIU T,QIAN WJ,GRITSENKO M A,etal.Human plasma N-glycoproteome analysis by immunoaffinity subtraction,hydrazide chemistry,and mass spectrometry[J].Journal of Proteome Research,2005,4(6):2070-2080.
[4]GAO J,GU X,ZHANG H.SID1 transmembrane family,member 2 (Sidt2):A novel lysosomal membrane protein[J].Biochemical & Biophysical Research Communications,2010,402(4):588-594.
[5]RUSHTON L.Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica[J].Reviews on Environmental Health,2007,22(4):255-272.
[6]FOGHSGAARD L,WISSING D,MAUCH D,etal.Cathepsin B Acts as a Dominant Execution Protease in Tumor Cell Apoptosis Induced by Tumor Necrosis Factor[J].Journal of Cell Biology,2001,153(5):999-1010.
[7]ANDRÉ C,CHIANG S C,ANA S,etal.Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage[J].Blood,2013,122(8):1411-1418.
[8]YANG CX,ZHANG XH.Lysosomal acid lipase deficiency causes respiratory inflammation and destruction in the lung[J].American Journal of Physiology Lung Cellular & Molecular Physiology,2004,286(4):L801-L807.
[9]YU L,MCPHEE CK,ZHENG L,etal.Termination of autophagy and reformation of lysosomes regulated by mTOR[J].Nature,2010,465(7300):942-946.
[10] ALINA A,INÉS L A,ADRIN G L,etal.Defective autophagy impairs ATF3 activity and worsens lung injury during endotoxemia[J].Journal of Molecular Medicine,2014,92(6):665-676.
文章编号:1002-0217(2016)04-0307-04
基金项目:国家自然科学基金项目(81200632;81471002);安徽省自然科学基金项目(1308085QH134);弋矶山医院引进人才基金项目(2011014)
收稿日期:2016-01-02
作者简介:蒋雪(1989-),女,2013级硕士研究生,(电话)18356565009,(电子信箱)3186411346@qq.com;
【文献标识码】【中图号】Q 786;R 563A
Lung morphology change in Sidt2 knockout mice
JIANG Xue,ZHANG Yao,WANG Lizhuo,WANG Yun,XIA Libing,CHEN Yueping,WANG Yin,GAO Jialing
Department of Respiratory Medicine,The First Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
【Abstract】Objective:To investigate the role of Sidt2 gene in the lung morphogenesis through examining the lung tissue ultrastructure in Sidt2 knockout mice.Methods: Sidt2(-/-) mice generated by gene targeting and homologous recombination technology were mated with wild-type B129 mice,the genotype was identified by DNA extracted from rat tail.The offspring with the genotype Sidt2(-/+) were crossed each other,the Sidt2(-/-) mice in the F3 generation were selected as experimental group,wild-type littermates as control mice.Lung tissue morphology was observed by light microscopy and electron microscopy after confirming genotype with DNA,RNA and Western blotting.Results:Animal models were successfully established through verification by DNA,RNA and protein levels.Light microscopy indicated smooth alveolar wall of control mice,with a small amount of granulocyte infiltration.Dilated blood capillary,hyperemia,and focally distributed inflammatory cells were observed in alveolar interstitial of model mice.Lung morphology in control mice viewed by electron microscopy,while alveolar epithelial cells disruption,capillary hyperemia and basement membrane thickening were shown in experimental mice.Conclusion:Sidt2 knockout can affect the lung morphology,characterized by cell apoptosis,capillary hyperemia and basement membrane thickening as well as a large number of inflammatory cells infiltration,thus leading to lung damage.
【Key words】lysosome membrane proteins;Sidt2;lung morphology;inflammation;lung injury
王莹,女,主任医师,(电子信箱)w19y29h@163.com,通信作者;
高家林,男,副主任医师,(电子信箱)jialing.gao@yahoo.com,通信作者.
