大豆根际溶磷菌分离鉴定及溶磷过程中有机酸的分泌
2016-08-05杨美英王春红武志海岳胜天刘晶晶孙合美
杨美英, 王春红, 武志海, 岳胜天, 付 丽, 刘晶晶, 孙合美
(1吉林农业大学 生命科学学院, 吉林 长春 130118; 2 吉林农业大学 农学院, 吉林 长春 130118)
大豆根际溶磷菌分离鉴定及溶磷过程中有机酸的分泌
杨美英1, 王春红1, 武志海2, 岳胜天1, 付丽1, 刘晶晶1, 孙合美1
(1吉林农业大学生命科学学院, 吉林 长春 130118; 2 吉林农业大学 农学院, 吉林 长春 130118)
摘要:【目的】明确吉林省地区大豆Glycine max根际溶磷菌的种类及溶磷特点。【方法】利用溶磷圈法筛选溶磷菌,16S rDNA序列测定和Vitek2生理生化系统对菌株进行分析鉴定。测定菌株生长量、溶磷量、培养基pH变化与有机酸的产生。【结果】从大豆根际土壤中分离获得4株溶磷菌株WJ1、WJ3、WJ5和WJ6。4个菌株分别属于假单胞菌属Pseudomonas sp.、肠杆菌属Enterobacter sp.、苍白杆菌属Ochrobacterum sp.和克雷伯菌属 Klebsiella sp.。4株溶磷菌96 h内最大溶磷量分别为558、 478、 596和586 μg·mL-1。甲基红试验和培养物pH测定结果表明:4个菌株在溶磷过程中可使培养物的pH下降,当pH小于4时,会明显阻碍菌株的生长。pH为 5时,WJ1和WJ3的生长受到轻微的影响,WJ5和WJ6能正常生长。GC-MS对菌株在溶磷过程中产生的有机化合物的分析表明,4菌株均分泌多种有机酸,其中α-酮戊二酸在WJ1、WJ3和WJ6菌株溶磷过程中大量产生。【结论】4菌株具有较好的溶磷能力,溶磷过程中分泌有机酸种类不完全相同,有机酸的分泌造成培养基的pH降低,影响菌体生长,而菌体数量决定各菌株的溶磷量。
关键词:大豆; 溶磷菌; pH; 有机酸; 溶磷作用
磷是植物和大部分农作物所需的大量营养元素之一,缺磷会明显抑制植物的生长[1]。不同物种对磷的需求量从10到100 kg·hm-2不等[2]。而土壤中磷易被转化为磷酸钙[Ca3(PO4)2]、磷酸铁 (FePO4)和磷酸铝 (AlPO4)等不溶性磷酸盐,造成土壤中可溶性磷的浓度通常仅为1 mg·L-1或更少[1-3]。因此,为了增加农作物产量与效益,过度施用磷肥已使我国大部分土壤处于富磷状态。
土壤中大多数溶磷菌(Phosphate solubilizing bacteria,PSB)能通过生成有机酸、嗜铁素、矿物酸、质子、腐殖质、CO2和H2S等来释放可溶性磷[4],有效提高土壤中植物可利用磷的含量,同时也可以减少化肥的使用[5]。有研究表明,由于微生物对各种根系信号传导和分泌模式有不同的应答,尤其是当植物处于磷胁迫状态下,微生物群落受不同植物种类的影响较大[6]。Kobus等[7]发现溶磷微生物在土壤中的数量受土壤物理结构、有机质含量、土壤类型、土壤肥力、耕作方式和措施等因素的影响。目前共有89种溶磷微生物被鉴定,其中27种真菌,58种细菌和4种放线菌。相较于真菌和放线菌,溶磷菌是溶磷微生物的主要种类[8]。
中国东北黑土区是重要的粮食生产基地,过去的20年由于土壤腐蚀和大量施肥,黑土中磷的总量日趋增加[9],但磷的当季利用率仅有5.12%[10]。大豆Glycinemax是该地区主要农作物之一,平均种植面积2010年已经增长到800万 hm2[11]。因此,明确黑土区大豆根际溶磷菌的种类与溶磷特点,发现大豆专属生物菌肥的有效菌源,在降低农业生产成本及资源节约利用方面将有重要的意义。但关于东北黑土区溶磷菌的研究报道并不多见。本研究从吉林省地区大豆根际土壤中分离到4株优势PSB,命名为WJ1、WJ3、WJ5和WJ6,并对这4种菌株的溶磷和产酸特性进行分析比较。
1材料与方法
1.1土壤样品及培养基
3种土壤样品均取自于中国东北吉林省地区(吉林农业大学大豆试验田,长春市农安县大豆试验地和吉林省公主岭大豆试验地)的大豆根际土壤。NBRIP液体生长培养基[12]配方为:10 g·L-1葡萄糖, 5 g·L-1MgCl2·6H2O,0.25 g·L-1MgSO4·7H2O, 0.2 g·L-1KCl, 0.1 g·L-1(NH4)2SO4和5.0 g·L-1Ca3(PO4)2作为磷源,pH 7。固体培养基需添加15 g·L-1琼脂。改良NBRIP培养基:pH 8,0.5 g·L-1蛋白胨代替0.1 g·L-1(NH4)2SO4。LB培养基配方为:10 g·L-1NaCl, 10 g·L-1胰蛋白胨, 5 g·L-1酵母膏。
1.2PSB菌株的分离和鉴定
为了从土壤中分离得到PSB,每份土样与无菌水按质量比1∶100混合摇床震荡1 h。然后将逐级稀释的上清液涂布NBRIP固体培养基。28 ℃培养2 d,有明显溶磷圈的菌落为PSB[13]。在NBRIP琼脂平板上进行3~4次的纯化培养。纯化后的菌株-70 ℃条件保存备用。
利用Vitek2 (bioMerieus, France) 细菌自动分析系统和16S rDNA分子生物学技术进行菌株鉴定。分别提取WJ1、WJ3、WJ5和WJ6的总DNA,进行16S rDNA序列扩增,PCR所用引物分别对应于大肠埃希菌 (GenBank序列号为J01859)的7~26位和1 512~1 491位[14],上、下游引物序列分别为,5′-AGAGTTTGATCATGGCTCAG-3′和5′-TACGGTTACCTTGTTACGACTT-3′。PCR产物由上海生工生物工程股份有限公司进行测序。GenBank DNA数据库和BLAST程序查找同源序列。
1.396 h细菌溶磷量与生长量的测定
菌株WJ1、WJ3、WJ5和WJ6分别接种在LB培养基中,当培养液细胞浓度为D600 nm=0.6时,按体积分数为0.5% 接种于100 mL改良NBRIP培养基。连续培养96 h,每隔6 h取样,标准板计数法测定细胞数量,钼蓝比色法测定溶磷量。
1.4细菌生长对培养基pH的影响
利用甲基红显色反应检测细菌溶磷过程中改良NBRIP培养基pH的变化。溶磷菌的培养同“1.3”,每隔1 h取PSB菌液2 mL,与100 μL 0.5 g·L-1的甲基红指示剂混合以记录培养基的颜色。利用同样的方法将4个菌株的培养液分别接种到100 mL改良NBRIP培养基和LB培养基中,培养12 h,每隔2 h取菌液2 mL,利用pH计记录培养基的pH。
1.5培养基初始pH对细菌生长的影响
将LB液体培养基pH分别调至3、 4、 5、 6、 7、 8、 9,按上面所述方法向LB培养基中接入4株分离的菌株,每隔2 h取1次菌液,记录12 h内D600 nm的值。
1.6PSB菌株有机酸的提取
为了测定不同PSB菌株产有机酸种类,将WJ1、WJ3、WJ5和WJ6种子液(同“1.3”)接种到改良NBRIP培养基中培养24 h后,培养液6 000 r·min-1离心15 min。上清液用0.22 μm滤膜真空抽滤,通过转酯作用对样品进行甲酯化反应[15]。每个样品取5 mL滤液与9 mL甲醇-硫酸(体积比=10∶7)混合,60℃培养12 h,待培养液冷却后离心分离,将5 mL甲醇加入到离心后的上清液中,上清液合并转移到60 mL分液漏斗中,再加入1 mL饱和NaCl溶液、20 mL蒸馏水、5 mL二氯甲烷进行洗涤,剧烈振荡60 s后静置分层。将脱水后的二氯甲烷相在40 ℃水浴条件下利用氮气吹干,然后准确加入1 mL二氯甲烷。以未接种的培养基作对照。样品进行GC-MS分析。
1.7PSB菌株有机酸的GC-MS分析
Agilent 5975c ga系统装置购于美国Agilent公司, 采用3轴的HED-EM质谱检测系统。Agilent hp-35弹性石英毛细管柱为30 m×0.25 mm×0.25 μm,采用氦气为1.0 mL·min-1的恒速流动模式。柱箱程序升温,初始温度为80 ℃,保持2 min,然后以5 ℃·min-1的速率升温至280 ℃,保持15 min。通过与Wiley 7 和 NIST库匹配的质谱来鉴定成分。
1.8统计分析
采用Windows XP系统中DPS统计软件(12.01版)分析数据。
2结果与分析
2.1PSB菌株的分离与鉴定
按照溶磷圈大小,从大豆根际土壤分离获得WJ1、WJ3、WJ5和WJ6共4株溶磷能力较强的菌株。各菌株16S rRNA基因序列利用GenBank DNA 数据库进行BLAST同源性比较,结果表明:菌株WJ1(登录号KM975675)与PseudomonasputidaN-128 (登录号JN216880.1)的相似性为99%;菌株WJ3(登录号KM975676)与Enterobactercloacaesubsp. Cloacae ENHKU01 (登录号CP003737.1)的相似性为99%;菌株WJ5(登录号KM975677)与OchrobacterumhaematophilumATCC49188 (登录号NR-074243.1)的相似性为98%;菌株WJ6(登录号KM975678)与Klebsiellapneumoniae342 (登录号 CP000964.1)的相似性为98%。结合Vitek 2自动分析系统结果,将菌株WJ1、WJ3、WJ5和WJ6分别鉴定为假单胞菌Pseudomonassp.、肠杆菌Enterobactersp.、苍白杆菌Ochrobacterumsp.和克雷伯菌Klebsiellasp.。
2.2PSB菌株溶磷量与生长曲线的变化
为了研究pH、生长量和溶磷量之间的关系,将4株溶磷菌接种到以Ca3(PO4)2为唯一磷源的改良NBRIP培养基中。由图1可知,各菌株的溶磷量和细胞生长量有明显的关系,当菌株生长量达到最大值时,溶磷量也趋于最大。溶磷菌WJ1、WJ3、WJ5、WJ6经过6 h延滞期后,开始以对数形式增长,之后分别在42、 36、 30和30 h时达到稳定期,稳定期分别维持在42~60、 36~48、 30~54和30~54 h。液体培养基中释放的可溶性磷的量随时间的变化逐渐增长,4种PSB最大溶磷量分别为558、 478、 596和 586 μg·mL-1。在最初的12 h 时,WJ5的溶磷能力都低于其他菌株,24 h之后溶磷量明显高于WJ1和WJ3。
2.3细菌溶磷过程中培养基pH的变化
PSB在溶解磷酸盐过程中能够产酸[16-17]。虽然磷酸盐溶解的机理仍有许多不明之处,但已有报道称有机酸的释放导致的pH下降可能与溶磷作用相关[18]。甲基红试验表明:加入指示剂后,各菌株的培养物都观察到一致的颜色变化趋势(图2):由黄色变为橙色,最后变为红色,但不同菌株菌液达到红色的时间明显不同。菌株WJ1、WJ3、WJ5、WJ6分别在4、 3、 8和2 h时开始变色,在6、 17、 13和4 h后保持红色不变。由图3可知,在改良NBRIP培养基中,细菌的生长过程伴随明显的pH下降。在12 h内,菌株WJ1、WJ3、WJ6培养物的pH从开始的8降到3~5。12 h内相对应的LB液体培养基的pH略有下降,之后又恢复到最初的数值。菌株WJ5在LB培养基中培养,12 h 内培养液pH略有下降,在改良NBRIP培养基中培养12 h后,与其他3株菌相比,培养液pH下降较小。
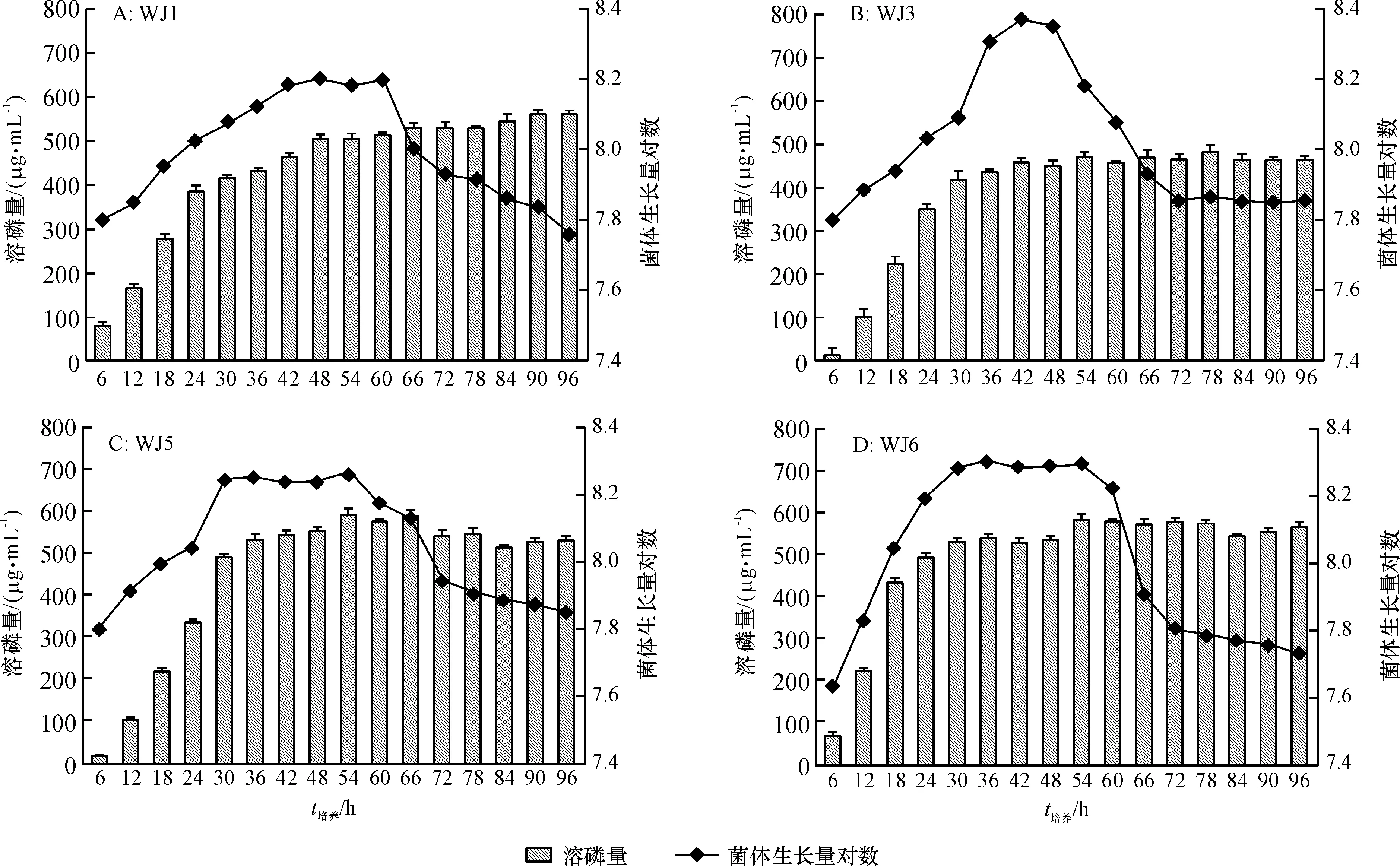
图1 不同溶磷菌在接菌96 h内溶磷量与生长曲线的变化

图2 不同溶磷菌的培养基在接菌18 h内的甲基红显色结果
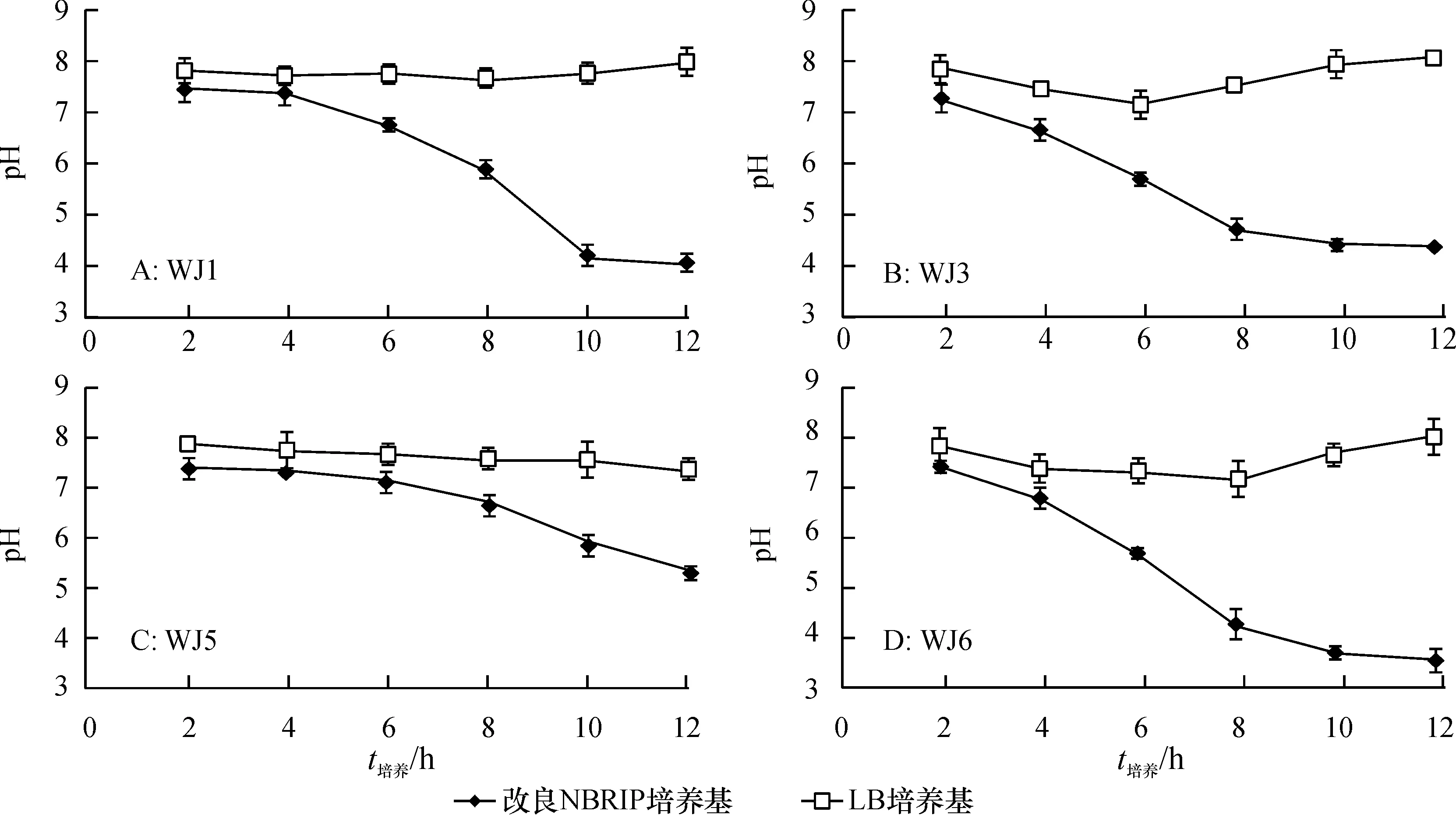
图3 不同溶磷菌在12 h内对改良NBRIP和LB培养基pH的影响
2.4培养基初始pH对PSB菌株生长的影响
为了研究pH和细胞生长量之间的关系,在初始pH为3~9的LB培养基中对PSB的生长进行了观测。由图4可知,各pH条件下,WJ1、WJ3、WJ5和WJ6的细胞生长趋势相似。培养基pH低于4时,各菌株生长量明显下降。pH为5的条件下,WJ1和WJ3的生长轻微减缓,而WJ5和WJ6仍正常生长。
2.5PSB溶磷过程中产有机酸的分析
对4菌株24 h培养物中的有机化合物进行GC-MS分析。表1显示, WJ1、WJ3、WJ5、WJ6菌株的培养滤液中分别检测到6、8、8和7种有机化合物,这些有机化合物中包含了不同种类的有机酸。其中,乙酰丙酸的相对含量最高,但其是对照中检测到的仅有的有机酸成分,因而不能认定乙酰丙酸为PSB菌株溶磷过程中产生的。2,2-二甲氧基丙酸是4种菌株培养滤液中另一种共有的成分,相对于检测到的化合物总量所占百分比分别为:1.52%、2.36%、 4.04%和 3.44%。WJ1、WJ3、WJ6培养滤液中α-酮戊二酸的相对含量较高,分别达到21.46%、26.53%和23.80%。此外,WJ3与WJ6还检测到3种相同的物质,包括bis- (methoxycarbony) ethoxyiminomethane、琥珀酸、柠檬酸。
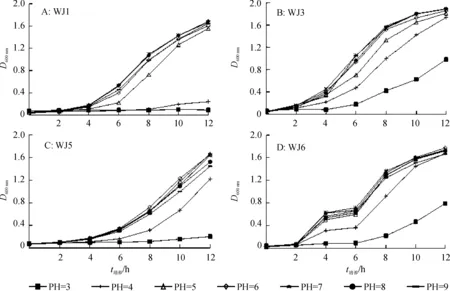
图4 不同溶磷菌在不同初始pH LB培养基中的生长曲线
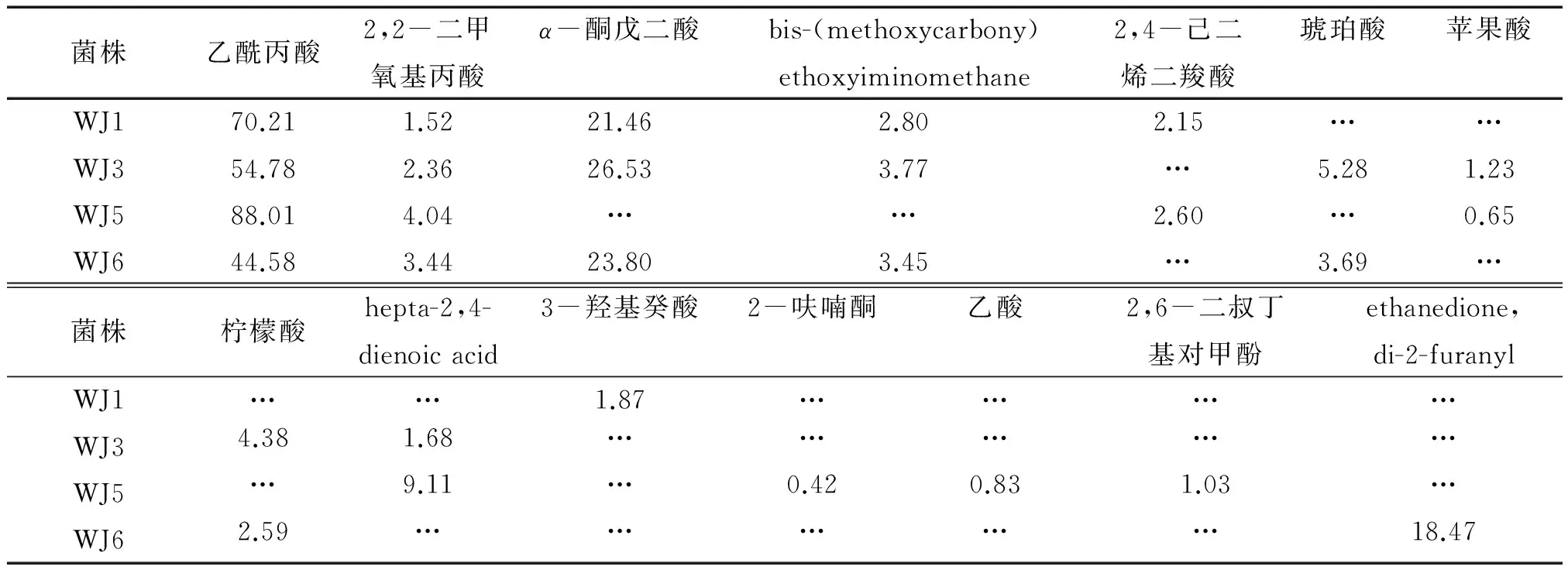
菌株乙酰丙酸2,2-二甲氧基丙酸α-酮戊二酸bis-(methoxycarbony)ethoxyiminomethane2,4-己二烯二羧酸琥珀酸苹果酸WJ170.211.5221.462.802.15……WJ354.782.3626.533.77…5.281.23WJ588.014.04……2.60…0.65WJ644.583.4423.803.45…3.69…菌株柠檬酸hepta-2,4-dienoicacid3-羟基癸酸2-呋喃酮乙酸2,6-二叔丁基对甲酚ethanedione,di-2-furanylWJ1……1.87…………WJ34.381.68……………WJ5…9.11…0.420.831.03…WJ62.59……………18.47
1)…表示未检测到。
3讨论与结论
甲基红试验和pH测定结果表明:PSB溶磷过程中pH会不断下降,pH降低到一定值时溶磷量也不再增加,这与菌株Ps.fluorescensRAF15表现的规律基本一致[9]。GC-MS对培养基上清液中有机酸的测定结果证实,pH的下降是有机酸分泌的结果。PSB耐酸性的强弱决定了细胞数量,而当细胞数量较多、生长稳定期较长,则溶磷量较大。菌株WJ5和WJ6具有更好的耐酸性,且WJ5分泌酸比较晚,有利于菌体生长;菌株WJ6的生长表现出更长的稳定期。因此,WJ1、WJ3、WJ5和WJ6产酸对于溶磷是1个必要条件,但是不同PSB菌株的溶磷能力依赖于活细胞的数量和其耐酸性。

本试验从东北大豆根际土壤中分离获得4株溶磷菌株WJ1、WJ3、WJ5和WJ6,分别被鉴定为假单胞菌属、肠杆菌属、苍白杆菌属和克雷伯氏菌属。4株溶磷菌96 h内最大溶磷量分别为558、 478、 596和586 μg·mL-1。4个菌株均分泌有机酸,但有机酸种类不完全相同,有机酸的分泌造成培养基pH降低,pH低于4时,明显影响溶磷菌的数量,而菌体数量多,菌体在平台期维持的时间较长,溶磷量较大。
参考文献:
[1]VYAS P, ARVIND G. Organic acid production in vitro and plant growth promotion in maize under controlled envi-ronment by phosphate-solubilizingPseudomonasfluores-cent[J]. BMC Microbiol, 2009, 9(1): 174-188.
[2]YADAV B K, TARAFDAR J C. Ability of Emericella rugulosa to mobilize unavailable P compounds during Pearl millet[Pennisetumglaucum(L.) R. Br.] crop under arid condition[J]. Indian J Microbiol, 2007, 47(1): 57-63
[3]CHUNG H K, PARK M S, MUNUSAMY M H Y. Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea[J]. Soil Biol Biochem, 2005, 37(10): 1970-1974.
[4]孙振宁, 段兴武, 谢云. 东北典型黑土供肥量与大豆肥料利用率[J]. 中国农学通报, 2012, 28(15): 46-51.
[5]YANG P X, MA L, CHEN M H, et al. Phosphate solubilizing ability and phylogenetic diversity of bacteria from P-rich soils around Dianchi Lake drainage area of China[J]. Pedosphere, 2012, 22(5): 707-716.
[6]RODRIGUEZ H, REYNALDO F. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnol Adv, 1999, 17(4/5): 319-339.
[7]KOBUS J. The distribution of microorganisms mobilizing phosphorus in different soils[J]. Acta Microbiol Pol, 1962, 11: 255- 264.
[8]LIU H, WU X Q, REN J H, et al. Isolation and identification of phosphobacteria in poplar rhizosphere from different regions of China[J]. Pedosphere, 2011, 21(21): 90-97.
[9]PARK K H, LEE C Y, SON H J. Mechanism of insoluble phosphate solubilization byPseudomonasfluorescensRAF15 isolated from ginseng rhizosphere and its plant growth-promoting activities[J]. Lett Appl Microbiol, 2009, 49(49): 222-228.
[10]段兴武, 赵振, 刘刚. 东北典型黑土区土壤理化性质的变化特征[J]. 土壤通报, 2012, 43(3): 529-534.
[11]薛庆喜. 中国及东北三省30年大豆种植面积、总产、单产变化分析[J]. 中国农学通报, 2013, 29(35): 102-106.
[12]PARK J H, NANTHI B, MALLAVARAPU M, et al. Concomitant rock phosphate dissolution and lead immobilization by phosphate solubilizing bacteria(Enterobactersp.)[J]. J Environ Manage, 2011, 92(4): 1115-1120.
[13]NAUTIYALA C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiol, 1999, 170(1): 265-270.
[14]YANG M Y, LI W M, GUO X X, et al. Isolation and identification of a carbazole degradation gene cluster fromSphingomonassp. JS1[J]. World J Microbiol Biotechnol, 2009, 25(9): 1625-1631.
[15]谢文明, KO K Y, LEE K S. 土壤和白菜中低分子量有机酸的气相色谱分析[J]. 岩矿测试, 2009, 28(2): 97-100.
[16]LIN T F, HUANG H I, SHEN F T, et al. The protons of gluconic acid are the major factor responsible for the dissolution of tricalcium phosphate byBurkholderiacepaciaCC-Al74[J]. Bioresource Technol, 2006, 97(7): 957-960.
[17]HOBERG E, MARSCHNER P, LIEBEREI R. Organic acid exudation and pH changes byGordoniasp. andPseudomonasfluorescensgrown with P adsorbed to goethite[J]. Microbiol Res, 2005, 160(2): 177-187.
[18]FUENTES B, JORQUERA M, MORA M L. Dynamics of phosphorus and phytateutilizing bacteria during aerobic degradation of dairy cattle dung[J]. Chemosphere, 2009, 74(2): 325- 331.
[19]ANTOUN H. Beneficial microorganisms for the sustainable use of phosphates in agriculture[J]. Procedia Eng, 2012, 46(3): 62-67.
[20]PATEL D K, MURAWALA P, ARCHANA G, et al. Repression of mineral phosphate solubilizing phenotype in the presence of weak organic acids in plant growth promoting fluorescent pseudomonads[J]. Bioresour Technol,2011, 102(3): 3055-3061.
[21]赵小蓉, 林启美. 微生物解磷的研究进展[J]. 土壤肥料, 2001, 56(3): 7-11.
[22]PARK J H, NANTHI B, MALLAVARAPU M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. JHazard Mater, 2011, 185(2/3): 829-836.
[23]TOFAZZAL-ISLAMA M, DEORAA A, HASHIDOKOA Y, et al. Isolation and identification of potential phosphate solubilizing bacteria from the rhizoplane ofOryzasativaL. cv. BR29 of Bangladesh[J].Z Naturforsch C, 2007, 62(1/2): 103-110.
[24]KHAN M S, ZAIDI A, WANI P A. Role of phosphate-solubilizing microorganisms in sustainable agriculture: A review[J]. Agron Sustain Dév, 2007, 27(1): 29-43.
[25]ILLMER P, SCHINNER F. Solubilization of inorganic phosphates by microorganisms isolated from forest soil[J]. Soil Biol Biochem, 1992, 24(4): 389-395.
[26]ILLMER P, SCJOMMER F. Solubilization of inorganic calcium phosphates-solubilization mechanisms[J]. Soil Biol Biochem, 1995, 27(3): 257-263.
【责任编辑庄延, 柴焰】
收稿日期:2015- 12- 10优先出版时间:2016- 07- 05
作者简介:杨美英(1974—),女,副教授,博士,E-mail: jlaumeiying@163.com
基金项目:国家自然科学基金(31201687)
中图分类号:S828
文献标志码:A
文章编号:1001- 411X(2016)05- 0038- 07
Identification of PSB in soybean rhizosphere and secretion of organic acids in the process of phosphate solubilizing
YANG Meiying1, WANG Chunhong1, WU Zhihai2,YUE Shengtian1, FU Li1, LIU Jingjing1, SUN Hemei1
(1 College of Life Science, Jilin Agricultural University, Changchun 130118, China ; 2 Faculty of Agronomy,Jilin Agricultural University, Changchun 130118, China)
Abstract:【Objective】 In order to determine the species and characteristics of phosphate solubilizing bacteria (PSB) in soybean, Glycine max, rhizosphere soil in Jilin Province.【Method】PSB were screened based on the formation of a halo zone of dissolving phosphate, and were identified by 16S rDNA gene sequencing and Vitek 2 system. Bacterial growth rates, soluble phosphorus concentrations, pH changes of the media and the types and amounts of secreted organic acids were determined. 【Result】WJ1, WJ3, WJ5 and WJ6 were isolated from soybean rhizosphere soil, and were identified as Pseudomonas sp., Enterobacter sp., Ochrobacterum sp. and Klebsiella sp. respectively. The maximum soluble phosphorus concentrations within 96 h of inoculating four PSB were 558, 478, 596 and 586 μg·mL-1respectively. The methyl red tests and pH measurements indicated that media pH all decreased during the phosphate solubilizing process of four PSB. Bacterial growth was limited when pH was below 4. Growth of WJ1 and WJ3 were slightly affected at pH 5, whereas WJ5 and WJ6 grew normally. Various organic compounds secreted from four PSB were analyzed by GC-MS, and among them α-ketoglutaric acid was identified as an abundant compound secreted by WJ1, WJ3 and WJ6.【Conclusion】All four PSB can effectively solubilize phosphate. The types of organic acids produced by the four PSB are not exactly the same,and the secretion of organic acids causes medium pH to decline, which inhibit the bacterial growth. The number of the bacteria determinines the amount of dissolved phosphorus.
Key words:Glycine max; phosphate solubilizing bacteria; pH; organic acid; phosphate solubilizing
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20160705.1200.034.html
杨美英, 王春红, 武志海,等.大豆根际溶磷菌分离鉴定及溶磷过程中有机酸的分泌[J].华南农业大学学报,2016,37(5):38- 44.
