阿托伐他汀对老龄大鼠胡须体觉皮层缺血后细胞凋亡的影响
2016-08-05张云云黄玲玲万鹤鸣陆守荣丁新生
张云云 黄玲玲 王 滨 洪 侃 万鹤鸣 陆守荣 丁新生
(南京医科大学附属无锡市人民医院,江苏 无锡 214000)
阿托伐他汀对老龄大鼠胡须体觉皮层缺血后细胞凋亡的影响
张云云黄玲玲王滨洪侃万鹤鸣陆守荣丁新生1
(南京医科大学附属无锡市人民医院,江苏无锡214000)
〔摘要〕目的探讨阿托伐他汀对老龄大鼠永久局灶性胡须体觉皮层缺血后凋亡的影响及机制。方法45只老龄大鼠依随机数字表法分为假手术组、对照组(等量生理盐水)、阿托伐他汀处理组(20 mg/kg)。对照组及阿托伐他汀组于显微镜下结扎大脑中动脉数根分支构建局灶胡须体觉皮层缺血模型并于造模后0、6、24、48 h分别以生理盐水及阿托伐他汀灌胃。造模后72 h应用苏木精-伊红(HE)染色检测脑组织形态学;流式细胞仪检测各组缺血区周围细胞凋亡及坏死率;免疫组织化学染色检测缺血区周围Caspase-3 及血管内皮生长因子受体(VEGFR)-1 的表达。结果与对照组相比,阿托伐他汀对老龄大鼠72 h后有抗凋亡作用,其机制可能与减少缺血区周围Caspase-3表达有关。该剂量阿托伐他汀对缺血后72 h的VEGFR-1表达无明显影响。结论阿托伐他汀可能通过减少老龄大鼠胡须体觉皮层缺血后72 h的Caspase-3表达起着较好的抗凋亡作用。
〔关键词〕阿托伐他汀;脑缺血;凋亡
流行病学调查显示年龄超过55岁后,脑卒中的风险每十年增加1倍,而且其神经祖细胞及非成熟神经元随着年龄的增长逐渐增加。本研究探讨阿托伐他汀对老龄大鼠胡须体觉皮层缺血后72 h凋亡及坏死影响及可能机制。
1材料与方法
1.1主要试剂及仪器雄性SD大鼠20~22 月龄45只。阿托伐他汀辉瑞制药公司。AnnexinV-FITC/PI双染细胞凋亡检测试剂盒购自凯基生物公司。Caspase-3、血管内皮生长因子受体(VEGFR)-1抗体购自Santa-Cruz公司。免疫组化试剂盒武汉博士德生物有限公司。FACSCalibur流式细胞仪美国BD公司。Leica 彩色图像分析系统;GS-2010 手术显微镜(常州三能光学设备有限公司);10-0带线缝合针(上海医菱医疗器械销售公司),多导生理记录仪、TSD 激光多普勒探头、激光多普勒血流仪(Biopac公司,美国)。
1.2模型制备大鼠麻醉后固定在手术台上,切开颞部皮肤和肌肉,用手术电钻开6~8 mm的颅窗,刺激对侧胡须,激光多普勒血流仪测定刺激前后局部脑血流,确定体觉皮层支配血管后在显微镜下以10-0 手术线穿过硬脑膜,结扎胡须体觉皮层周围数根大脑中动脉的分支,激光多普勒血流仪再次测定局部脑血流,同时结扎双侧劲总动脉10 min。假手术组的大鼠麻醉后固定在手术台上,切开颞部皮肤和肌肉,用手术电钻开6~8 mm颅窗,不结扎大脑中动脉树根分支〔1〕。
1.3大鼠分组45只老龄大鼠随机分为假手术组、对照组及阿托伐他汀组,对照组及阿托伐他汀组予术后0、6、24、48 h以20 mg/kg生理盐水及阿托伐他汀灌胃,72 h后处死各组大鼠。
1.4病理学观察假手术组、对照组及阿托伐他汀组进行常规苏木精-伊红( HE) 染色,光镜下观察脑缺血72 h后组织形态学改变。
1.5流式细胞仪检测缺血区凋亡各组大鼠处死于75%酒精浸泡1~3 min放置超净工作台,取出大脑缺血区及周围组织并将其置于事先消毒好的200目筛网,轻轻研磨脑组织,使其变成单个细胞,待研碎后用培养液冲洗,细胞筛下容器内所盛溶液为单细胞悬液;将细胞重悬于500 μl上样缓冲液,加入5 μlAnnexinV-FITC 和5 μl PI,混匀后室温避光反应10 min,上机检测。
1.6取材及切片制备72 h后各组分别取5只大鼠麻醉后打开腹腔,剪开肋骨,经左心室插管至主动脉后快速依次灌注生理盐水及4%多聚甲醛,断头取脑分离前囟前后1 mm脑组织浸入4%多聚甲醛固定6 h,蒸馏水漂洗,酒精脱水,二甲苯透明、浸蜡、包埋,连续切片5 张,片厚5 μm。
1.7免疫组化染色检测缺血区周围Caspase-3及VEGFR-1表达常规脱蜡至水,以Caspase-3、VEGFR-1抗体为一抗进行操作,方法参照试剂盒说明书。DAB 显色,苏木素复染,封片镜检。PBS 代替Caspase-3、VEGFR-1抗作阴性对照。采用Leica计算机图像分析系统对组织切片图像分析,以细胞呈棕色或棕褐色为标准,每张切片计算5个不重复的视野计数,取其平均值来作为Caspase-3、VEGFR-1的阳性细胞数。
1.8统计学分析用SPSS16.0软件,行单因素方差分析,方差齐时进一步采用LSD进行两两比较。
2结果
2.1HE染色假手术组脑组织细胞正常,老龄大鼠脑缺血后72 h神经元及胶质细胞变性,胞核溶解,可见较多细胞碎片。阿托伐他汀组老龄大鼠缺血后72 h神经元及胶质细胞亦有水肿、变性坏死,但较模型组细胞稍完整(图1)。

图1 老龄大鼠胡须体觉皮层缺血后72 h病理学观察(HE,×200)
2.2流式细胞仪检测缺血区凋亡情况假手术组可见少量凋亡及坏死细胞,对照组及阿托伐他汀组的细胞凋亡及坏死细胞数较相应假手术组均明显增加,与对照组缺血72 h组相比,阿托伐他汀组老龄缺血72 h组的凋亡及坏死细胞数明显减少(表1)。
2.3免疫组化染色检测缺血区周围Caspase-3表达假手术组仅可见少量Caspase-3阳性细胞数,对照组及阿托伐他汀组的Caspase-3阳性细胞数较相应假手术组均明显增加,与对照组缺血72 h组相比,阿托伐他汀组老龄缺血72 h组的Caspase-3阳性细胞数明显增加(图2,表1)。
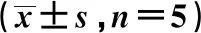
表1 各组老年大鼠凋亡及坏死率及Caspase-3、VEGFR-1阳性细胞数
与假手术组比较:1)P<0.01;与对照组比较:2)P<0.01

图2 免疫组化染色检测老龄大鼠胡须体觉皮层缺血后72 h的Caspase-3表达(DAB,×200)
2.4免疫组化染色检测缺血区周围VEGFR-1表达假手术组仅可见少量VEGFR-1阳性细胞数,对照组及阿托伐他汀组的VEGFR-1阳性细胞数较相应假手术组均明显增加,与对照组缺血72 h相比,阿托伐他汀组老龄缺血72 h的VEGFR-1阳性细胞数无明显差异(图3,表1)。

图3 免疫组化染色检测老龄大鼠胡须体觉皮层缺血后72 h的VEGFR-1表达(DAB,×200)
3讨论
本研究发现阿托伐他汀对老龄大鼠晚期凋亡有明显保护作用,其与减少Caspase-3表达可能有关,同时发现该剂量的阿托伐他汀对缺血后72 h的VEGFR-1表达无明显影响。
脑缺血后神经细胞的死亡包括缺血中心早期凋亡和半暗带区的迟发性凋亡。细胞凋亡是细胞在生理状态下的死亡过程,其有促进和凋亡基因共同作用。Caspase家族是目前哺乳动物凋亡的主要启动因子,其中Caspase-3是Caspase级联瀑布下游最关键的凋亡蛋白酶。正常情况下,Caspase-3参与细胞凋亡可以通过线粒体途径和细胞表面受体途径来发挥作用〔2〕。早期研究〔3〕表明在局灶性永久性脑缺血模型中,利用Northern印迹分析提示缺血侧半球脑组织缺血后16~ 24 h,Caspase-3水平显著增高。还有研究发现抑制Caspase-3的活化可以减轻以细胞凋亡为主要机制的缺血后迟发性细胞损害,增加存活神经元数量,缩小脑梗死体积,并改善神经功能〔4~6〕。
年龄对脑组织缺血后的凋亡及修复有着重要的影响,Davis 等〔7〕比较了成年和老龄大鼠脑组织梗死后梗死体积情况,提示老龄大鼠的梗死体积较成年大鼠体积增大,推测脑梗死的体积与增龄有关。李建生等〔8〕研究表明老龄大鼠脑缺血3 h和I/R12 h 脑梗死面积较青年大鼠增大,随着I/R 时间延长,脑组织细胞损伤逐步加重,老龄大鼠较青年大鼠严重,细胞凋亡随着I/R 时间延长而明显增加,老龄大鼠出现的早、持续时间长。本研究药物对老龄大鼠胡须体觉皮层永久性脑缺血模型晚期凋亡及坏死率的保护作用更符合临床中出现的病例特征。
研究发现脑组织轴突损伤后可以修复,但修复能力较弱,可能周围微环境影响其修复过程〔9〕。脑缺血后神经修复依赖于轴突的生长、准确的投射及突触的形成〔10〕,其过程不仅仅需要营养因子、生长因子等调控,与轴突生长抑制因子表达有着密切的关系〔11〕。VEGF作为内皮细胞的分裂原,主要与细胞表面受体结合后促进内皮细胞的增殖、加速新生血管形成〔12,13〕。VEGF同时能够促进轴突生长,对神经起着直接营养的作用〔14〕。VEGFR包括:VEGFR-1(Flt-1)、VEGFR-2(Flk-1/KDR)、VEGFR-3(Flk-4)及神经纤维网蛋白(NP)-1和NP-2。血管内皮细胞表面主要是VEGFR-1与VEGFR-2,VEGFR-2主要是诱导血管内皮细胞增殖和分化,VEGFR-1也参与该过程。VEGFR-1的胞外部分则比VEGFR-2对VEGF具有更高的亲和力,能以可溶形式存在〔15〕。VEGF主要通过VEGFR-1与VEGFR-2在内皮细胞上发挥作用〔16〕。本研究发现该剂量的阿托伐他汀对缺血后72 h的VEGFR-1表达无明显影响,可能考虑与阿托伐他汀的剂量及作用时间有关。
他汀类药物,即3-羟基3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,是一类强效降胆固醇药物。既往研究表面阿托伐他汀钙具有降低血脂、稳定斑块、预防卒中复发等作用〔17,18〕。阿托伐他汀可能通过上调eNOS挽救缺血周围区的神经细胞,通过增加脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)的表达促进缺血后神经功能的恢复,而与血清胆固醇水平无关〔19~22〕。
4参考文献
1Li WL,Yu SP,Ogle ME,etal. Enhanced neurogenesis and cell migration following focal ischemia and peripheral stimulation in mice〔J〕. Dev Neurobiol,2008;68(13):1474-86.
2Budihardjo I,Oliver H,Lutter M,etal. Biochemical pathways of caspase activation during apoptosis〔J〕. Ann Rev Cell Dev Biol,1999;15(11):269-90.
3Velier JJ,Ellison JA,Kikly KK,etal. Caspase-8 and caspase-3 are expressed by different populations of cortical neurons undergoing delayed cell death after focal stroke in the rat〔J〕. J Neurosci,1999;19(14):5932-41.
4Himi T,Ishizaki Y,Murota S. A caspase inhibitor blocks ischaemia-induced delayed neuronal death in the gerbil〔J〕. Eur J Neurosci,1998;10(2):777-81.
5Ma J,Endres M,Moskowitz MA. Synergistic effects of caspase inhibitors and MK-801 in brain injury after transient focal cerebral ischaemia in mice〔J〕. Br J Pharmacol,1998;124(4):756-62.
6Cheng Y,Deshmukh M,D'Costa A,etal. Caspase inhibitor affords neuroprotection with delayed administration in a rat model of neonatal hypoxic-ischemic brain injury〔J〕. J Clin Invest,1998;101(9):1992-9.
7Davis M,Mendelow AD,Perry RH,etal. Experimental stroke and neuroprotection in the aging rat brain〔J〕. Stroke,1995;26(6):1072-8.
8李建生,任小巧,刘轲,等. 老龄大鼠脑缺血再灌注神经细胞凋亡变化规律研究〔M〕. 中国危重病急救医学,2004;16(3):151-4.
9Ramon Y,Cajal S. Degeneration and regenration of nervous system〔M〕. London: Oxford University Press,1998:46-51.
10Rakic P. Neurobiology. Discriminating migrations〔J〕. Nature,1999;400(6):315-6.
11曾进胜,李华,洪华,等.实验性大脑皮层梗死后丘脑和纹状体突触重构与抑制性蛋白表达〔J〕.中国临床康复,2002;6(17):2534-5.
12Gao P,Shen F,Gabriel RA,etal. Attenuation of brain response to vascular endothelial growth factor-mediated angiogenesis and neurogenesis in aged mice〔J〕.Stroke,2009;40(11):3596-600.
13Hermann DM,Zechariah A. Implications of vascular endothelial growth factor for postischemic neurovascular remodeling〔J〕. J Cereb Blood Flow Metab,2009; 29(10):1620-43.
14Schmid-Brunclik N,Burgi-Taboada C,Antoniou X,etal. Astrocyte responses to injury: VEGF simultaneously modulates cell death and proliferation〔J〕. Am J Physiol Regul Integr Comp Physiol,2008;295(3):R864-73.
15Freitas-Andrade M,Carmeliet P,Stanimirovic DB,etal. VEGFR-2-mediated increased proliferation and survival in response to oxygen and glucose deprivation in PlGF knockout astrocytes〔J〕. J Neurochem,2008;107(3):756-67.
16Chiba Y,Sasayama T,Miyake S,etal. Anti-VEGF receptor antagonist (VGA1155) reduces infarction in rat permanent focal brain ischemia〔J〕. Kobe J Med Sci,2008;54(2):E136-46.
17Vaughan CJ,Delanty N,Basson CT. Statin therapy and stroke prevention〔J〕.Curr Opin Cardiol,2001;16(4):219-24.
18Blanco M,Nombela F,Castellanos M,etal. Statin treatment withdrawal in ischemic stroke: a controlled randomized study〔J〕. Neurology,2007;69(9):904-10.
19Asahi M,Huang Z,Thomas S,etal.Protective effects of statins involving both eNOS and tPA in focal cerebral ischemia〔J〕. J Cereb Blood Flow Metab,2005;25(6):722-9.
20Lee SH,Kim YH,Kim YJ,etal. Atorvastatin enhances hypothermia-induced neuroprotection after stroke〔J〕. J Neurol Sci,2008;275(1-2):64-8.
21Zhang L,Zhang ZG,Liu XS,etal. The PI3K/Akt pathway mediates the neuroprotective effect of atorvastatin in extending thrombolytic therapy after embolic stroke in the rat〔J〕. Arterioscler Thromb Vasc Biol,2007;27(11):2470-5.
22Chen J,Zhang C,Jiang H,etal. Atorvastatin induction of VEGF and BDNF promotes brain plasticity after stroke in mice〔J〕. J Cereb Blood Flow Metab,2005;25(2):281-90.
〔2014-12-08修回〕
(编辑赵慧玲/曹梦园)
基金项目:无锡市科技计划指导性项目(SCZ00N1102);南京医科大学科技发展基金面上项目(2011njmu023)
通讯作者:王滨(1960-),男,硕士,主任医师,主要从事脑血管病及神经变性病研究。
〔中图分类号〕R743
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3128-03;
doi:10.3969/j.issn.1005-9202.2016.13.015
1南京医科大学附属江苏省人民医院
第一作者:张云云 (1985-),女,硕士,主治医师,主要从事脑血管病研究。
