马铃薯种质的遗传特性与抗旱性的关系
2016-08-02白江平杨宏羽李维婷高慧娟张俊莲张金林王旺田
娄 艳,白江平,杨宏羽,李维婷,高慧娟,张俊莲,王 蒂,张金林,王旺田
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州 730070; 3.甘肃农业大学园艺学院,甘肃 兰州 730070;4.兰州大学草地农业科技学院,甘肃 兰州 730020)
马铃薯种质的遗传特性与抗旱性的关系
娄 艳1,2,白江平1,2,杨宏羽1,3,李维婷1,2,高慧娟1,2,张俊莲1,3,王 蒂1,2,张金林4,王旺田2
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州 730070; 3.甘肃农业大学园艺学院,甘肃 兰州 730070;4.兰州大学草地农业科技学院,甘肃 兰州 730020)
摘要:为探究马铃薯(Solanum tuberosum)不同遗传特性与其对水分胁迫响应之间的相关关系,本研究通过SSR分析了供试材料的遗传多样性,并通过PEG-6000和不浇水胁迫处理马铃薯移栽苗的方法,研究了干旱胁迫下不同马铃薯品种中过氧化物酶(POD、CAT)活性及可溶性蛋白含量的变化。结果显示,在遗传相似系数(GS)为0.700水平上,44份马铃薯材料可被聚为5类,大部分品种聚在一起,说明供试品种的遗传基础相对狭窄。通过GGE-Biplot综合分析POD、CAT及可溶性蛋白质变化量,将44份供试材料分为6组。比对分析遗传多样性分析与生理结果,发现二者之间并不具有明显的一致性,即品种遗传特性的差异并不能直接反映品种的抗旱性能差异,而两种胁迫方式在研究品种抗旱特性上具有较高的一致性。该研究结果可以为今后抗旱试验的进行提供参考。
关键词:遗传多样性;PEG胁迫;双标图;抗旱性
自1995年Veilleux[1]首次使用SSR标记研究马铃薯(Solanumtuberosum)以来,SSR标记因其多态性高、可重复性好、操作简单等优点而被广泛应用于马铃薯遗传关系分析研究[2-4]、品种鉴定[5]、重点种质资源的收集和评价[6]等方面。近年来,中国学者在应用SSR对种质材料遗传多样性分析[7-10]、作物抗旱性相关基因的SSR分子标记[11]、水分胁迫下抗旱相关性状的QTL分析[12]及对控制水分胁迫应答蛋白的相关基因的SSR标记[13]等方面也做了大量的研究。
干旱是影响植物正常生长发育的主要环境胁迫因素之一[14]。植物在长期进化过程中,演化出一系列形态学的和生理生化方面的适应性机制和策略,能有效抵制胁迫逆境如调节保护酶系统[15-16],改变过氧化物酶(POD)、过氧化氢酶(CAT) 的活性等,在逆境胁迫下动员酶和非酶防御系统来清除活性氧,保护植物细胞免受氧化损害。自1979 年,Heyser和Nabors[17]首次以PEG作为诱导剂和筛选剂筛选出抗旱的烟草(Nicotianatabacum)细胞系以来,高分子量的聚乙二醇(PEG)(分子量≥6 000)常作为一种非穿透渗透剂被广泛用于植物研究领域[18-21]。然而,关于不同马铃薯品种在PEG-6000溶液处理下进行模拟干旱胁迫与自然干旱水分胁迫处理方面的研究很少。同时,众所周知,作物在水分胁迫条件下的抗性因品种遗传特性的不同而异,而就能否从遗传多样性的角度来解释不同种质间胁迫响应差异方面的研究还未见报道。
本研究通过SSR分子标记对44份马铃薯材料的遗传多样性进行分析,并利用GGE-Biplot对44份马铃薯材料在水分逆境胁迫下的响应能力进行综合评价分析,尝试从遗传多样性的角度解释不同种质间胁迫响应差异,并探索两种水分胁迫方式在研究作物抗旱性能上是否具有一致性,以期为马铃薯抗旱性材料的筛选和鉴定,品种特性的改良等方面提供理论依据。
1材料与方法
1.1供试材料
试验于2014年6-9月在甘肃农业大学作物遗传育种和干旱生境作物学重点实验室进行,本研究选用42份从国际马铃薯研究中心(CIP)引进的马铃薯材料(表1)和两份本地品种,即抗逆性较强的栽培种陇薯3号(L3)和对逆境胁迫较敏感的栽培种大西洋(DXY)脱毒试管苗为试验材料。所有品种均由甘肃农业大学马铃薯品种改良重点实验室提供。
1.2试验方法
1.2.1马铃薯材料试管苗的培养以同一时期转接的长势相对一致的脱毒试管苗为基础苗,将其剪成至少带一片叶的小茎段,插入装有固体培养基(MS)50 mL的三角瓶中,每瓶扦插6~8个茎段。置于平均温度为(22±2) ℃,光照为3 000 lx,光周期为16 h·d-1的培养室进行培养。
1.2.2基因组DNA的提取与检测及试管苗的移栽1)剪取培养30 d左右的各供试材料试管苗新鲜茎叶,用液氮研磨并参考 CTAB[22]法提取总基因组DNA。采用1%琼脂糖凝胶电泳检测DNA质量,用紫外分光光度计法检测其质量和浓度。用ddH2O将各样品稀释到25 ng·μL-1,置于-20 ℃冰箱保存。2)将经过炼苗的试管苗洗去培养基,剪去根部(保留一部分),移栽入装有蛭石(基质)的72孔育苗盘中(皿数6×12,口径40 mm×40 mm, 底部20 mm×20 mm,皿深45 mm),种植深3~4 cm,每个品种每个处理各种12株,移栽在不同的穴盘上,共36株。扦插后,浇透水,将育苗盘摆放在培养室,盖上塑料薄膜保湿5~7 d。每隔1 d浇1次水(1周浇3次水),每隔1周浇1次营养液(即不加蔗糖的液体MS培养基),营养液pH值在5.8左右。移栽苗在育苗盘生长20 d后进行试验处理。PEG处理组用10% PEG(-0.120 MPa)浇灌(第1次10%PEG10mL·穴-1,其余几次均为10%PEG5mL·穴-1);自然胁迫处理组不浇水;对照(CK)正常浇水,水量和处理组PEG的量一致。处理6 d后,最早发现2号材料PEG处理组的植株出现萎蔫症状,拍照、采样后分装并冷冻于-80 ℃冰箱备用。
1.2.3SSR条带检测与相关生理指标的测定参照已发表的24对SSR引物[5,8,23]并由上海生工生物工程技术服务有限公司合成(23对表2已列出),进行SSR-PCR扩增,PCR产物用8.0%非变性聚丙烯酰胺凝胶电泳分离检测,银染显色并统计多态性条带。
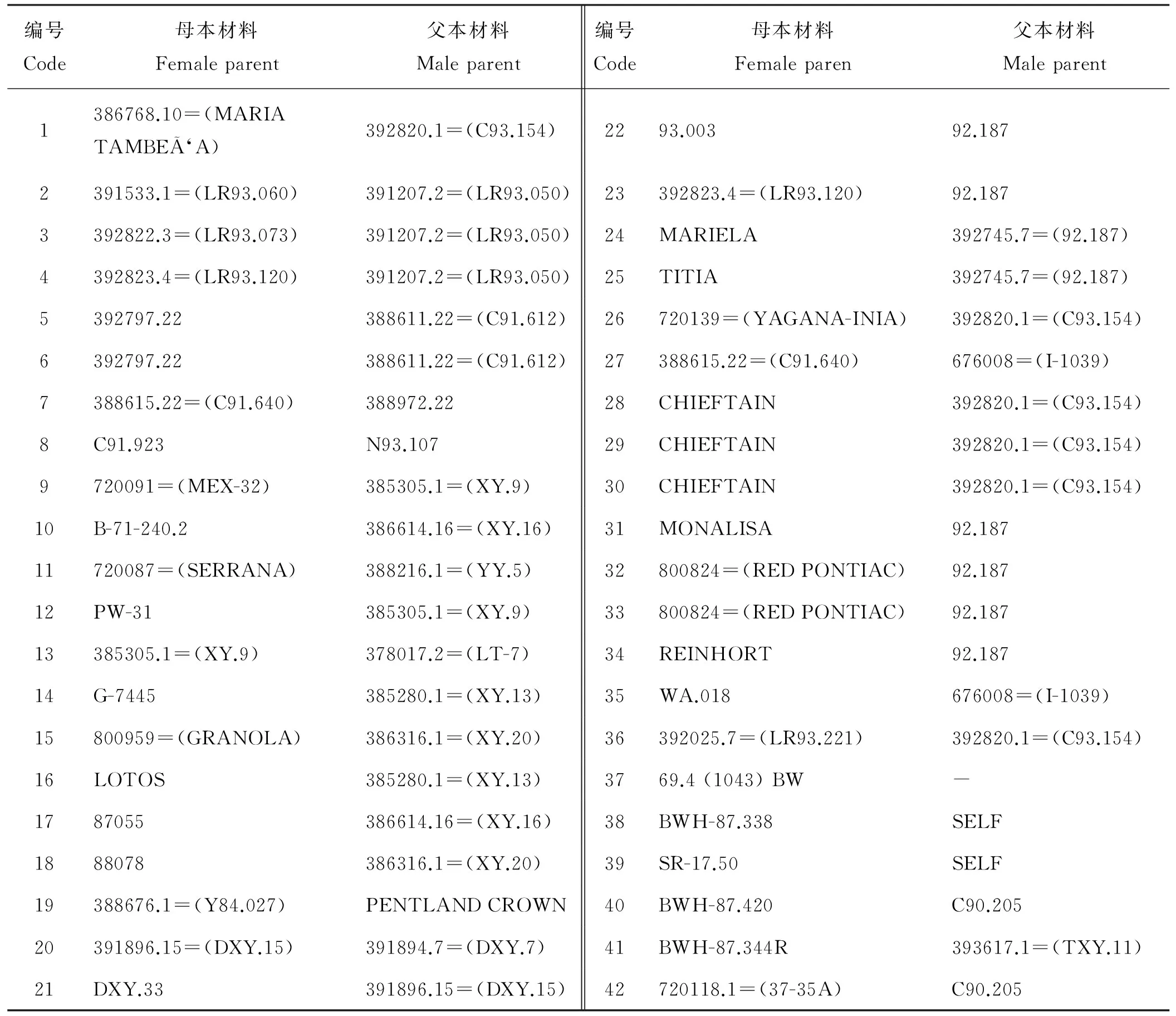
表1 42份引进马铃薯种质材料编号及亲本材料
过氧化氢酶(CAT)的活性测定采用紫外吸收法[24];过氧化物酶(POD)活性测定采用愈创木酚法[24],可溶性蛋白质的提取及含量测定采用考马斯亮蓝G-250法[24]。
1.2.4条带统计与数据分析采用人工读胶法统计电泳谱带,在同一位置上清晰的条带记为1,无条带记为0,扩增不出的记为-9,建立0,1数据库并保存到Excel中。利用 NTSYS-pc 2.10e软件[25],通过UPGMA方法进行聚类分析。通过Popgene1.32软件[26]计算每个位点的等位变异数目,有效等位基因数目[27],Shannon’s信息指数[28]及等位基因频率;计算多态性信息含量(Polymorphism Information Content):PIC=1-∑(Pi2)[29]。其中Pi指在第i位点处检测到的等位基因频率。
用Microsoft Excel 2007对生理数据进行输入、整理,并计算出对应品种胁迫前后酶活性的变化量,相对变化量=(胁迫后植株体内酶含量-处理后对照组中酶含量)/对照中酶含量×100%;通过SPSS Statistics 18.0 软件进行SPSS方差分析(Analysis of Variance ANOVA)(P≤0.05)和聚类分析,多重比较采用最小显著差数法(LSDα)和新复极差法(Duncan法),用来检测不同品种胁迫前后酶活性变化量差异。检测到显著差异P≤0.05后,使用GGE-Biplot软件[23,30]对两向数据进行主成分分析。
2结果与分析
2.1SSR标记多态性分析
本研究用24对SSR引物对44份马铃薯供试材料进行PCR,选出其中多态性较好的23对SSR引物(表2)。结果显示,23对SSR引物在44份供试材料中共检测到66个SSR标记,平均每个等位位点的等位变异数为2.869 6,变异范围为2~5;平均等位变异数为2.463 1,平均有效等位变异所占的比重为72.88%;23对SSR引物的Shannon’s信息指数的变化范围为0.248 9~1.334 8,平均为0.776 2;多态性信息含量 (PIC)变化范围为0.127 1~0.727 1,平均为0.465 0,表明供试材料的遗传多样性较高(表2)。
2.2遗传相似系数和聚类分析
为了分析供试材料的遗传相似系数(GS),并以更直观的方式揭示材料间的亲缘关系。本研究利用NTSYS-pc2.10e软件分析了供试马铃薯材料的遗传相似系数(GS),并根据UPGMA方法进行聚类分析。结果显示,44份供试马铃薯材料的遗传相似系数变异范围为0.484 9~0.909 1。其中31和36号材料之间的遗传相似系数最大(GS=0.909 1),表明这两份材料的遗传背景相似;其次是材料8与9 和28与29(GS=0.893 9),所以不建议用材料31与36、8与9和28与29进行亲本杂交组合配置;遗传相似系数最小的是材料4与14(GS=0.484 9),说明材料4与14之间的亲缘关系较远,遗传差异性较大。UPGMA方法聚类分析发现(图1),在遗传相似系数(GS)为0.700水平上,44份马铃薯材料可被聚为5类,分别记为A、B、C、D和E,每类分别包含有6、32、4、1和1份马铃薯材料。B类中所包含的32份马铃薯材料,占所有供试材料的72.7%。

表2 23对SSR引物在44份马铃薯材料中的多态性
注:SSR引物选自已发表的论文研究:a[5],b[23], c[8]。
Note:SSR primer sequences were selected from previous studies: a[5], b[23], c[8].
2.3水分胁迫处理相关数据分析
为了分析两种处理下各不同变量之间的相关性,判断分析两种水分胁迫方式之间是否有一定的一致性。采用SPSS R型聚类(变量聚类),对PEG处理下可溶性蛋白相对于对照的变幅(PEG-P或PEG protein)、 PEG处理下POD相对于对照的变幅(PEG-POD)、PEG处理下CAT相对于对照的变幅(PEG-CAT)、自然胁迫下可溶性蛋白相对于对照的变幅(ZR-P或ZR protein)、自然胁迫下POD相对于对照的变幅(ZR-POD)、自然胁迫下CAT相对于对照的变幅(ZR-CAT)共6个变量进行相关性分析(表3),结果显示,ZR-POD与PEG-POD之间显著相关,相关系数最大,为0.965,ZR-CAT与PEG-CAT之间显著相关,相关系数为0.933,ZR protein与PEG protein间显著相关,相关系数为0.888,均在P<0.01水平上达到极显著。不同胁迫处理下,同种酶酶活性变量间相关性较高,说明不论是PEG模拟水分胁迫还是自然水分胁迫,对马铃薯相关生理生化指标的影响具有较高的一致性。材料1因在前期试验中死亡,故后续生理测定试验中只测定了43份材料。
为了对供试马铃薯材料进行生理上群体划分并解释各处理变量之间的关系,本研究利用GGE-Biplot对43个品种不同处理下不同酶活性变化量进行了分析(图2)。图2中的多边形由连接同一方向上距双标图原点最远的品种的酶活性变化量位点构成,其余的品种都被包括在多边形内部。由原点出发并且与多边形各边垂直的射线将整个双标图分为6个大小不同的区域,并由此将不同品种分为6个组,即a、b、c、d、e和f。
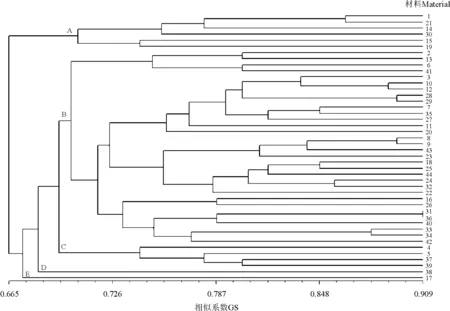
图1 供试马铃薯材料聚类图
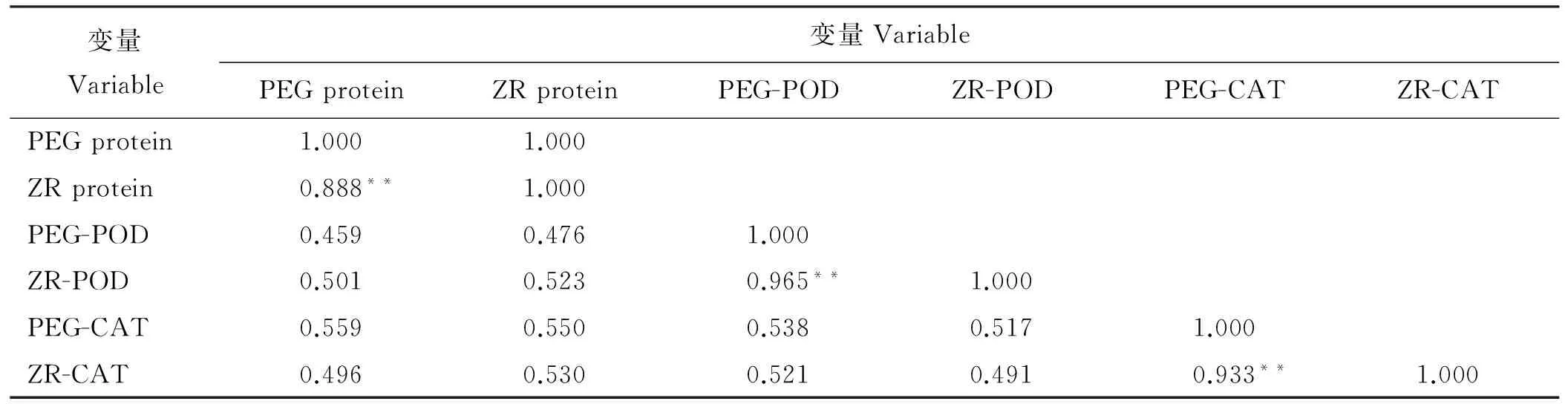
变量Variable变量VariablePEGproteinZRproteinPEG-PODZR-PODPEG-CATZR-CATPEGprotein1.0001.000ZRprotein0.888**1.000PEG-POD0.4590.4761.000ZR-POD0.5010.5230.965**1.000PEG-CAT0.5590.5500.5380.5171.000ZR-CAT0.4960.5300.5210.4910.933**1.000
注:**代表在0,01水平上显著相关。
Note: ** show significant difference at 0.01 level.
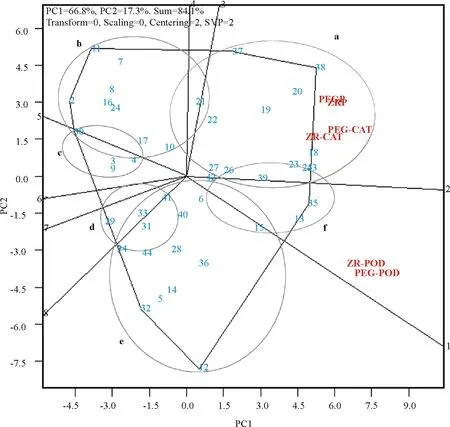
图2 GGE-Biplot双标图分析不同马铃薯品种与不同胁迫处理方式及胁迫前后不同酶活性变化间的关系
处理变量可以被分为两个组:PEGP(PEG protein)、ZRP(ZR protein)、PEG-CAT及ZR-CAT为一组,PEG-POD和ZR-POD为一组,而且第一主成分(PC1)与第二主成分(PC2)一起可以解释84.1%的变量,说明双标图足以解释不同处理下不同酶活性变化量与不同品种间的差异。不论是在PEG处理下,还是在自然水分胁迫下,可溶性蛋白含量及CAT活性在品种38中变化量最大, 而POD在品种35中的变化量最大,说明相比于其它品种,35和38的抗氧化系统对干旱胁迫的响应更为灵敏。为了分析不同供试材料在胁迫前后酶活性变化量的大小及同一品种在不同酶活性测定下,其变化量的稳定性,本研究利用GGE-Biplot对43份供试马铃薯材料在水分胁迫诱导前后酶活性的变化量进行排序,并对其变化量的稳定性进行分析。图中带箭头的直线是平均处理轴,它同时经过双标图原点和平均处理值(红色圆圈),其位置取决于各处理坐标的平均值[31],箭头所指的方向是酶活性变化量在所有处理下的近似平均变化量,箭头方向代表变化量越大。通过双标图原点并与平均处理轴垂直的双箭头直线代表各品种酶活性变化量的稳定性,箭头所指的方向为变化不稳定,并且越偏离平均处理轴,说明变化量越不稳定。如图3所示,品种23、13、20、25、43、35、18和38的变化量均高于平均值,而且品种38的变化量最大。但是,13、20、35、38这4个品种的位点与平均处理轴间的距离较远,所以它们的变化易受不同酶活性测定的影响,稳定性较差。为进一步分析不同处理间及不同酶活性测定间的关系,利用GGE-Biplot进行区别力与代表性的分析。如图4所示,连接各处理变量的位点与双标图原点的直线称为处理向量。向量的不同长度反映的是不同处理变量对酶活性变化量的区别能力,向量之间的夹角的余弦值近似代表两个处理变量之间的相关性系数[30]。除PEG-POD与ZR-POD外,各处理的向量长度比较接近,说明同一酶活性变化量在不同处理变量下的变化趋势较接近。PEG-P与ZR-P、PEG-CAT与ZR-CAT、PEG-POD与ZR-POD之间的夹角均很小,说明PEG胁迫处理和自然胁迫处理之间具有较高的相关性,这与通过SPSS R型聚类对各处理变量间的相关性分析结果一致。而两种胁迫处理下POD测定与可溶性蛋白、CAT测定间的夹角较大,虽然小于90°,但仍能说明,即使在相同的胁迫处理下POD活性变化量与可溶性蛋白、CAT活性变化量之间的变化差异较为明显,尤其与可溶性蛋白含量的变化更为明显。
3讨论与结论
通过对种质材料遗传相似系数的研究分析发现,供试材料遗传背景的相似性与其遗传相似系数大小之间具有一定的相关性。如本研究中材料28与29具有相同的父本和母本,材料33与34则只具有相同的父本,育成品种亲缘关系亦比较近,这与材料28与29(GS=0.893 9)和33与34(GS=0.878 8)较高的遗传相似系数是一致的,这也与刘建霞等[7-9]的相关研究中遗传背景相似的品种遗传差异较小的结论是一致的。然而,31和36号材料的亲本虽然完全不同,但二者之间的遗传相似系数最大(GS=0.909 1),仍表明这两份材料的亲缘关系是较近的,这可能是由于材料本身遗传特性的差异或发生遗传变异引起的,也有可能是由于SSR分子标记试验所用的引物较少,未能充分表现材料本身的遗传特异性等原因引起的。

图3 利用GGE-Biplot分析43份马铃薯材料在两种胁迫处理下酶活性变化量的排序

图4 利用GGE-Biplot双标图分析各处理之间的相关性
马铃薯根系较浅,对水分亏缺非常敏感[32]。水分亏缺会对植物的生长状况、形态结构与生理生化产生显著影响[33-34]。本研究发现,受到水分胁迫后,不同马铃薯植株体内POD、CAT活性及可溶性蛋白含量较对照均有所上升,这与大量研究报道[35-37]一致。且几种酶活性变化在两种不同的胁迫处理间具有较高的相关性,这与抗艳红等[34]、张立军等[38]的PEG模拟干旱试验测得的生理指标与室外旱池的实际抗旱指标有较好的一致关系的结论相符合。
综合比较SSR分子标记聚类分析与生理分析结果,发现两种聚类分析结果间并不具有较高一致性。例如SSR聚类分析B类中的材料31和36间因具有较高的遗传相似系数(GS=0.909 1)而被聚在一起,与此同时,二者在受到水分胁迫后在生理生化反应也具有一定的一致性,而被聚为同一组(e)中。然而,对于大部分品种来说,遗传亲缘关系的远近与其对生理胁迫的响应间并不具有高度的一致性。如材料28、29具有相同的父本[392 820.1=(C93.154)]和母本(CHIEFTAIN),遗传背景相似而聚在一起,然而,二者在对水分胁迫的响应并不一致,分别属于不同的组,即d和e。同样,材料8、9间因具有较高的遗传相似系数(GS=0.893 9)而被聚在一起,但二者在受到水分胁迫后其生理生化反应并不具有较高一致性,二者分别属于不同的组,即b和c。综合多个品种遗特性及对生理生化响应的差异,发现二者之间并不具有简单的相关性。其主要原因可能为:1)材料多样性分析的出发点不一样。SSR分子标记通过分析,且广泛分布在真核生物基因组上的,由于其重复次数不同或重复程度不完全而形成每个座位的多态性,对物种种质资源进行遗传多样性分析[39]。然而,GGE-Biplot聚类分析是通过检测植物受到水分逆境胁迫后,其体内抗氧化物酶活性的变化情况,对供试材料的水分逆境胁迫响应快慢进行的分析。2)两种试验方法采用了不同的统计分析软件,数据算法不一样,如SSR分子标记使用NTSYS-pc2.10e,采用UPGMA法构建聚类图,而水分胁迫后,酶活性变化的分析采用SPSS R型聚类,因此也使得聚类结果有差异。3)SSR分子标记试验所用的引物较少,因此扩增获得的多态性条带数目也有限,未能充分表现材料本身的遗传特异性。另一方面,植物对水分胁迫逆境的响应机制是由多种因素共同参与的复杂过程[7,40],单纯的对水分胁迫逆境下对抗氧化物酶活性的测定并不能充分表现品种的生理特性。
本研究通过SSR分子标记技术将44份马铃薯材料在遗传相似系数(GS)为0.700水平上被聚为5类,且大部分品种被聚在一个类群,说明供试品种遗传基础还是相对狭窄。遗传相似系数较大的品种往往被聚在一起,说明它们的亲缘关系较近。通过水分胁迫试验发现,马铃薯移栽苗受到PEG-6000浇灌和自然不浇水两种胁迫处理后其体内的POD、CAT及可溶性蛋白含量相对于对照均上升,且同一种酶在两种胁迫处理下的变化量具有较高的相关性,说明两种水分胁迫方式在鉴定马铃薯抗旱特性上具有较高的一致性。综合分析3种酶在两种胁迫处理下,不同品种中的变化量,将43份材料聚为大小不一的6组。综合比较两种聚类结果发现,二者并不具有一致的相关性,说明不能从遗传多样性的角度很好地解释不同种质间对胁迫响应差异,其原因还有待于进一步研究。
参考文献(References)
[1]Veilleux R E,Shen L Y,Paz M M.Analysis of the genetic composition of anther-derived potato by randomly amplified polymorphic DNA and simple sequence repeat.Genome,1995,38(6):1153-1162.
[2]Provan J,Powell W,Waugh R.Microsatellite analysis of relationships within cultivated potato (Solanumtuberosum).Theoretical and Applied Genetics,1996,92(8):1078-1084.
[3]Rocha E A,Paiva L V,de Carvalho H H,Guimarães C T.Molecular characterization and genetic diversity of potato cultivars using SSR and RAPD markers.Crop Breeding and Applied Biotechnology,2010,10(3):204-210.
[4]de Galarreta J I R,Barandalla L,Rios D J,Lopez R,Ritter E.Genetic relationships among local potato cultivars from Spain using SSR markers.Genetic Resources and Crop Evolution,2011,58(3):383-395.
[5]Ghislain M,Spooner D M,Rodríguez F,Villamn F,Nunez J,Vásquez C,Waugh R,Bonierbale M.Selection of highly informative and user-friendly microsatellites (SSRs) for genotyping of cultivated potato.Theoretical and Applied Genetics,2004,108(5):881-890.
[6]Spooner D M,Núez J,Trujillo G,María del R H,Guzmán F,Ghislain M.Extensive simple sequence repeat genotyping of potato landraces supports a major reevaluation of their gene pool structure and classification.Proceedings of the National Academy of Sciences of USA,2007,104(49):19398-19403.
[7]刘建霞,雷海英,温日宇,郭耀东,王润梅,周凤.山西省马铃薯主栽品种遗传多样性的SSR分析.华北农学报,2013,27(6):72-77.
Liu J X,Lei H Y,Wen R Y,Guo Y D,Wang R M,Zhou F.SSR analysis on genetic diversity of leading potato cultivars in Shanxi Province.Acta Agriculturae Boreali-sinica,2013,27(6):72-77.(in Chinese)
[8]叶景秀,张凤军,张永成.青海省20个主要马铃薯审定品种的SSR标记遗传分析.种子,2013,32(6):1-4.
Ye J X,Zhang F J,Zhang Y C.Genetic diversity analysis of 20 potato (SolanumtuberosumL.) genetypes in Qinghai Province with SSR markers.Seeds,2013,32(6):1-4.(in Chinese)
[9]段艳凤,刘杰,卞春松,段绍光,徐建飞,金黎平.中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析.作物学报,2009,35(8):1451-1457.
Duan Y F,Liu J,Bian C S,Duan S G,Xu J F,Jin L P.Construction of fingerprinting and analysis of genetic diversity with SSR markers for eighty-eight approved potato cultivars (SolanumtuberosumL.) in China.Acta Agronomica Sinica,2009,35(8):1451-1457.(in Chinese)
[10]陈立强,师尚礼.42份紫花苜蓿种质资源遗传多样性的SSR分析.草业科学,2015,32(3):372-381.
Chen L Q,Shi S L.Genetic diversity among 42 alfalfa accession revealed by SSR marker.Pratacultural Science,2015,32(3):372-381.(in Chinese)
[11]黄素华.玉米自交系多样性研究以及玉米苗期耐旱相关基因的克隆、分析.北京:中国农业科学院博士后学位论文,2005.
Huang S H.Study on diversity of maize (ZeamaysL.) inbred lines and cloning of related genes for drought resistance(tolerance)from corn seedling.Post Doctoral Thesis.Beijing:Chinese Academy of Agricultural Sciences,2005.(in Chinese)
[12]王阳,刘成,王天宇,石云素,宋燕春,黎裕.干旱胁迫和正常灌溉条件下玉米产量性状的QTL分析.植物遗传资源学报,2007,8(2):179-183.
Wang Y,Liu C,Wang T Y,Shi Y S,Song Y C,Li Y.QTL analysis of yield components in maize under different water regimes.Journal of Plant Genetic Resources,2007,8(2):179-183.(in Chinese)
[13]张洁.冬小麦幼苗期水分胁迫应答蛋白及其分子标记的研究.杨凌:西北农林科技大学硕士学位论文,2007.
Zhang J.Molecular marker and response protein of winter wheat during seedling stage in the water stress condition.Master Thesis.Yangling:Northwest Agriculture and Forestry University,2007.(in Chinese)
[14]胡国霞,马莲菊,陈强,赵贵林,褚妍,任菲,李雪梅.植物抗氧化系统对水分胁迫及复水响应研究进展.安徽农业科学,2011,39(3):1278-1280.
Hu G X,Ma L J,Chen Q,Zhao G L,Chu Y,Ren F,Li X M.Research progress of plant antioxidant system to water stress and rewatering. Journal of Anhui Agricultural Sciences,2011,39(3):1278-1280.(in Chinese)
[15]赵海超,抗艳红,龚学臣,尹江,田再民.干旱胁迫对不同马铃薯品种苗期生理生化指标的影响.作物杂志,2013(6):63-69.
Zhao H C,Kang Y H,Gong X C,Yin J,Tian Z M.Effects of drought stress on physiological and biochemical indices of different potato variety.Crops,2013(6):63-69.(in Chinese)
[16]何淼,李文鹤,卓丽环.野菊幼苗对自然干旱胁迫的生理响应.草业科学,2011,28(8):1456-1460.
He M,Li W H,Zhuo L H.Physiological response ofDendrathemaindicumseedlings to nature drought stress.Pratacultural Science,2011,28(8):1456-1460.(in Chinese)
[17]Heyser J W,Nabors M W.Osmotic adjustment of tobacco cells and plants to penetrating and non-penetrating solutes.Plant Physiology,1979,63:77-77.
[18]Carpita N,Sabularse D,Montezinos D,Delmer D P.Determination of the pore size of cell walls of living plant cells.Science,1979,205:1144-1147.
[19]王瑾,刘桂茹,杨学举.PEG胁迫下不同抗旱性小麦品种幼苗形态及主要理化特性的比较.河北农业大学学报,2005,28(5):6-10.
Wang J,Liu G R,Yang X J.Comparison of the morphology and biochemical characteristics of wheat seedlings between drought-resistant and drought-sensitive varieties under PEG water-stress.Journal of Agricultural University of Hebei,2005,28(5):6-10.(in Chinese)
[20]李建武,王蒂.水分胁迫对马铃薯试管苗抗氧化酶活性的影响.北方园艺,2008(1):7-9.
Li J W,Wang D.The effect of water stress on the activity of antioxidant enzymes ofSolanumtuberosumL.Northern Horticulture,2008 (1):7-9.(in Chinese)
[21]秦玉芝,陈珏,刘明月,熊兴耀,何长征,周玄,邢铮.聚乙二醇模拟干旱对马铃薯幼苗生长与细胞膜透性的影响.湖南农业大学学报(自然科学版),2011,37(6):627-631.
Qin Y Z,Chen Y,Liu M Y,Xiong X Y,He C Z,Zhou X,Xing Z.Effect of PEG-induced water stress on morphologic characters and membrane permeability of potato.Journal of Hunan Agricultural University(Natural Sciences),2011,37(6):627-631.(in Chinese)
[22]Jones A S,Walker R T.Isolation and analysis of the deoxyribonucleic acid ofMycoplasmamycoidesvar.capri. Nature,1963,198:588-589.
[23]Feingold S,Lloyd J,Norero N,Bonierbale M,Lorenzen J.Mapping and characterization of new EST-derived microsatellites for potato (SolanumtuberosumL.).Theoretical and Applied Genetics,2005,111(3):456-466.
[24]邹奇.植物生理实验指导.北京:中国农业出版社,2000,163-165.
Zou Q.Experiment Instruction of Plant Physiology.Beijing:China Agricultural Press,2000:163-165.
[25]Rolf F.Ntsys-Pc:Numerical Taxonomy and Multivariate Analysis System Version 2.1.Setauket,NY,USA:Exeter Publishing,2000.
[26]Yeh F C,Yang R C,Boyle T.PopGene Version 131:Microsoft Window-based freeware for population genetic analysis.University of Alberta and Centre for International Forestry Research,1999:11-23.
[27]Kimura M,Crow J F.The number of alleles that can be maintained in a finite population.Genetics,1964,49(4):725.
[28]Lewontin R C.The Apportionment of Human Diversity.Evolutionary Biology.US:Springer,1995:381-398.
[29]Nei M.Analysis of gene diversity in subdivided populations.Proceedings of the National Academy of Sciences of USA,1973,70(12):3321-3323.
[30]严威凯.双标图分析在农作物品种多点试验中的应.作物学报,2010,36(11):1805-1819.
Yan W K.Optimal use of biplots in analysis of multi-location variety test data.Acta gronomica Sinica,2010,36(11):1805-1819.(in Chinese)
[31]白江平,崔同霞,张金文,张俊莲,王蒂.马铃薯块SGAs合成途径关键基因表达量的GGE双标图分析.植物研究,2014,34(2):238-244.
Bai J P,Cui T X,Zhang J W,Zhang J L,Wang D.GGE-Biplot analysis on gene expression of seven key genes mediating biosynthesis of steroidal glycoalkaloid in potato.Bulletin of Botanical Research,2014,34(2):238-244.(in Chinese)
[32]Gopal J,Iwama K.In vitro screening of potato against water-stress mediated through sorbitol and polyethylene glycol.Plant Cell Reports,2007,26(5):693-700.
[33]焦志丽,李勇,吕典秋,王晶英.不同程度干旱胁迫对马铃薯幼苗生长和生理特性的影响.中国马铃薯,2012,25(6):329-333.
Jiao Z L,Li Y,Lyu D Q,Wang J Y.Effects of different drought treatments on growth indicators and physiological characters of potato seedlings.Chinese Potato Journal,2012,25(6):329-333.(in Chinese)
[34]抗艳红,龚学臣,田再民,赵海超,齐海明.聚乙二醇处理马铃薯脱毒试管苗的生理反应.江苏农业科学,2011(2):162-164.
Kang Y H,Gong X C,Tian Z M,Zhao H C,Qi H M.Physiological response of potato virus-free test-tube plantlets under peg-induced water stress.Jiangsu Agricultural Sciences,2011(2):162-164.(in Chinese)
[35]李建武,王蒂,司怀军,彭晓莉.水分胁迫下马铃薯试管苗的生理响应.甘肃农业大学学报,2005(3):319-323.
Li J W,Wang D,Si H J,Peng X L.Physiological response of test-tuber plantlets of potato under water stress.Journal of Gansu Agricultural University,2005(3):319-323.(in Chinese)
[36]Devi R,Kaur N,Gupta A K.Potential of antioxidant enzymes in depicting drought tolerance of wheat (TriticumaestivumL.).Indian Journal of Biochemistry & Biophysics,2012,49(4):257-265.
[37]Mirzaee M,Moieni A,Ghanati F.Effects of Drought stress on the lipid peroxidation and antioxidant enzyme activities in two canola(BrassicanapusL.)Cultivars.Journal of Agricultural Science and Technology,2013,15(3):593-602.
[38]张立军,樊金娟,阮燕晔,关义新.聚乙二醇在植物渗透胁迫生理研究中的应用.植物生理学通讯,2004,40(3):361-364.
Zhang L J,Fan J J,Ruan Y Y,Guan Y X.Application of polyethylene glycol in the study of plant osmotic stress physiology.Plant Physiology Communications,2004,40(3):361-364.(in Chinese)
[39]杨文柱,焦燕.SSR分子标记技术在生物遗传学领域的应用.安徽农业科学,2012,40(2):640-642.
Yang W Z,Jiao Y.Application of SSR molecular marker technique in the field of biogenetics.Journal of Anhui Agricultural Sciences,2012,40(2):640-642.(in Chinese)
[40]张斌,秦岭,王莹莹,范仲学,毕玉平.作物抗旱分子机制研究进展.山东农业科学,2012(12):22-26.
Zhang B,Qin L,Wang Y Y,Fan Z X,Bi Y P.Research progress of crop drought-resistant mechanism.Shandong Agricultural Sciences,2012(12):22-26.(in Chinese)
(责任编辑张瑾)
DOI:10.11829/j.issn.1001-0629.2015-0182
*收稿日期:2015-03-31接受日期:2015-08-20
基金项目:科技部国际科技合作项目(2014DFG31570);甘肃科技基金(1308RJZA131、1308RJIA005);兰州科技研究项目(2013-4-156)
通信作者:王蒂(1955-),男,陕西延安人,教授,博导,博士,研究方向为作物遗传育种研究。E-mail:wangd@gsau.edu.cn
中图分类号:S532.03
文献标识码:A
文章编号:1001-0629(2016)3-0431-11* 1
Corresponding author:Wang DiE-mail:wangd@gsau.edu.cn
Analyze the genetic variation and drought resistance of the potato germplasm
Lou Yan1,2, Bai Jiang-ping1,2, Yang Hong-yu1,3, Li Wei-ting1,2, Gao Hui-juan1,2,Zhang Jun-lian1,3, Wang Di1,2, Zhang Jin-lin4, Wang Wang-tian2
(1.Gansu Key Laboratory of Crop Improvement and Germplasm Enhancement/Gansu Provincial Key Laboratory of Aridland Crop Science, Lanzhou 730070, China;2.College of Agronomy, Gansu Agricultural University, Lanzhou 730070, China;3.College of Horticulture, Gansu Agricultural University, Lanzhou 730070, China;4.College of pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730000, China)
Abstract:To explore the relationship between potato (Solanum tuberosum) different genetic traits and its response to water stress, we analyzed the genetic diversity of test materials by the methods of SSR, studied the content variation of peroxidase (POD and CAT) activity and soluble protein of different potato varieties under water stresses by processing potato transplanting seedling for PEG-6000 simulated water stress and natural water stress method. The results showed that the genetic similarity coefficient (GS) at 0.700 level, 44 potato materials can be divided into five types, most breed clustered together, explaining the genetic basis of testing varieties is still relatively narrow. Through a GGE-biplot comprehensive analysis of soluble protein, POD and CAT variation, 44 selected materials were divided into 6 groups. Comparative analysis of genetic diversity analysis and physiological results found that there were no obvious consistency between them, namely the species differences in genetic traits can’t react their drought resistance performance difference directly. But two stress modes with high consistency on studying the characteristics of varieties of drought resistance. This research provides the reference for further drought resistance research.
Key words:genetic diversity; PEG stress; GGE-biplot; drought resistance
娄艳,白江平,杨宏羽,李维婷,高慧娟,张俊莲,王蒂,张金林,王旺田.马铃薯种质的遗传特性与抗旱性的关系.草业科学,2016,33(3):431-441.
Lou Y,Bai J P,Yang H Y,Li W T,Gao H J,Zhang J L,Wang D,Zhang J L,Wang W T.Analyze the genetic variation and drought resistance of the potato germplasm.Pratacultural Science,2016,33(3):431-441.
第一作者:娄艳(1989-),女,甘肃临夏人,在读硕士生,研究方向为马铃薯遗传育种。E-mail:lou_yan0931@163.com
共同第一作者:白江平(1978-),男,甘肃天水人,副教授,硕导,博士,研究方向为作物遗传育种。E-mail:baijp@gsau.edu.cn
