燕麦幼苗对低温胁迫的响应
2016-08-02柏晓玲周青平陈有军田莉华陈仕勇肖雪君
柏晓玲,周青平,陈有军,田莉华,陈仕勇,肖雪君
(1.西南民族大学生命科学与技术学院,四川 成都 610041; 2.西南民族大学青藏高原研究院,四川 成都 610041)
燕麦幼苗对低温胁迫的响应
柏晓玲1,周青平2,陈有军2,田莉华2,陈仕勇1,肖雪君1
(1.西南民族大学生命科学与技术学院,四川 成都 610041; 2.西南民族大学青藏高原研究院,四川 成都 610041)
摘要:在0、12、36、60 h不同时间梯度下,对7个燕麦(Avena sativa)品种(青引1号、青引2 号、青引3号莜麦、青海甜燕麦、青海444、青燕1号和林纳)进行连续低温(5 ℃)胁迫,比较其抗寒能力。结果表明,与低温胁迫前(0 h)相比,低温处理后(12、36和60 h)7个燕麦品种幼苗叶片丙二醛、脯氨酸含量和超氧化物歧化酶、过氧化物酶活性均显著增加(P<0.05);各燕麦品种幼苗叶片丙二醛、脯氨酸含量和过氧化物酶、超氧化物歧化酶活性在低温胁迫初期(0-12 h)显著增加(P<0.05)并达到最大值;随着低温胁迫时间延长,其含量开始下降。7个燕麦品种抗寒能力依次表现为青引3号莜麦>青海甜燕麦>青引2号>林纳>青燕1号>青海444>青引1号。
关键词:燕麦幼苗;丙二醛;超氧化物歧化酶;抗寒性;主成分分析
燕麦在植物学分类上属于禾本科燕麦属(Avena),为一年生粮饲兼用作物,按其外稃性状分为带稃型和裸粒型,具有适应性强、适口性好、营养价值高和生产潜力大等特点,是重要的牧草兼粮食作物,广泛分布于我国东北、华北、西北等高寒地区,目前生产上广泛应用的是普通栽培燕麦(A. sativa)和裸燕麦(A. nuda)[1-4]。由于燕麦秸草具有较高的生长速率和生物量累积速率,因此,已成为高寒牧区冷季主要的补饲饲草。
燕麦适宜在高寒及冷凉地区栽培生长[5],但低温仍是限制燕麦产量、品质的重要因素。研究发现,低温胁迫使植物体内防御活性氧的酶促和非酶促保护系统能力降低,致使细胞内自由基水平提高,膜脂过氧化作用加剧,导致质膜损伤,造成低温伤害[6]。随着温度的降低,燕麦的开花数量呈下降趋势[7];随海拔升高,气温下降,燕麦的产量不断下降[8]。余前媛和林谦[9]研究表明,燕麦种子最适宜的发芽温度为20 ℃,低温对燕麦种子萌发有一定限制作用,主要表现为发芽率低,出苗不整齐。目前,相关学者在燕麦的抗旱性[10]、栽培方式[11-12]、遗传多样性[13]及营养品质[14]等方面已取得不少研究成果,而针对高寒地区燕麦抗寒性研究鲜有报道。为此,本研究选用7个燕麦品种,通过人工模拟5 ℃低温环境,研究不同低温胁迫时间对燕麦幼苗叶片丙二醛(malonaldehyde,MDA)含量、过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxidedismutase,SOD)、脯氨酸(proline,Pro)等酶活性及叶绿素相对含量(chlorophyllindex,SPAD)的影响,探究不同燕麦品种在低温胁迫下的响应的差异,旨在为燕麦在青藏高原高寒地区的种植栽培和扩大引种提供科学依据。
1材料与方法
1.1试验材料
试验材料为青海牧区普遍种植的林纳(A. sativacv.Linna)、青引1号(A. sativacv.QingyinNo.1)、青引2号(A. sativacv.QingyinNo.2)、青燕1号(A. sativacv.QingyanNo.1)、青海甜燕麦(A. sativacv.Qinghaisweetoat)、青海444(A. sativacv.QinghaiNo. 444)、青引3号莜麦(A. sativacv.QingyinNo.3)7个燕麦品种,均由西南民族大学青藏高原研究院提供。
1.2试验处理
对试验材料粒选,选择成熟、饱满和大小相对一致的种子150粒,种子用0.1%HgCl2消毒15min,以蒸馏水冲洗干净,播种于石英砂(含水量为70%)和营养液为1∶2的沙盘(长30cm×宽20cm×高10cm)中,每个品种各播种3盘,每盘播种50粒,放置于25 ℃的恒温培养箱中培养,光照4 000lx,每天照明12h,相对湿度60%~70%。培育至植株长出两片真叶后转置于5 ℃培养箱进行低温胁迫处理,连续处理60h,分别测定低温胁迫前(0h)及胁迫12、36和60h后的MDA含量、POD、SOD和Pro活性及SPAD,每个指标测定3次。
1.3测定方法
参照邹琦[15]和夏超等[16]方法测定各个生理指标。MDA含量采用硫代巴比妥酸法测定;SPAD采用SPAD叶绿素仪测定;Pro含量采用双组分光光度计测定;POD活性采用双组分光光度计测定;SOD活性采用双组分光光度计测定。
1.4统计分析
采用Excel2007进行数据处理和图表绘制。用SPSS18.0对不同时间低温胁迫燕麦幼苗各生理生化指标进行单因素方差分析,并用Duncan法对测定指标进行多重比较;用SPSS18.0对7个燕麦品种幼苗抗寒性进行主成分分析并排序。
2结果与分析
2.1燕麦幼苗MDA含量对低温胁迫的响应
低温胁迫处理前(0h),以青引3号莜麦、青燕1号和林纳MDA含量较高,分别为0.06、0.03和0.02μmol·g-1;低温胁迫处理12、36和60h后,7个品种MDA含量均发生变化。低温处理至12h时,7个燕麦品种MDA含量均增加,林纳和青海甜燕麦MDA含量增加最快,分别增加了0.14和0.13μmol·g-1,显著大于其它品种(P<0.05);其次是青海444、青引2号,都增加了0.08μmol·g-1;青引3号莜麦和青引1号分别增加了0.03和0.04μmol·g-1;青燕1号MDA含量最大(P<0.05),增加了0.02μmol·g-1。低温胁迫至36h,各品种MDA含量均显著降低(P<0.05),林纳和青海甜燕麦MDA含量下降最多,分别降了0.10和0.09μmol·g-1;青引3号莜麦MDA含量下降了0.05μmol·g-1,但这3个品种显著高于其余品种,其它燕麦品种MDA含量下降了0.02μmol·g-1左右;低温胁迫至60h,7个燕麦品种MDA含量与36h处理相比差异不大,青引3号莜麦继续下降,青海444、青燕1号、青引1号和青引2号均较处理前有少量增加。总体上看,不同时间低温胁迫对燕麦幼苗MDA含量产生显著影响,12h低温胁迫下燕麦幼苗MDA含量达到最大,这可能是品种对MDA含量的积累有很大影响(图1)。

图1 低温胁迫时间对7个燕麦品种幼苗MDA含量的影响Fig.1 Effects of chilling stress time on the MDA contents of seven cultivars of oat seedlings
注:不同大写字母表示相同低温胁迫时间下不同燕麦品种幼苗间差异显著(P<0.05),不同小写字母表示相同燕麦品种幼苗不同低温胁迫时间处理间差异显著(P<0.05)。胁迫时间0h为未进行低温胁迫处理,作为对照。下同。
Note:Differentcapitallettersshowsignificantdifferenceamongdifferentoatseedlingsinthesamechillingtimeat0.05level,anddifferentlowercaselettersshowsignificantdifferenceamongdifferentchillingtimeinthesameoatseedlingsat0.05level.Thesamebelow.
2.2燕麦幼苗SPAD对低温胁迫的响应
随着低温胁迫时间的延长,7个燕麦品种SPAD呈降低趋势(图2)。低温胁迫处理前(0h),青海444、青引3号莜麦和林纳的SPAD最大(P<0.05),分别为45.1、43.2和39.6;低温胁迫至12h,青引3号莜麦的SPAD为43.24,林纳、青海444和青海甜燕麦SPAD基本一致,青燕1号、青引1号和青引2号差异不显著(P>0.05)。低温处理36和60h时,7个燕麦品种SPAD降低,其中青海444显著下降(P<0.05),相比处理前(0h)分别降低了17.2和20.3。
2.3燕麦幼苗Pro含量对低温胁迫的响应
低温胁迫处理前,青海444的Pro含量最大,显著高于其它品种,青海甜燕麦最小(图3)。低温处理后,7个燕麦品种幼苗Pro含量显著高于对照(P<0.05)。胁迫处理12h时,Pro含量活性上升最快,青海444、青燕1号、林纳和青海甜燕麦分别升高了4.90、3.48、3.40和2.25μg·g-1,青引1号、青引2号和青引3号莜麦Pro含量差异显著(P<0.05),分别增加了0.97、1.32和1.71μg·g-1。相比12h低温处理,在36h低温胁迫下,林纳、青海444和青燕1号分别降低了2.00、1.62和1.27μg·g-1,而青引1号上升了1.13μg·g-1,这可能与品种间对低温的耐受范围不同有关。低温胁迫60h,青引2号和青引3号莜麦Pro含量分别升高了2.43和1.58μg·g-1。总体上看,胁迫处理后燕麦幼苗中Pro含量较处理前有所增加。

图2 低温胁迫时间对7个燕麦品种幼苗SPAD的影响Fig.2 Effects of chilling stress time on the SPAD of seven cultivars of oat seedlings
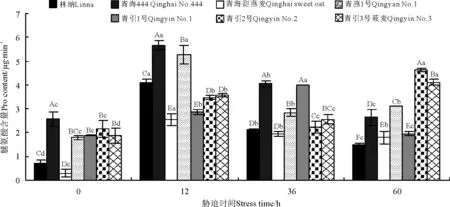
图3 低温胁迫时间对7个燕麦品种幼苗Pro含量的影响Fig.3 Effects of chilling stress time on the Pro content of seven cultivars of oat seedlings
2.4燕麦幼苗POD活性对低温胁迫的响应
低温胁迫处理12、36和60h后燕麦幼苗POD活性同胁迫前相比发生了明显变化(图4)。低温胁迫处理前,除青海甜燕麦(4.41U·g-1)以外,其它6个燕麦品种幼苗POD活性无显著差异(P>0.05)。低温胁迫持续处理12h后,POD活性显著增加,以青引2号POD活性最高,增加了6.53U·g-1,显著高于其他品种(P<0.05);青引3号莜麦、青燕1号POD活性分别增加了1.98和1.32U·g-1。低温持续胁迫处理至36h时,各品种POD活性均下降,青引2号、青海444和林纳显著降低(P<0.05),分别下降了5.69、4.01 和3.51U·g-1,青引3号莜麦POD活性降低了0.07U·g-1(P>0.05)。低温持续胁迫处理至60h,青海444和青燕1号POD活性继续降低,其它品种开始增加。
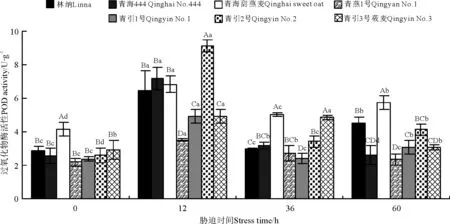
图4 低温胁迫时间对7个燕麦品种幼苗POD活性的影响Fig.4 Effects of chilling stress time on the POD activity of seven cultivars of oat seedlings
2.5燕麦幼苗SOD活性对低温胁迫的响应
低温胁迫处理(12、36、60h)后与低温胁迫处理前(0h)相比,燕麦幼苗SOD活性表现出先升高后降低趋势(图5)。低温胁迫前,以青引2号SOD活性较大,为1.52U·g-1,其次青引3号莜麦为1.25U·g-1,其它5个品种无显著差异(P>0.05);低温胁迫12h对燕麦幼苗SOD活性影响最大,以青引3号莜麦增加最快(P<0.05),增加了2.35U·g-1;胁迫36h后燕麦幼苗SOD活性开始下降,但均高于胁迫前(P<0.05),青引3号莜麦、青引1号和林纳下降最显著(P<0.05),分别降低了1.97、1.51和1.37U·g-1;胁迫至60h,青海444、青海甜燕麦和青引2号SOD活性继续降低,青引3号莜麦、林纳、青引1号和青燕1号SOD活性开始增加。总体而言,燕麦幼苗SOD活性在在低温胁迫12h下达到最大值,随胁迫时间延长趋于下降,但均高于胁迫前。
2.6各燕麦品种抗寒性综合评价
对各生理指标进行PCA分析,选取特征根大于1,累积贡献率达到83.214%的前3个因子作为主成分(表1),代表燕麦抗寒性指标,由主成分载荷矩阵计算出相应的主成分表达式,以各主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重计算主成分综合模型。

图5 低温胁迫时间对7个燕麦品种幼苗SOD活性的影响Fig.5 Effects of chilling stress time on the SOD activity of seven cultivars of oat seedlings表1 解释的总方差表Table 1 Explain the total variance

成分Component初始特征值Initialeigenvalues合计Total贡献率Contributionrate/%累积贡献率Cumulativecontribution/%提取平方和载入Extractionofsumofsquaresloadings合计Total贡献率Contributionrate/%累积贡献率Cumulativecontribution/%SOD2.01140.22240.2222.01140.22240.222POD1.20624.12564.3471.20624.12564.347MDA0.94318.86783.2140.94318.86783.214SPAD0.56511.29894.512Pro0.2745.488100.00
2.6.1低温胁迫下燕麦各生理指标主成分表达式
F1=0.080XPro+0.103XPOD-0.103XMDA+0.053XSOD+0.104XSPAD
(1)
F2=-0.059XPro-0.034XPOD+0.124XMDA+0.207XSOD+0.07XSPAD
(2)
F3=0.323XPro-0.244XPOD+0.118XMDA-0.025XSOD+0.123XSPAD
(3)
由各主成分得分表达式得综合模型:F=0.268XPro+0.094XPOD-0.062XMDA+0.319XSOD+0.357XSPAD。
2.6.2供试品种抗寒性综合评价将不同生理指标的含量值与相应主成分得分系数的乘积相加得到燕麦抗寒性的主成分得分,根据主成分得分综合模型即可对燕麦抗寒性进行综合评价,得分越高,表明抗寒性越强(表2)。
根据主成分综合模型计算各品种抗寒能力高低,根据各品种得分值大小对其进行抗寒性强弱排序(表2)。青引3号莜麦得分值最高,为15.15,说明抗寒性最强;青海甜燕麦、青引2号、林纳、青燕1号、青海444得分值依次降低,都略低于青引3号莜麦,表明抗寒性适中;青引1号得分值最低,为11.70,说明抗寒性最弱。

表2 各品种综合评价得分Table 2 Comprehensive evaluation score of seven cultivars of oat
3讨论与结论
MDA是植物细胞膜脂过氧化后的重要产物,受低温胁迫其含量逐渐增加,植物的抗寒性鉴定可以通过MDA指标来评价,这已在小麦(Triticum aestivum)[17]、油菜(Brassica campestris)[18]等研究中得到证实。在不同时间低温处理燕麦各品种幼苗叶片后,7个燕麦幼苗MDA含量均有不同,相对处理前有增加趋势(青引3号莜麦除外),低温持续到12h,MDA含量达到最大,说明燕麦对短期的低温胁迫表现出一定的耐受能力,也证明了12h的低温胁迫时燕麦幼苗的耐冷的临界温度;时间延长到36和60h时,青引3号莜麦的MDA含量均小于处理前,发现此品种在较长的低温胁迫下膜系统遭到破坏,抗寒力降低。
研究表明,植物受到低温胁迫后,其体内的自由基和活性氧大量积累,导致细胞发生膜脂氧化作用,致使植株细胞结构破裂、植株冻害损伤甚至死亡[19]。本研究认为持续低温胁迫对燕麦幼苗叶片内叶绿体造成一定破坏,导致SPAD下降,这与高素华等[20]研究低温对玉米(Zea mays)幼苗的SPAD影响结果相一致,即低温处理下玉米幼苗SPAD随着低温的持续胁迫而下降。
Pro作为植物对抗逆境的重要保护酶之一,Pro含量表现植物的抗逆能力[21]。在持续低温胁迫下,各品种脯氨酸含量均高于处理前含量值,表明了膜系统的保护作用增强,这与罗丹等[22]对番茄(Lycopersicon esculentum)受低温胁迫后Pro含量变化研究结果相似,即番茄内Pro含量随低温胁迫时间的延长呈先升高后降低的趋势。
POD和SOD是植物体内的保护活性酶,是主要的活性氧自由基清除系统[23]。随着低温胁迫时间的延长,7个燕麦品种幼苗内的SOD和POD活性呈先增加后降低再增加的趋势,但低温处理后幼苗SOD和POD活性值均高于未处理燕麦幼苗,表明低温胁迫增强了燕麦幼苗对活性氧的清除能力。抗寒性较强的品种(青引3号莜麦、青燕1号、林纳)在较长低温胁迫处理时间下提高了自身的抗寒性。当低温处理到12h,酶活性达到高峰,之后随时间延长而略有降低,这可能是植物对逆境胁迫所表现的一种应激反应。
本研究运用PCA排序方法对MDA、SPAD、Pro、POD和SOD5个生理生化指标对7个燕麦品种进行综合排序分析,认为7个燕麦品种在幼苗期抗寒能力评价研究得到抗寒性强弱依次为青引3号莜麦>青海甜燕麦>青引2号>林纳>青燕1号>青海444>青引1号。
燕麦在高寒牧区适应性强,耐贫瘠、耐盐碱、抗旱耐寒、产草量高,加之籽实和青干草都是优质的饲草来源,故燕麦作为一种饲草来源对高寒牧区畜牧业的发展意义深远[24-25]。选育优质高产抗寒性牧草品种在高寒牧区种植推广,可有效缓解高寒牧区冬春季的饲草缺乏现状。本研究开展持续低温胁迫试验,综合分析7个燕麦品种幼苗的5项生理生化指标并对其抗寒性进行评价,筛选出7个品种中抗寒性最好的青引3号莜麦,为抗寒燕麦品种在高寒牧区的推广提供了理论基础。
参考文献References:
[1]周青平.高原燕麦的栽培与管理.江苏:江苏凤凰科学技术出版社,2014:11.
ZhouQP.CultivationandManagementofOatsinAlpineRegion.Jiangsu:PhoenixSciencePress,2014:11.(inChinese)
[2]马雪琴,赵桂琴,龚建军.播期与氮肥对燕麦种子产量构成要素的影响.草业科学,2010,27(8):88-92.
MaXQ,ZhaoGQ,GongJJ.Effectsowingdateandnitrogenfertilizeronseedyieldanditscomponentsofoatsinalpinearea.PrataculturalScience,2010,27(8):88-92.(inChinese)
[3]武俊英,刘景辉.不同品种燕麦种子萌发和幼苗生长的耐盐性.生态学杂志,2009,28(20):1960-1965.
WuJY,LiuJH.Salt-toleranceofseedgerminationandseedlinggrowthofdifferenceoatvarieties.ChineseJournalofEcology,2009,28(20):1960-1965. (inChinese)
[4]徐长林.高寒牧区不同燕麦品种生长特性比较研究.草业学报,2012,21(2):280-285.
XuCL.Astudyongrowthcharacteristicsofdifferentvarietiesofoat(Avena sative)inalpineregion.ActaPrataculturaeSinica,2012,21(2):280-285. (inChinese)
[5]万帆.基于GIS的中国燕麦填图.兰州:兰州大学硕士学位论文,2009.
WanF.GIS-basecroponmappingforoatsinChina.MasterThesis.Lanzhou:LanzhouUniversity,2009.(inChinese)
[6]刘欢,赵桂琴.燕麦抗逆性研究进展.草原与草坪,2008(6):63-68.
LiuH,ZhaoGQ.Researchprogressinstresstoleranceofoats.GrasslandandTurf,2008(6):63-68.(inChinese)
[7]刘秉信,祁翠兰.皮燕麦(Avena sativa)开花习性的研究.中国草地学报,1993(4):41-43.
LiuBX,QiCL.Studyonbloomingcharacteristicsofcommonoat(Avena sativa).ChineseJournalofGrassland,1993(4):41-43.(inChinese)
[8]郎百宁,车敦仁,刘迎春,陆家宝.高原低温条件对燕麦产量形成的影响.草业科学,1991,8(5):54-58.
LangBL,CheDR,LiuYC,LuJB.EffectoflowtemperatureonyieldofoatyieldformatioontheQinghai-TibetanPlateau.PractaculturalScience,1991,8(5):54-58.(inChinese)
[9]余前媛,林谦.不同浓度GA3及温度对不同种源地燕麦发芽率的影响.现代农业科技,2009(21):10-12.
[10]张娜,赵宝平,郭若龙,张艳丽,刘景辉,王莹,李立军.水分胁迫对不同抗旱性燕麦品种生理特性的影响.麦类作物学报,2012,32(1):150-156.
ZhangN,ZhaoBP,GuoRL,ZhangYL,LiuJH,WangY,LiLJ.Effectofwaterstressonphysiologicalcharacteristicsofdifferentoatscultivars.JournalofTriticeaeCrops,2012,32(1):150-156.(inChinese)
[11]周萍萍,赵军,颜红海,兰秀锦,彭远英.播期、播种量与施肥量对裸燕麦籽粒产量及农艺性状的影响.草业科学,2015,32(3):433-441.
ZhouPP,ZhaoJ,YangHH,LanXJ,PengYY.Effectofsowingdate,sowingrateandfertilizerrateongrainyieldandagronomicofAvena sative.PractaculturalScience,2015,32(3):433-441.(inChinese)
[12]马力,周青平,颜红波,梁国玲,刘勇.氮肥与保水剂配施对青燕1号燕麦产量的影响.草业科学,2014,31(10):1929-1934.
MaL,ZhouQP,YanHB,LangGL,LiuY.EffectofnitrogenfertilizerandabsorbentpolymeronyieldofAvena sativecv.QingyanNo.1.PractaculturalScience,2014,31(10):1929-1934.(inChinese)
[13]毛明艳.不同燕麦基因型耐盐碱能力比较研究.保定:河北农业大学硕士学位论文,2009.
MaoMY.Studyontoleranceofdifferentoatgenotypestosaline-alkalistress.MasterThesis.Baoding:AgriculturalUniversityofHebei,2009.(inChinese)
[14]周海涛.不同生态环境对裸燕麦籽实营养品质影响的研究.北京:中国农业科学院硕士学位论文,2014.
ZhouHT.Effectsofenvironmentonthequalitytraitsofnakedoatscultivars.MasterThesis.Beijing:ChineseAcademyofAgriculturalSciences,2014.(inChinese)
[15]邹琦.植物生理学实验指导.北京:中国农业出版社,2000.
[16]夏超,钟睿,张兴旭,南志标.醉马草挥发油对多年生黑麦草种子萌发及幼苗生理变化的影响.草业科学,2015,32(5):658-666.
XiaC,ZhongR,ZhangXX,NanZB.Allelopathiceffectsvolatilecompoundsfromendophyte-freeandinfectedAchnatherum inberiansonLolium perenne.PrataculturalScience,2015,32(5):658-666.(inChinese)
[17]陈禹兴,付连双,王晓楠,李卓夫.低温胁迫对冬小麦恢复生长后植株细胞膜透性和丙二醛含量的影响.东北农业大学学报,2010,41(10):10-16.
ChenYX,FuLS,WangXN,LiZF.EffectoffreezingstressonmembranepermeabilityandMDAcontentinthere-growthplantofwinterwheatcultivars.JournalofNortheastAgriculturalUniversity,2010,41(10):10-16.(inChinese)
[18]王仕林,黄辉跃,唐建,汪仁全,王相权.低温胁迫对油菜幼苗丙二醛含量的影响.湖北农业科学,2012,51(20):4467-4469.
WangSL,HuangHY,TangJ,WangRQ,WangXQ.Effectsoflowtemperaturestressonthecontentofmalondialdehydeinrapeseedlings.HubeiAgriculturalSciences,2012,51(20):4467-4469.(inChinese)
[19]马凤鸣,王瑞,石振.低温胁迫对玉米幼苗某些生理指标的影响.作物杂志,2007(5):41-45.
MaFM,WangR,ShiZ.Somephysiologicalindexesofcornseedlingunderthelowtemperaturestresstreatment.Journalofcrops,2007(5):41-45.(inChinese)
[20]高素华,郭建平,张国民,王连敏,王立志.低温对玉米幼苗生理反应的影响.应用气象学报,1999,10(2):238-242.
GaoSH,GuoJP,ZhangGM,WangLM,WangLZ.Thecompactsoflowtemperatureoncornseedlingphysiologicalresponse.JournalofAppliedMeteorologicalScience,1999,10(2):238-242.(inChinese)
[21]王小华,庄南生.脯氨酸与植物抗寒性的研究进展.中国农学通报,2008,24(11):398-402.
WangXH,ZhuangNS.Advancesinresearchonprolineandcoldresistanceofplant.ChineseAgriculturalScienceBulletin,2008,24(11):398-402.(inChinese)
[22]罗丹,张喜春,田硕.低温胁迫对番茄幼苗脯氨酸积累及其代谢关键酶活性的影响.中国农学通报,2013,29(16):90-95.
LuoD,ZhangXC,TianS.Effectoflowtemperaturestressonprolineaccumulationandtheactivityofkeyenzymesinvolvedintheprolinemetabolisminleavesoftomatoseedlingtreatments.ChineseAgriculturalScienceBulletin,2013,29(16):90-95.(inChinese)
[23]李锐,李生泉,范月仙.低温胁迫对棉花幼苗SOD、CAT活性的影响.中国棉花,2008,35(2):18-19.
LiR,LiSQ,FanYX.TheSOD,CATactivitiesofcottonseedlingsunderthelowtemperaturestresstreatment.ChinaCotton,2008,35(2):18-19.(inChinese)
[24]赵秀芳,戎郁萍,赵来喜.我国燕麦种质资源的收集和评价.草业科学,2007,24(3):36-40.
ZhaoXF,RongYP,ZhaoLX.ThecollectionandevaluationofoatsinChina.PrataculturalScience,2007,24(3):36-40.(inChinese)
[25]赵桂琴,师尚礼.青藏高原饲用燕麦研究与生产现状、存在问题与对策.草业科学,2005,21(11):17-21.
ZhaoGQ,ShiSL.Currentsituationofoatresearchandproduction,problemsandstrategyinTibetanPlateau.PrataculturalScience,2005,21(11):17-21.(inChinese)
(责任编辑王芳)
DOI:10.11829/j.issn.1001-0629.2015-0510
*收稿日期:2015-09-11接受日期:2015-12-08
基金项目:青藏高原特有草种质资源创新及草地生态恢复(14TD0049 );“科技援青”高寒典型沙化综合治理技术集成与示范 (2015SZ0062);川西北藏区沙化土地生态修复技术研究及示范(2015BAC05B01)
通信作者:周青平(1962-),男,甘肃宁县人,教授,博导,博士,研究方向为牧草培育栽培。E-mail:qpingzh@aliyun.com
中图分类号:S512.6;Q945.78
文献标识码:A
文章编号:1001-0629(2016)7-1375-08*
Corresponding author:Zhou Qing-pingE-mail:qpingzh@aliyun.com
Responsesofoatseedlingstochillingstress
BaiXiao-ling1,ZhouQing-ping2,ChenYou-jun2,TianLi-hua2,ChenShi-yong1,XiaoXue-jun1
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China;2.InstituteofQinghai-TibetanPlateau,SouthwestUniversityforNationalities,Chengdu610041,China)
Abstract:In the present research, seven oat cultivars, including Qingyin No.1, Qingyin No.2, Qingyin No.3, Qinghai sweet oat, Qinghai 444, Qingyan No.1, and Linna, were treated with continuous chilling stress (5 ℃) with 0 h, 12 h, 36 h, and 60 h to compare their cold resistance. The results revealed that the activities of SOD (Superoxide dismutase), and POD (Peroxidase) and the contents of MDA (Malonaldehyde) and Pro (Proline) of all seven oat cultivars significantly increased under the chilling stress with 12, 36, and 60 h when compared with those of 0 h treatment. The activities of SOD, and POD and the contents of MDA and Pro of all seven oat cultivars reached the maximum with 12 h of chilling stress time (P<0.05), and then decreased with the extention of chilling stress time. The cold resistance of seven oat cultivars decreased in the following order Qingyin No.3 > Qinghai sweet oat > Qingyin No.2 > Linna > Qingyan No.1 > Qinghai 444 > Qingyin No.1.
Key words:oat seedlings; malonaldehyde; superoxide dismutase; cold resistance; principal component analysis
柏晓玲,周青平,陈有军,田莉华,陈仕勇,肖雪君.燕麦幼苗对低温胁迫的响应.草业科学,2016,33(7):1375-1382.
Bai X L,Zhou Q P,Chen Y J,Tian L H,Chen S Y,Xiao X J.Responses of oat seedlings to chilling stress.Pratacultural Science,2016,33(7):1375-1382.
第一作者:柏晓玲(1990-),女,四川遂宁人,在读硕士生,研究方向为牧草培育栽培。E-mail:302729414@qq.com
