达乌尔黄鼠线粒体Cyt b 基因序列特征及其系统进化分析
2016-08-02纪维红徐长林苏军虎
王 静,纪维红,徐长林,苏军虎,3
(1.兰州职业技术学院,甘肃 兰州 730070; 2.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 3.甘肃农业大学-新西兰梅西大学草地生物多样性研究中心,甘肃 兰州 730070; 4.Institute of Natural and Mathematical Sciences,Massey University,Private Bag 102 904 North Shore Mail Centre 0632,Auckland,New Zealand)
达乌尔黄鼠线粒体Cyt b 基因序列特征及其系统进化分析
王静1,纪维红2,3,4,徐长林2,苏军虎2,3
(1.兰州职业技术学院,甘肃 兰州730070; 2.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070; 3.甘肃农业大学-新西兰梅西大学草地生物多样性研究中心,甘肃 兰州730070; 4.Institute of Natural and Mathematical Sciences,Massey University,Private Bag 102 904 North Shore Mail Centre 0632,Auckland,New Zealand)
在甘肃省天祝藏族自治县采集12只达乌尔黄鼠(Spermophilusdauricus),PCR产物直接测序获得Cyt b基因1140 bp序列,采用Clustal X 1.84、MEGA 6.0、Dna SP 5.0 等生物信息学软件进行了序列特征和系统地位分析。结果显示,达乌尔黄鼠Cyt b基因含116个多态信息位点,群体中多态位点类型有转换、颠换,Cyt b基因T,C,A,G碱基含量分别为33.7%,25.9%,27.6%,12.9%。基于Kimura双参数的遗传距离显示,属内种间大黄鼠(Spermophilusmajor)与新疆黄鼠(Spermophilusfulvus)间遗传距离最小(0.034),高加索黄鼠(Spermophilusmusicus)与达乌尔黄鼠最大(0.172),达乌尔黄鼠群体内遗传距离为0.140,种群分化较大,基于NJ法构建的系统进化树符合传统分类标准,研究为达乌尔黄鼠Cyt b基因标记的种群遗传学应用提供了参考。
达乌尔黄鼠;线粒体;遗传多样性;Cyt b
达乌尔黄鼠(Spermophilusdauricus)又名草原黄鼠,隶属于啮齿目松鼠科[1],是地栖松鼠类的一种,大多栖息在沙质或半沙质山坡、平原等[2]。其分布范围比较广,多见于我国东北、华北、西北等地区,主要是鼠疫的宿主和农业、牧业、林业等的害鼠之一,对人类卫生健康也有较大的影响。
一个物种的准确分类和生态学认识是其综合利用和管理的关键,迄今有关达乌尔黄鼠的形态、分类与分布、生长发育与繁殖、年龄、性比、种群数量动态、栖息地特征、食性、昼夜活动节律、实验动物化开发及防控等方面取得了丰富的研究成果[3-6]。系统分类地位方面,对达乌尔黄鼠种的划分仍存有争议,Gunduz等[7]比较了土耳其黄鼠属物种的形态等差异,并描述了一个新种。Tsvirka等[8]比较了黄鼠属(Spermophilus)内物种的分子遗传关系。Helgen等[9]对包含达乌尔黄鼠的黄鼠属物种进行了详细的分类,并论证了属内各物种之间的关系。甘肃境内达乌尔黄鼠分布较广[10],天祝地区存有阿拉善黄鼠(Spermophilusalaschanicus),对其进一步的研究可为种的合理划分及其综合管理利用提供基础。
线粒体是真核细胞中最小的复制单位,因其具有拷贝数目多、化学分子量小、蛋白质编码效率高、母系遗传和进化速度也较核基因组快等特点,近年来越来越多的被作为分子标记,广泛地应用在动物进化遗传学、遗传多样性、分子生态学、物种以及品系鉴定等方面[11]。线粒体的细胞色素b(Cytochrome b,Cyt b)位于线粒体内膜的磷脂双分子层中,是参与氧化磷酸化合成能量ATP过程电子传递链中不可或缺的重要物质,也是线粒体自身编码的为数不多的蛋白质之一[12]。Meyer的研究表明,初步进行某种物种分子系统发育研究时可以首先采用Cyt b基因,它是13个蛋白质编码基因中了解的最为清楚的基因,也是被认为最可信的分子标记之一,同时用保守引物扩增线粒体Cyt b基因较其他线粒体基因要容易的多,因此线粒体Cyt b基因研究较为广泛。已有研究表明线粒体Cyt b基因在研究亲缘关系较近的物种分类阶元系统关系和种系地理学方面非常有用[13]。对甘肃省境内达乌尔黄鼠分子分类学地位的研究报道较少,通过对达乌尔黄鼠线粒体Cyt b基因全序列进行序列分析,并与Gen Bank中黄鼠属的多个种Cyt b基因进行同源性比较分析,目的在为达乌尔黄鼠种质资源保护、研究和利用提供基础研究数据,为达乌尔黄鼠的综合控制、管理和开发利用等提供参考。
1 材料和方法
1.1样本采集
12只达乌尔黄鼠于2012年6~7月从甘肃省境内的武威市天祝自治县采集。其中,雄性4只(成年个体3只),雌性8只(成年个体4只)。采集肝脏后,于体积分数为95%的乙醇中保存,带入实验室置于-70℃冰箱冷冻保存待用。再根据头骨类型、牙齿及其他性状特征,通过参照标本,对比鉴别[14-15],将其归分为达乌尔黄鼠。
1.2基因组DNA的提取
称取研磨的肝脏组织0.5~1.0 g,采用常规的酚氯仿抽提法提取基因组DNA[16]。
1.3线粒体DNA序列的扩增及测定
参考序列来自NCBI上发表的黄鼠属(登录号为NC005315)等线粒体DNA全序列。利用Clustal X(1.83)软件[17]和BLAST软件进行序列对比后,用Primer Premier 5.0设计[18]用于扩增控制区的特异性引物,所用引物由上海生工生物技术有限公司合成。引物序列为:上游5′-TCCCCAAAGCATCAAGGAAG;下游5′-GGCATGGGCTGATTAGACATT。PCR扩增的反应体系:DNA模板1 μL,PCR buffer(含Mg2+20 mmol/L)2.5 μL,dNTP(10 mmol/L)0.5 μL,上下游引物(10 pmol/μL)各1 uL,TaqDNA聚合酶(2 U/uL)0.5 μL,加水补足25 μL。扩增的反应条件:94℃预变性5 min,94℃变性40 s,57℃退火40 s,72℃延伸40 s,35个循环,最后72℃延伸10 min,然后于4℃保存。扩增得到的PCR产物用1.5%的琼脂糖凝胶电泳检测,用DNA胶回收试剂盒(TaKaRa)进行纯化、回收,对扩增效果良好的样品送往上海生工生物工程有限公司进行双向测定。
1.4数据处理和分析
通过Chromas (V 1.45)软件获得原始序列数据,同时进行人工校对,用Clustal X(1.83)程序对所得的DNA序列进行比对。通过Dna SP 5.0[19]比较分析。检测多态位点,划分单倍型,测定单倍型多样度。基于Kimura双参数法估算遗传距离[20],应用MEGA 6.0[21]的邻近距离法(NJ),参照文献[9]的方法以草原旱獭(Marmotabobak)为外群构建亲缘关系树,自引导检验估计系统树中结点的置信度,重复次数为1 000次。
2 结果与分析
2.1各序列变异分析
通过测序获得了达乌尔黄鼠的Cyt b基因1 140 bp序列,发现了达乌尔黄鼠有116个多态信息位点,群体中多态位点类型有转换、颠换,T,C,A,G碱基含量分别为33.7%,25.9%,27.6%,12.8%。表现出明显的反G偏倚,G+C含量(38.7%)明显小于A+T(61.3%)含量(表1)。
2.2遗传距离分析
用MEGA 6.0软件分析得到Kimura-2 parameter遗传距离(表2)。研究结果显示,各群体间的遗传距离都与群体内的一致。内类群的最小遗传距离是大黄鼠与新疆黄鼠之间(0.034),最大遗传距离是高加索黄鼠与达乌尔黄鼠之间(0.172)。长尾黄鼠,达乌尔黄鼠,安纳托利亚黄鼠3个近缘物种之间的遗传距离在(0.132)~0.169,平均遗传距离为0.147。
2.3分子系统树的构建
根据Cyt b 基因构建的系统进化树中,处于进化外群的是两种旱獭M.robusya和M.bobak。进化处于顶端的两个物种是犹地州地松鼠(S.mollis)和Spermophilusvigilis。本试验所研究的12种黄鼠属基本处于进化的中间位置。其中2个单倍型达乌尔黄鼠聚在一起形成一个分支再与安纳托利亚黄鼠聚合成一个支。同样是高加索黄鼠和小黄鼠先聚合后再与长
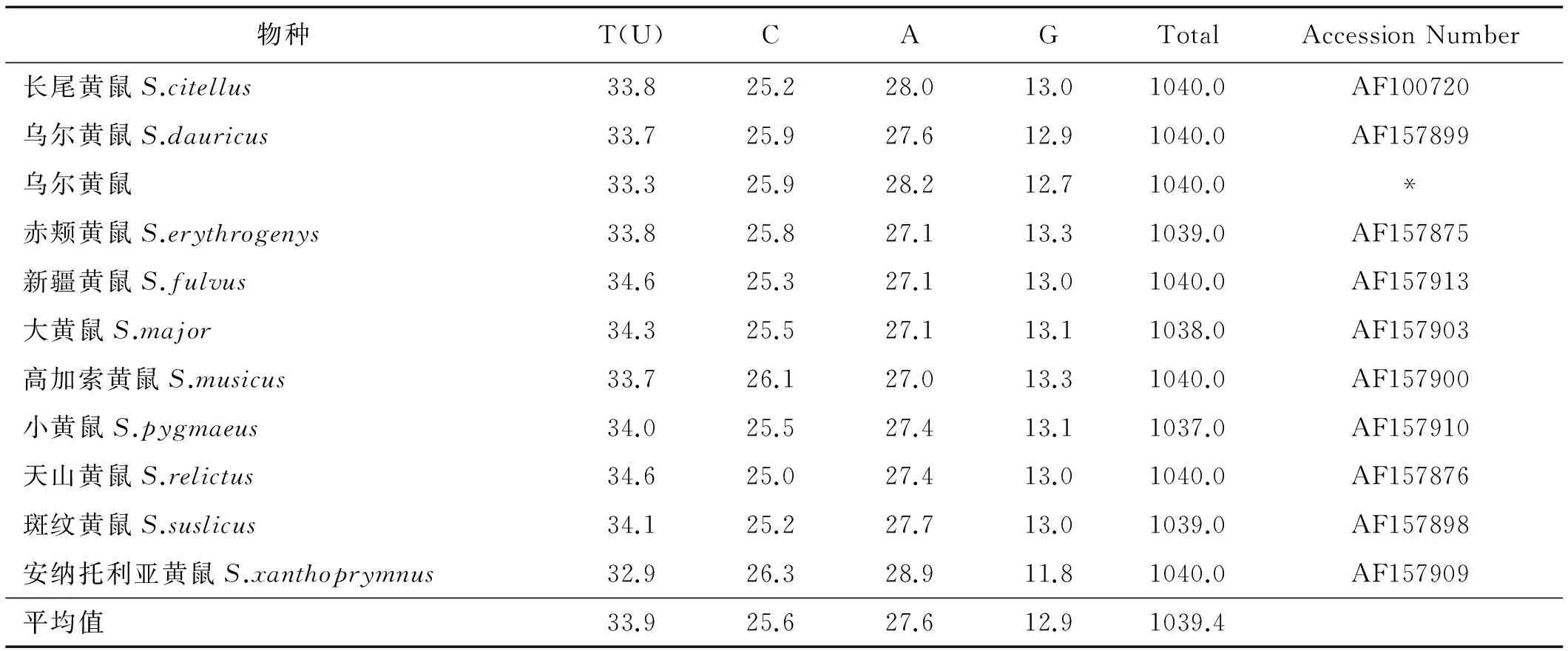
表1 黄鼠属物种碱基序列组成
注:*为此研究测得的单倍型序列
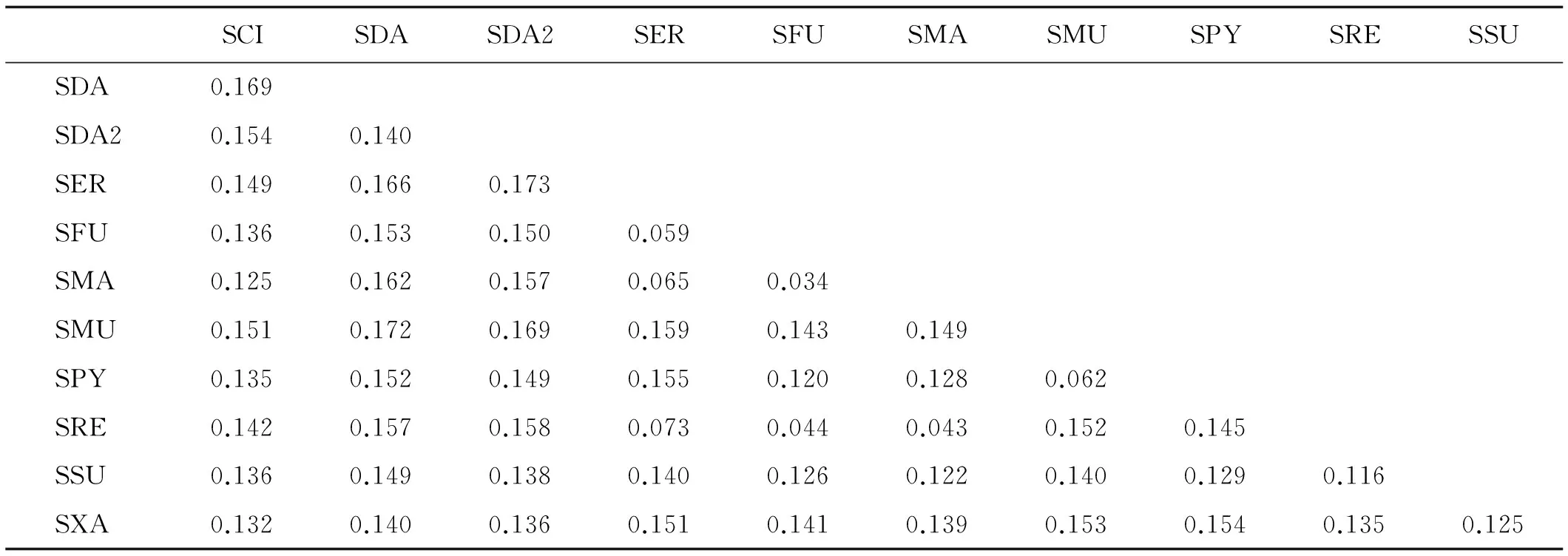
表2 松鼠科Cyt b基因片段序列遗传距离(基于Kimura双参数模型)
注:SCI,SDA,ADA2,SER,SFU,SMA,SMU,SPY,SRE,SSU和SXA分别代表物种S.citellus,S.dauricus,S.dauricus,S.erythrogenys,S.fulvus,S.major,S.musicus,S.pygmaeus,S.relictus,S.suslicus.
尾黄鼠聚成一个合支形成姐妹群。新疆黄鼠和大黄鼠的分支与淡尾黄鼠(S.pallicaudata)和天山黄鼠的分支互为姐妹群,再与赤颊黄鼠聚合,最后与斑纹黄鼠聚合成一个合支。处于同一分支的物种遗传距离小,相应的进化关系也相近(图1)。
3 讨论
线粒体 Cyt b基因一般情况不发生缺失和(或)插入,碱基置换大多数也很稳定。很大程度上只倾向于转换或颠换,并且编码蛋白质的密码子位点进化速度不恒定。线粒体Cyt b基因和其他大多数的脊椎动物一样,具有较高的保守性,也说明其在生物体的生命活动过程中的重要作用。Cyt b基因作为蛋白质编码基因比线粒体rDNA和非编码区的基因更易于排序,再加上能用一些通用引物扩增[22],所以,线粒体DNA细胞色素b序列在解决亲缘关系较近的分类阶元的系统关系方面很有用,被认为是解决系统发育问题最可信的分子标记之一[12]。通过试验所测得的线粒体Cyt b 基因部分序列进行了分析,结果表明这几种黄鼠科的线粒体Cyt b 基因序列合并后,A+T的平均含量为61.3%,明显高于G+C的平均含量(38.7%)表现出明显的A+T的含量偏斜。与其他黄鼠一样,鸟嘌呤是稀有碱基,腺嘌呤出现比较频繁,这与文献记载的mtDNA富含A+T相一致[23]。
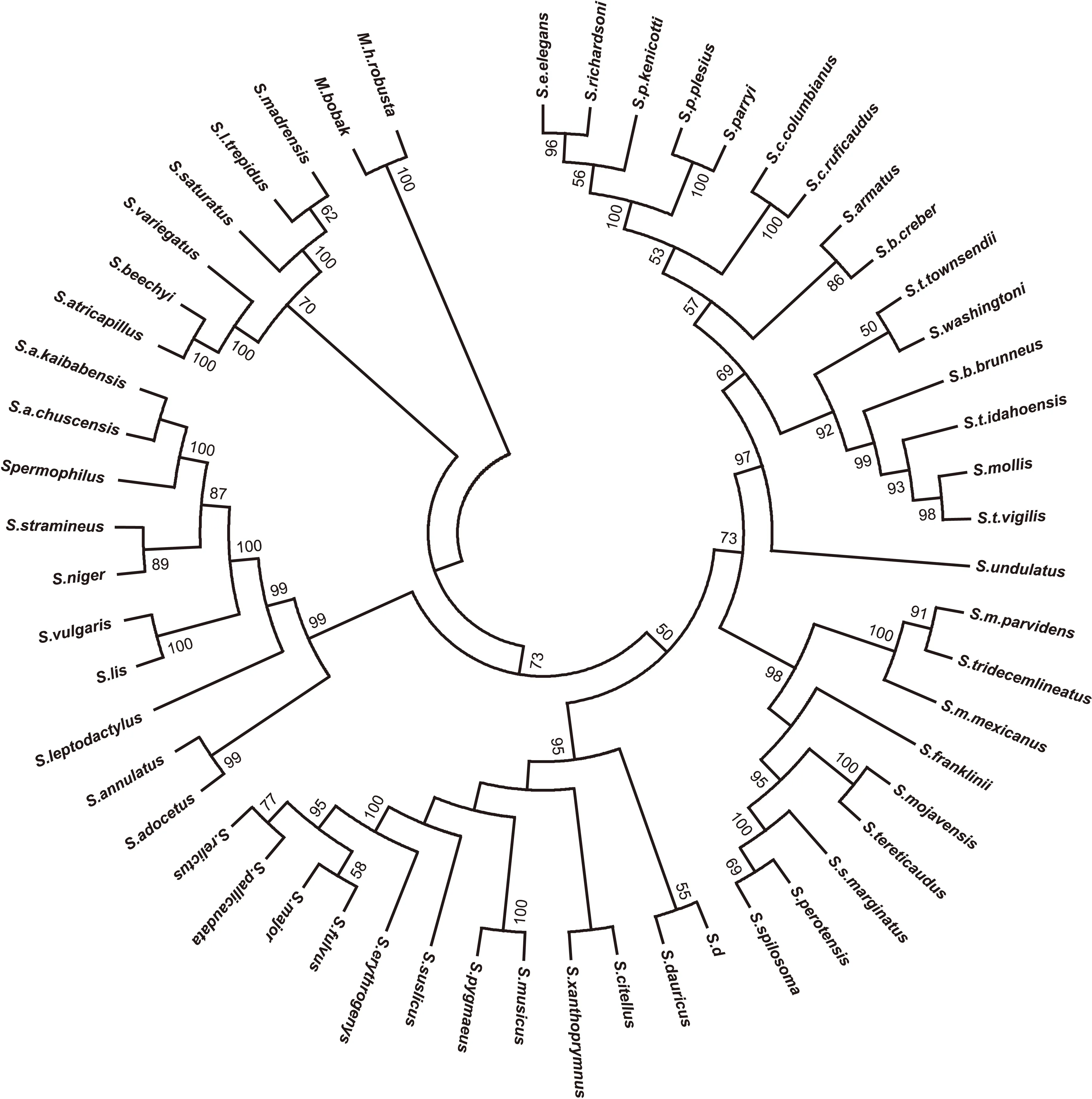
图1 基于线粒体Cyt b基因序列构建的NJ树Fig.1 NJ tree of Spermophilus dauricus based on mitochondrial Cyt b gene sequences
用MEGA 6.0软件分析得到的Kimura-2 parameter遗传距离,结果显示各群体间的遗传距离都与群体内的一致。最大遗传距离为高加索黄鼠与达乌尔黄鼠之间(0.172)。最小遗传距离是大黄鼠与新疆黄鼠之间(0.034),其中,同种的达乌尔黄鼠由于生活在不同的地区,其进化关系也相对较远,遗传距离也比较大,为0.140。由分子系统树分析大黄鼠和新疆黄鼠是姐妹种群,处于进化的顶端。而高加索黄鼠和达乌尔黄鼠处于分子树的不同支,交点也处于各分支的端点。固然采集该属内所有的物种对构建物种系统进化树是很关键,物种的不全可能会导致系统关系的变化,今后有必要收集该属内更全面的物种,并利用多基因数据(线粒体基因组和核基因组),或者更适宜的DNA条形码进行分类鉴定和系统发育关系的研究。
种群里的遗传性状在世代之间的变化是生物的进化。性状是指基因的表现型,在繁殖过程中,基因会经复制并传递到子代,基因的突变可使性状改变,进而造成种群中个体之间的变异。新性状又会因物种迁徙或是物种间的基因转移,而随着基因在种群中传递,并受到环境的影响与环境发生很好的契合,这些改变有更多的生态意义,可能会导致分布范围变化与物种的形成[24]。分子生物学与生物化学可以利用构成生命的各种分子,用来研究生物的进化关系。这些分子包括了核糖核酸(RNA)、脱氧核糖核酸(DNA)、线粒体(Cyt b,D-loop)基因、蛋白质与糖体等[25]。可以通过机器与电脑将这些分子的碱基序列、氨基酸序列定序构建出与传统分类学大致符合的分子系统树。如此就能推断并量化出物种间的亲缘关系。本研究提供了甘肃境内达乌尔黄鼠的Cyt b基因序列和分布信息,将为后续研究提供依据和相关信息,及进一步物种客观的划分等提供基础,从而为该物种的有效管理与合理利用奠定基础。
[1]王静,纪维红,苏军虎,等.达乌尔黄鼠(Spermophilusdauricus)生态学研究进展[J].中国农学通报,2015,31(8):33-39.
[2]孙小勇,高云芳,王琦,等.达乌尔黄鼠实验室饲养、繁殖及其冬眠阵[J].兽类学报,2012,32(4):356-361.
[3]姜树珍,谢卓,董润兰,等.山西五台县草地啮齿类动物空间生态位宽度及重叠度研究[J].草原与草坪,2016,36(1):72-77.
[4]赵天飙,梁炜,秦丰程,等.草原黄鼠生态学研究概述[J].内蒙古师大学报(自然科学汉文版),2000,29(2):125-129.
[5]刘加坤,王廷正,李金钢,等.达乌尔黄鼠种群年龄结构的研究[J].兽类学报.1993,13(4):277-282.
[6]罗明澍,钟文勤.达乌尔黄鼠种群生态的一些资料[J].动物学杂志,1990(2):50-60.
[7]Gunduz I,Jaarola M,Tez C,etal.Multigenic and morphometric differentiation of ground squirrels (Spermophilus,Scuiridae,Rodentia) in Turkey,with a description of a new species[J].Molecular Phylogenetics & Evolution,2007,43(3):916-35
[8]Tsvirka M V,Spiridonova L N,Korablev V P.Molecular genetic relationships among east Palaerctic ground squirrels of the genusSpermophilus(Sciuridae,Rodentia)[J].Russian Journal of Genetics,2008,44(8):966-974.
[9]Helgen K M,Cole F R,Helgen L E,etal.Generic revision in the Holarctic ground squirrel genusSpermophilus[J].Journal of Mammalogy,2009,90(2):270-305.
[10]杨彦东,苏军虎,花立民.碌曲县草原鼠害区划研究[J].草原与草坪,2014,34(6):51-55.
[11]陈星,沈永义,张亚平.线粒体DNA在分子进化研究中
的应用[J].动物学研究.2012,33(6):566-573.
[12]李宗军,徐建兴.线粒体的分子进化与氧效应[J].生物技术通讯,2005,16(2):168-171.
[13]Meyer A.Shortcoming of the cytochrome b gene as a molecular marker[J].Trends in Ecology and Evolution,1994,9(4):278-289.
[14]刘荣堂,武晓东.草地保护学-草地啮齿动物学[M].北京:中国农业出版社,2011.
[15]付和平,武晓东,张福顺,等.阿拉善黄鼠模式产地标本染色体核型[J].动物学杂志,2009,44(6):31-35.
[16]王海芳,苏军虎,刘荣堂,等.基于线粒体ND4基因的鼢鼠系统进化关系[J].草原与草坪,2008(4):20-23.
[17]Thompson H D,Gibson T J,Pllewnia K F,etal.The CLUSTAL X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J ].Nucleic Acids Res,1997,25(24):4876-4882.
[18]Singh V K,Mangalam A K,Dwivedi S,etal.Primer Premier:program for design of degenerate primers from a protein sequence[J].Bio Techniques,1998,24:318-319.
[19]Rozas J,Sanchez-DelBarrio X M,Rozas R,etal.DNA polymorphism analyses by the coalescent and other methods)[J].Bioinformatics,2003,19(4):2496-2497.
[20]Kimura M A.Simple method for estimating evolutionary rate of base substitution through comparative studies of nucleotide sequences[J].Journal of Molecular Evolution,1980,16(2):111-120.
[21]Tamura K,Stecher G,Peterson D,etal.MEGA6:Molecular Evolutionary Genetics Analysis Version 6.0[J].Molecular Biology and Evolution,2013,30:2725-2729.
[22]郭新红,刘少军,刘巧,等.鱼类线粒体DNA研究新进展[J].遗传学报,2004,31(9):983-1000.
[23]Campbell B C,Steffenl ampbell J D.Phylogeny of the Nasonia species complex (Hymenoptera:Pteromalidae) inferred from an internal transcribed spacer (ITS2) and 28S rDNA sequences[J].Insect Molecular Biology,1994,2(4):225-370.
[24]孙婷婷,颜忠诚.物种关系模式及其进化[J].生物学通报,2005,40(8):17-18.
[25]苏军虎,王静,刘荣堂,等.从线粒体序列分异探讨鼢鼠凸颅亚属(Eospalax)种间差异的有效性[J].草地学报,2011,19(4):694-698.
Sequence analysis of mitochondrial Cyt b gene and evolutionary relationships ofSpermo-philusdauricus
WANG Jing1, JI Wei-hong2,3,4,XU Chang-lin2,SU Jun-hu2,3
(1.LanzhouVocationalTechnologyCollege,Lanzhou730070,China; 2.CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem(MinistryofEducation)/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 3.GansuAgriculturalUniversity-MasseyUniversityResearchCentreforGrasslandBiodiversity,GansuAgriculturalUniversity,Lanzhou730070,China; 4.InstituteofNaturalandMathematicalSciences,MasseyUniversity,PrivateBag102 904NorthShoreMailCentre0632,Auckland,NewZealand)
TwelveSpermophilusdauricuswere collected from Tianzhu,Gansu Province,the mitochondrial 1140 bp Cyt b gene sequence were directly sequenced based on PCR products.Then Clustal X 1.84,MEGA 6.0 and Dna SP 5.0 bioinformatics software were used for sequence analysis.The results showed thatS.dauricushad 116 polymorphic information sites.Population polymorphic loci types had transition,transversion,Cyt b gene T,C,A,G nucleotide contents were 33.7%,25.9%,27.6%,12.9%.Based on genetic distance of Kimura two-parameter display,intraspecific between large ground squirrel (S.major) and Xinjiang ground squirrel (S.fulvus) genetic distance is the minimum (0.034),then Caucasian squirrels (S.musicus) and ground squirrels (S.dauricus) is the maximum (0.172),withinSpermophilusdauricusgenetic distance is 0.140,suggesting large population differentiation,NJ-based phylogenetic tree meeted with the traditional taxonomy.The results provided a reference marker toSpermophilusspeciespopulation genetics researches.
Spermophilusdauricus;mitochondrial;evolutionary relationships;Cyt b
2016-04-06;
2016-05-18
兰州市农业攻关项目“兰州市农田害鼠(达乌尔黄鼠)监测及防控技术研究”(2013-4-131);甘肃省高校科研项目“药用动物鼢鼠(塞隆骨)DNA条码形筛选及鉴定研究”(2015A-205)资助
王静(1982-),女,甘肃兰州市人,博士,讲师,主要从事生物工程的教学研究工作。
E-mail:jwang_423@126.com
S 443;Q 754
A
1009-5500(2016)03-0017-06
苏军虎为通讯作者。
