消痰通腑方对结肠癌SW480细胞磷脂酶A2、环氧合酶2表达及细胞生物学行为的影响
2016-08-01胡学谦朱童王丹魏品康
胡学谦 朱童 王丹 魏品康
摘要:目的 观察消痰通腑方对结肠癌SW480细胞增殖、迁移的影响,探讨其分子作用机制。方法 采用不同浓度消痰通腑方作用结肠癌SW480细胞,CCK8法和平板克隆形成实验检测细胞增殖,Transwell小室实验检测细胞迁移能力,RT-qPCR检测磷脂酶A2(PLA2)和环氧合酶2(COX-2)mRNA表达,Western blot检测PLA2和COX2蛋白表达,RNA干扰技术沉默SW480细胞株中PLA2基因表达。结果 消痰通腑方低、高剂量组较对照组结肠癌SW480细胞增殖能力明显减弱(P<0.05),克隆形成率及迁移能力明显下降(P<0.05,P<0.01),PLA2、COX-2 mRNA和蛋白表达均明显下调(P<0.05),并呈浓度依赖性;与质粒对照组和对照组比较,PLA2 shRNA干扰组细胞PLA2和COX2蛋白表达明显下调(P<0.05)。结论 消痰通腑方可抑制结肠癌SW480细胞增殖和迁移,其机制可能与PLA2及COX-2的表达下调有关。
关键词:消痰通腑方;磷脂酶A2;环氧合酶2;结肠癌SW480细胞
DOI:10.3969/j.issn.1005-5304.2016.08.014
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)08-0050-04
结肠癌是常见的恶性肿瘤,其发病率在男性和女性中分别位居第3位和第2位,且有逐年上升趋势[1]。
结肠癌属中医学“肠蕈”范畴,多因饮食失节、脾胃受损、湿热壅聚成痰而搏结肠腑所致。消痰通腑方为魏品康教授从痰论治消化道肿瘤核心治则“消痰散结八法”之一。磷脂酶A2(phospholipase A2,PLA2)是一类可催化脂肪酸水解并产生以花生四烯酸(arachidonic acid,AA)为主的游离脂肪酸酶,具有产生炎性介质、参与细胞信号转导等多种功能,在人类肿瘤发生、发展中发挥重要生物效应[2]。环氧化酶(cyclooxygenase,COX)是PLA2催化AA生成生物活性分子的限速酶,包括COX-1和COX-2。研究表明,COX-2在结肠中过度表达,其与细胞增殖、分化等有关[3]。本研究采用消痰通腑方干预结肠癌SW480细胞,观察其对细胞增殖、迁移的影响,探讨其分子作用机制。
1 实验材料
1.1 细胞株
人结肠癌SW480细胞,中国科学院上海细胞库。
1.2 药物及制备
消痰通腑方由制半夏、制南星、大黄、陈皮、鸡内金、炙甘草组成,所有饮片由上海雷允上药业有限公司提供。消痰通腑方由第二军医大学试剂中心制备,按比例(制半夏15 g,制南星15 g,大黄6 g,陈皮15 g,鸡内金15 g,炙甘草6 g)称取10倍量的饮片,加8倍体积的75%乙醇,回流提取煎煮2次,每次1 h,将煎液合并后离心、浓缩、干燥至干品即得消痰通腑方醇提物,其得率为1 g原药材/0.26 g。等比例换算至药物浓度分别为2.24、8.96 g/mL。实验前称取适量醇提物干粉,经涡旋、超声、水浴等方法使其充分溶解于DMEM培养基后,0.22 μm滤器过滤并配置成所需浓度的溶液,4 ℃冰箱贮存备用。
1.3 主要试剂与仪器
DMEM培养基,胎牛血清(FBS),0.25%胰蛋白酶、青链霉素混合液,qPCR、cDNA反转录、总RNA提取试剂盒,transwell小室,CCK8溶液,PLA2抗体,COX-2抗体,PLA2 shRNA质粒,shRNA对照质粒,shRNA质粒转染试剂,均购自Santa cruz公司。
超净工作台(广州深华生物技术有限公司),CO2培养箱、BIOMATE型紫外可见分光光度计(Thermo),LXJ-ⅡA型离心机(上海安亭科学仪器厂),GE4852 型PCR仪(杭州柏恒科技有限公司),DYCZ-24DN电泳仪(北京六一仪器厂),Tocan500全自动凝胶成像系统(南京裴尔森生物科技有限公司)。
2 实验方法
2.1 细胞培养及药物干预
结肠癌SW480细胞常规培养于含10%FBS和1%青-链霉素双抗DMEM培养基,每隔1~2 d换液,待细胞融合约80%时进行细胞传代及种板。消痰通腑方原药材浓度为8.96 g/mL,经0.22 μm无菌过滤器过滤,用培养基稀释成实验所需浓度。实验根据药物浓度分为对照组(0 g/mL)、低剂量组(2.24 g/mL)、高剂量组(8.96 g/mL)。
2.2 CCK-8法检测
取对数生长期上述3组细胞,经胰酶消化后,接种于96孔板,每孔细胞数为1×103。每组设5个复孔。分别于24、48、72、96、120 h后加10 μL CCK-8溶液。置于培养箱培养4 h,于酶标仪波长450 nm处测定细胞吸光度(A)值,计算细胞相对增殖率[(实验组A值-对照组A值)÷对照组A值×100%]。
2.3 平板克隆形成实验
取对数生长SW480细胞悬液梯度倍比稀释后,接种于6孔板中,每孔50个细胞。置于培养箱内培养24 h,各组分别加入各浓度消痰通腑方溶液,重新置于培养箱中,经常观察,当出现肉眼可见克隆时,弃去上清液,PBS清洗2次,甲醇溶液固定15 min后加Gimesa染液染色。计算克隆细胞数目。实验重复3次,取其平均值。
2.4 Transwell小室实验
收集3组细胞,800 r/min离心5 min,PBS清洗2次,用培养基重悬并调整细胞浓度为1×109/L。分别取100 μL细胞液置于Transwell小室上层,同时在下层加500 μL DMEM培养基。37 ℃培养箱中培养48 h,擦净小室滤膜上层的细胞。4%多聚甲醛固定10 min,PBS清洗并用结晶紫染色。每组同时做3个重复小室,200倍显微镜下计数并拍照。
2.5 RT-qPCR检测结肠癌SW480细胞磷脂酶A2和环氧合酶2 mRNA表达
从Gene Bank网站获取PLA2、COX-2基因序列,并使用Premier5.0软件设计引物(见表1),引物由上海生工生物工程有限公司合成。采用Trizol试剂提取细胞总RNA,每份样品均取2 μg,按试剂盒说明进行反转录。以Tubulin为内参,PLA2、COX-2表达的相对定量值用于统计分析。
2.6 Western blot检测结肠癌SW480细胞磷脂酶A2和环氧合酶2蛋白表达
用含有蛋白酶抑制剂的RIPA裂解并收集细胞总蛋白,BCA法检测蛋白浓度后加入上样缓冲液,煮沸变性。样品进行SDS-PAGE电泳,电转移至PVDF膜上。5%脱脂奶粉封闭2 h后,特异性一抗4 ℃摇床过夜,洗膜后,二抗孵2 h,EC显影。
2.7 shRNA转染实验
人结肠癌SW480细胞分为PLA2 shRNA干扰组、质粒对照组、对照组,每组设3个复孔。以2 μg PLA2 shRNA质粒和对照质粒分别转染SW480细胞,转染24 h后,用5 μg/μL嘌呤霉素筛选细胞株,继续培养24 h。对照组为不加任何处理的SW480细胞。
3 统计学方法
采用SPSS16.0统计软件进行分析。计量资料以—x±s表示,采用t检验。P<0.05表示差异有统计学意义。
4 结果
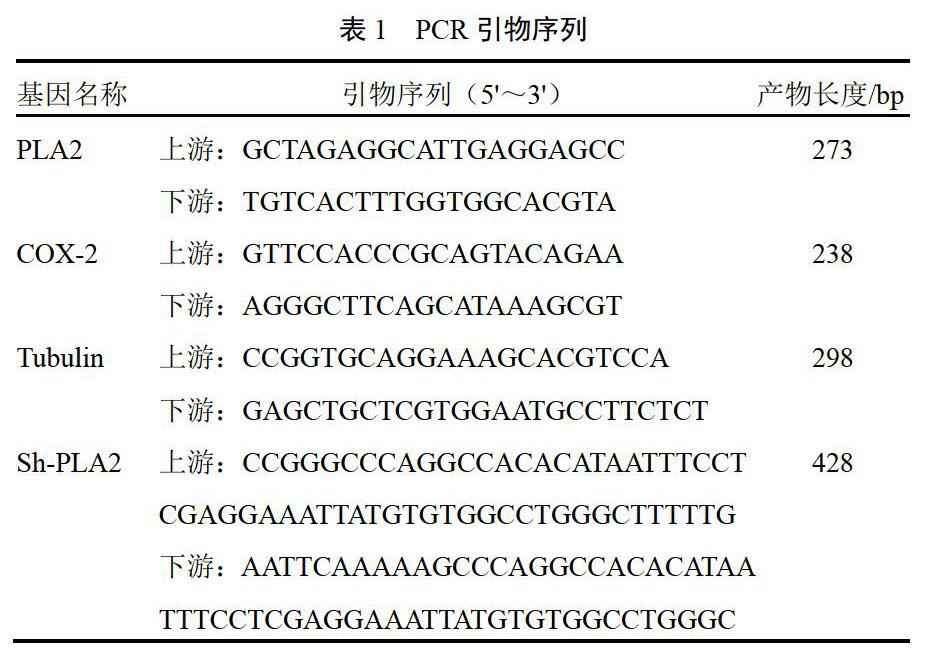
4.1 消痰通腑方对结肠癌SW480细胞增殖的影响
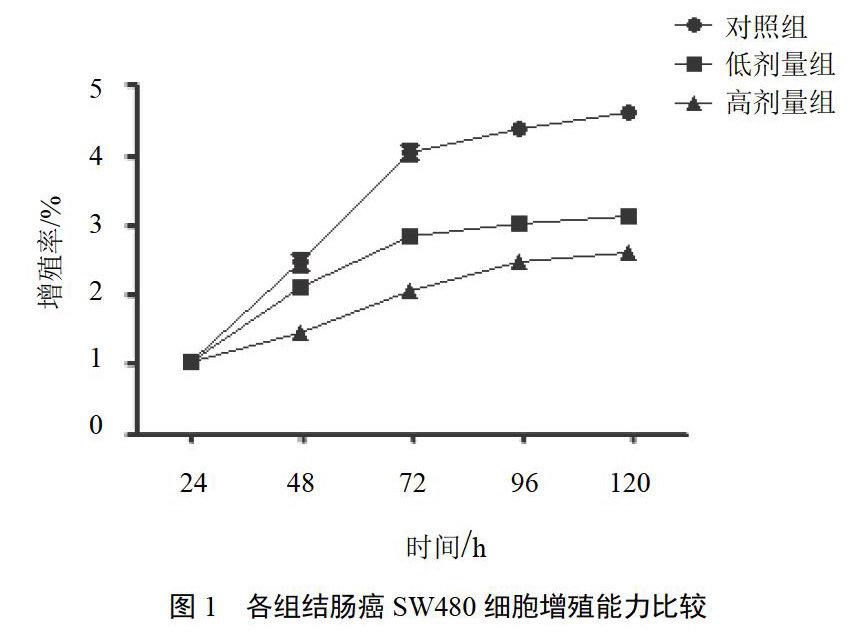
高剂量组较对照组增殖能力明显减弱(P<0.05),低剂量组也能抑制细胞增殖但效果不如高剂量组,结果见图1。高剂量组克隆形成率为(48.38±3.67)%、低剂量组为(121.13±2.64)%,较对照组(205.65±3.72)%明显降低(P<0.05,P<0.01),结果见图2。
4.2 消痰通腑方对结肠癌SW480细胞侵袭能力的影响
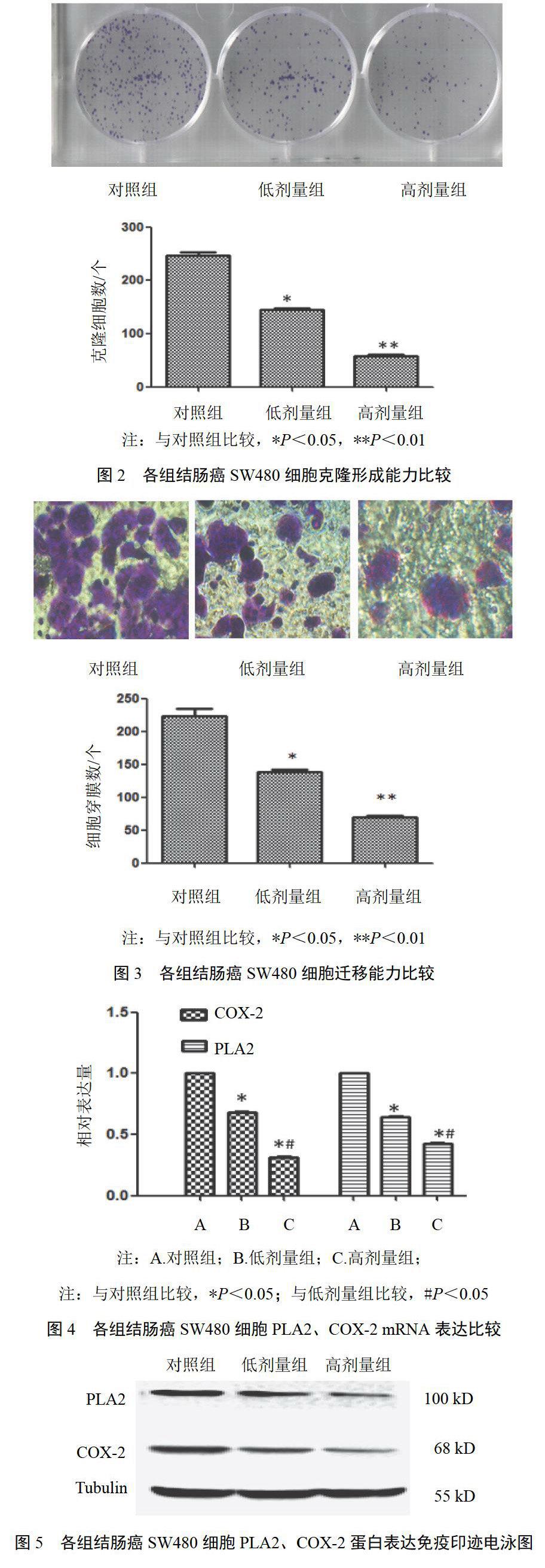
消痰通腑方作用48 h,低、高剂量组较对照组穿膜细胞数明显降低(P<0.05,P<0.01)。结果见图3。
4.3 消痰通腑方对结肠癌SW480细胞磷脂酶A2和环氧合酶2 mRNA和蛋白表达的影响
消痰通腑方作用72 h,PLA2、COX-2 mRNA和蛋白表达量均显著降低,与对照组比较差异有统计学意义(P<0.05);高剂量组较低剂量组差异更显著(P<0.05)。结果图4、图5。
4.4 PLA2 shRNA干扰后消痰通腑方对结肠癌SW480细胞磷脂酶A2和环氧合酶2蛋白表达的影响
PLA2 shRNA干扰48 h,与质粒对照组和对照组相比较,转染PLA2 shRNA质粒的SW480细胞PLA2蛋白表达明显受到抑制,PLA2 shRNA干扰成功。同时,COX-2的表达与PLA2的表达具有一致性。结果见图6。
5 讨论
中医学认为,结肠癌多因饮食失节,嗜食肥甘厚腻,困遏脾土,而致脾胃受损,脾运化失常,湿浊内生,气机阻滞,精微不能正常布散而发病。湿聚为痰,热炼津为痰,故湿热壅聚则久能生痰,搏结肠腑,致肠腑湿热重滞,气机运化不畅,大肠传导失司,痰热湿浊不能及时排除体外而在体内停聚,日久形成积块而成痰结[4]。
消痰通腑方为魏品康教授从痰论治消化道肿瘤的经验用方。研究表明,该方可抑制炎症因子引发的炎症反应[5-6]。方中制半夏、制南星为消痰散结之君药,大黄、炒枳实壳清热通腑为臣药,鸡内金、陈皮理气消积,顾护脾胃为佐使,炙甘草调和药性,共奏消痰散结祛除痰结、清热通腑推陈出新。PLA2是磷脂代谢的关键酶之一,可分解磷脂产生AA从而进一步产生COX-2、前列腺素E2(PGE2)等炎性介质,从而引发炎症。研究表明,PLA2的活化与多种肿瘤相关[7-9]。慢性炎症促进肿瘤的发生发展涉及多条细胞内信号通路,其中PLA2-COX-2-PGE2信号通路是其重要途径之一。研究表明,结直肠癌的发展常伴随着COX-2基因过度表达,其过度表达可通过促进细胞的增殖、存活,进而在肿瘤进展中发挥重要作用[10]。
本实验结果显示,与对照组比较,高剂量组能降低结肠癌细胞增殖能力(P<0.05),抑制结肠癌细胞的迁移(P<0.01)。低剂量组虽不如高剂量组效果好,但与对照组比差异有统计学意义(P<0.05)。而且消痰通腑方能降低结肠癌SW480细胞PLA2及COX-2的表达,PLA2 shRNA干扰实验进一步证实PLA2与COX-2的表达存在一致性,提示消痰通腑方可能通过降低PLA2的表达从而下调AA通路下游靶基因COX-2来调控结肠癌的增殖与迁移。
综上所述,本研究表明消痰通腑方可以抑制人结肠癌细胞SW480的增殖和迁移。其机制可能与抑制PLA2及AA通路中COX-2的表达有关,为消痰通腑方用于结肠癌的治疗提供了实验依据,但其体内的具体作用机制仍需进一步研究。
参考文献:
[1] MAGAJI B A, MOY F M, ROSLANI A C, et al. Descriptive epidemiology of colorectal cancer in university Malaya medical centre, 2001 to 2010[J]. Asian Pac Cancer Prev,2014,15(15):6059-6064.
[2] HU J J, TIAN G, ZHANG N. Cytosolic phospholipase A2 and its role in cancer[J]. Clin Oncol Cancer Res,2011,8(11):71-76.
[3] ASTING A G, CAREN H, ANDERSSON M, et a1. COX-2 gene expression in colon cancer tissue related to regulating factors and promoter methylation status[J]. BMC Cancer,2011,11(7):238-241.
[4] 赵颖,李勇进,魏品康.消痰通腑方对结肠癌肝转移模型小鼠胰岛素生长因子蛋白表达的影响[J].中国中医药信息杂志,2012,19(11):25-28.
[5] 叶敏,孙大志,修丽娟,等.消痰通腑颗粒对危重患者炎性因子的影响[J].中国中医急症,2013,22(2):184-186.
[6] YANG B, SHI J, XIU L J, et al. Xiaotan Tongfu granules contribute to the prevention of stress ulcers[J]. World J Gastroenterol, 2013,19(33):5473-5484.
[7] SETHI G, SHANMUGAM M K, Ramachandran L, et al. Muhifaceted link between cancer and inflammation[J]. Biosci Rep,2011,32(1):1-15.
[8] CAIAZZA F, MC N S, YOUNG L, et al. Cytosolic Phospholipase A2 overexpression in breast cancer is associated with EGFR expression and correlates with an adverse prognosis in luminal tumors[J]. Br J Cancer,2011,104(2):338-344.
[9] 张勇,蒋堃,王春阳,等.PLA2G2A在胰腺癌组织中的表达及其与患者术后生存期的关系[J].中华胰腺病杂志,2013,13(5):337-339.
[10] SOBOLEWSKI C, CERELLA C, DICATO M, et a1. The role of cyclooxygenose-2 in cell proliferation and cell eath in human malignancies[J]. Int J Cell Biol,2010,5(4):215158.
