莆田黑鸭MHCⅠ基因外显子2的遗传多态性
2016-07-28林威敏胡宇平毛小鸿肖天放
汪 稳, 林威敏, 陈 静, 胡宇平, 毛小鸿, 肖天放
(福建农林大学动物科学学院,福建 福州 350002)
莆田黑鸭MHCⅠ基因外显子2的遗传多态性
汪稳, 林威敏, 陈静, 胡宇平, 毛小鸿, 肖天放
(福建农林大学动物科学学院,福建 福州 350002)
摘要:以莆田黑鸭为材料,对其主要组织相容性复合体(MHC)Ⅰ基因外显子2进行PCR扩增和DNA测序,分析其遗传多态性及变异特征,为进一步寻求抗病分子提供依据.结果表明,莆田黑鸭MHCⅠ基因外显子2处有丰富的遗传多态性,核苷酸变异以颠换为主,同义替换率大于非同义替换率,总GC含量较高,为59%,其中,密码子第3位的GC含量最高,为82.7%.莆田黑鸭MHCⅠ基因外显子2编码的氨基酸有明显的疏水性,对维持MHC分子的结构和功能具有重要作用.聚类分析结果表明,禽类分支中,莆田黑鸭与家鹅的亲缘关系较近,与鸡的亲缘关系较远.
关键词:莆田黑鸭; 主要组织相容性复合体Ⅰ(MHCⅠ); DNA测序; 遗传多态性
主要组织相容性复合体(major histocompatibility complex, MHC)作为一类具有遗传多态性的细胞表面转膜蛋白,与许多疾病的抗性、易感性、选择性、免疫应答及生产性能和遗传进化有着密切的关系[1].其中,绝大多数疾病与MHCⅠ类等位基因有关,Ⅰ类位点编码的蛋白位于分子顶端的肽类结合区域,其复杂性和遗传多态性使个体间的免疫应答有所不同[2].刘志方等[3]研究表明,哈萨克绵羊MHCⅠ类基因第2、3外显子序列具有丰富的遗传多态性,碱基组成具有一定的不平衡性,并且经过了自然选择的作用,与NCBI数据库中牛的序列比对分析显示了跨物种遗传多态性.胡丹丹等[4]研究表明,鱼类MHC基因的遗传多态性主要取决于群体内MHC基因的大量等位基因及等位基因间高度的序列变异.因此,通过对MHCⅠ基因外显子2序列遗传多态性的研究来实现对MHC的初步分型具有重要的生产意义.
目前在MHC基因的研究中,对人和鼠的研究最为透彻[5-8],为哺乳动物MHC基因的研究提供了理论基础.随着哺乳动物MHC基因研究的不断深入,人们对鸟类、鱼类、两栖类和爬行类等非哺乳动物的MHC基因研究也逐渐展开[9-12].但在水禽中,关于MHC基因的研究很少,尤其对家鸭的研究更为缺乏.此外,MHC是个多基因家族,其Ⅱ类基因的遗传多态性比Ⅰ类基因明显[13],有关Ⅱ类基因遗传多态性的研究报道较多,而Ⅰ类较少.鉴于此,本试验对莆田黑鸭MHCⅠ基因外显子2进行PCR扩增、测序、比对和生物信息学分析,探究其分子特征、蛋白质的理化特性及对外源性疾病的抗性或易感性,旨在为进一步研究鸭的免疫系统发生机制及抗病机理提供参考.
1材料与方法
1.1材料
动物来源于福建石狮水禽保种中心.随机选取成年莆田黑鸭50只(公∶母=2∶3),翅静脉采血,加入ACD抗凝(ACD∶血液=1∶6),并置冰箱(-20 ℃)中保存备用.
1.2方法
1.2.1基因组DNA的提取参照酚氯仿法提取基因组DNA.采用0.8%琼脂糖凝胶电泳和紫外分光光度计对DNA进行检测,置冰箱(-20 ℃)中保存备用.
1.2.2引物设计参照GenBank提供的莆田黑鸭MHCⅠ基因(AB119993)外显子2序列,采用Primer 5.0软件设计引物(表1),由上海生工生物工程有限公司合成.

表1 莆田黑鸭MHCⅠ基因位点及引物序列
1.2.3PCR扩增建立总体积为25 μL的PCR反应体系,具体组成如下:2.5 μL 10×PCR buffer(含Mg2+)、0.5 μL 10 mmol·L-1dNTP、20 μmol·L-1上游引物和下游引物各0.5 μL、2.0 μL DNA模板、0.5 μL 2 U·μL-1Taq DNA聚合酶,加ddH2O至25 μL.PCR反应条件:95 ℃预变性5 min;95 ℃变性45 s,56.4 ℃退火45 s,72 ℃延伸45 s,共32个循环;72 ℃再延伸10 min.
1.2.4PCR产物的SSCP检测取PCR产物与甲酰胺上样缓冲液按3∶8的比例混合,于98 ℃变性10 min后迅速冰浴10 min.将变性好的PCR产物用微量注射器加到12%的非变性聚丙烯酰胺凝胶中,先于200~250 V高压电泳5 min,后于140 V电压电泳12~16 h,电泳结束后银染显色.
1.2.5测序经PCR-SSCP分析后,将扩增效果好的PCR产物按照回收试剂盒使用说明进行回收纯化操作.纯化产物送天根生化科技有限公司进行测序.
1.2.6统计分析应用Mega 4.1软件比对DNA序列和相对应的氨基酸序列,确定突变位点的位置和突变类型,用DnaSP5软件计算简约信息位点数和单个突变位点数,利用Mega 4.1软件构建多个物种间MHCⅠ基因外显子2的分子系统发育树,分析亲缘关系.
2结果与分析
2.1莆田黑鸭MHCⅠ基因外显子2的PCR扩增结果
对不同个体莆田黑鸭基因组DNA进行扩增,PCR产物用1%琼脂糖凝胶电泳检测.凝胶成像结果(图1)显示,特异性扩增良好,片段大小位于260 bp左右,与预期大小(259 bp)相近.初步判断所得片段为目的片段,可直接进行测序.
2.2莆田黑鸭MHCⅠ基因外显子2的核苷酸分析
2.2.1序列比对结果将测序所得的莆田黑鸭MHCⅠ基因外显子2序列与GenBank上莆田黑鸭MHCⅠ基因(AB119993)外显子2序列进行比对,得到18种不同的DNA序列,比对结果见图2.
2.2.2突变位点将莆田黑鸭MHCⅠ基因外显子2的18种DNA序列进行比对.结果表明:18种核苷酸序列的共同保守区有173个位点;多态变异位点有84个,其中,简约信息位点73个,单个突变位点11个,碱基插入或缺失位点3个. 采用Mega 4.1软件中的Kumar方法计算得到平均非同义替换率为0.144,平均同义替换率为0.173,平均非同义替换率与平均同义替换率的比值为0.832.
2.2.3核苷酸序列碱基组成莆田黑鸭MHCⅠ基因外显子2各基因型序列碱基组成(表2)显示,该位点A、T、C和G的平均含量分别为22.3%、18.8%、25.4%和33.6%,G含量最高,GC含量为59.0%,AT含量为41.0%.由此可见,莆田黑鸭MHCⅠ基因外显子2的GC含量较高.
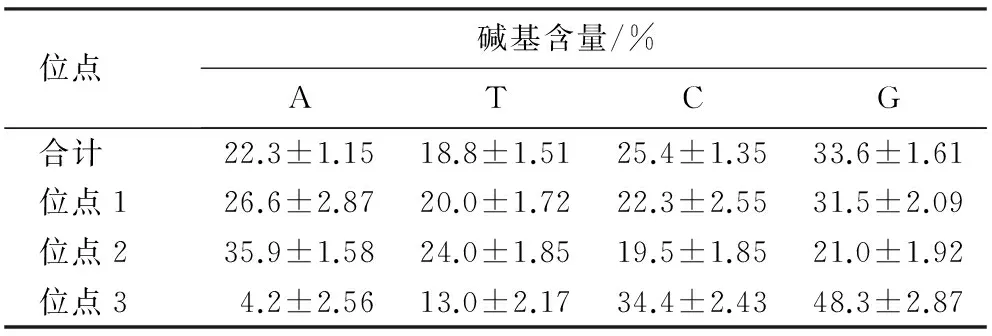
表2 莆田黑鸭MHCⅠ基因外显子2的碱基组成
密码子第1位A、T、C和G的平均含量分别为26.6%、20.0%、22.3%和31.5%,其中,G含量最高;密码子第2位A、T、C和G的平均含量分别为35.9%、24.0%、19.5%和21.0%,其中,A含量最高,AT含量为59.9%,高于GC含量;密码子第3位A、T、C和G的平均含量分别为4.2%、13.0%、34.4%和48.3%,其中,G含量最高,A含量最低,GC含量为82.7%,远远高于AT含量(17.2%).
2.2.4序列变异位点类型莆田黑鸭MHCⅠ基因外显子2的突变类型和密码子变异情况(表3)显示,该位点的颠换频率大于转换频率,密码子第1位的转换频率与颠换频率几乎相同,密码子第2和3位的颠换频率大于转换频率.
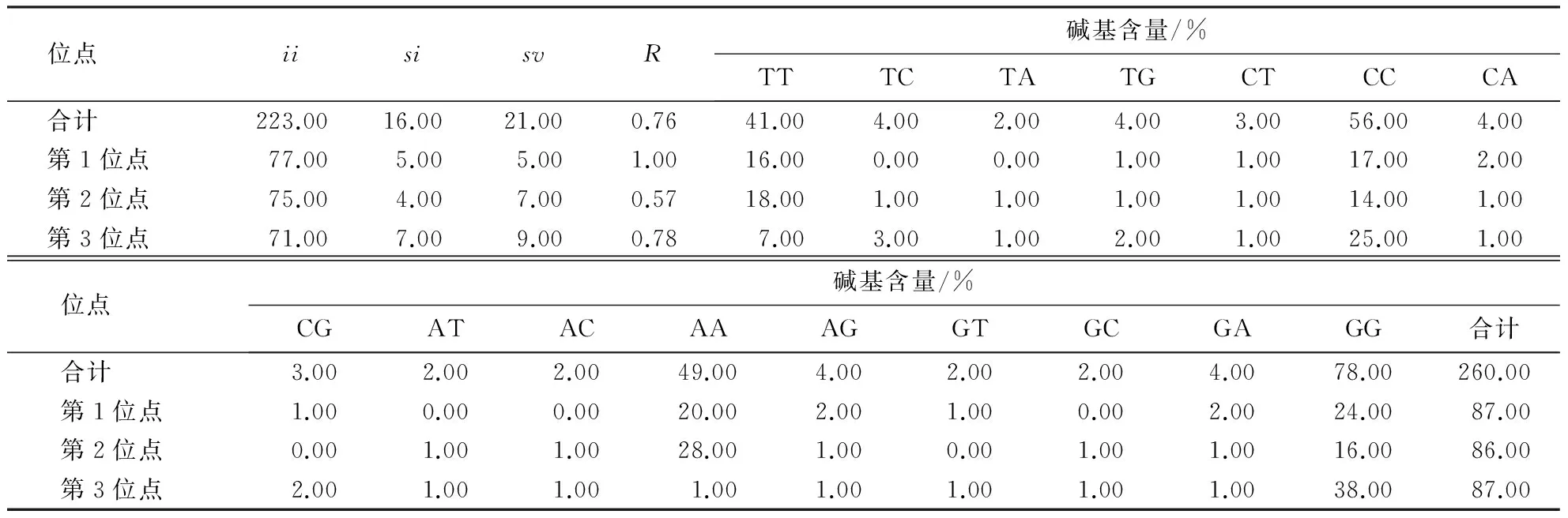
表3 莆田黑鸭MHCⅠ基因外显子2 的转换和颠换频率1)
1)ii=同义替换数;si=转换数;sv=颠换数;R=转换数/颠换数.
2.3莆田黑鸭MHCⅠ基因外显子2的氨基酸序列
2.3.1氨基酸序列比对将莆田黑鸭MHCⅠ基因外显子2的18种DNA序列翻译成氨基酸序列进行比对.结果(图3)显示,莆田黑鸭MHCⅠ基因外显子2编码86个氨基酸残基,其中,多态变异位点有41个,简约信息位点34个,单突变位点7个.
2.3.2氨基酸组成从莆田黑鸭MHCⅠ基因外显子2的氨基酸组成(表4)可以看出:该位点18种DNA序列中的第1~6、9~10和12~18类不编码半胱氨酸,第1~4、9、12和14~15,18类不编码赖氨酸,第5类不编码甲硫氨酸;该位点编码的氨基酸中半胱氨酸和赖氨酸所占比率最小,分别为0.32%和0.65%,精氨酸所占比率最多(11.15%).
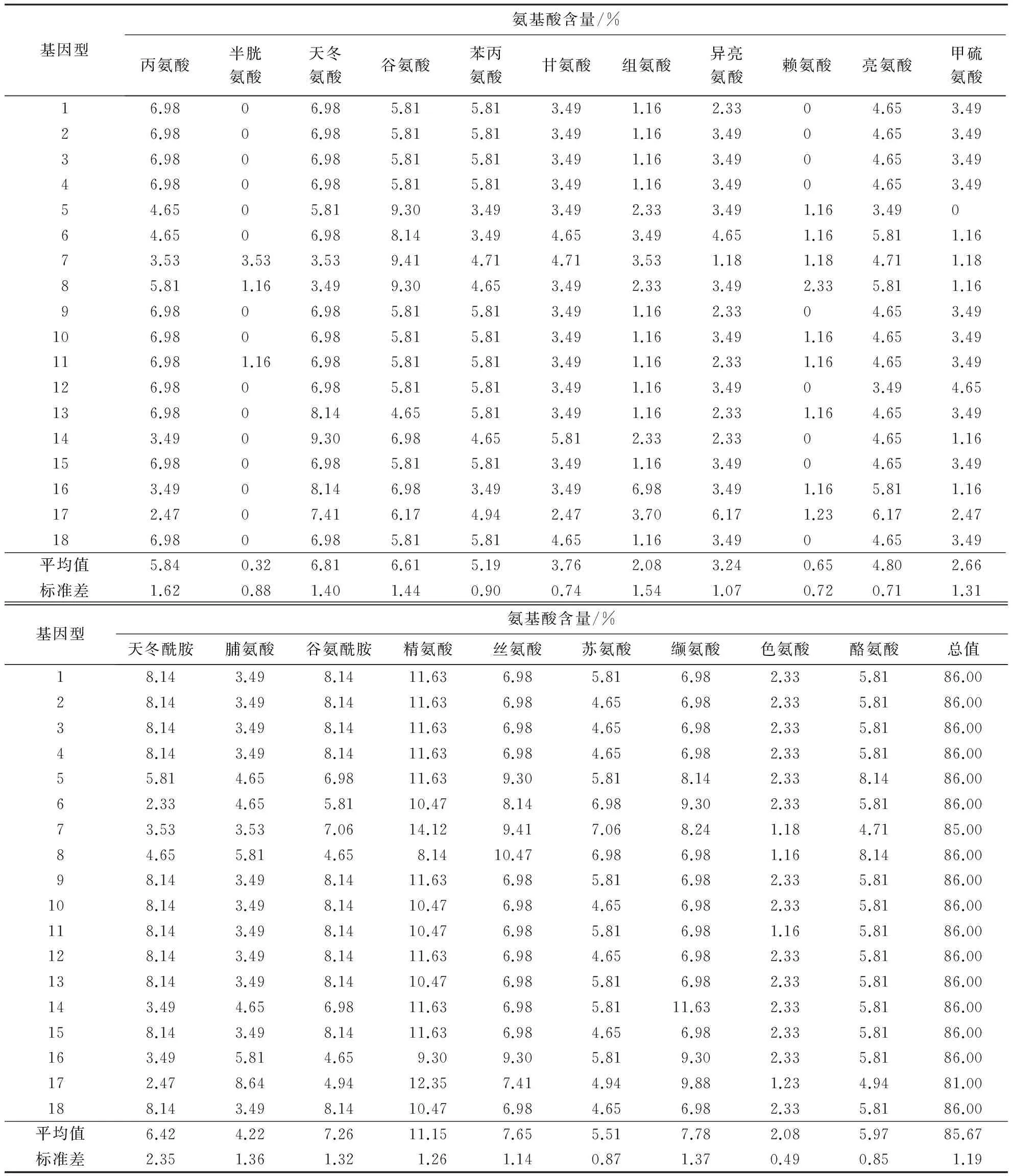
表4 莆田黑鸭MHCⅠ基因外显子2的氨基酸组成
通过计算可知,莆田黑鸭MHCⅠ基因外显子2编码的中极性氨基酸与非极性氨基酸,带正电荷的氨基酸与带负电荷的氨基酸几乎达到平衡.非极性氨基酸(丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸)占35.81%;不带电荷的极性氨基酸(甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺)占36.89%;带正电荷的氨基酸(赖氨酸、精氨酸、组氨酸)占13.88%;带负电荷的氨基酸(天冬氨酸、谷氨酸)占13.42%.
莆田黑鸭MHCⅠ基因外显子2编码的氨基酸中,疏水氨基酸(酪氨酸、色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、丙氨酸)占39.12%,亲水氨基酸(甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、半胱氨酸)占30.92%,疏水氨基酸所占比率大于亲水氨基酸.可见,莆田黑鸭MHCⅠ基因外显子2编码的氨基酸有明显的疏水性.
2.4莆田黑鸭MHCⅠ基因外显子2与其他物种的聚类分析
应用Mega 4.1软件中的Kimura双参数遗传距离法构建莆田黑鸭MHCⅠ基因外显子2与其他物种的系统发育树.结果(图4)显示,系统发育树分为3个分支,禽类为一个分支,禽类中的黑鸭(Anasrubripes)与家鹅(Anserdomestica)的亲缘关系最近,其次为灰雁(Anseranser),与鸡(Gallusdomesticus)的亲缘关系最远;马(Equuscaballus)和人(Homosapiens)为一个分支;家鼠(Musmusculus)单独作为一个分支.
3讨论
MHC基因区域的遗传多态性已经在很多脊椎动物中发现,并主要由自然选择来维持,由长期进化过程中等位基因的积累、融合和扩增形成,产生遗传多态性的机制主要是突变和基因转换[14-15].赵淑娟[16]对突变体黑羽鹌鹑MHCⅠ基因遗传多态性的研究表明,其第4外显子具有较高的遗传多态性,在296 bp片段上有18个突变位点,运用病毒感染后产生的抗体与第4外显子遗传多态性进行关联分析的方法,寻找到抗病力强的基因型,这些基因可作为抗病力的主要候选基因,这一思路可以运用到莆田黑鸭MHCⅠ外显子2免疫功能的研究上,为鸭的抗病育种提供免疫遗传学基础.
本试验利用PCR-SSCP技术对莆田黑鸭MHCⅠ基因的外显子2进行检测,由于其遗传多态性较丰富,判型比较困难,不适合SSCP分型进而使用DNA测序,这一结果与刘莹莹[17]对江豚MHC-DQB外显子2遗传多态性的研究结果相似.本试验在50只莆田黑鸭中共检测出18种不同的DNA序列类型,其位点编码86个氨基酸残基,其中,多态变异位点有41个,简约信息位点34个,单突变位点7个,说明在MHC基因存在变异且遗传多态性丰富,可以作为分子标记,为家禽的抗病育种研究提供重要依据.核苷酸突变分析结果表明,莆田黑鸭MHCⅠ基因外显子2以颠换为主,这与李齐发等[18]对牛亚科MHCDRB3基因外显子2序列变异的分析结果一致.一般认为,自然选择主要在蛋白质水平上起作用,同义突变不造成氨基酸顺序的任何变化,因而,同义突变被当作选择上呈中性突变的侯选者.本试验中,非同义替换率小于同义替换率,比值为0.832,说明莆田黑鸭在进化过程中受负选择的影响,这与刘志方等[3]对新疆哈萨克绵羊MHCⅠ基因外显子2序列遗传多态性的分析结果相似.说明非同义位点的进化速度要高于同义位点,这一特点也可能使得新的基因变异产生和遗传多态性增加,也为MHC基因适应不断变化的抗原创造了条件[19].
莆田黑鸭MHCⅠ基因外显子2突变位点为84个,GC含量为59%,突变率高,其高度的突变率表明MHCⅠ类分子与内源性抗原的呈递有关;而外显子2作为其抗原结合区,证实了免疫系统的抗原多样性,从而可以与疾病的抗性相关联.莆田黑鸭MHCⅠ基因密码子第3位的GC含量为82.7%,表明该位点密码子第3位受到突变压的制约,其含量越大,受到的突变压也相应较大,这说明与维持MHC抗原分子的功能相关.在氨基酸组成中,莆田黑鸭MHCⅠ基因外显子2的极性氨基酸与非极性氨基酸,带正电荷的氨基酸与带负电荷的氨基酸几乎达到平衡,疏水性氨基酸大于亲水性氨基酸.由此可见,莆田黑鸭MHCⅠ基因外显子2编码的氨基酸有明显的疏水性,而氨基酸的极性、带电性和疏水性决定了MHC抗原的稳定性和功能性,疏水性这一特征使得MHC抗原进一步折叠,形成更紧密的空间结构,从而与相应抗原决定簇发生特异结合,发挥抗原呈递作用.本试验结果可为进一步研究MHCⅠ类分子的遗传多态性与疾病抗性之间的关系提供数据基础,也为抗原表位疫苗的研发做了前期工作.
本试验对莆田黑鸭MHCⅠ基因的单个位点进行了PCR检测和测序,尚未对多个位点的遗传多态性作出分析,存在一定的局限性.因此,继续研究莆田黑鸭MHCⅠ基因的不同区域以找到更多的遗传多态性位点是下一步工作的重点.
参考文献
[1] 武永淑,韩凌霞.家禽MHC结构研究进展[J].遗传,2012,34(6):673-678.
[2] KULSKI J K, SHIINA T, ANZAI T, et al. Comparative genomic analysis of theMHC: the evolution of class Ⅰ duplication blocks, diversity and complexity from shark to man [J]. Immunol Rev, 2002,190(1):95-122.
[3] 刘志方,吴长新,张辉,等.新疆哈萨克绵羊MHCⅠ类基因第二、三外显子序列多态性分析[J].石河子大学学报(自然科学版),2013,31(2):170-175.
[4] 胡丹丹,刘哲.MHC基因在鱼类遗传育种中的研究与应用[J].水产学杂志,2013,26(3):64-68.
[5] 毛小鸿.莆田黑鸭MHC基因遗传多态性研究[D].福州:福建农林大学,2010.
[6] 杜佳莹.赤点石斑鱼MHC基因的克隆与多态性分析[D].厦门:厦门大学,2008.
[7] 解学辉.大仓鼠SSR座位的筛选及黑线仓鼠MHC基因的克隆与序列分析[D].曲阜:曲阜师范大学,2009.
[8] 阮小飞.鸭MHCⅠ和β2 m基因的表达与纯化及其蛋白二级结构分析[D].北京:中国农业大学,2006.
[9] DIJKSTRA J M, KATAGIRI T, HOSOMICHI K, et al. A third broad lineage of major histocompatibility complex (MHC) class Ⅰ in teleost fish;MHCclass Ⅱ linkage and processed genes [J]. Immunogenetics, 2007,59(4):305-321.
[10] WEIGAND L U, LIANG X, SCHMIED S, et al. Isolation of humanMHCclass Ⅱ-restricted T cell receptors from the autologous T-cell repertoire with potent anti-leukaemic reactivity [J]. Immunology, 2012,137(3):226-238.
[11] CHEN W, JIA Z, ZHANG T, et al.MHCclass I presentation and regulation by IFN in bony fish determined by molecular analysis of the class Ⅰ locus in grass carp [J]. J Immunol, 2010,185(4):2 209-2 221.
[12] AGUILAR A, EDWARDS S V, SMITH T B, et al. Patterns of variation inMHCclass Ⅱ beta loci of the little greenbul (Andropadusvirens) with comments onMHCevolution in birds [J]. J Hered, 2006,97(2):133-142.
[13] 赵淑娟,周虚,庞有志,等.家禽MHC分子多态性与抗病育种[J].湖北农业科学,2011,50(17):3 480-3 483.
[14] 孙菲菲,刘桂芬,万发春,等.渤海黑牛BOLA-DQA2基因SNPs多态性与生长性状的关联性分析[J].西南农业学报,2012,25(1):271-275.
[15] KAUFMAN J, SALOMONSEN J. The “minimal essentialMHC” revisited: both peptide-binding and cell surface expression level ofMHCmolecules are polymorphisms selected by pathogens in chickens [J]. Hereditas, 1997,127(1-2):67-73.
[16] 赵淑娟.突变体黑羽鹌鹑的纯化及其MHCclass Ⅰ基因多态性与免疫功能关系研究[D].长春:吉林大学,2011.
[17] 刘莹莹.渤海和北部黄海海域江豚MHC-DQB第二外元遗传多态性的分析[D].济南:山东大学,2009.
[18] 李齐发,李艳华,赵兴波,等.牛亚科MHCDRB3基因外显子2的序列变异分析[J].农业生物技术学报,2005,13(4):441-446.
[19] 肖娜,任艳玲,李敏,等.洼地绵羊MHC-DRB1基因PCR-RFLP多态性分析[J].动物医学进展,2011,32(5):63-68.
(责任编辑:施晓棠)
收稿日期:2015-11-19修回日期:2016-05-04
基金项目:福建省高等学校科技项目(JA09082);福建省高校产学合作科技重大项目(2012N5001).
作者简介:汪稳(1991-),女,硕士研究生.研究方向:动物遗传育种.Email:1196867380@qq.com.通讯作者肖天放(1964-),男,教授.研究方向:动物遗传育种.Email:tfxiao@163.com.
中图分类号:S834.89; S813.1
文献标识码:A
文章编号:1671-5470(2016)04-0420-07
DOI:10.13323/j.cnki.j.fafu(nat.sci.).2016.04.009
Genetic polymorphism of exon 2 inMHCⅠ gene of Putian black duck
WANG Wen, LIN Weimin, CHEN Jing, HU Yuping, MAO Xiaohong, XIAO Tianfang
(College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract:To establish theoretical basis for duck breeding of disease-resistance species, genetic polymorphism analysis was conducted by PCR amplification and DNA sequencing of exon 2 in MHCⅠ gene from Putian black duck (hereafter referred to as exon 2). Results showed that exon 2 had high degree of genetic polymorphism, whose nucleotide variance was mainly attributed to transversion, and higher rate of synonymous substitution than non-synonymous substitution. The total content of GC in exon 2 was 59%, with the highest portion coming from the 3rd codon (82.7%). Amino acid composition analysis illustrated that exon 2 had high level of hydrophobicity, which might play a significant role in maintaining the structure and function of MHC. Moreover, cluster analysis showed that Putian black duck had a closer relationship with goose, and farther with chicken.
Key words:Putian black duck; major histocompatibility complex Ⅰ(MHCⅠ); DNA sequencing; genetic diversity
