十二烷基硫酸钠微生物降解研究进展
2016-07-27张若木李泽琴陈杨武兰书焕谭周亮成都理工大学四川成都60059中国科学院成都生物研究所四川成都6004
张若木,李泽琴,陈杨武,兰书焕,谭周亮(.成都理工大学,四川成都60059;.中国科学院成都生物研究所,四川成都6004)
十二烷基硫酸钠微生物降解研究进展
张若木1,2,李泽琴1,陈杨武2,兰书焕2,谭周亮2
(1.成都理工大学,四川成都610059;2.中国科学院成都生物研究所,四川成都610041)
摘要:十二烷基硫酸钠(SDS)作为重要的阴离子表面活性剂,因其具有成本低、起泡性好等特点,被广泛应用于日常生活和工业生产中,从而导致环境中的SDS含量越来越高,对人类与环境造成严重危害。微生物降解法在众多SDS处理方法中,具有反应条件温和、操作简单、氧化彻底、无二次污染等优点,是最经济有效的途径。从SDS微生物降解菌株以及其降解的最佳参数、筛选方法、微生物来源和降解途径几个方面,对微生物降解SDS进行综述,对未来SDS微生物降解的研究发展进行了展望。
关键词:十二烷基硫酸钠;微生物降解;研究进展;降解途径
十二烷基硫酸钠(Sodium dodecyl sulphate,简称SDS)是一类阴离子表面活性剂,具有分散、增溶、乳化、消泡、润滑、洗涤、防腐和杀菌等作用。在工业和日常生活中,因其优异的发泡能力,阴离子表面活性剂SDS的用量大约占世界总合成表面活性剂的25%~30%[1]。但是,大量的SDS等阴离子表面活性剂进入水体之后,会在水环境中缓慢积累并对人类和生态系统造成不利影响[2]。据报道,SDS能抑制双壳贝类的滤食习性[3]、引起植物的氧化应激[4]、大大影响藻类的生长和蠕动等[5]。有研究指出,在10 mg/L SDS作用下,鲤鱼的游泳能力降低了5倍且耗氧量增加2.8倍[6]。此外,SDS还会造成人的过敏性反应,引起晶状体透明度的损失等[7,8]。在废水的生物处理过程中,因为它的高起泡性,会降低氧化电位导致水中微生物死亡[9],从而引起微生物废水处理系统失稳或崩溃。目前,表面活性剂的污染治理主要采用物理化学法和微生物降解法,其中微生物降解法因具有处理效果好、运行成本低和对环境影响小等优点,在环境污染修复技术中是综合效益最好的方法[10]。国内外已筛选得到多种SDS降解菌,同时关于SDS降解菌的降解动力学、降解性能及SDS的降解途径等的报道也较多,但目前关于SDS废水生物处理的工程实例还很少。因为在废水生物处理过程中,SDS的高起泡性会降低氧化电位而导致水中微生物的死亡[9],从而引起系统失稳或崩溃。
目前,SDS的微生物降解研究主要集中在3个方面:菌株筛选分离、影响因子及条件优化、降解途径与机理。重点介绍了SDS降解菌的来源与筛选情况,系统阐述了pH值、温度、底物浓度等环境因子对SDS降解菌的降解性能的影响,简要介绍了SDS降解菌在表面活性剂废水生物处理中的应用情况,对可进一步开展研究的方向进行了展望,以期为SDS降解菌实现工程应用提供指导与参考。
1 降解SDS的微生物种类
SDS的生物降解研究最早始于Payne and Feisal (1963),其对假单胞菌的SDS生物降解作了详细研究,包括酶学和降解动力学[11],之后陆续有学者筛选出能够以SDS作为碳源生长的菌,其中以假单胞菌最多,此外还包括克雷伯杆菌、放线菌、不动杆菌等,具体见表1。
大多数SDS降解菌的最佳生长温度为30℃,少数菌在25℃或37℃下活性更高;最佳生长pH值均为中性偏碱性(pH值7~8.5)条件;摇床转速与溶解氧(DO)相关,一般摇床转速在120 r/min以上时更利于SDS降解菌的生长,低转速则会影响SDS的降解[23]。
由于SDS对微生物的毒性作用,浓度过高时会对降解菌的活性产生抑制[22]。总体上,大部分菌在SDS浓度为1 500~2 500 mg/L时有最佳降解速率与生长量,但有研究发现Acinetobacter calcoaceticus和Pantoea agglomerans的混合菌在8 000 mg/L的SDS浓度下,仍能保持高的生长与降解速率[23];尽管不同菌的SDS降解速率差异较大,但大部分菌的SDS降解速率在15~45 mg/L·h-1,而Chaturvedi等人筛选出的Pseudomonas aeruginosa SDS3的降解速率能达到81 mg/L·h-1[15]。
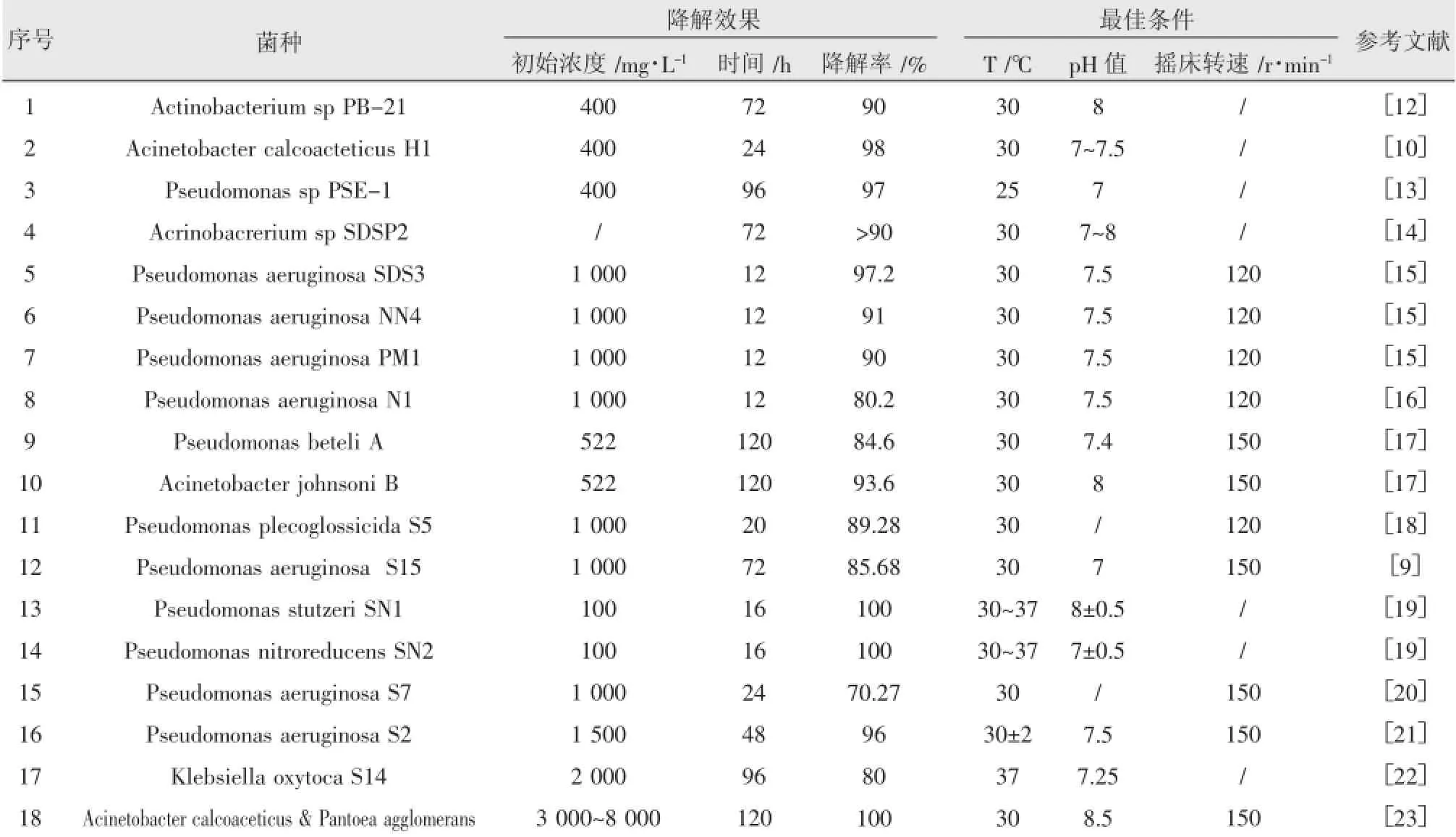
表1 部分SDS降解菌的最佳降解条件及其降解效果
1.1温度
过高和过低的温度都会导致微生物酶活的降低,进而限制其对SDS的降解活动。Klebsiella oxytoca S14降解SDS时的最佳温度为37℃,当温度降低或升高都会降低菌对SDS的降解率;Actinobacterium sp PB-21 对SDS的最佳降解温度为30℃,去除率达75.4%,而当温度升到45℃时,SDS去除率只有不到30%[12]。
虽然大量研究表明温度的变化对SDS降解菌有较大影响,但已有学者发现有的SDS降解菌在一定温度范围内仍可保持较高的SDS降解率。Ambily等发现,Pseudomonas aeruginosa菌株MTCC10311在最佳温度30℃下降解率为96%,而该菌株在40℃时降解率也能达到 90%[21]。Abbouda等人研究用Acinetobacter calcoaceticus和 Pantoea agglomerans两种菌混合降解SDS,在30~37℃,其降解效果差异不大[23]。Acrinobacrerium sp SDSP2的最佳生长温度为30℃,当温度在30~37℃时,虽然生长量大幅降低,但是降解率仍然较高,在50%以上[14]。Margesin等人从高地湿原土中筛出的菌株RM8/11,经低温驯化后在10℃下,72 h能够降解2 000 mg/L的SDS,平均降解速率为27.8 mg/L·h-1[24]。
1.2pH值
pH值是微生物活性的一个重要影响因子。大量文献表明,SDS降解菌最佳 pH值普遍在 7~8。Acinetobacter calcoacteticus H1的最佳pH值为7~7.5,当pH值降至6.0或升至9.0时,菌株几乎完全失去降解能力[10]。Shukor等研究发现,菌株Klebsiella oxytoca S14降解SDS的最佳pH值为7.25,当pH值比最佳pH值高或低时,菌株生长量都会减少[22]。此外,有的SDS降解菌可以适应较广的pH值范围。如李田[13]等筛选出的铜绿假单胞菌在pH值为6~9时,降解率均在90%以上;尽管Pseudomonas aeruginosa MTCC 10311的最佳pH值为7.5,但pH值在4~10范围内,其降解率变化并不大[21]。工业废水的pH值范围通常较广,因此,pH值适应范围广的SDS菌将在实际废水处理中得到更好的应用。
1.3SDS底物浓度
一方面,SDS可以为微生物提供碳源;另一方面,SDS作为表面活性剂会对微生物细胞的生长产生抑制,且随着污水中表面活性剂浓度的增大,营养物质和微生物间的作用力将下降[27]。SDS因其高起泡性,会降低氧合电位,使水生生物死亡,并能在生物废水处理过程中导致泡沫量大、氧传递效率下降等问题[17]。因此,适宜的底物浓度能让微生物具有更好的活性。
研究发现,Klebsiella oxytoca S14在以SDS为唯一碳源生长的情况下,当SDS浓度在1~2 g/L时,浓度越高细胞生长量越大;浓度在2~10 g/L时,随着SDS浓度的升高,菌株生长量变少[22]。与此相似的是,Sharrel Rebello等人筛选出的Pseudomonas aeruginosa S15在SDS浓度,为0.1%时,降解率最高,测试了0.05%和1%浓度,发现其降解率均比在0.1%浓度中低[9]。Pseudomonas aeruginosa MTCC 10311在1 500 mg/L浓度的SDS中降解率为96%,而在10 000 mg/L浓度下,降解率只有20%[21]。因此,SDS对微生物既是碳源又有毒性,根据实际情况筛选出相应浓度下的SDS降解菌,可以提高废水处理效率。
1.4外加碳源、氮源等
外加碳源或氮源是难降解有机废水微生物处理过程中的常用方法。SDS降解菌大多都可利用SDS作为唯一碳源来降解SDS,但外加碳源或氮源有时可以促进SDS的降解。因为SDS对微生物具有毒性,在SDS的氧化胁迫下微生物活性受到抑制,额外提供易降解的初级碳源,为微生物降解SDS提供能量。
颜丙花[12]和王星辉[14]等学者曾报道添加葡萄糖或有机污泥可以提高降解菌对SDS的降解率,并且添加有机污泥的效果要比葡萄糖更好,可使Actinobacterium PB-21的SDS降解率从75.4%提高到85%,这是因为添加有机物质可为降解菌提供附着表面,添加污泥能给降解菌提供适宜的生活环境,从而提高其降解能力[12]。Ambily等研究也发现外加碳源如葡萄糖、蔗糖、麦芽糖和甘露醇,以及氮源如氯化铵、硝酸铵、蛋白胨和酵母提取物等,会提升降解菌Pseudomonas aeruginosa MTCC 10311对SDS的降解率,但添加丁二酸盐则引起降解率降低[21];不同SDS降解菌的最佳氮源差异较大,如Klebsiella oxytoca S14的最佳氮源为硫酸铵[22],Acrinobacrerium sp SDSP2在以蛋白胨作为氮源的时候有最大降解率[14],而Acinetobacter calcoacteticus H1在酵母浸出物中有最大降解速率[10]。
虽然大多数情况下添加碳源、氮源等物质可以促进降解菌降解SDS,但由于葡萄糖等碳源比SDS更易被微生物降解,添加碳源可能会减少SDS降解酶的诱导表达,进而导致微生物对底物的利用情况发生变化[48]。如Abbouda等通过外加碳源(葡萄糖、蔗糖、麦芽糖、甘露醇和丁二酸等)和氮源来考察两株菌混合对SDS的降解情况,发现外加碳源虽然会提高该混合菌的初始SDS降解速率,但整体降解速率会降低;外加氮源除琼脂粉外,其余氮源均对SDS的降解率有轻微促进作用[23]。因此,针对不同的SDS降解菌,在考虑外加碳源、氮源时,一定要综合考虑添加的种类、剂量、组合比例和成本等问题,通过有效的实验设计得到最佳条件,使其既能达到促进SDS的生物降解,又能有效诱导更多SDS降解酶产生的效果。
1.5溶解氧
研究表明,溶解氧的高低会影响微生物体内不同酶的表达能力。细菌在降解SDS过程中,通常以氧为电子受体来氧化SDS,溶解氧浓度会影响微生物活性与降解能力。已报道的绝大部分SDS降解菌均为好氧菌,体系溶解氧主要与装液量和转速相关。李田[13]等人在研究溶解氧时是用锥形瓶中的装液量来表示,当250 mL锥形瓶中的装液量从50 mL提升至200 mL时,降解率从95%降低至85%。
Abbouda等用混合菌降解SDS时,尝试了75 r/min,150 r/min和250 r/min 3种转速,发现150 r/min和250 r/min下,SDS降解率相差不大,而在75 r/min下,SDS难以降解[23]。因此,众多研究者将摇床转速控制在120 r/min或者150 r/min,以保证反应体系的好氧条件。尽管大多数SDS降解菌在好氧条件下具有高活性,但Pseudomonas stutzeri SN1和Pseudomonas nitroreducens SN2在缺氧厌氧的条件下,以硝酸盐和亚硝酸盐作为电子受体来降解SDS[19]。
1.6其他
除了上述因素外,培养基种类、气候因素[30]、盐度和重金属离子等也会对SDS降解菌的降解效果造成影响。
两株菌混合菌降解SDS,发现该混菌在营养肉汤(NB)培养基中能完全降解SDS,而在基本培养基中SDS的去除率仅为10%[23]。George[30]等人研究了季节性因素对南极沿海水域中SDS降解的影响,发现季节的变换会通过改变海水的温度、盐度等因素对降解SDS的微生物产生影响。
盐度也是一个影响微生物生长的重要因素。Acinetobacter calcoacteticus H1在0~10 g/L的盐度下SDS降解率变化不大,但在10~25 g/L的盐度下,生长量与降解速率均受到极大抑制,在25 g/L时受到完全抑制[10]。这是因为高盐度下由于盐析作用导致微生物的脱氢酶活性降低;盐浓度升高还会引起渗透压升高,可能引起微生物的质壁分离以致失活[28]。
金属离子如Ca2+,Mg2+,Cu2+等是微生物生长的必须元素,添加少量金属离子能促进微生物的SDS降解速率[14],若金属离子浓度过高,则会对微生物产生毒害作用,其主要作用机理为抑制微生物的呼吸作用、与酶等蛋白质结合使细胞失活等引起微生物中毒甚至死亡[29]。但也有部分SDS降解菌能耐高浓度的金属离子,如Acinetobacter calcoacteticus H1在200 mg/L的重铬酸钾下仍有90%降解率[10]。
2 SDS降解途径
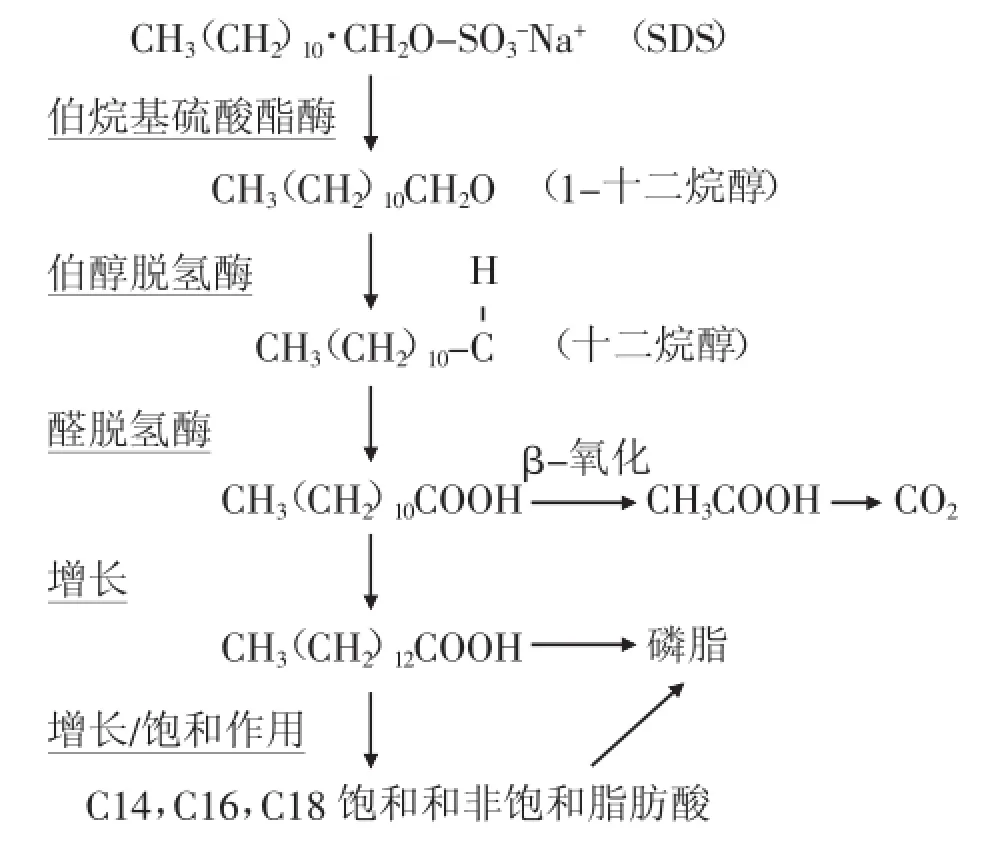
SDS的降解通常是由烷基硫酸酯酶脱去硫酸基团开始的[23],而烷基硫酸酯酶主要包括3类机制不同的关键酶[31]。第一类是芳基硫酸酯酶,这类酶的研究主要来自真核生物,他们是由位于活性位点丝氨酸或半胱氨酸翻译修饰成甲酰甘氨酸来表征的,使硫酸酯中的CO-S键断裂,产生无机硫酸盐与相应的醇。第二类是Fe(II)α-酮戊二酸相关的双加氧酶超级家族的酶。这类酶需要α-酮戊二酸作为共底物,断裂烷基硫酸酯键变为无机硫酸盐以及响应的醛,例如Pseudomonas putida SP3的酶Atsk[32]。第三类是包含金属-β-内酰胺酶(MBL)相关的酶,这类酶裂解烷基硫酸盐成相应的醇并且释放出水分子。已有相关铜绿假单胞菌的报道,例如Pseudomonas aeruginosa SDS3[33]和Pseudomonas aeruginosa PA01[34]的酶sdsA1。
大部分假单胞菌可以产生多种烷基硫酸酯酶,分别对应不同构型的烷基硫酸盐。比如C12B[50]能够产生5种烷基硫酸酯酶,恶臭假单胞菌FLA[51]能产生6种,假单胞菌DESI能产生4种[31],假单胞菌C12B产生5种烷基硫酸酯酶,但有的菌(如S5)仅能产生1种烷基硫酸酯酶的假单胞菌[18]。
Thomas和White[37]对假单胞菌C12B的SDS生物降解做了详细的研究。他们使用14C-放射性示踪技术来研究C12B降解SDS时14C的踪迹。在SDS的降解产物1-十二烷醇和1-十二烷酸中检测到放射性14C的存在。Ambily等人[35]用乙醚提取SDS降解的副产物,并使用GC-MS进行分析。发现在SDS降解过程中,副产物的产生顺序分别为十二烷醇、十二烷醛和十二烷酸,之后经β-氧化途径形成酸残基。John等人[18]在进行酶谱分析时发现了十二烷醇的产生,并且在进行聚丙烯酰胺凝胶电泳(PAGE)时发现由于释放出的SO42-与Ba2+结合生成了沉淀,形成了一条白色带。这些研究结果均直接或间接表明细菌通过烷基硫酸酯酶来降解SDS。SDS通过烷基硫酸酯酶水解后,生成相应的十二烷醇或十二烷醛,再被氧化为对应的十二烷酸,之后十二烷酸经过β-氧化或ω-氧化生成多种短链酸,最终被氧化为二氧化碳和水。其中β-氧化占绝大多数,如Pseudomonas aeruginosa MTCC 10311[35],Pseudomonas aeruginosa N1[16]和Pseudomonas sp C12B[37]。SDS降解途径如下[31]。
3 工程应用
目前,尽管国内外已有部分关于SDS废水微生物处理的研究见诸报道,但大多针对的是SDS模拟废水,使用筛选出的纯菌或者混菌用于SDS废水生物处理的工程实例还少有报道。Nicholas J[52]等人将SDS降解菌固定于河流中污水厂排污口的生物膜上,对河流中的SDS进行降解。考察了用生物膜法修复被SDS污染河流时细菌数量变化及降解速率等的变化。柳红军[36]等人用膜生物反应器处理模拟SDS废水,研究了通气量、SDS浓度、活性污泥浓度及外加碳源等因素的变化对SDS降解的影响,并对其降解途径与降解动力学进行了研究。另外,也有部分学者将SDS的微生物降解与工业应用相结合。如Rebello S[9]等利用Pseudomonas aeruginosa S15将SDS转化为鼠李糖脂。在以SDS为唯一碳源的培养基中,该菌株可将1 g SDS可以转化为6.9 g鼠李糖脂,解决了鼠李糖脂生产成本高的问题。
4 结语与展望
在我国表面活性剂使用量与SDS排放量日益增加、水质环境日益复杂的今天,针对SDS废水处理新技术的研发工作越来越得到重视。目前,国内外已筛得到多种多样的特异性SDS降解菌株,并且对其的降解性能、降解途径与参与SDS降解的酶及相应基因等进行了研究和报道,但针对实际废水处理的应用研究还很少,今后可从以下3个方面进一步研究。
(1)涉及SDS降解的基因、酶及降解途径需更深入的研究。目前,国内外对微生物降解SDS所需的酶及其对应基因、降解途径已有初步研究,但不同的SDS降解菌可能具有不同的功能基因、酶及SDS代谢途径,借助分子生物学手段及高效液相色谱、气相色谱、离子色谱及液质联用等检测手段,可为更多的功能基因和酶的种类的发现提供可能,可为SDS的微生物降解机理及代谢途径的明晰提供便利。
(2)极端条件下SDS降解菌的筛选与应用研究较少。由当前的研究可知,大多SDS降解菌的最佳生长条件在30℃及中性或者偏碱性条件;但实际SDS废水处理过程可能处于低温、高盐及极端pH等条件下,目前相关方面的研究还很少,筛选、驯化出能适应极端条件的SDS降解菌,对于SDS废水的有效处理具有重要的实际意义。
(3)如何将已筛选得到的高效降解菌与实际废水处理过程有机结合是一个亟待解决的问题。尽管目前已有很多关于纯菌降解SDS的研究见诸报道,但其在实际废水处理中的应用还非常少,采用分子生物学、降解动力学、流体力学与环境工程学相结合,实现多领域的交叉研究,对SDS废水处理过程中微生物的种群结构与丰度变化追踪、微生物作用机理、作用过程及降解性能的优化调控等具有十分重要的意义,多学科、多领域交叉研究将对已筛选得到的SDS高效降解菌的实际应用提供更为有效的解决思路。
参考文献
[1]Ambily P S,Jisha M S.Metabolic profile of sodium dodecyl sulphate(SDS)biodegradation by Pseudomonas aeruginosa (MTCC 10311)[J].Journal of Environmental Biology,2014,35 (5):827-831.
[2]Chaturvedi V,Kumar A.Toxicity of sodium dodecyl sulfate in fishes and animals.A review[J].Int J Appl Biol Pharm Technol,2010(1):630-633.
[3]Ostroumov S A.Studying effects of some surfactants and detergentsonfilter-feedingbivalves.Hydrobiologia[J]. Hydrobiologia,2003,500(1-3):341-344.
[4]Ye X,Li X,Shu C,et al.The effects of surfactants on the activity of invertase and superoxide dismutase of soybean leaf in vitro and in vivo.Colloids Surf A[J].Colloids& SurfacesAPhysicochemical&EngineeringAspects,2000,175(1-2):249-255.
[5]Aizdaicher N A,Markina Z V.Toxic effects of detergents on thealga Plagioselmisprolonga(Cryptophyta)[J].Russian Journal of Marine Biology,2006,32(1):45-49.
[6]Susmi T S,Rebello S,Jisha M S,et al.Toxic effects of sodium dodecyl sulphate on grass carp Ctenopharyngodon idella[J].Fishery Technology,2010,47(2):145.
[7]Marrakchi S,Maibach H I.Sodium lauryl sulfate-induced irritation inthehumanface:regional andage-related differences[J].Skin pharmacology and physiology,2006,19 (3):177-180.
[8]Bantseev V,Mccanna D A,Wong W W,et al.Mechanisms of ocular toxicity using the in vitro bovine lens and sodium dodecyl sulfateasachemical model.Toxicol Sci[J]. Toxicological Sciences,2003,73(1):98-107.
[9]Rebello S,Asok A K,Joseph S V,et al.Bioconver sion of Sodium Dodecyl Sulphate to Rhamnolipid by Pseudomonas aeruginosa:A Novel and Cost-Effective Production Strategy [J].Applied Biochemistry&Biotechnology,2013,169(2):418-430.
[10]关向杰,杨海君,黄水娥,等.一株耐铬不动杆菌对十二烷基硫酸钠的降解特性[J].环境工程学报,2014(05):2 117-2 123.
[11]Payne W J,Feisal V E.Bacterial Utilization of Do decyl SulfateandDodecylBenzeneSulfonate[J].Applied Microbiology,1963,11(4):339-344.
[12]颜丙花,杨海君,罗琳,等.十二烷基硫酸钠降解菌的分离、鉴定及其降解能力[J].化工环保,2011(2):110-113.
[13]李田.一株十二烷基硫酸钠降解菌的筛选及降解特性的研究[D].兰州:兰州大学,2007.
[14]王星辉.制革废水中SDS降解菌的分离及其降解特性研究[D].长沙:湖南农业大学,2010.
[15]Chaturvedi V,Kumar A.Diversity of culturablesodium dodecyl sulfate(SDS)degrading bacteria isolated from detergent contaminated ponds situated in Varanasi city,India[J].International Biodeterioration&Biodegradation,2011,65(7):961-971.
[16]Chaturvedi V,Kumar A.Metabolism Dependent Chemotaxis of Pseudomonas aeruginosa N1 Towards Anionic Detergent Sodium Dodecyl Sulfate[J].Indian Journal of Microbiology,2014,54(2):134-138.
[17]Hosseini F,MalekzadehF,Amirmozafari N,etal. Biodegradation of anionic surfactants by isolated bacteria fromactivatedsludge[J].InternationalJournalof Environmental Science&Technology,2007,4(1):127-132.
[18]John E M,Rebello S,Asok A K,et al.Pseudomonas plecoglossicidaS5,anovel nonpathogenicisolatefor sodiumdodecyl sulfatedegradation[J].Environmental Chemistry Letters,2015,13(1):117-123.
[19]Paulo A M S,Plugge C M,García-Encina P A,et al. Anaerobic degradation of sodium dodecyl sulfate(SDS)by denitrifying bacteria[J].International Biodeterioration&Biodegradation,2013,84(5):14-20.
[20]Yeldho D,Rebello S,Jisha M S.Plasmid-Mediated Biodegradation of the Anionic Surfactant Sodium Dodecyl Sulphate,by Pseudomonas aeruginosa S7[J].Bulletin of Environmental Contamination&Toxicology,2011,86(1): 110-113.
[21]Ambily P S,Jisha M S.Biodegradation of anionic surfactant,sodium dodecyl sulphate by Pseudomonas aeruginosa MTCC 10311[J].Journal of Environmental Biology,2012,33(4):717-720.
[22]Shukor M Y,Husin W S,Rahman M F,et al.Isolation and characterization of an SDS-degrading Klebsiella oxytoca[J]. Journal of Environmental Biology,2009,30(1):129-34.
[23]Abboud M M,Khleifat K M,Batarseh M,et al.Different optimizationconditionsrequiredforenhancingthe biodegradation of linear alkylbenzosulfonate and sodium dodecylsulfatesurfactantsbynovelconsortiumof Acinetobacter calcoaceticus and Pantoea agglomerans[J]. Enzyme&Microbial Technology,2007,41(4):432-439.
[24]Margesin R,Schinner F.Biodegradation of the anionic surfactant sodium dodecyl sulfate at low temperatures[J]. International Biodeterioration&Biodegradation,1998,41 (2):139-143.
[25]杜倩,杨亲正.水中阴离子表面活性剂生物降解的研究进展[J].广州化工,2012,40(09):16-18.
[26]刘畅.产生物表面活性剂低温菌的筛选及初步应用研究[D].东北农业大学,2013.
[27]刘赫.表面活性剂对微生物降解污水中有机物的影响[J].环境科学与技术,2014(01):150-153.
[28]邹小玲,丁丽丽,赵明宇,等.高盐度废水生物处理研究[J].工业水处理,2008,28(9):1-4.
[29]李健中.重金属对生物脱氮除磷系统中微生物的毒性影响[D].广州:广州大学,2010.
[30]GeorgeAL.Seasonalfactorsaffectingsurfactant biodegradation in Antarctic coastal waters:comparison of apollutedandpristinesite[J].Marineenvironmental research,2002,53(4):403-415.
[31]Chaturvedi V,Kumar A.Bacterial utilization of sodium dodecyl sulfate[J].Int J Appl Biol Pharmaceut Tech,2010 (1):1126-1131.
[32]Chaturvedi V,Kumar A.Isolation of a strain of Pseudomonas putida capable of metabolizing anionic detergent sodium dodecyl sulfate(SDS).Iran J Microbiol 3:47-53[J].Iranian Journal of Microbiology,2011,3(1):47-53.
[33]Chaturvedi V,KumarA.PresenceofSDS-degrad ing enzyme,alkyl sulfatase(SdsA1)is specific to differ ent strains of Pseudomonas aeruginosa[J].Process Biochemistry,2013,48(4):688-693.
[34]Hagelueken G,Schubert W D.The Crystal Structure of SdsAl,an Alkylsulfatase from Pseudomonas aeruginosa,Defines a Third Class of Sulfatases[J].PNAS USA 2006,103(20):7 631-7 636.
[35]Ambily P S,Jisha M S.Metabolic profile of sodium dodecyl sulphate(SDS)biodegradation by Pseudomonas aeruginosa (MTCC 10311).[J].Journal of Environmental Biology,2014,35(5):827-831.
[36]柳红军.MBR处理三种阴离子表面活性剂废水的研究[D].哈尔滨:哈尔滨工程大学,2007.
[37]ThomasO, WhiteG.Metabolicpathwayforthe biodegradation of sodium dodecyl sulfate by Pseudomonas sp.C12B[J].Biotechnology&Applied Biochemistry,1989,11:3(3):318-327.
[38]Halmi M I,Hussin W S,Aqlima A,et al.Characterization of a sodium dodecyl sulphate-degrading Pseudomonas sp. strainDRY15fromAntarcticsoil[J].Journalof Environmental Biology,2013,34(6):1 077-1 082.
[39]Navais R,Méndez J,Cascales D,et al.The heat sensitive factor(HSF)of Yersinia ruckeri is produced by an alkyl sulphataseinvolved in sodiumdodecyl sulphate(SDS) degradation but not in virulence[J].Bmc Microbiology,2014,14(1):221-221.
[40]Gregor H,Adams T M,Lutz W,et al.The crystal structure of SdsA1,an alkylsulfatase from Pseudomonas aeruginosa,defines a third class of sulfatases.[J].Proceedings of the National Academy of Sciences of the U nited States of America,2006,103(20):7 631-7 636.
[41]Gadler P,Faber K.New enzymes for biotransformations: microbialalkylsulfatasesdisplayingstereo-and enantioselectivity.[J].Trends in Biotechnology,2007,25(2): 83-88.
[42]Chaturvedi V,Kumar A,Chaturvedi V,et al.Isolation of sodium dodecyl sulfate degrading strains from a detergent polluted pond situated in Varanasi city,India[J].Journal of Cell&Molecular Biology,2010:120-123.
[43]Long M,Ruan L,Li F,et al.Heterologous expression and characterizationofarecombinantthermostable alkylsulfatase(sdsAP)[J].Extremophiles,2011,15(2): 293-301(9).
[44]SharvelleS,Lattyak R,BanksMK.Evaluationof Biodegradability and Biodegradation Kinetics for Anionic,Nonionic,and Amphoteric Surfactants[J].Water Air&Soil Pollution,2007,183(1-4):177-186.
[46]Fadime Y,Bulent I.Characterization of SDS-degrading Delftia acidovorans and in situ monitoring of its temporalsuccessioninSDS-contaminatedsurfacewaters[J]. Environmental Science&PollutionResearch,2014,21 (12):7413-7424.
[47]Ambily P S,Jisha M S.Characterization of alkyl sulfatase required for the biodegradation of sodium dodecyl sulphate (SDS)[J].Eur J Exp Biol,2011(1):41-49.
[48]Klebensberger J,Rui O,Fritz E,et al.Cell aggregation of Pseudomonas aeruginosa strain PAO1 as an energydependent stress response during growth with sodium dodecyl sulfate[J].Archives of microbiology,2006,185(6): 417-427.
[49]Syed M A,Mahamood M,Shukor M Y,et al.Isolation and CharacterizationofSDS-degradingPseudomonas aeruginosa sp.strain D1[J].Australian Journal of Basic& Applied Sciences,2010:261-265
[50]T JBateman,K SDodgson,GFWhite.Primary alkylsulphataseactivitiesofthedetergent-degrading bacterium Pseudomonas C12B.Purification and properties of the P1 enzyme.[J].Biochemical Journal,1986,236(2): 401-408.
[51]Lillis V,Dodgson K S,White G F,et al.Initiation of activation of a preemergent herbicide by a novel alkylsulfatase of Pseudomonasputida FLA[J].Applied&Environmental Microbiology,1983,46(5):988-994.
[52]Russell N J,Anderson D J,Day M J,et al.Colonization of biofilmsbybacteriacapableofbiodegradingsodium dodecyl sulphate(SDS)at clean and polluted riverine sites [J].Microbial Ecology,1991,22(1):85-98.
中图分类号:X703
文献标志码:A
文章编号:1674-0912(2016)01-0034-07
收稿日期(2015-12-29)
作者简介:张若木(1990-),男,四川泸州人,硕士研究生,专业方向:微生物水处理。
Research advances on microbial degradation of sodium dodecyl sulfate
ZHANG Ruomu1,2,LI Zeqin1,CHEN Yangwu2,LAN Shuhuan2,TAN Zhouliang2
(1.Chengdu University of Technology,Chengdu 610059,China; 2.Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu 610041,China)
Abstract:Sodium dodecyl sulphate(SDS),an anionic surfactant,has been used extensively in industrial production and daily life due to its excellent foaming properties and low cost,which leads to the SDS content in the environment is more and more high,causing serious harm to human and environment.Within so many methods of SDS treatment, microbial degradation is the most economical and efficiency way by virtues of its mild reaction conditions,simple operation,completely oxidation,no secondary pollution,and so on.From several aspects on the detergent of microbial degradation of SDS,and the degradation of the optimum parameters,the method of screening,microbial sources and degradation pathways,microbial degradation of SDS are reviewed,and the research and development of future SDS microbial degradation are discussed.
Keywords:sodium dodecyl sulphate;microbial degradation;research advances;degradation pathway
