血必净对脂多糖诱导的急性肺损伤大鼠肺组织细胞间粘附分子-1表达的影响
2016-07-26张之龄沈琪琦朱健童小文徐兵周吴刚
张之龄,沈琪琦,朱健,童小文,徐兵,周吴刚
(上海交通大学医学院附属第九人民医院急诊科,上海 200011)
·基础研究·
血必净对脂多糖诱导的急性肺损伤大鼠肺组织细胞间粘附分子-1表达的影响
张之龄,沈琪琦,朱健,童小文,徐兵,周吴刚
(上海交通大学医学院附属第九人民医院急诊科,上海200011)
目的观察血必净对脂多糖诱导的急性肺损伤(ALI)大鼠细胞间粘附分子-1(ICAM-1)表达的影响。方法将45只Wistar 大鼠采用随机数字表分为三组:(1)健康对照(Control)组(15只)、(2)脂多糖 (LPS)组(15只)、(3) 血必净(XBJ)组 (15只)。LPS组和XBJ组采用股静脉注射LPS(5 mg/kg)制备大鼠ALI模型。造模前半小时开始给药,XBJ组给予血必净4 mL/kg;Control组和LPS组则给予等容积0.9%氯化钠注射溶液。在造模后6 h、12 h、24 h各随机处死大鼠5只,分别作为Ⅰ、Ⅱ、Ⅲ亚组,光镜下观察肺脏组织形态学变化,免疫组织化学法(IHC)检测肺组织中ICAM-1蛋白表达。结果造模后LPS组随着实验时间的延长,肺组织ICAM-1蛋白呈逐渐增加趋势,至24 h达到高峰。与LPS组相比,血必净组各时间点肺组织ICAM-1蛋白表达明显降低(P 急性肺损伤;脓毒症;胞间黏附分子1 ;大鼠,Wistar 脓毒症目前依然是ICU患者最主要的死亡原因,严重时可并发急性肺损伤(ALI)和多器官衰竭(MOF)。最新的流行病学调查结果[1]显示ALI患者死亡率在34%至58%之间,因此,寻找新的ALI发病的分子机制及治疗策略刻不容缓。虽然ALI的具体发病机制仍不明确,但研究[2]发现细胞间粘附分子-1(ICAM-1)的黏附功能和炎性反应及其相互关系是导致ALI的主要因素,与炎症性疾病有着十分密切的关系,在ALI/ARDS的发生和发展过程中起重要作用。有研究[3-4]认为针对ICAM-1进行干预将有利于炎症的恢复。本实验通过观察血必净注射液对ALI 模型大鼠肺组织ICAM-1表达的影响,探讨其可能的保护作用机制。 1.1实验动物健康雄性Wistar大鼠45只,2.5~3.5月龄,体质量250~280 g/只,由上海西普尔-必凯实验动物有限公司提供[生产许可证号:SCXK(沪)2008-0016]。 1.2实验药品和试剂血必净注射液(10 mL/支,天津红日药业有限公司产);脂多糖(LPS,Escherichia coliO127:B8,L3129,Sigma,美国);ICAM-1羊抗大鼠多克隆抗体(Santa Cruz,美国)。 1.3方法 1.3.1实验动物分组、模型建立及给药方法腹腔注射10%水合氯醛(5 mL/kg)麻醉后固定,经大鼠股静脉注射LPS(5 mg/kg)。45只SPF级雄性成年Wistar大鼠采用随机数字表分为三组:(1)健康对照组(n=15)、(2)脂多糖组(LPS组,n=15)、(3)血必净干预组(XBJ组,n=15)。血必净组在造模前半小时静脉内给予血必净4 mL/kg,健康对照组和LPS组则给予等容积0.9%氯化钠注射溶液。在造模后6 h、12 h、24 h各随机处死大鼠5只,分别作为I、Ⅱ、Ⅲ亚组,无菌留取大鼠肺组织。 1.3.2标本制备在造模后6 h、12 h、24 h各随机处死大鼠5只,分别作为Ⅰ、Ⅱ、Ⅲ亚组,取右肺上、下叶组织置入4%多聚甲醛固定,制作组织病理切片和免疫组织化学染色切片用于病理学检查。 1.3.3免疫组织化学法(IHC)检测肺组织中ICAM-1蛋白表达采用SP法检测肺组织中ICAM-1蛋白表达。肺组织经石蜡包埋作5 μm厚度的切片常规脱蜡至水,0.3%H2O2甲醇溶液消除内源性过氧化物酶,正常羊血清封闭,滴加一抗(羊抗大鼠ICAM-1多克隆抗体,浓度 1∶50)。PBS漂洗后滴加辣根过氧化物酶标记的兔抗羊二抗,37 ℃孵育30 min,PBS漂洗后二氨基联苯胺(DAB)显色,苏木精染色。光镜观察并应用Image pro Plus5.1图像处理系统采集图片对结果进行半定量分析,每张切片随机选5个不重复的视野,放大400倍,计算ICAM-1阳性染色的积分吸光度值(IOD),分别取其平均值进行分析。 1.4统计学处理采用SPSS13.0软件包分析,多组均数采用单因素方差分析(ONE-WAY ANOVA),组间两两比较采用SNK法。P<0.05为差异有统计学意义。 2.1肺组织的病理形态学变化健康对照组大鼠肺组织结构完整,肺泡腔清晰,肺泡间隔无炎症、无水肿。且各时间点无明显差异;LPS组大鼠肺组织结构基本毁损,肺泡间隔增宽,部分肺泡内见渗出、水肿、出血及纤维蛋白沉积,肺间质见大量炎症细胞浸润。且随时间点增长而明显。XBJ组大鼠肺组织肺泡隔略有增宽,肺泡内渗出、水肿、出血情况有所改善,肺间质见少量炎症细胞浸润。 2.2肺组织ICAM-1蛋白的表达正常大鼠肺组织微弱阳性表达ICAM-1,仅少量分布于肺泡上皮细胞。LPS组肺组织ICAM-1强阳性表达,主要分布于肺泡上皮和肺血管内皮细胞。XBJ组肺组织ICAM-1阳性表达减轻。图像分析软件测定的积分吸光度值提示,LPS 各亚组较健康对照组,差异有统计学意义(P<0.05),XBJ各亚组较LPS组比较,差异有统计学意义(P<0.05)。见表1。 表1 三组大鼠不同时间点肺组织ICAM-1的免疫组织化学表达 注:表中为IOD值;与对照组同时间点比较,aP<0.05;与LPS组同时间点比较,bP<0.05 脓毒症常在感染和手术应激情况下发生,其本质为大量细胞因子和炎性介质释放后引起宿主自身免疫损伤进而导致多器官功能障碍综合征。流行病学调查显示,脓毒症与诸多免疫信号通路异常激活有密切的关系。有研究证实,临床上超过60%脓毒症患者的致病菌为革兰阴性菌[5],而启动免疫反应的LPS是革兰阴性菌细胞壁释放的重要成分。LPS与细胞表面受体结合后,激活了一系列免疫信号通路,同时分泌大量炎性因子,最终导致机体发生失控的炎性反应[6]。目前,脓毒症确切的分子发病机制还不清楚。 ALI是脓毒症最主要的器官并发症[7]。由于脓毒症引起机体免疫功能受损,致使大量处于极度活跃状态的炎症细胞诸如巨噬细胞和中性粒细胞释放的炎性介质和细胞因子进一步加重肺组织及肺毛细血管内皮损伤。因此,深入研究脓毒症诱导肺损伤的发病机制对于临床治疗ALI至关重要。 ICAM-1又名 CD54,是免疫球蛋白超家族类的成员之一,是一种重要的细胞表面粘附分子[8],其参与介导中性粒细胞与上皮细胞或血管内皮细胞的粘附,在炎性反应的发生发展过程中具有不可替代的作用。作为粘附分子家族的重要成员之一,ICAM-1在重症急性胰腺炎早期即显著升高,并与急性肺损伤的发生有密切的关系,提示 ICAM-1可能在危重病时介导了炎症网络的形成。在各种ALI/ARDS动物模型中发现,ICAM-1在肺泡上皮细胞和血管内皮细胞膜表面大量并持久表达,并且ICAM-1的表达量与肺损伤的严重程度呈正相关[9-10]。有研究表明,经 ICAM-1基因敲除处理后的小鼠,可阻断PMN与内皮细胞的粘附,进而减轻肺组织的损伤;应用 ICAM-1单克隆抗体阻断ICAM-1形成,可减轻LPS引起的肺、肾、肝等多器官损伤[11]。全身的炎性反应及致病因子对肺血管内皮细胞的直接损伤是ALI的发病机制中最主要的环节。中性粒细胞(PMN)、巨噬细胞等炎症细胞和肿瘤坏死因子-α(TNF-α)等炎症介质以及它们与血管内皮细胞的相互作用[12-13]贯穿了全身炎性反应的整个过程,而ICAM-1 在细胞与细胞粘附的相互作用过程中起重要作用。如能有效地控制ICAM-1的过度表达,对ALI的治疗具有重要意义。 血必净是由中药赤芍、川芎、丹参、红花、当归的提取物组成的复方中药静脉制剂,具有很好活血化瘀、疏通络脉、溃散毒邪的作用。临床上被广泛应用于治疗脓毒症。多项研究证实血必净是一种有效的抗炎药物,能增强annexin A1表达并抑制白介素(IL)-1,6,8,23和TNF-α等促炎因子的生成[14-16]。王煜霞等[17]发现血必净能显著抑制缺血再灌注家兔肺组织ICAM-1释放,提高家兔的动脉氧分压。顾滔[18]在对复苏综合征患者的临床研究中发现血必净可有效下调ICAM-1等炎症介质的过量表达,从而抑制机体过度炎性反应,提高患者的30 d存活率。 本实验采取LPS静脉内注射的方式造模。本实验病理学观察发现肺泡间隔增宽,肺泡腔出血,间质内大量炎细胞浸润,提示成功建立了ALI的动物模型。本实验采用免疫组织化学方法检测的研究结果显示,同时间点LPS组的肺组织ICAM-1蛋白表达量显著高于正常组,且呈逐渐上升趋势,结合对脓毒症大鼠的肺组织病理学观察等结果,发现 ICAM-1蛋白表达水平与肺组织的病理损害程度基本一致。提示ICAM-1 可能在脂多糖诱导ALI的过程中具有重要作用,与 Beck-Schimmer等[19]的结果相吻合。 本实验前期研究[20-21]发现,血必净可以有效减轻ALI 时肺组织的炎性反应。为了进一步研究血必净对ALI大鼠的保护作用机制,本研究拟从分子机制上探讨其对肺组织局部ICAM-1表达的影响。研究结果显示,血必净可通过抑制ICAM-1的表达,进而减少炎性因子的释放和炎性反应的扩大,减轻肺组织炎性反应,从而实现对脓毒症诱导肺损伤的保护作用,为临床救治急性肺损伤提供了新思路。 [1]MacCallum NS,Evans TW.Epidemiology of acute lung injury[J].Current Opinion in Critical Care,2005,11(1): 43-49. [2]Mondrinos MJ,Zhang T,Sun S,et al.Pulmonary endothelial protein kinase C-delta (PKCδ) regulates neutrophil migration in acute lung inflammation[J].Am J Pathol,2014,184(1):200-213. [3]Hou S,Ding H,Lv Q,et al.Therapeutic effect of intravenous infusion of perfluorocarbon emulsion on LPS-induced acute lung injury in rats[J].PLoS ONE,2014,9(1):e87826. [4]Theobaldo MC,Llimona F,Petroni RC,et al.Hypertonic saline solution drives neutrophil from bystander organ to infectious site in polymicrobial sepsis: a cecal ligation and puncture model[J].PLoS ONE,2013,8(9):e74369. [5]王强.JAK/STAT信号通路对脓毒症大鼠肿瘤坏死因子-α表达的影响及意义[D].西安:第四军医大学,2001. [6]Durosier LD,Herry CL,Cortes M,et al.Does heart rate variability reflect the systemic inflammatory response in a fetal sheep model of lipopolysaccharide-induced sepsis?[J].Physiol Meas,2015,36 (10):2089-2102. [7]Filgueiras LR,Martins JO,Serezani CH,et al.Sepsis-induced acute lung injury (ALI) is milder in diabetic rats and correlates with impaired NFkB activation[J].PLoS One,2012,7(9):e44987. [8]Arnson Y,Shoenfeld Y,Amital H.Effects of tobacco smoke on immunity,inflammation and autoimmunity[J].J Autoimmun,2010,34(3): 258-265. [9]Chunsheng L,Peichun G,Xinhue H.Expression of intercellular adhesion molecule in lung tissues of experimentaI:acute lung injury and the affect of Rhubarb on it[J].Chin Med Sci,2000,5(1):93-97. [10] Zhou Q,Bai M.Intercellular adhension molecule-1 in the pathogenesis of heroin-induced acute lung injury in rats[J].J Hnazhong Univ Sci Teehnolog Med Sci,2004,241(5):430-432. [11] 闫文生,阚文宏,黄巧冰,等.脂多糖诱导小鼠脏器中细胞间黏附分子l的表达[J].生理学报,2002,54(1):71-74 [12] 罗昆仑,何振平.中性粒细胞介导组织损伤的机制[J].国外医学:生理、病理科学与临床分册,1999,19(1) : 51-54. [13] Siblle Y,Reynolds Y.Macrophages and polymorphonuclear neutrophils in lung defense and injury[J].Am Rev Respir Dis,1990,141(2):471-501. [14] He XD,Wang Y,Wu Q,et al.Xuebijing protects rats from sepsis challenged with Acinetobacter baumannⅡ by promoting annexin A1 expression and inhibiting proinflammatory cytokines secretion[J].Evid-based Compl Alt,2013:11. [15] Jiang M,Zhou M,Han Y,et al.Identification of NF-κB Inhibitors in Xuebijing injection for sepsis treatment based on bioactivity-integrated UPLC-Q/TOF[J].J Ethnopharmacol,2013,147(2):426-433. [16] Sun J,Xue Q,Guo L,et al.Xuebijing protects against lipopolysaccharide-induced lung injury in rabbits[J].Exp Lung Res,2010,36(4):211-218. [17] 王煜霞,王雷,姬明丽.血必净注射液对家兔左心缺血再灌注损伤肺脏的保护作用[J].河南师范大学学报(自然科学版),2013,41(6):127-129. [18] 顾滔.血必净注射液对复苏后综合征血液流变学和凝血功能的影响[J].环球中医药,2013,6(S1):97-98. [19] Beck-schimmer B,Schimmer RC,Warner RL,et al.Expression of lung vascular and airway ICAM- 1 after exposure to bacterial lipopolysaccharide[J].Am J Respir Cell Mol Biol,1997,17(2):344-352. [20] 张之龄,尹小燕,童小文,等.血必净对脂多糖诱导的急性肺损伤大鼠肺组织高迁移率族蛋白1表达的影响[J].中国临床保健杂志,2011,14(4):395-397. [21] 张之龄,童小文,徐兵,等.血必净对脂多糖诱导急性肺损伤大鼠的保护作用[J].中国临床保健杂志,2014,17(4):373-375. Effect of Xuebijing on expression of ICAM-1 in the lung tissue of rats with acute lung injury induced by lipopolysaccharide ZhangZhiling,ShenQiqi,ZhuJian,TongXiaowen,XuBing,ZhouWugang (DepartmentofEmergentMedicine,AffiliatedNinthPeople'sHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200011,China)Correspondingauthor:ShenQiqi,Email:shen_qiqi@21cn.com ObjectiveTo observe the effect of Xuebijingon expression of intercellular adhesion molecule-1(ICAM-1)in the lung tissue of rats with acute lung injuryinduced by lipopolysaccharide.MethodsForty-five Wistar rats were randomly divided into 3 groups byrandom number table method:(1)control group(n=15),(2)LPS group(n=15),(3) Xuebijing group(XBJ group) (n=15).Injection of LPS(5 mg/kg) into femoral vein to reproduce ALI model in LPS group and XBJ group.Male Wistar rats of XBJ group were given XBJ 4 mL/kg 30 min before the intravenous injection of LPS,whereas control group and LPS group were given equivalent volume normal saline.Five rats in each group were killed at 6 h,12 h and 24 h,which were divided into subgroup I,Ⅱ,Ⅲ.The pathomorphism changes of lung tissue were observed by light microscope,and expression of ICAM-1 in pulmonary was examined by immunohistochemistry.ResultsExpression of ICAM-1 were gradually increased with experimental time prolonged and reached the peak at 24h in LPS group after establishing model.ICAM-1 were significantly lower in XBJ group than LPS group at each time points (P<0.05).Compared to LPS group,the pathological change was significantly reduce in XBJ group under microscope.ConclusionXuebijing can inhibit the expressions of ICAM-1 and reduce acute lung injury induced by lipopolysaccharide in the lung tissue of rats. Acute Lung injury;Sepsis;Intercellular adhesion molecule-1 ;Rats,Wistar 张之龄,副主任医师,Email:zhangzhiling1970@163.com 沈琪琦,副主任医师,Email:shen_qiqi@21cn.com R563.8 A 10.3969/J.issn.1672-6790.2016.04.022 2016-02-16)1 材料与方法
2 结果
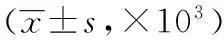
3 讨论
