累积嫁接对黄瓜雌雄花及花粉萌发的影响
2016-07-25管雪松李洪岩欧阳明安
管雪松++李洪岩++欧阳明安
摘要:通过插接法对接穗黄瓜和砧木黑籽南瓜进行多次累积嫁接,研究不同嫁接次数黄瓜雌雄花的生物学性状和花粉在不同温度下萌发率的变化。结果表明,巨丰八号黄瓜接穗生长节间数分别为2~10节位、11~20节位、大于20节位时,其黄瓜雄花的花梗长、花瓣长、总长和质量均显著高于自根苗,且雄花梗长随嫁接次数的增加呈先增加后略降低趋势,2~10节位嫁接的花梗比其他更长;盛花期时,嫁接黄瓜的雌花其果梗长、花瓣长和总长显著大于对照,而子房长度显著小于对照,2次嫁接的黄瓜子房最短;嫁接的黄瓜花粉萌发率显著高于对照,且具有一定耐低温和高温特性;10、35 ℃处理下,花粉萌发率随嫁接次数提高而提高。累积嫁接具有一定的性状累积效应,这为嫁接诱变育种提供了基础资料。
关键词:累积嫁接;黄瓜;生物学性状;花粉萌发;花梗;节位
中图分类号: S642.201文献标志码: A文章编号:1002-1302(2016)06-0248-04
收稿日期:2015-12-29
基金项目:福建省自然科学基金(编号:K1312004C);福建省重点基金项目(编号:K53150006A)。
作者简介:管雪松(1989—),男,湖北黄冈人,硕士研究生,从事嫁接诱变育种研究。E-mail:fafugxs@163.com。
通信作者:欧阳明安,男,研究员,主要从事小分子化合物与生物学研究。E-mail:maouyang@hqu.edu.cn。植物嫁接技术被广泛应用于农业、林业中,对提高植物抗生物和非生物胁迫、作物产量,改善作物品质等有重大意义[1-4]。目前,随着国内外对嫁接嵌合体接穗和砧木间频繁大量遗传物质交流的深入研究,嫁接可促使不同物种间基因水平转移(horizontal gene transfer,HGT)[5-6]或诱导接穗DNA甲基化[7],使其具有可遗传性变异,这为作物遗传育种提供了新思路和新方法。嫁接是无性繁殖,但大量研究表明,嫁接可以诱导植物产生变异,主要是来自韧皮部RNA的运输调控作用[8-9],近年来,在蓖麻、西瓜、拟南芥、甜瓜、黄瓜等植物韧皮液中发现大量的mRNA,且具有广泛的功能[10-13]。Xoconostle-Cázares 等在南瓜韧皮液内得到第1 个RNA 结合蛋白CmPP16[14];同年,Ruiz-Medrano 等以黄瓜为接穗、南瓜为砧木进行异源嫁接,结果表明,CmGAIP、Cmpp16、CmNACP 可从南瓜砧木中被运输到黄瓜接穗[15]。Ham等发现,CmGAIP、Cmpp16、CmSTMP、CmMybP 可与蛋白CmRBP50一起被运输到黄瓜接穗中,南瓜韧皮部中CmGAIP是能进行长距离移动且具有功能的RNA[16]。Haywood等研究发现,当野生型番茄为接穗和含南瓜功能缺失突变基因Cmgaip或拟南芥 ΔDELLA-gai转基因番茄为砧木,其接穗叶片形态也随之改变[17]。
黄瓜是葫芦科重要的一种蔬菜,黑籽南瓜是一种对低温、干旱、土壤贫瘠及瓜类枯萎病等逆境具有较强抗性的葫芦科草本植物[18],栽培过程中,常用黑籽南瓜(Cucurbita ficifolia)作为砧木[19]来提高黄瓜嫁接苗的抗土传病害、耐盐胁迫、产量等[20-21]。目前,研究较多的是1次嫁接引起的接穗变异,多次嫁接引起的变异还未见报道,而且针对黄瓜嫁接的研究主要集中在嫁接的亲和性、抗性生理、嫁接植株营养吸收及果实品质评价等方面[22-24],关于累积嫁接对接穗黄瓜雌雄花发育的生物学特性和花粉耐低温、高温特性的影响研究相对较少。本试验利用巨丰八号黄瓜为接穗、黑籽南瓜为砧木,通过累积嫁接研究接穗黄瓜花在不同嫁接次数间的差异及花粉在不同温度下耐低温、耐高温特性,以期通过累积嫁接充分利用砧木南瓜的抗性优势,培育出抗生物或非生物胁迫的黄瓜品种,为嫁接诱变育种提供理论基础。
1材料与方法
1.1试验材料
“巨丰八号”黄瓜、黑籽南瓜种子,均由山东寿禾种业公司提供。
1.2试验方法
1.2.1累积嫁接对黄瓜生物学性状的影响2014年4月1日,用50~55 ℃水浸泡黑籽南瓜种子(标记为HZ)8~12 h,进行黑暗下催芽,并播种于Fafard泥炭土上;4 d后,采用同样方法对巨丰八号黄瓜种子(标记为G01)催芽,待黄瓜幼苗2片子叶完全展开,采用宋永海的斜插接法和嫁接后管理方法进行嫁接和管理[25];嫁接3 d内保持嫁接苗90%以上的相对湿度,5 d后适度见光,15 d后移植到温室大棚内,盛花期进行人工自交授粉,收获黄瓜种子(标记为G02);以G02为接穗、黑籽南瓜为砧木再次嫁接,进行人工自交收获种子(标记为G03)。2015年6月13日,以G01不进行嫁接为对照,以G01、G02、G03为接穗,黑籽南瓜为砧木进行嫁接,分别标记为G01/HZ、G02/HZ、G03/HZ,并移植到大棚内进行正常生产管理;分别选取25株生长状况一致的苗,在接穗生长节间数分别为2~10节、11~20节、大于20节3个时期和盛花期,于08:00—09:00分别测量G01、G01/HZ、G02/HZ、G03/HZ黄瓜的雄花花梗长、花瓣长、总长、质量和雌花的果梗长、子房长、花瓣长、总长,以及不同温度处理下雄花的花粉萌发率。计算公式为:花粉萌发率=萌发花粉数/总花粉数×100%;雄花总长=花梗长+雄花瓣长;雌花总长=果梗长+子房长+雌花瓣长。
1.2.2累积嫁接对花粉萌发率的影响盛花期,于开花前 1 d 下午取雄花,分别在4、10、28、30、35、40 ℃下用水琼脂培养12 h,每个处理10朵雄花,每隔5 d取1次;第2 d上午,挑取花粉于150 g/L蔗糖+100 mg/L H3BO3+11.1 mg/L CaCl2配制而成的液体培养基内,同等温度下萌发2 h,以花粉管长度大于花粉粒直径作为花粉萌发依据,用光学显微镜观察花粉萌发情况,每个观察视野的花粉粒不少于60粒,每次选择6个视野,重复3次。
1.3数据分析
采用Microsoft Excel 2003绘图,采用IBM SPSS 21统计软件分析试验数据。
2结果与分析
2.1累积嫁接对接穗黄瓜雄花生物学性状的影响
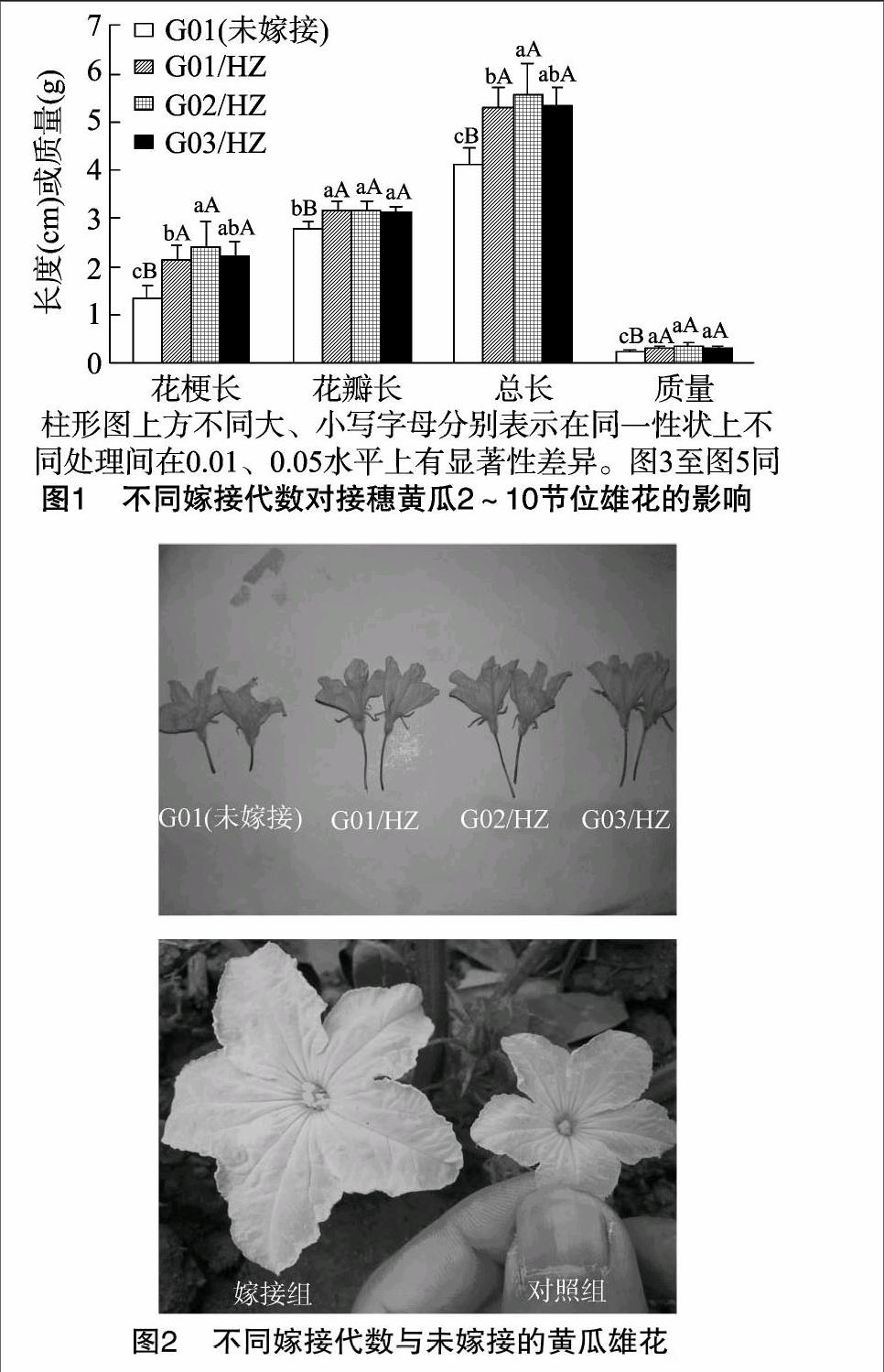
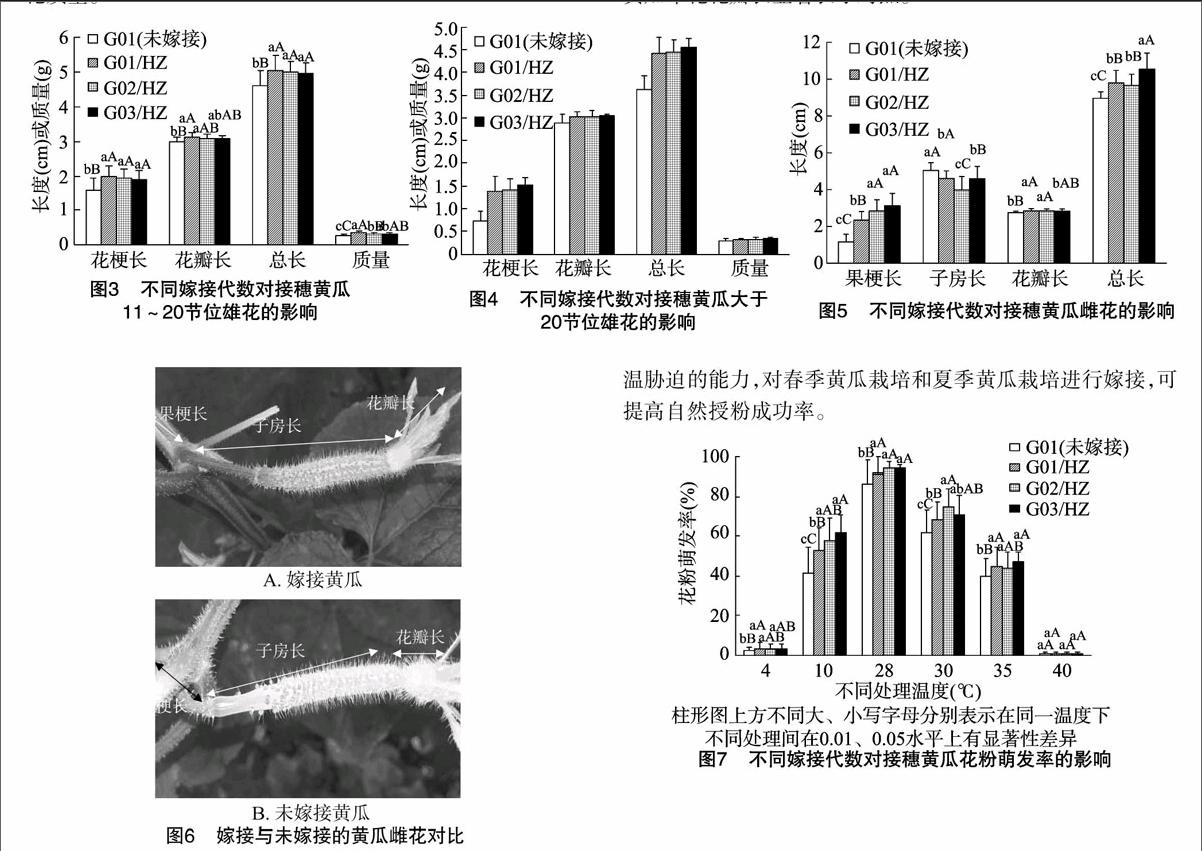
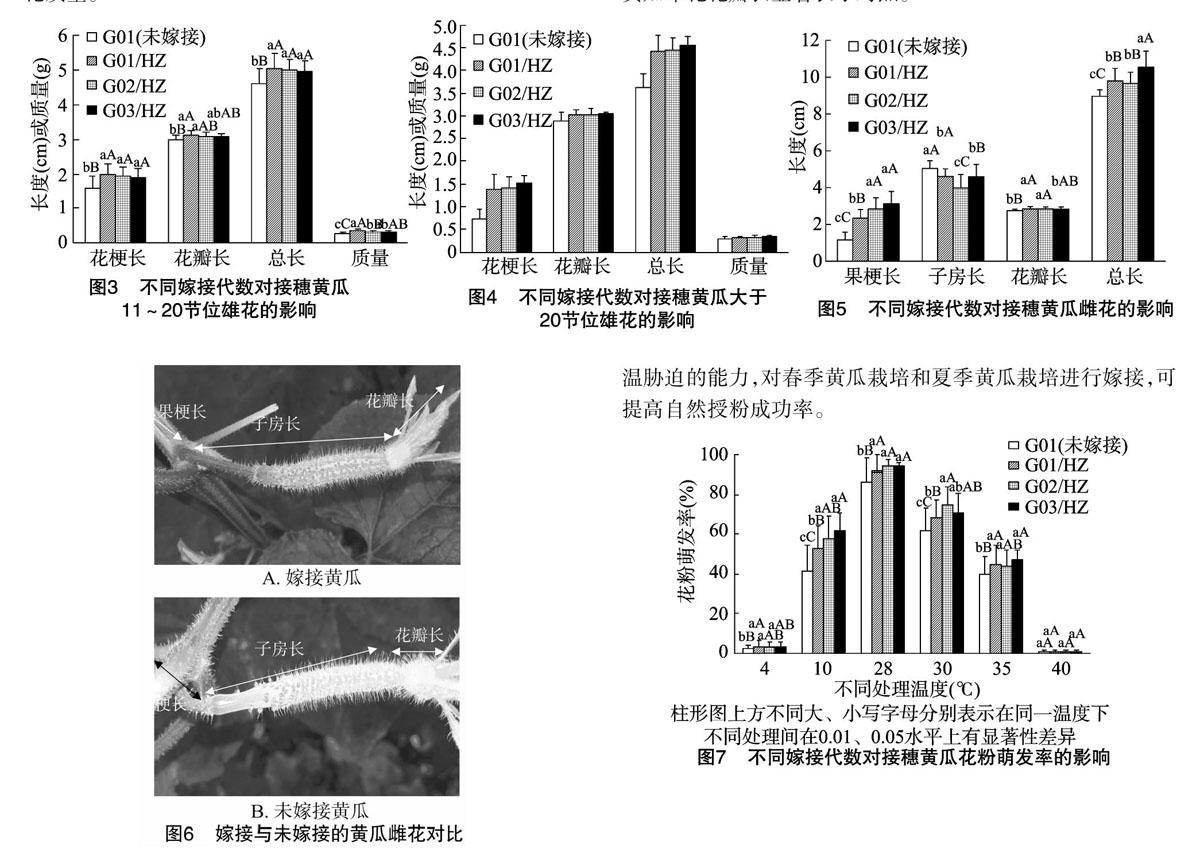
2.1.1对接穗黄瓜2~10节雄花生物学性状的影响由图1、图2可见,嫁接黄瓜2~10节位雄花的花梗长、花瓣长、总长、雄花质量均显著高于未嫁接G01;嫁接3代内,雄花的花梗长和总长随嫁接代数的增加呈先增加后略降低趋势;花梗长在不同嫁接代数间差异较大,G02/HZ花梗长达2.42 cm,比G01、G01/HZ分别提高81.95%、13.61%,G03/HZ花梗长为2.20 cm,比G01、G02/HZ分别提高65.41%、-9.09%,G01/HZ花梗长为2.13 cm,比G01增长60.15%;雄花的花瓣长度在嫁接代数间无明显差异,较对照增长幅度为 13.31%~14.39%;嫁接黄瓜G02/HZ、G03/HZ、G01/HZ的雄花总长分别为5.58、5.35、5.31 cm,均显著大于对照;嫁接黄瓜的雄花质量差异不明显,但显著高于对照。这说明嫁接可以改善黄瓜2~10节位雄花的质量,2次嫁接显著优于1次嫁接,第3次嫁接略有下降趋势,可能是由于连续多代自交会出现衰退现象。
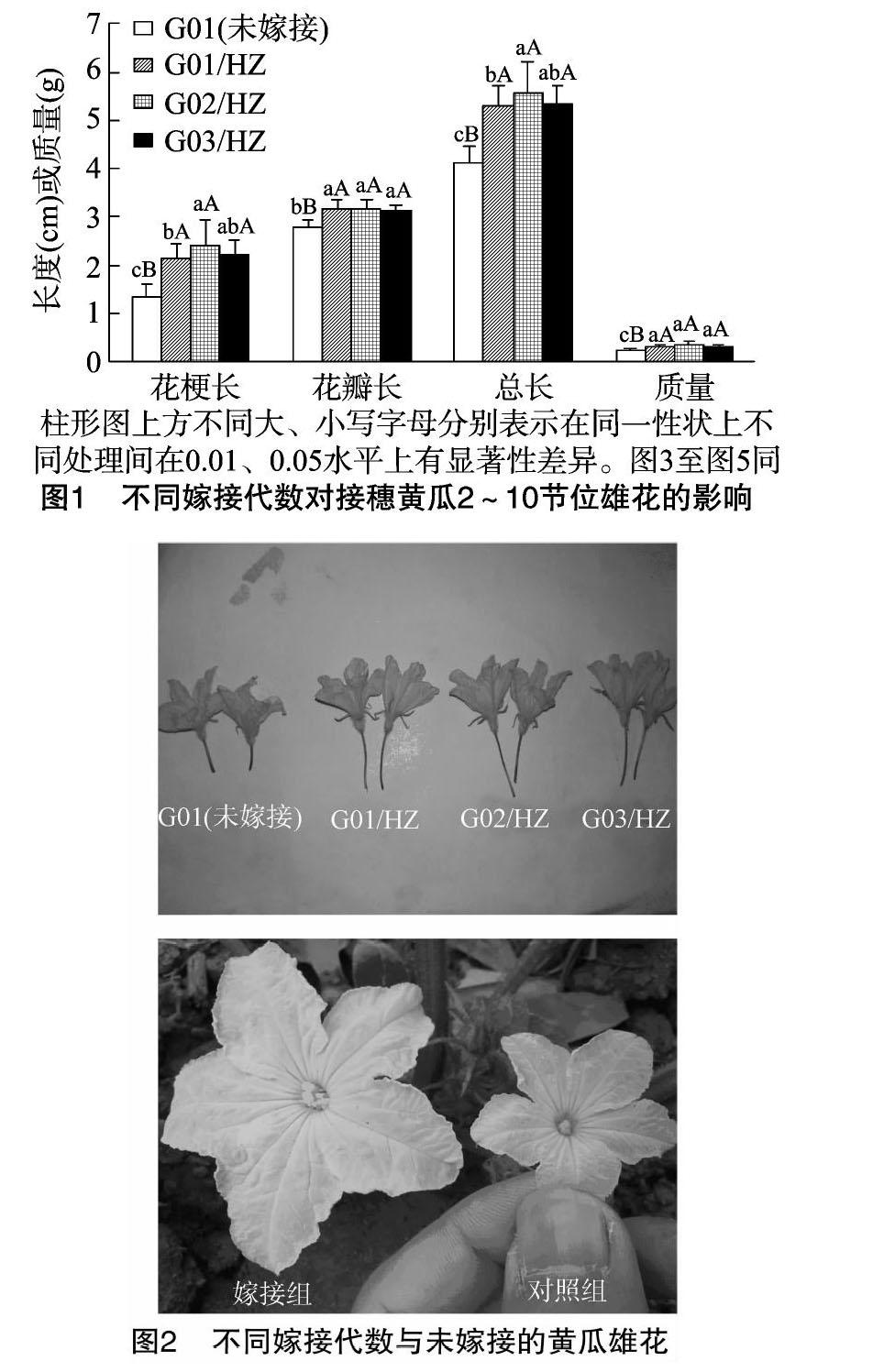
2.1.2对接穗黄瓜11~20节雄花生物学性状的影响由图3可见,嫁接黄瓜11~20节位雄花的花梗长、花瓣长、总长、质量相互间无明显差异,但均显著高于G01黄瓜;G01/HZ的花瓣长最长,为3.10 cm,其次是G02/HZ,为3.08 cm,G03/HZ在嫁接黄瓜中相对最短,为3.05 cm;雄花总长与花瓣长有相似规律;G01/HZ的雄花质量相对最大,为0.34 g,其次是G03/HZ、G02/HZ,质量分别为0.33、0.31 g,对照G01相对最轻,为0.28 g。这说明嫁接可以明显改善黄瓜11~20节位间的雄花质量。
2.1.3对接穗黄瓜大于20节雄花生物学性状的影响由图4可见,嫁接黄瓜大于20节位雄花的花梗长、花瓣长、总长、质量相互间无明显差异,但均显著高于对照组黄瓜;G03/HZ的花梗长相对最长,为1.51 cm,其次是G02/HZ、G01/HZ,花梗长分别为1.40、1.38 cm,而G01花梗长相对最短,为 0.73 cm;G03/HZ花瓣长相对最长,为3.04 cm,其次为G01/HZ、G02/HZ,均为3.03 cm;G03/HZ雄花的质量相对最大,为0.33 g,其次是G01/HZ、G02/HZ,为0.32 g,而对照G01仅为0.29 g。这说明嫁接也可以明显改善黄瓜大于20节位的雄花质量。
2.1.4对接穗黄瓜雌花生物学性状的影响由图5、图6可见,嫁接黄瓜的果梗长、雌花花瓣长、总长极显著大于对照组,而子房长度显著短于对照组,且G02/HZ的子房相对最短,为3.98 cm;果梗长随嫁接代数的增加而增长,G03/HZ相对最长,为3.12 cm,但2次嫁接与3次嫁接的黄瓜果梗长差异不显著;G01的子房长度相对最长,为 5.04 cm;嫁接1~2代的黄瓜雌花花瓣长显著长于对照。
2.2嫁接对接穗黄瓜盛花期不同温度处理花粉萌发的影响
由图7可见,4、10、28、30、35 ℃处理12 h的嫁接黄瓜,其花粉萌发率显著高于对照组;40 ℃处理的嫁接和对照黄瓜,其花粉萌发率无明显差异,几乎为0%;28 ℃时,花粉体外萌发率均达到86%以上,G03/HZ的花粉萌发率相对最高,为94.40%,其次为G01/HZ、G02/HZ,花粉萌发率分别为 91.58%、94.03%,对照G01仅为86.32%;嫁接能提高雄花的耐低温能力,4 ℃下G01/HZ的萌发率相对最高,为 3.29%,其次为G02/HZ、G03/HZ,萌发率分别为3.08%、3.01%,G01萌发率相对最低,为1.93%;10 ℃时,3代嫁接内的花粉萌发率随嫁接代数的增加而增大,嫁接3代萌发率最高,为61.70%,其次为嫁接1、2代,其萌发率分别为 52.51%、57.77%,而对照仅为41.06%,且均较4 ℃处理有明显提高;嫁接也能提高花粉的耐高温性,35 ℃处理时,嫁接3代的雄花花粉萌发率相对最高,为47.20%,其次为嫁接1、2代,其萌发率分别为44.39%、43.61%,而对照仅为 39.32%。这说明嫁接可以提高接穗黄瓜花粉的耐高温和低温胁迫的能力,对春季黄瓜栽培和夏季黄瓜栽培进行嫁接,可提高自然授粉成功率。
3讨论与结论
植物嫁接能改变接穗的生物学性状,如叶片、果实、茎粗、花色等[26],且部分性状的改变还具有可遗传性[27]。苗永美等研究发现,黄瓜雄花花器性状为数量遗传,遗传率相对较高,受环境影响较小[28];马德华等发现,瓜长、果梗长、瓜粗等也是数量遗传性状[29]。利用多代嫁接方法探究砧木对接穗的累积传代影响有着十分重要的意义。试验结果表明,多代嫁接对接穗巨丰八号黄瓜的雌、雄花影响显著,特别是对雄花花梗长和雌花果梗长、子房长度的影响;嫁接黄瓜的雄花梗长在2~10节位、11~20节位、大于20节位时的变异程度不一致,2~10节的变异程度均达到60%以上,嫁接2代达到82%,嫁接3时略降低,这可能是由于嫁接多次的砧木黑籽南瓜降低了接穗黄瓜的累积作用,在一定程度上具有自交衰退的内因;嫁接黄瓜11~20节位和大于20节位的雄花花梗长变异程度明显不如2~10节位,可能是由于砧木RNA的短距离运输调控量要比长距离运输量大[30]。另外,随嫁接代数的增大,嫁接黄瓜的花瓣长、总长、质量呈先增大后降低趋势,其作用机理还有待进一步研究;雌花生物学性状变化类似于雄花,嫁接黄瓜的果梗长、子房长度、雌花瓣长、总长随嫁接代数增加呈先增大后略减小趋势,其中果梗长、子房长度变化极为明显,这2个性状在黄瓜育种中是比较重要的农艺性状[31];嫁接明显缩短果实的长度,果型指数减小,而嫁接次数对雌花发育机理的影响也有待进一步研究。需说明的是,由于巨丰八号黄瓜3次自交花的分离性状差异不明显,因此,试验数据可以排除自交性状分离的干扰。
植物耐低温和耐高温特性是目前研究的热点,嫁接对黄瓜接穗的耐低温和耐高温特性已有相关研究[32-33],但对不同温度下嫁接是否能提高雄花的花粉萌发率研究极少。10、35 ℃培养12 h时,与对照相比,嫁接黄瓜花粉的萌发率显著提高,分别达到52.51%、43.61%以上,这对春季和夏季黄瓜栽培及植物花粉低温保存有一定的理论指导意义。须强调的是,在镜检时,最好确保环境温度和花粉处理温度的一致性,计数过程中尽量快速,尽可能减少环境温度、光照等因素的影响。
总之,嫁接黄瓜3种不同节位的雄花生物学性状均显著高于黄瓜自根苗,多次累积嫁接在一定程度上具有优势累积效应,其接穗性状更加趋向于砧木,越靠近嫁接口的花,其生物学性状受到诱导变异的可能性越大;嫁接黄瓜果梗长、雌花花瓣长、总长显著大于对照,而子房长度显著短于对照;嫁接黄瓜雄花花粉的萌发率显著高于对照,耐低温和高温性得到明显提高。累积嫁接研究为嫁接诱变育种提供了基础资料。
参考文献:
[1]Lee J M. Cultivation of grafted vegetables Ⅰ. current status,grafting methods,and benefits[J]. Hort Science,1994,29(4):235-239.
[2]Koepke T,Dhingra A. Rootstock scion somatogenetic interactions in perennial composite plants[J]. Plant Cell Reports,2013,32(9):1321-1337.
[3]张圣平,顾兴芳,王烨. 野生棘瓜砧木对黄瓜生长及抗逆性的影响[J]. 园艺学报,2006,33(6):1231-1236.
[4]Zhang W N,Kollwig G,Stecyk E,et al. Graft-transmissible movement of inverted-repeat-induced siRNA signals into flowers[J]. The Plant Journal 2014,80(1):106-121.
[5]Fuentes I,Stegemann S,Golczyk H,et al. Horizontal genome transfer as an asexual path to the formation of new species[J]. Nature,2014,511(7508):232-235.
[6]Tsaballa A,Athanasiadisa C,Pasentsis K,et al. Molecular studies of inheritable grafting induced changes in pepper (Capsicum annuum) fruit shape[J]. Scientia Horticulturae,2013,149:2-8.
[7]Avramidou E,Kapazoglou A,Filippos A A,et al. Global DNA methylation changes in Cucurbitaceae inter-species grafting[J]. Crop Breeding and Applied Biotechnology,2015,15(2):112-116.
[8]孙敬爽,李少峰,董辰希,等. 嫁接植物体中RNA分子长距离传递研究进展[J]. 林业科学,2014,50(11):158-165.
[9]张志宏,张锋. 园艺植物MicroRNA研究进展[J]. 沈阳农业大学学报,2014,45(4):385-392.
[10]Doering-Saad C,Newbury H J,Couldridge C E,et al. A phloem-enriched cDNA library from Ricinus:insights into phloem function[J]. Journal of Experimental Botany,2006,57(12):3183-3193.
[11]Omid A,Keilin T,Glass A,et al. Characterization of phloem-sap transcription profile in melon plants[J]. Journal of Experimental Botany,2007,58(13):3645-3656.
[12]Deeken R,Ache P,Kajahn I,et al. Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments[J]. Plant Journal,2008,55:746-759.
[13]Guo S,Zhang J,Sun H,et al. The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions. Nature Genetics,2013,45:51-58.
[14]Xoconostle-Cázares B,Xiang Y,Ruiz-Medrano R,et al. Plant paralog to viral movement protein that potentiates transport of mRNA into the phloem[J]. Science,1999,283(5398):94-98.
[15]Ruiz-Medrano R,Xoconostle-Cazares B,Lucas W J. Phloem long-distance transport of CmNACP mRNA:Implications for supracellularregulation in plants[J]. Development,1999,126:4405-4419.
[16]Ham B K,Brandom J L,Xoconostle-Cazares B,et al. A polypyrimidine tract binding protein pumpkin RBP50,forms the basis of a phloem-mobile ribonucleoprotein complex[J]. Plant Cell,2009,21:197-215.
[17]Haywood V,Yu T S,Huang N C,et al. Phloem long-distance trafficking of gibberellic acid-insensitive RNA regulates leaf development[J]. Plant Journal,2005,42:49-68.
[18]尹梅,杨明挚,陈善娜,等. 黑子南瓜的抗逆性初探[J]. 云南大学学报:自然科学版,2003,25(增刊1):131-134.
[19]费雨兰,王晶,沈佳,等. 不同砧木嫁接对黄瓜长势及果实品质的影响[J]. 江苏农业科学,2013,41(12):147-149.
[20]曾义安,朱月林,黄保健,等. 黑籽南瓜砧木对黄瓜生长结实、抗病性及营养元素含量的影响[J]. 植物资源与环境学报,2004,13(4):15-19.
[21]田雪梅,魏珉,刘青,等. 不同抗性砧木嫁接黄瓜幼苗对NaCl胁迫的生理响应[J]. 应用生态学报,2012,23(1):147-153.
[22]姜闯,张青,方伟,等. 3种嫁接方法对黄瓜嫁接苗前期生长的影响[J]. 园艺与种苗,2011(6):4-6.
[23]杨欢欢,李景富. 不同砧木黄瓜/南瓜嫁接愈合过程的解剖学观察[J]. 北方园艺,2014(8):5-8.
[24]刘青,魏珉,沈琼,等. 不同砧木对嫁接黄瓜蜡粉形成及硅吸收分配的影响[J]. 园艺学报,2012,39(5):897-904.
[25]宋永海. 黄瓜嫁接技术[J]. 现代农业科技,2010(20):145,147.
[26]王燕,谢辉,陈利萍. 植物嫁接诱导的遗传变异机理的研究进展[J]. 遗传,2011,33(6):585-590.
[27]Zhang D H,Meng Z H,Xiao W M,et al. Graft-induced inheritable variation in mungbean and its application in mungbean breeding[J]. Acta Botanica Sinica,2002,44(7):832-837.
[28]苗永美,隋益虎,简兴. 黄瓜雄花性状的遗传分析[J]. 广西植物,2015(5):704-708.
[29]马德华,吕淑珍,沈文云,等. 黄瓜主要品质性状配合力分析[J]. 华北农学报,1994,9(4):65-68.
[30]李苹芳,羊杏平,徐锦华,等. RNA分子在植物韧皮部长距离运输的研究进展[J]. 园艺学报,2013,40(10):2058-2066.
[31]王敏,董邵云,张圣平,等. 黄瓜果实品质性状遗传及相关基因分子标记研究进展[J]. 园艺学报,2013,40(9):1752-1766.
[32]郄丽娟,齐铁权,苏俊坡,等. 低温弱光对不同砧木嫁接黄瓜幼苗生理特性的影响[J]. 西南大学学报:自然科学版,2008,30(10):68-72.
[33]郝婷,丁小涛,余纪柱,等. 丝瓜作砧木对黄瓜幼苗耐热性的影响[J]. 浙江农业学报,2015,27(3):365-371.
管雪松 李洪岩 欧阳明安
摘要:通过插接法对接穗黄瓜和砧木黑籽南瓜进行多次累积嫁接,研究不同嫁接次数黄瓜雌雄花的生物学性状和花粉在不同温度下萌发率的变化。结果表明,巨丰八号黄瓜接穗生长节间数分别为2~10节位、11~20节位、大于20节位时,其黄瓜雄花的花梗长、花瓣长、总长和质量均显著高于自根苗,且雄花梗长随嫁接次数的增加呈先增加后略降低趋势,2~10节位嫁接的花梗比其他更长;盛花期时,嫁接黄瓜的雌花其果梗长、花瓣长和总长显著大于对照,而子房长度显著小于对照,2次嫁接的黄瓜子房最短;嫁接的黄瓜花粉萌发率显著高于对照,且具有一定耐低温和高温特性;10、35 ℃处理下,花粉萌发率随嫁接次数提高而提高。累积嫁接具有一定的性状累积效应,这为嫁接诱变育种提供了基础资料。
关键词:累积嫁接;黄瓜;生物学性状;花粉萌发;花梗;节位
中图分类号: S642.201文献标志码: A文章编号:1002-1302(2016)06-0248-04
收稿日期:2015-12-29
基金项目:福建省自然科学基金(编号:K1312004C);福建省重点基金项目(编号:K53150006A)。
作者简介:管雪松(1989—),男,湖北黄冈人,硕士研究生,从事嫁接诱变育种研究。E-mail:fafugxs@163.com。
通信作者:欧阳明安,男,研究员,主要从事小分子化合物与生物学研究。E-mail:maouyang@hqu.edu.cn。植物嫁接技术被广泛应用于农业、林业中,对提高植物抗生物和非生物胁迫、作物产量,改善作物品质等有重大意义[1-4]。目前,随着国内外对嫁接嵌合体接穗和砧木间频繁大量遗传物质交流的深入研究,嫁接可促使不同物种间基因水平转移(horizontal gene transfer,HGT)[5-6]或诱导接穗DNA甲基化[7],使其具有可遗传性变异,这为作物遗传育种提供了新思路和新方法。嫁接是无性繁殖,但大量研究表明,嫁接可以诱导植物产生变异,主要是来自韧皮部RNA的运输调控作用[8-9],近年来,在蓖麻、西瓜、拟南芥、甜瓜、黄瓜等植物韧皮液中发现大量的mRNA,且具有广泛的功能[10-13]。Xoconostle-Cázares 等在南瓜韧皮液内得到第1 个RNA 结合蛋白CmPP16[14];同年,Ruiz-Medrano 等以黄瓜为接穗、南瓜为砧木进行异源嫁接,结果表明,CmGAIP、Cmpp16、CmNACP 可从南瓜砧木中被运输到黄瓜接穗[15]。Ham等发现,CmGAIP、Cmpp16、CmSTMP、CmMybP 可与蛋白CmRBP50一起被运输到黄瓜接穗中,南瓜韧皮部中CmGAIP是能进行长距离移动且具有功能的RNA[16]。Haywood等研究发现,当野生型番茄为接穗和含南瓜功能缺失突变基因Cmgaip或拟南芥 ΔDELLA-gai转基因番茄为砧木,其接穗叶片形态也随之改变[17]。
黄瓜是葫芦科重要的一种蔬菜,黑籽南瓜是一种对低温、干旱、土壤贫瘠及瓜类枯萎病等逆境具有较强抗性的葫芦科草本植物[18],栽培过程中,常用黑籽南瓜(Cucurbita ficifolia)作为砧木[19]来提高黄瓜嫁接苗的抗土传病害、耐盐胁迫、产量等[20-21]。目前,研究较多的是1次嫁接引起的接穗变异,多次嫁接引起的变异还未见报道,而且针对黄瓜嫁接的研究主要集中在嫁接的亲和性、抗性生理、嫁接植株营养吸收及果实品质评价等方面[22-24],关于累积嫁接对接穗黄瓜雌雄花发育的生物学特性和花粉耐低温、高温特性的影响研究相对较少。本试验利用巨丰八号黄瓜为接穗、黑籽南瓜为砧木,通过累积嫁接研究接穗黄瓜花在不同嫁接次数间的差异及花粉在不同温度下耐低温、耐高温特性,以期通过累积嫁接充分利用砧木南瓜的抗性优势,培育出抗生物或非生物胁迫的黄瓜品种,为嫁接诱变育种提供理论基础。
1材料与方法
1.1试验材料
“巨丰八号”黄瓜、黑籽南瓜种子,均由山东寿禾种业公司提供。
1.2试验方法
1.2.1累积嫁接对黄瓜生物学性状的影响2014年4月1日,用50~55 ℃水浸泡黑籽南瓜种子(标记为HZ)8~12 h,进行黑暗下催芽,并播种于Fafard泥炭土上;4 d后,采用同样方法对巨丰八号黄瓜种子(标记为G01)催芽,待黄瓜幼苗2片子叶完全展开,采用宋永海的斜插接法和嫁接后管理方法进行嫁接和管理[25];嫁接3 d内保持嫁接苗90%以上的相对湿度,5 d后适度见光,15 d后移植到温室大棚内,盛花期进行人工自交授粉,收获黄瓜种子(标记为G02);以G02为接穗、黑籽南瓜为砧木再次嫁接,进行人工自交收获种子(标记为G03)。2015年6月13日,以G01不进行嫁接为对照,以G01、G02、G03为接穗,黑籽南瓜为砧木进行嫁接,分别标记为G01/HZ、G02/HZ、G03/HZ,并移植到大棚内进行正常生产管理;分别选取25株生长状况一致的苗,在接穗生长节间数分别为2~10节、11~20节、大于20节3个时期和盛花期,于08:00—09:00分别测量G01、G01/HZ、G02/HZ、G03/HZ黄瓜的雄花花梗长、花瓣长、总长、质量和雌花的果梗长、子房长、花瓣长、总长,以及不同温度处理下雄花的花粉萌发率。计算公式为:花粉萌发率=萌发花粉数/总花粉数×100%;雄花总长=花梗长+雄花瓣长;雌花总长=果梗长+子房长+雌花瓣长。
1.2.2累积嫁接对花粉萌发率的影响盛花期,于开花前 1 d 下午取雄花,分别在4、10、28、30、35、40 ℃下用水琼脂培养12 h,每个处理10朵雄花,每隔5 d取1次;第2 d上午,挑取花粉于150 g/L蔗糖+100 mg/L H3BO3+11.1 mg/L CaCl2配制而成的液体培养基内,同等温度下萌发2 h,以花粉管长度大于花粉粒直径作为花粉萌发依据,用光学显微镜观察花粉萌发情况,每个观察视野的花粉粒不少于60粒,每次选择6个视野,重复3次。
1.3数据分析
采用Microsoft Excel 2003绘图,采用IBM SPSS 21统计软件分析试验数据。
2结果与分析
2.1累积嫁接对接穗黄瓜雄花生物学性状的影响
2.1.1对接穗黄瓜2~10节雄花生物学性状的影响由图1、图2可见,嫁接黄瓜2~10节位雄花的花梗长、花瓣长、总长、雄花质量均显著高于未嫁接G01;嫁接3代内,雄花的花梗长和总长随嫁接代数的增加呈先增加后略降低趋势;花梗长在不同嫁接代数间差异较大,G02/HZ花梗长达2.42 cm,比G01、G01/HZ分别提高81.95%、13.61%,G03/HZ花梗长为2.20 cm,比G01、G02/HZ分别提高65.41%、-9.09%,G01/HZ花梗长为2.13 cm,比G01增长60.15%;雄花的花瓣长度在嫁接代数间无明显差异,较对照增长幅度为 13.31%~14.39%;嫁接黄瓜G02/HZ、G03/HZ、G01/HZ的雄花总长分别为5.58、5.35、5.31 cm,均显著大于对照;嫁接黄瓜的雄花质量差异不明显,但显著高于对照。这说明嫁接可以改善黄瓜2~10节位雄花的质量,2次嫁接显著优于1次嫁接,第3次嫁接略有下降趋势,可能是由于连续多代自交会出现衰退现象。
2.1.2对接穗黄瓜11~20节雄花生物学性状的影响由图3可见,嫁接黄瓜11~20节位雄花的花梗长、花瓣长、总长、质量相互间无明显差异,但均显著高于G01黄瓜;G01/HZ的花瓣长最长,为3.10 cm,其次是G02/HZ,为3.08 cm,G03/HZ在嫁接黄瓜中相对最短,为3.05 cm;雄花总长与花瓣长有相似规律;G01/HZ的雄花质量相对最大,为0.34 g,其次是G03/HZ、G02/HZ,质量分别为0.33、0.31 g,对照G01相对最轻,为0.28 g。这说明嫁接可以明显改善黄瓜11~20节位间的雄花质量。
2.1.3对接穗黄瓜大于20节雄花生物学性状的影响由图4可见,嫁接黄瓜大于20节位雄花的花梗长、花瓣长、总长、质量相互间无明显差异,但均显著高于对照组黄瓜;G03/HZ的花梗长相对最长,为1.51 cm,其次是G02/HZ、G01/HZ,花梗长分别为1.40、1.38 cm,而G01花梗长相对最短,为 0.73 cm;G03/HZ花瓣长相对最长,为3.04 cm,其次为G01/HZ、G02/HZ,均为3.03 cm;G03/HZ雄花的质量相对最大,为0.33 g,其次是G01/HZ、G02/HZ,为0.32 g,而对照G01仅为0.29 g。这说明嫁接也可以明显改善黄瓜大于20节位的雄花质量。
2.1.4对接穗黄瓜雌花生物学性状的影响由图5、图6可见,嫁接黄瓜的果梗长、雌花花瓣长、总长极显著大于对照组,而子房长度显著短于对照组,且G02/HZ的子房相对最短,为3.98 cm;果梗长随嫁接代数的增加而增长,G03/HZ相对最长,为3.12 cm,但2次嫁接与3次嫁接的黄瓜果梗长差异不显著;G01的子房长度相对最长,为 5.04 cm;嫁接1~2代的黄瓜雌花花瓣长显著长于对照。
2.2嫁接对接穗黄瓜盛花期不同温度处理花粉萌发的影响
由图7可见,4、10、28、30、35 ℃处理12 h的嫁接黄瓜,其花粉萌发率显著高于对照组;40 ℃处理的嫁接和对照黄瓜,其花粉萌发率无明显差异,几乎为0%;28 ℃时,花粉体外萌发率均达到86%以上,G03/HZ的花粉萌发率相对最高,为94.40%,其次为G01/HZ、G02/HZ,花粉萌发率分别为 91.58%、94.03%,对照G01仅为86.32%;嫁接能提高雄花的耐低温能力,4 ℃下G01/HZ的萌发率相对最高,为 3.29%,其次为G02/HZ、G03/HZ,萌发率分别为3.08%、3.01%,G01萌发率相对最低,为1.93%;10 ℃时,3代嫁接内的花粉萌发率随嫁接代数的增加而增大,嫁接3代萌发率最高,为61.70%,其次为嫁接1、2代,其萌发率分别为 52.51%、57.77%,而对照仅为41.06%,且均较4 ℃处理有明显提高;嫁接也能提高花粉的耐高温性,35 ℃处理时,嫁接3代的雄花花粉萌发率相对最高,为47.20%,其次为嫁接1、2代,其萌发率分别为44.39%、43.61%,而对照仅为 39.32%。这说明嫁接可以提高接穗黄瓜花粉的耐高温和低温胁迫的能力,对春季黄瓜栽培和夏季黄瓜栽培进行嫁接,可提高自然授粉成功率。
3讨论与结论
植物嫁接能改变接穗的生物学性状,如叶片、果实、茎粗、花色等[26],且部分性状的改变还具有可遗传性[27]。苗永美等研究发现,黄瓜雄花花器性状为数量遗传,遗传率相对较高,受环境影响较小[28];马德华等发现,瓜长、果梗长、瓜粗等也是数量遗传性状[29]。利用多代嫁接方法探究砧木对接穗的累积传代影响有着十分重要的意义。试验结果表明,多代嫁接对接穗巨丰八号黄瓜的雌、雄花影响显著,特别是对雄花花梗长和雌花果梗长、子房长度的影响;嫁接黄瓜的雄花梗长在2~10节位、11~20节位、大于20节位时的变异程度不一致,2~10节的变异程度均达到60%以上,嫁接2代达到82%,嫁接3时略降低,这可能是由于嫁接多次的砧木黑籽南瓜降低了接穗黄瓜的累积作用,在一定程度上具有自交衰退的内因;嫁接黄瓜11~20节位和大于20节位的雄花花梗长变异程度明显不如2~10节位,可能是由于砧木RNA的短距离运输调控量要比长距离运输量大[30]。另外,随嫁接代数的增大,嫁接黄瓜的花瓣长、总长、质量呈先增大后降低趋势,其作用机理还有待进一步研究;雌花生物学性状变化类似于雄花,嫁接黄瓜的果梗长、子房长度、雌花瓣长、总长随嫁接代数增加呈先增大后略减小趋势,其中果梗长、子房长度变化极为明显,这2个性状在黄瓜育种中是比较重要的农艺性状[31];嫁接明显缩短果实的长度,果型指数减小,而嫁接次数对雌花发育机理的影响也有待进一步研究。需说明的是,由于巨丰八号黄瓜3次自交花的分离性状差异不明显,因此,试验数据可以排除自交性状分离的干扰。
植物耐低温和耐高温特性是目前研究的热点,嫁接对黄瓜接穗的耐低温和耐高温特性已有相关研究[32-33],但对不同温度下嫁接是否能提高雄花的花粉萌发率研究极少。10、35 ℃培养12 h时,与对照相比,嫁接黄瓜花粉的萌发率显著提高,分别达到52.51%、43.61%以上,这对春季和夏季黄瓜栽培及植物花粉低温保存有一定的理论指导意义。须强调的是,在镜检时,最好确保环境温度和花粉处理温度的一致性,计数过程中尽量快速,尽可能减少环境温度、光照等因素的影响。
总之,嫁接黄瓜3种不同节位的雄花生物学性状均显著高于黄瓜自根苗,多次累积嫁接在一定程度上具有优势累积效应,其接穗性状更加趋向于砧木,越靠近嫁接口的花,其生物学性状受到诱导变异的可能性越大;嫁接黄瓜果梗长、雌花花瓣长、总长显著大于对照,而子房长度显著短于对照;嫁接黄瓜雄花花粉的萌发率显著高于对照,耐低温和高温性得到明显提高。累积嫁接研究为嫁接诱变育种提供了基础资料。
参考文献:
[1]Lee J M. Cultivation of grafted vegetables Ⅰ. current status,grafting methods,and benefits[J]. Hort Science,1994,29(4):235-239.
[2]Koepke T,Dhingra A. Rootstock scion somatogenetic interactions in perennial composite plants[J]. Plant Cell Reports,2013,32(9):1321-1337.
[3]张圣平,顾兴芳,王烨. 野生棘瓜砧木对黄瓜生长及抗逆性的影响[J]. 园艺学报,2006,33(6):1231-1236.
[4]Zhang W N,Kollwig G,Stecyk E,et al. Graft-transmissible movement of inverted-repeat-induced siRNA signals into flowers[J]. The Plant Journal 2014,80(1):106-121.
[5]Fuentes I,Stegemann S,Golczyk H,et al. Horizontal genome transfer as an asexual path to the formation of new species[J]. Nature,2014,511(7508):232-235.
[6]Tsaballa A,Athanasiadisa C,Pasentsis K,et al. Molecular studies of inheritable grafting induced changes in pepper (Capsicum annuum) fruit shape[J]. Scientia Horticulturae,2013,149:2-8.
[7]Avramidou E,Kapazoglou A,Filippos A A,et al. Global DNA methylation changes in Cucurbitaceae inter-species grafting[J]. Crop Breeding and Applied Biotechnology,2015,15(2):112-116.
[8]孙敬爽,李少峰,董辰希,等. 嫁接植物体中RNA分子长距离传递研究进展[J]. 林业科学,2014,50(11):158-165.
[9]张志宏,张锋. 园艺植物MicroRNA研究进展[J]. 沈阳农业大学学报,2014,45(4):385-392.
[10]Doering-Saad C,Newbury H J,Couldridge C E,et al. A phloem-enriched cDNA library from Ricinus:insights into phloem function[J]. Journal of Experimental Botany,2006,57(12):3183-3193.
[11]Omid A,Keilin T,Glass A,et al. Characterization of phloem-sap transcription profile in melon plants[J]. Journal of Experimental Botany,2007,58(13):3645-3656.
[12]Deeken R,Ache P,Kajahn I,et al. Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments[J]. Plant Journal,2008,55:746-759.
[13]Guo S,Zhang J,Sun H,et al. The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions. Nature Genetics,2013,45:51-58.
[14]Xoconostle-Cázares B,Xiang Y,Ruiz-Medrano R,et al. Plant paralog to viral movement protein that potentiates transport of mRNA into the phloem[J]. Science,1999,283(5398):94-98.
[15]Ruiz-Medrano R,Xoconostle-Cazares B,Lucas W J. Phloem long-distance transport of CmNACP mRNA:Implications for supracellularregulation in plants[J]. Development,1999,126:4405-4419.
[16]Ham B K,Brandom J L,Xoconostle-Cazares B,et al. A polypyrimidine tract binding protein pumpkin RBP50,forms the basis of a phloem-mobile ribonucleoprotein complex[J]. Plant Cell,2009,21:197-215.
[17]Haywood V,Yu T S,Huang N C,et al. Phloem long-distance trafficking of gibberellic acid-insensitive RNA regulates leaf development[J]. Plant Journal,2005,42:49-68.
[18]尹梅,杨明挚,陈善娜,等. 黑子南瓜的抗逆性初探[J]. 云南大学学报:自然科学版,2003,25(增刊1):131-134.
[19]费雨兰,王晶,沈佳,等. 不同砧木嫁接对黄瓜长势及果实品质的影响[J]. 江苏农业科学,2013,41(12):147-149.
[20]曾义安,朱月林,黄保健,等. 黑籽南瓜砧木对黄瓜生长结实、抗病性及营养元素含量的影响[J]. 植物资源与环境学报,2004,13(4):15-19.
[21]田雪梅,魏珉,刘青,等. 不同抗性砧木嫁接黄瓜幼苗对NaCl胁迫的生理响应[J]. 应用生态学报,2012,23(1):147-153.
[22]姜闯,张青,方伟,等. 3种嫁接方法对黄瓜嫁接苗前期生长的影响[J]. 园艺与种苗,2011(6):4-6.
[23]杨欢欢,李景富. 不同砧木黄瓜/南瓜嫁接愈合过程的解剖学观察[J]. 北方园艺,2014(8):5-8.
[24]刘青,魏珉,沈琼,等. 不同砧木对嫁接黄瓜蜡粉形成及硅吸收分配的影响[J]. 园艺学报,2012,39(5):897-904.
[25]宋永海. 黄瓜嫁接技术[J]. 现代农业科技,2010(20):145,147.
[26]王燕,谢辉,陈利萍. 植物嫁接诱导的遗传变异机理的研究进展[J]. 遗传,2011,33(6):585-590.
[27]Zhang D H,Meng Z H,Xiao W M,et al. Graft-induced inheritable variation in mungbean and its application in mungbean breeding[J]. Acta Botanica Sinica,2002,44(7):832-837.
[28]苗永美,隋益虎,简兴. 黄瓜雄花性状的遗传分析[J]. 广西植物,2015(5):704-708.
[29]马德华,吕淑珍,沈文云,等. 黄瓜主要品质性状配合力分析[J]. 华北农学报,1994,9(4):65-68.
[30]李苹芳,羊杏平,徐锦华,等. RNA分子在植物韧皮部长距离运输的研究进展[J]. 园艺学报,2013,40(10):2058-2066.
[31]王敏,董邵云,张圣平,等. 黄瓜果实品质性状遗传及相关基因分子标记研究进展[J]. 园艺学报,2013,40(9):1752-1766.
[32]郄丽娟,齐铁权,苏俊坡,等. 低温弱光对不同砧木嫁接黄瓜幼苗生理特性的影响[J]. 西南大学学报:自然科学版,2008,30(10):68-72.
[33]郝婷,丁小涛,余纪柱,等. 丝瓜作砧木对黄瓜幼苗耐热性的影响[J]. 浙江农业学报,2015,27(3):365-371.
