关于超电势和电解压的教学讨论
2016-07-25王新平王旭珍任素贞王新葵
王新平 王旭珍 任素贞 王新葵 吕 哲
(大连理工大学化工环境生命学部,化学学院,辽宁大连116024)
关于超电势和电解压的教学讨论
王新平*王旭珍任素贞王新葵吕哲
(大连理工大学化工环境生命学部,化学学院,辽宁大连116024)
摘要:分析了现有物理化学教材中关于电解池电极极化曲线和电解曲线图形表述的不足。以1.0 mol·L-1KOH和0.50 mol·L-1H2SO4为电解液,实测了用Pt电极电解水的电解曲线,对水在低电压和高电压区间的电解曲线进行了讨论,就观察到的关键实验现象进行了原因分析,这些结果有助于人们更深刻和更全面地理解电解过程。提出了在物理化学教学中应有的电解池电极极化曲线和电解曲线表现形式,以助益教学。
关键词:电极极化;超电势;电解压
电流密度(或电流强度)随电解池上外加电压的变化曲线,称为电解曲线。电解曲线可直接反映电解池的反电动势、电解反应的超电势以及电极的多种极化情况。因此可以认为,讲解电解曲线是电化学教学中总结电化学动力学理论,并将其与实践结合的重要一环。成功地科学分析电解曲线,不仅可以有效地沟通电解池的反电动势、电极极化的原因和超电势内容,还可使学生对电化学动力学这一知识模块所包含科学内容的脉络更加清晰,有利于学生对这一知识模块内容形成整体的认识。本文分析讨论该部分教学内容,为教学同行给出一些参考。
1 怎样由电解曲线分析电解池电极的多种超电势?
现有的物理化学教材,因教材不同,给出的电解池电极极化曲线有图1所示a或b两种形式,而给出的电解曲线则有图2所示A、B或C三种形式[1-5]。

图1 电解池电极的极化曲线

图2电解曲线
不同教材中,电解池电极极化曲线与电解曲线有不同的组合。例如,有电解池电极极化曲线a与电解曲线A(或B)的组合,有电解池电极极化曲线a与电解曲线C的组合,也有电解池电极极化曲线b与电解曲线C的组合。这些不同的组合,在本科生物理化学的学习中,困扰着学习能力较强的学生。这是因为,这些学生通常并不满足于课本知识,他们翻阅较多的教学参考书,甚至还到一些相应课程的网站上进行浏览,以获取更广泛的信息。作为一名物理化学教师,必须能够准确地回答这些问题。
单独比较电解池电极极化曲线a和b,可以认为二者并无矛盾。前者描述的是电解池上所加电压在较低范围内的电极极化曲线,而后者描述的则是电解池上的所加电压达到了较高范围的电极极化曲线;单独比较不同的电解曲线时,也可以得出类似的结论。即,图形C描述的是电解池上所加电压达到了较高范围时的电解曲线,而电解曲线A仅是由于电解池上的所加电压未达到更高的值[1]。显然,在教学中和教材中如果能够对此略加说明,则会有利于学生准确和深刻地认识电解曲线和电解池电极极化曲线。对此,我们已有了成功的教学经验。
通过以上分析讨论可以认为,电解池电极极化曲线a与电解曲线A(或B)的组合一致描述电解池上所加电压在较低范围的情况;电解池电极极化曲线b与电解曲线C的组合则一致描述电解池上所加电压达到更高数值的情况。但是,由于用极化曲线a难以解释电解曲线C,因此可以认为,极化曲线a与电解曲线C组合的教材和教学不利于学生在机制上认识电解曲线,难以使学生形成贯穿于电解池电极极化曲线-超电势-电解曲线这一知识模块的统一认识。比较上述多种电解池电极极化曲线与电解曲线的组合,无疑可得出下述结论:电解池电极极化曲线b与电解曲线C的组合,比较有利于学生从整体上掌握该知识模块。
分解电压,是指电解时使电解质在两极上持续不断分解所需的最小外加电压[2]。比较图2所示的A和B两种分解电压的图示表述,可以认为后者给出的分解电压仅是符合上述定义的图示,而前者则可较准确地反映分解电压的物理意义。
2 实测水的电解曲线
为了更准确地把握电解曲线的形貌,以及分解电压、反电动势在电解曲线上的位置,我们分别用1.0 mol·L-1KOH和0.50 mol·L-1H2SO4为电解液,实测了用Pt电极电解水的电解曲线。
图3给出了在25°C时用Pt电极电解水的电解池装置照片,图4给出了分别用1.0 mol·L-1KOH和0.50 mol·L-1H2SO4为电解液时的电解曲线。

图3 用Pt电极在25°C电解水的电解池装置照片

图4 常压下实测电解水的电流-电压曲线总图(A)和低电压区间图(B)
2.1反电动势的计算
当在1.0 mol·L-1KOH溶液中电解水(电解池I)时,形成原电池Pt|H2(常压)|OH-1(c=1 mol·L-1)| O2(常压)|Pt。如果该原电池所涉及的气体和离子均为标准态时,其电极反应和标准电极电势为:

由于电解池I在电解时形成的实际原电池极接近上述标准态条件,所以该实际原电池所产生的反电动势为EMF,反(常压)≈E⊖MF,反=0.4009 V-(-0.8277 V)=1.229 V。
当在0.50 mol·L-1H2SO4溶液中电解水(电解池II)时,形成原电池Pt|H2(常压)|H+(c=1 mol·L-1)|O2(常压)|Pt。如该原电池所涉及的气体和离子均为标准态时,其电极反应和标准电极电势为:
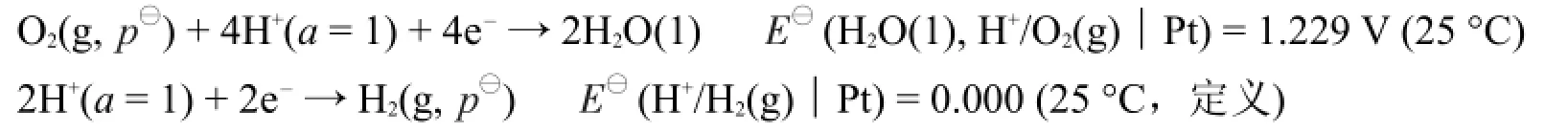
由于电解池II在电解时形成的实际原电池也极接近上述标准态条件,所以该实际原电池所产生的反电动势为EMF,反(常压)≈E⊖MF,反=1.229 V-0=1.229 V。
2.2所观察到的关键实验现象
如图4所示,当使用1.0 mol·L-1KOH溶液为电解液时,在外加电压为1.0-1.8 V范围内,均未有任何现象发生。当外加电压达到2.0 V时,有极微小的气泡产生并附着于两电极上,同时,电流强度在0和0.01 A间闪烁,并最终稳定于0点。当外加电压调至2.2 V时,电流强度再次闪烁于0和0.01 A之间,但已开始不断有微小气泡从两电极上溢出。此后进一步加大外加电压时,所测电流强度随之近线性增加(图4B)。当外加电压达到20 V时,大气泡激烈地从两电极上溢出,同时电流强度增加开始变缓(图4A)。25 V和30 V的外加电压给出了相同的电流强度和气泡溢出强度。使用0.50 mol·L-1H2SO4溶液为电解液时,所观测到的情况类似(图4)。
2.3理论分析
在外加电压略高于原电池反电动势EMF,反的3个实验点(1.4 V,1.6 V和1.8 V)上,之所以未观测到两电极上有气泡溢出,是由于两极上电化学超电势(η+,a,η-,a)的存在[3]。该电化学超电势也称为电极反应的活化超电势,即为电极反应需要较高活化能而导致的电极势(ϕ)相对于平衡电极势(ϕe)的偏离[4]:

两电极上电化学超电势之和,构成活化超电压(Va)。当两电极上的外加电压大于活化超电压时,开始有H+和OH-分别在负极和正极放电生成H2和O2分子,形成微弱电流(用灵敏电流计应能观测到)。继续增大外加电压使电极上生成H2和O2的分压迅速升高,所形成原电池的反电动势EMF,反(pO2,pH2)迅速变大,这就是将外加电压加大到2.0 V时,电流强度起始在0和0.01 A间闪烁,而最终又稳定于0点的原因。
因此,分解电压、常压反电动势、活化超电压三者在量值上的关系为:

对于图4所示水的电解,可以认为V分解均为2.0 V(图4B),而活化超电压Va均为:

在较低的外加电压区间(V外加=2-16 V)内,电流强度随外加电压线性增加:

在较高的外加电压区间(V外加=20-30 V),电流强度显著偏离线性(甚至不再增加),作为其原因,除浓差超电势开始出现和迅速增大外,气体快速溢出导致电极与电解液接触实际面积的迅速变小也贡献于其中。
3 关于电解池极化曲线和电解曲线教学的建议
在本文第1部分中,我们已经指出,用图1所示电解池电极极化曲线b与图2所示电解曲线C的组合进行教学,比较有利于学生从整体上掌握电解池电极极化曲线-超电势-电解曲线这一知识模块。尽管如此,用图1所示电解池电极极化曲线b表述实际的电解情况,仍有以下两点欠缺:
1)不能表现电流密度为0时,实际存在的、由式(1)和式(2)给出的活化超电势。
2)不能表现阴、阳两极超电势(η=ηa+ηc,其中ηa为活化超电势,ηc为浓差超电势)在通常情况下并不相同的实际情况。
因此,我们建议在教学中将电解池电极的极化曲线表述为图5所示的形状。
关于电解曲线,我们则建议在教学中给出水的实际电解曲线(图4)。这是因为,该电解曲线不仅更有利于从理论上阐述式(1)-式(4),还有利于学生认知电极上大量气体快速溢出时,使电极与电解液实际接触面积变小的真实情况,而后者则是使电流密度难以随外加电压持续增大的重要原因之一。

图5 电解超电势η与电流密度J的关系
参考文献
[1]胡英,吕瑞东,刘国杰,黑恩成.物理化学.第5版.北京:高等教育出版社,2007.
[2]李松林,周亚平,刘俊吉.物理化学.第5版.北京:高等教育出版社,2009.
[3]傅献彩,沈文霞,姚天扬,侯文华.物理化学.第5版.北京:高等教育出版社,2006.
[4]王新平,王旭珍,王新葵.基础物理化学.第1版.北京:高等教育出版社,2011.
[5]傅玉普,郝策.多媒体CAI物理化学.第5版.大连:大连理工大学出版社,2010.
中图分类号:O6;G64
doi:10.3866/PKU.DXHX201508001
*通讯作者,Email:dllgwxp@dlut.edu.cn
About Teaching the Overpotential and Decomposition Potential
WANG Xin-Ping*WANG Xu-ZhenREN Su-ZhenWANG Xin-KuiLÜ Zhe
(College of Chemistry,Faculty of Chemical,Environmental and Biological Science and Technology,Dalian University of Technology,Dalian 116024,Liaoning Province,P.R.China)
Abstract:The shortcomings of the graphic statements on electrode polarization curves and electrolysis curves in current physical chemistry textbook were discussed.The electrolysis curves were recorded using Pt as the electrode,and 1.0 mol·L-1KOH and 0.50 mol·L-1H2SO4as electrolytes.The key experimental phenomena in both low-voltage and high-voltage regions were discussed,which would be helpful for the profound understanding of the electrolysis process.On this basis,the electrolysis and polarization curves in the forms helpful for the physical chemistry teaching were suggested.
Key Words:Electrode polarization;Overpotential;Decomposition potential
