腐皮镰刀菌对不同品种核桃抗性生理指标的影响
2016-07-25麻文建朱天辉
郑 磊, 张 静, 麻文建, 彭 燕, 朱天辉
( 四川农业大学 林学院, 四川 雅安 625014 )
腐皮镰刀菌对不同品种核桃抗性生理指标的影响
郑磊, 张静, 麻文建, 彭燕, 朱天辉*
( 四川农业大学 林学院, 四川 雅安 625014 )
摘要:为分析腐皮镰刀菌(Fusarium solani)引起的核桃根腐病对寄主抗性生理指标的影响,该研究以铁核桃、绵阳早熟、新疆2号3个核桃品种为材料,研究各品种受腐皮镰刀菌侵染后,不同时期的发病情况以及丙二醛(MDA)、可溶性糖含量以及过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的动态变化。结果表明:接种病原菌50 d后,铁核桃100%发病,属高感品种,绵阳早熟和新疆2号发病率分别为23.33%和16.67%,属抗病品种;在50 d监测范围内,各品种对照组各项叶部生理指标仅出现上下波动且差异不显著;然而,各品种核桃接入腐皮镰刀菌后,可溶性糖含量随时间迅速下降,MDA含量和POD活性总体表现为先上升趋势,SOD、PPO活性总体则表现为先上升后下降的变化趋势,并且5个指标品种间差异显著,而CAT活性变化无规律。相关性分析表明,可溶性糖、MDA含量、SOD、POD、PPO活性可以作为核桃品种抗性评价指标。该研究结果为深入研究由腐皮镰刀菌引起的核桃根腐病发病机制以及通过诱导等措施提高其抗性的研究提供了理论基础。
关键词:根腐病, 腐皮镰刀菌, 核桃, 抗性生理指标
核桃(Juglansregia)属于胡桃科(Juglandaceae)植物,与扁桃、腰果、榛子并列为世界四大干果(余旋等,2012),也是我国重要的经济林树种之一(武晓霞,2013),其树体高大,能防风固沙,树皮枝叶及外果皮有很高的药用价值,特别是果实独特的营养保健价值(Grief et al,2007),长期以来受到人们的喜爱。随着核桃的种植面积越来越大,其病害发生也呈逐年上升的趋势。作者于2013年4月在凉山州木里县铁核桃(J.sigllata)种植区内发现腐皮镰刀菌(Fusariumsolani)可引起大面积铁核桃根腐病的发生,受到病原菌侵染的植株出现叶片干枯,枝条死亡,甚至有些2~3年生植株死亡,使得铁核桃大量减产,造成严重经济损失,但这种现象品种间差异显著,可能与核桃某些生理代谢有联系。
丙二醛、可溶性糖等抗性物质以及超氧化歧化酶、多酚氧化酶、过氧化物酶、过氧化氢酶等防御酶类,与植物的病害抗性能力存在相关性(Mullet et al,1990;王国莉,2008;韩珊和朱天辉,2009;Liu et al,2011;李姝江等,2012;Debona et al,2012)。研究寄主植物受到病原侵染后的生理生化变化,对进一步揭示病原致病机制,植物的抗性遗传基础和抗病基因的表达方式及表达过程有重要意义。本研究选取铁核桃、新疆2号及绵阳早熟3个核桃品种为材料,研究接种腐皮镰刀菌后各核桃品种的发病情况,以及不同时期的可溶性糖、丙二醛含量和上述防御酶类活性的变化情况,分析腐皮镰刀菌侵染后核桃的相关生理指标的变化规律以及与品种抗性之间的相关性,以期为核桃进一步抗病育种提供参考。
1材料与方法
1.1 供试材料
供试菌种:腐皮镰刀菌(Fusariumsolani),分离自凉山州木里县铁核桃桃根内,由四川农业大学森林保护重点实验室提供。供试植株:3年生铁核桃、新疆2号、绵阳早熟实生苗,由四川省雅安市石棉县核桃育种基地提供。
1.2 菌液的制备及侵染
腐皮镰刀菌孢悬液:将已活化的腐皮镰刀菌接种于新鲜PDA平板上,25 ℃培养5~7 d,收集分生孢子,用无菌水稀释成3×105cfu·mL-1浓度,制成孢悬液待用。腐皮镰刀菌对核桃侵染:选取健康、无病害、长势相同的铁核桃、新疆2号、绵阳早熟实生苗各40株,盆栽于直径40 cm塑料盆内,生长2周后,各选取30株统一采用根部创伤法与灌根接种法(周林等,2010)相结合,将配制好的病原菌孢悬液侵染核桃,同时选取10株分别以灌等量无菌水的处理作为对照。叶片采集:分别于0、10、20、30、40、50 d时,对各组处理植株采集5 g叶片,液氮速冻后,带回实验室保存于-80 ℃冰箱内。
1.3 粗酶液的提取
粗酶液提取参照童蕴慧等(2004)的方法(略有改动):1.0 g核桃叶片,加适量聚乙烯吡咯烷酮(PVP)和少量石英砂以及10 mL 0.5 mol·L-1pH6.8磷酸缓冲液在研钵中冰浴研磨成匀浆,转入10 mL离心管,旋涡震荡1 min,4 ℃、6 000 r·min-1离心15 min,上清液即为粗酶液。
1.4 指标检测及方法
可溶性糖(Soluble sugar)含量的测定采用蒽酮比色法、丙二醛(Malondialdehyde, MDA)含量的测定采用硫代巴比妥酸 (Thiobarbituric acid, TBA)法测定、超氧化歧化酶(Superoxide dismutase,SOD)活性的测定采用淡蓝四唑(Nitro-blue tetrazolium,NBT)光还原法、多酚氧化酶(Polyphenol oxidase, PPO)采用邻苯二酚法、过氧化氢酶(Catalase,CAT)采用紫外吸收法、 过氧化物酶(Peroxidase,POD) 采用愈创木酚法(童蕴慧等,2004)。各项生理指标的测定均进行3次重复。
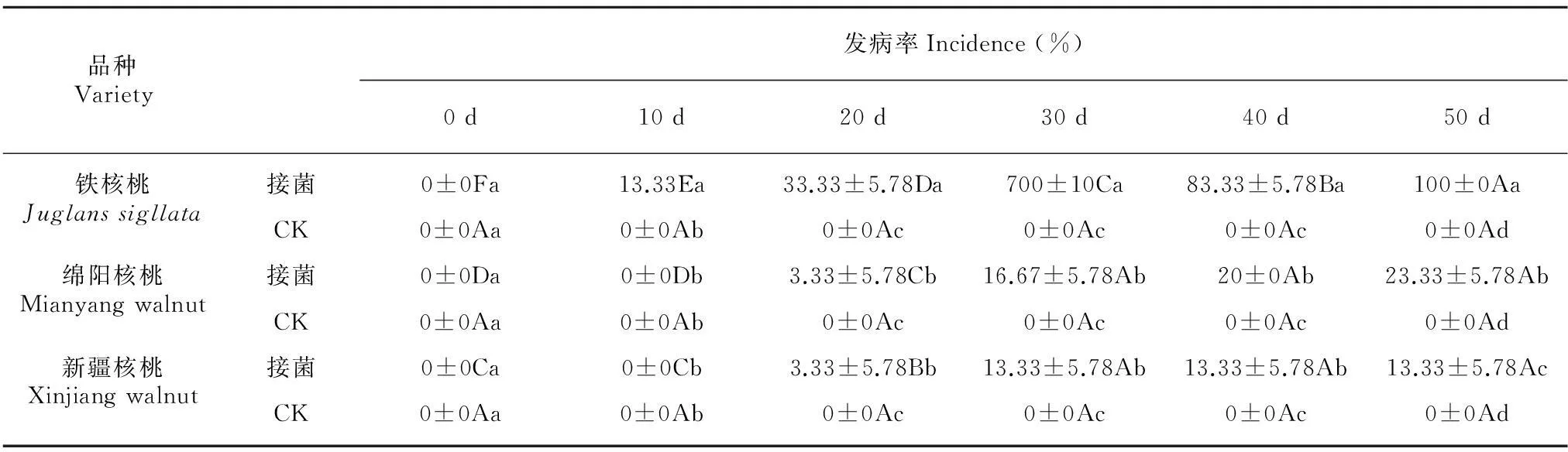
表 1 不同品种核桃接菌处理后的发病情况
注:不同小写字母表示品种间差异显著;不同大写字母表示不同时间差异显著(LSD法,P< 0.05)。
Note: Different lowercase letters indicate significant differences among different cultivars determined by LSD test (P<0.05); Different capital letters indicate significant differences among different treatment times determined by LSD test (P<0.05).
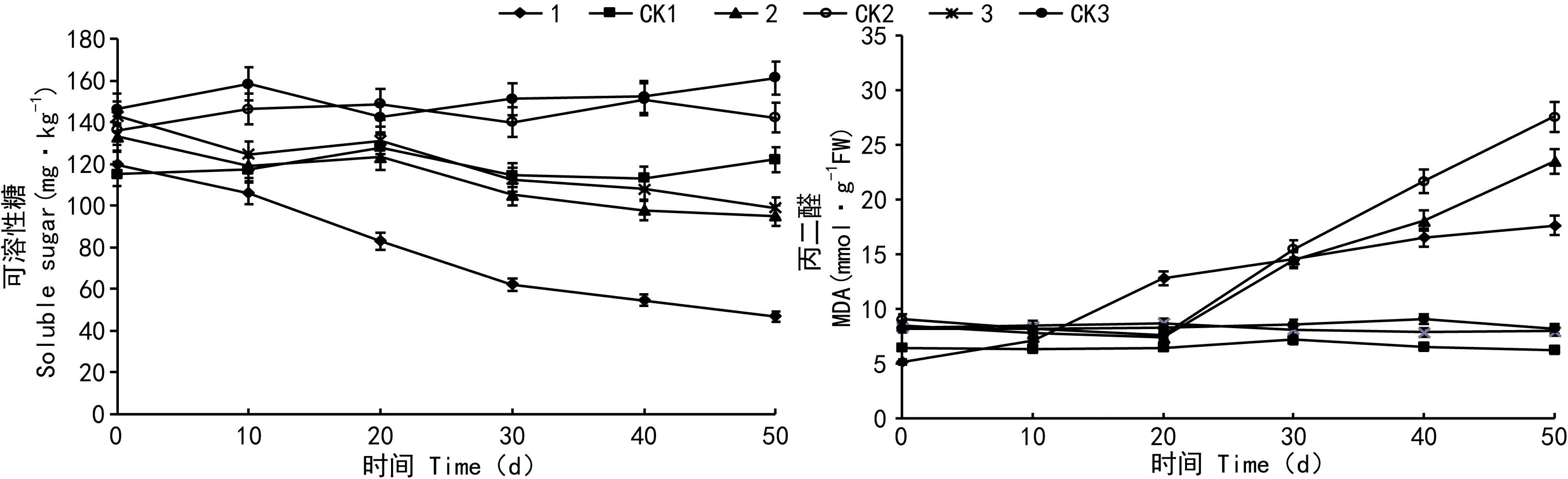
图 1 不同品种核桃叶部可溶性糖和丙二醛含量变化动态1. 铁核桃; CK 1. 铁核桃对照; 2. 绵阳核桃; CK 2. 绵阳核桃对照; 3. 新疆核桃; CK 3. 新疆核桃对照。下同。Fig. 1 Dynamic responses of soluble sugar and MDA content in different walnut varieties 1. Juglans sigllata; CK 1. Control of J. sigllata; 2. Mianyang walnut; CK 2. Control of Mianyang walnut; 3. Xinjiang walnut. CK 3. Control of Xinjiang walnut. The same below.

图 2 不同品种核桃叶部酶活性变化动态Fig. 2 Dynamic responses of enzyme activity different walnut varieties
1.5 数据分析
数据采用EXCEL 2010和SPSS 19.0软件分析处理,用LSD法做多重比较(P<0.05,P<0.01)。
2结果与分析
2.1 腐皮镰刀菌侵染核桃发病情况
对实验期间的各组处理的120株核桃植株发病情况进行调查,从表1可发现,绵阳早熟和新疆2号从第30天开始发病,50 d后,发病率分别为23.33%和16.67%,并且在调查过程中发现,两品种核桃发病情况较轻,只是处于病情级数1级阶段,表现为抗病品种,且新疆2号抗性最高;而铁核桃10 d时开始就出现发病现象,30 d时发病率达到63.33%,且个别植株出现死亡现象,50 d后表现为全部发病,属于腐皮镰刀菌的高感品种。
在取样过程中,发现绵阳早熟和新疆2号品种的根系比铁核桃发达,其中有些经过侵染处理的植株较对照组长势更为良好,这可能与品种的抗病反应有关。
2.2 腐皮镰刀菌对3种核桃MDA和可溶性糖含量的影响
不同品种核桃接种腐皮镰刀菌处理后叶片MDA含量变化如图1。从图1可以发现,各品种对照组叶片MDA含量接种前后无显著差异(P>0.05);接种后,腐皮镰刀菌导致铁核桃叶片内MDA含量迅速上升,50 d后达到最大值17.61 mmol·g-1FW,是对照的3.4倍且存在极显著差异(P<0.01);而绵阳早熟、新疆2号则是先下降,20 d后开始逐渐迅速上升,50 d后达到峰值且与接种前存在极显著性差异(P<0.01);50 d时,各品种叶片MDA含量存在显著差异(P<0.05),新疆2号>绵阳早熟>铁核桃。
不同品种核桃接种腐皮镰刀菌处理后叶片可溶性糖含量变化如图1。从图1可以发现,各品种对照组叶片可溶性糖含量接种前后无显著差异(P>0.05);然而,绵阳早熟和新疆2号各时期均大于铁核桃,且差异显著(P<0.05)。接种后,铁核桃叶片内可溶性糖含量迅速下降,且在整个测试时期均呈现显著下降趋势(P<0.05),50 d后达到最小值46.75 mg·kg-1;而绵阳早熟、新疆2号核桃与铁核桃叶片可溶性糖含量差异性显著,且下降趋势较为缓慢,在20 d时出现较为明显的回升。可溶性糖含量为铁核桃<绵阳早熟<新疆2号。
2.3 腐皮镰刀菌对3种核桃叶部防御酶活性的影响
2.3.1 SOD活性不同品种核桃接种腐皮镰刀菌处理后叶片SOD活性变化如图2,3种核桃的对照组叶片SOD活性随时间变化不大,而接种病原菌后,铁核桃、绵阳早熟、新疆2号变化趋势不同。如图2所示,接种病原菌后铁核桃SOD活性随时间上升,30 d时达到峰值,之后迅速下降,50 d后下降至50.80 U·g-1FW且低于对照组64.48 U·g-1FW,绵阳早熟则是接种后SOD活性急速上升,20 d时达到峰值165.42 U·g-1FW,之后有所下降但保持在较高的水平,新疆2号SOD活性接种后急速上升,20 d达到峰值182.42 U·g-1FW,之后略有下降40 d后达到第二个峰值168.56 U·g-1FW。通过方差分析SOD活性峰值:铁核桃<绵阳早熟<新疆2号存在显著性差异(P<0.05),且50 d时铁核桃与后两者差异极显著(P<0.01)。
2.4.2 POD活性不同品种核桃接种腐皮镰刀菌处理后叶片POD活性变化如图2, 3种核桃的对照组叶片POD活性随时间变化不大。接种腐皮镰刀菌后, 三种核桃的POD活性随着时间的变化趋势大致相同,均是保持上升趋势,然而, 铁核桃与其对照组叶片POD活性显著小于绵阳早熟、新疆2号和其对照组(P<0.05),并且在接种腐皮镰刀菌后整个时期POD活性也表现出此差异。叶片POD活性:铁核桃<绵阳早熟<新疆2号, 经方差分析发现各品种间存在显著性差异(P<0.05)。

表 2 生理指标、发病率、处理时间、品种抗性之间的相关性
注:*. 表示各生理指标与时间、抗性和感病指数呈显著相关(P<0.05,LSD测验);**. 表示各生理指标与时间抗性和感病指数呈极显著相关(P< 0.01,LSD测验)。
Note: *. Significant correlation among physiological index, time, resistance and incidence atP<0.05 using LSD test; **. Remarkably significant correlation atP<0.01 using LSD test.
2.3.3 PPO活性不同品种核桃接种病原菌腐皮镰刀菌处理后叶片PPO活性变化如图2,3种核桃的对照组叶片PPO活性随时间变化不大,接种病原菌后 ,3种核桃变化趋势大致相同且都呈现先上升后下降趋势,绵阳早熟、新疆2号接种20 d后达到峰值,分别是对照组的2.32和2.52倍,随后开始下降,但仍然保持相比与对照组较高的水平,各时期与对照组差异性显著(P<0.05),铁核桃30 d时达到峰值133.77,之后迅速下降。50 d时PPO活性:铁核桃<绵阳早熟<新疆2号,且存在显著性差异(P<0.05)。
2.3.4 CAT活性不同品种核桃接种腐皮镰刀菌处理后叶片CAT活性变化如图2,3种核桃的对照组CAT活性随时间变化不大。接种腐皮镰刀菌后,三种核桃的CAT活性随着时间的变化较大,但是各品种的叶片中CAT活性表现没有规律且各品种间无显著差异(P>0.05)
2.4 相关性分析
各项生理指标与接种时间、品种、发病率的相关性结果如表2所示。除CAT外其它各项生理指标与品种抗性的相关性均达到显著或极显著水平。具体来看,可溶性糖、丙二醛含量与时间、抗性、发病率相关性均达到极显著水平。在4种防御酶活性中,SOD、POD、PPO活性与抗性均呈极显著正相关关系,而与发病率呈显著或极显著负相关,但仅POD与时间存在显著正相关关系,CAT与时间、品种抗性、发病率无显著相关性。另外,发病率与时间呈极显著正相关,与品种间抗性为显著负相关。综上所述,推测可溶性糖、丙二醛含量与SOD、POD、PPO活性可以作为核桃品种抗性评价指标。
3讨论
腐皮镰刀菌可引起多种经济作物根腐病(Lozovaya et al, 2006;Koike et al,2011;Silva & Clark,2013;Cao et al,2013),还可引起一些植物的果实腐烂,如甜辣椒果腐病(Ramdial et al,2010)。目前,腐皮镰刀菌引起核桃根腐病还是首次被发现。当镰刀菌侵害植株时,病原菌分泌毒素,破坏植株的细胞膜系统,最终导致细胞死亡和寄主死亡,与此同时,寄主植物自身也会表现出抵抗反应,主要包括形态和生理生化两大方面。
目前,关于逆境胁迫影响核桃抗性生理生化特性的研究较多,如干旱胁迫、涝渍胁迫、酸雨胁迫以及UV-B辐射、一氧化氮处理等(郭其强等,2010;张往祥等,2011;相昆等,2007)对核桃生理生化的影响,但针对于病原菌的侵入对其生理生化特性的影响研究较少。笔者以腐皮镰刀菌引起核桃根腐病为基础,通过检测铁核桃、绵阳早熟、新疆2号三个品种接种后不同时间点的发病情况以及6个生理指标的变化情况,初步分析了腐皮镰刀菌侵染后核桃发病情况和对核桃的生理生化变化及其抗病性关系。
本研究表明,接种腐皮镰刀菌后,绵阳早熟和新疆2号属抗感品种,而铁核桃最终发病率达到100%,属易感品种;本研究还表明,接种腐皮镰刀菌后,各品种间叶片的可溶性糖含量、MDA含量、SOD酶活性、PPO酶活性、POD酶活性存在显著差异(P<0.05)。可溶性糖在植物体内主要参与呼吸代谢或为合成保护性物质提供物质来源(韩珊等,2009)。从本研究结果看,接种腐皮镰刀菌后,使铁核桃可溶性糖含量降低,核桃组织结构被破坏,进而光合作用削弱,这仅印证了“病原菌可使寄主体内糖代谢紊乱”(Madsen & Hodges,1983)的结论,但新疆2号、绵阳早熟在接种20 d后可溶性糖含量有所增加,说明抗病品种在受腐皮镰刀菌侵染后有一个合成保护性物质并提高生理强度的过程。MDA是细胞膜脂过氧化作用的产物,其含量与膜脂过氧化程度呈正相关关系(Resende et al,2012)。本研究发现,各品种叶片MDA含量存在显著差异(P<0.05),且新疆2号>绵阳早熟>铁核桃,这与“丙二醛含量在接种病原菌后增长的速度和积累量决定植株的抗病能力”(李海燕等,2006)的结论相呼应。
致病真菌对林木植物抗性酶活性有显著的影响(韩珊和朱天辉,2009),但这种影响也会因病原、寄主不同而有所差异。含金属离子的SOD在生物系统发育过程中的防御活性氧毒害起着重要的作用(Paczkowska et al,2007),本研究表明,绵阳早熟、新疆2号核桃在接种病原菌后,SOD活性迅速升高,后略有降低但保持较高水平,铁核桃则是升高后迅速下降低于对照组,说明抗性品种有很强的自我调节恢复能力,而铁核桃感病严重使得酶系统出现混乱,这与植物在感病后SOD活性上升且抗病品种SOD酶活性持续较高水平状态,感病品种后期则会降低至低于对照组(Liu et al,2011;李姝江等,2012)的规律一致,但董金皋等(1999)的研究表明SOD与抗病性呈现负相关。POD可参与植物体内多种代谢途径,从而在抗病性中起重要作用,POD也可作为 SOD的补救体系,当后期SOD活性降低时,细胞内另一个清除超氧自由基的防御体系启动,POD活性升高,阻止病害的侵入。但Filha et al(2011)发现植物在感病后期,植物体内POD活性越高则不利于抵抗病原的侵染。本研究表明SOD、POD酶活性与抗病性呈正相关关系,与Debona(2012)研究结果相吻合。PPO是氧化生物体内酚类物质的主要酶类,其氧化作用产生的醌类物质,如绿原酸、咖啡酸等,抑制病原菌毒素的产生或使毒素失活(房保海等,2004),均是有效的杀菌物质,大量研究表明,病原菌侵染植物体后可引起PPO酶活性的升高(Retig et al,1974),宋凤鸣等(2001)发现镰刀菌浸染植物体后,抗病品种PPO酶活性明显高于感病品种,本研究发现,品种间PPO活性差异显著,表明PPO酶活性与植物品种抗病性关系密切,可作为筛选抗根腐病品种的一项生理生化指标。 CAT广泛存在于植物体内,可将H2O2还原生成H2O,然而CAT清除H2O2效率较低,所以许多研究对CAT活性变化是否与植物发病存在相关性结论差异较大。如 Resende et al(2012)研究表明CAT活性与其抗病性呈正相关性;潘汝谦等(1999)研究认为CAT活性与其抗病性呈负相关性;葛秀春等(2000)研究认为CAT活性与其抗病性无明显关系;本研究表明,接种病原菌后各品种叶片CAT活性变化混乱无明显规律,CAT酶活性与抗病性也无明显相关性。造成此结果可能是当镰刀菌侵害植株时,病原菌分泌毒素,破坏植株的细胞膜系统,导致CAT酶系统絮乱(Liu et al,2011);另外,本研究还发现,绵阳早熟、新疆2号表现丙二醛、可溶性糖含量和酶活性的变化明显早于铁核桃,与Beckman(1990)的结果一致,抗病品种或感病品种受侵染后出现防卫反应的快慢和强度与品种康感性有关。
总之,核桃接种腐皮镰刀菌后,对叶部可溶性糖、丙二醛含量和SOD、POD、PPO活性有显著影响,结合3个不同核桃品种的糖代谢、丙二醛代谢和防御酶系的变化规律可以看出,本研究中涉及的生理指标(CAT除外)与核桃抗性之间相关性显著,可溶性糖、丙二醛含量和SOD、POD、PPO活性均可用作核桃抗性品种的评价指标。
参考文献:
BECKMAN CH, 1990. Host responses to the pathogen [A]. Ploetz RC(Ed.).Fusariumwilt of banana[M]. St. Paul, Minnesota: 93-105.
DALY JM, LADIEN P, SEEVERS, 1971. P. Physiology Plant Pathology [M]. 1:397-401.DEBONA D, RODRIGUES F, RIOS JA, et al, 2012. Biochemical changes in the leaves of wheat plants infected byPyriculariaoryzae[J]. Phytopathology, 102(12): 1 121-1 129.
DONG JH, FAN MZ, HAN JM, 1999. The effect of AB-toxin fromalternaria brassicae on membrane permeability and the activities of SOD and POD in cell of Chinese cabbage leaves [J]. Acta Phytopathol Sin, 29(2):138-141. [董金皋, 樊慕贞, 韩建民, 1999. 芸苔链格胞菌毒素对白菜细胞膜透性、SOD酶和POD酶活性的影响 [J]. 植物病理学报, 29(2):138-141.]
FANG BH, ZHANG GM, CHI CF, et al, 2004. The dynamic effects ofColletotrichumcapsicif. nicotianae toxin on MDA content and some protective enzymes in tobacco [J]. Acta Phytopathol Sin, 34(1): 27-31. [房保海, 张广民, 迟长凤, 等, 2004. 烟草低头黑病菌毒素对烟草丙二醛含量和某些防御酶的动态影响 [J]. 植物病理学报, 34(1): 27-31.]
FILHA MSX, RODRIGUES FA, DOMICIANO GP, et al, 2011. Wheat resistance to leaf blast mediated by silicon [J]. Austr Plant Pathol, 40(1): 28-38.
GE XC, SONG FM, ZHENG Z, 2000. The roles of active oxygen species and lipid peroxidation in the resistance of rice seedling toMagnaporthegrisea[J]. Acta Phytopohysiol Sin, 26(3):227-231. [葛秀春, 宋凤鸣, 郑重, 2000. 稻瘟菌侵染后水稻幼苗活性氧的产生与抗病性的关系 [J]. 植物生理学报, 26(3):227-231.]
GRIEF A, KRIS- ETHER TON PM, HILBERT KF, et al, 2007. An increase in dietary n-3 fatty acids decreases a marker of bone restoration in humans [J]. Nutr J Nutr J, 6:22.
GUO QQ, LUO DQ, WANG ZH, et al, 2010. Photosynthetic characteristics and protective enzyme activities ofPrunusmiraseedlings to drought stress [J]. J NW Sci Technol Univ Agric, 38(6):138-144. [郭其强, 罗大庆, 王贞红, 等, 2010. 光核桃幼苗光合特性和保护酶对干旱胁迫的响应 [J]. 西北农林科技大学学报·自然科学版, 38(6):138-144.]
HAN S, ZHU TH, 2009. The response of defense enzymes inCastaneamollissimaBlume varieties with different resistance to Cp-toxin fromCryphonectriaparasitica[J]. Acta Phytopathol Sin, 36(4):305-309. [韩珊, 朱天辉, 2009. 不同抗性板栗品种的防御酶系对栗疫菌Cp-毒素的响应 [J]. 植物保护学报, 36(4):305-309.]
KOIKE ST, 2011.F.susariumcrown and root rot of Tarragon in California caused byFusariumsolani[J]. Plant Dis, 95(6): 768.
LI SJ, ZHU TH, YANG L, et al, 2011. Effects of nonprotein toxin fromArthriniumphaeospermumon physiological metabolism ofBambusapervariabilis×Dendrocalamopisisgrandishybrid bamboo [J]. Acta Phytopathol Sin, 41(6): 587-595. [李姝江, 朱天辉, 杨莉, 等, 2011. 暗孢节菱孢菌非蛋白类毒素对杂交竹生理代谢的影响 [J]. 植物病理学报, 41(6): 587-595.]
LI HY, XI R, ZHEN Y, 2006. Study on the resistance to phytophthora blight of pepper and the effect of Pro,MAD and dissolubility sugar [J]. Chin Agric Sin, 22(11): 315-317. [李海燕, 惕若, 甄艳, 2006. 辣椒品种对疫病的抗性研究-氨酸,丙二醛与可溶性糖在抗病中的作用 [J]. 中国农学通报, 22(11): 315-317.]
LIU H, XIN Z, ZHANG Z, 2011. Changes in activities of antioxidant-related enzymes in leaves of resistant and susceptible wheat inoculated withRhizoctoniacerealis[J]. Agric Sci China, 10(4): 526-533.
LOZOVAYA VV, LYGIN AV , ZERNOVA OV, et al, 2006. Lignin degradation byFusariumsolanif. sp.glycines[J]. Plant dis, 90(1): 77-82.
MADSEN JP, HODGES CF, 1983. Soluble sugar and free amino acids ofPoapratensisexposed to chlorophenoxy herbicides and pathogenesis byDrechslerasorokiniana[J]. Phytopathology, 73(5): 737-740.
MULLET JE, KLEIN PG, KLEIN RR,1990. Chlorophyll regulates accumulation of the plastid-encoded chlorophyll apoproteins CP43 and D1 by increasing apoprotein stability [J]. Proc Nat Acad Sci Unit States Am, 87: 4 038-4 042.
PACZKOWSKA M, KOZLOWSKA M, GOLINSKI P, 2007. Oxidative stress enzyme activity inLemnaminorL exposed to cadmium and lead [J]. Biol Cracov Ser Bot, 49(2): 33-37.
PAN RQ, HUANG XM, GU XX, 1999. Activity change in active-oxygen scavenging enzymes in cucumber infected by downy mildew [J]. Acta Phytopathol Sin, 29(3): 287-288. [潘汝谦, 黄旭明, 古希昕, 1999. 活性氧清除酶类在黄瓜感染霜霉病过程中的活性变化 [J]. 植物病理学报, 29(3): 287-288.]
RAMDIAL HA, SN, 2010. First Report ofFusariumsolanicausing fruit rot of sweet pepper in Trinidad Rampersad [J]. Plant Dis, 94(11): 1 375.
RETIG N, 1974. Changes in peroxidase and polyphenoloxidase associated with natural and induced resistance of tomato toFusariumwilt [J]. Physiol Plant Pathol, 4(2): 145-150.
RESENDE RS, RODRIGUES F, CAVATTE PC, et al, 2012. Leaf gas exchange and oxidative stress in sorghum plants supplied with silicon and infected byColletotrichumsublineolum[J]. Phytopathology, 102(9): 892-898.
SONG FM, GE XC, ZHENG Z, 2001. The roles of active oxygen species and lipid peroxidation in the resistance of cotton seedlings tofusariumwilt [J]. Acta Phytopathol Sin, 31(2):110-116. [宋凤鸣, 葛秀春, 郑重, 2001. 活性氧及膜脂过氧化与棉花对枯萎病抗性的关系 [J]. 植物病理学报, 31(2):110-116.]
SILVA WLD,CLARK CA, 2013. Infection of sweet potato byFusariumsolaniandMacrophominaphaseolinaprior to harvest [J]. Plant Dis, 97(12) : 1 636-1 644.
TONG YH, GUO GP, XU JY, et al, 2004. Mechanisms of resistance to gray mould in tomato plant induced by antagonistic bacteria [J]. Acta Phytopathol Sin, 34(6):507-511. [童蕴慧, 郭桂萍, 徐敬友, 等, 2004. 拮抗细菌诱导番茄植株抗灰霉病机理研究 [J]. 植物病理学报, 34(6):507-511.]
WANG GL, 2008 . Physiological mechanism in bitter melon infected with powdery mildew fungus [J]. Guihaia, 28(2): 242-246. [王国莉, 2008 . 白粉病菌侵染苦瓜的生理机制 [J]. 广西植物, 28(2): 242-246.]
WU XX, 2013. Studies on production and trade comparative advantage of walnut in China [D]. Jinzhong: Shanxi Agric Univ. [武晓霞, 2013. 我国核桃生产与贸易比较优势研究 [D]. 晋中: 山西农业大学.]
XIANG K, LI XL, ZHANG MY, et al, 2007. Effects of exogenous Nitric Oxide on drought-resistance of walnut (Juglansregia) [J]. Sci Silv Sin, 43(10):122-126. [相昆, 李宪利, 张美勇, 等, 2007. 外源一氧化氮对核桃幼苗抗旱性的影响 [J]. 林业科学, 43(10):122-126.]
CAO XM, CAI J, LI SB, ET AL, 2013.FusariumsolaniandFusariumoxysporumassociated with root rot ofGlycyrrhizauralensisin China [J]. Plant Dis, 97(11) :1 514.
YU X, ZHU TH, LIU X, 2012. Effects of different phosphate-solubilizing bacteria on rhizosphere microorganism and enzyme activities of pecan seedlings [J]. Sci Silv Sin, 48(2): 117-123. [余旋, 朱天辉, 刘旭, 2012. 不同解磷菌剂对美国山核桃根际微生物和酶活性的影响 [J]. 林业科学, 48(2): 117-123.]
ZHANG WX, ZHANG XY, CAO FL, et al, 2011. Effects of flooding stress on the physiological adaption metabolism of three tree species [J]. J Nanjing For Univ: Nat Sci Ed, 35(5):11-15. [张往祥, 张晓燕, 曹福亮, 等, 2011. 涝渍胁迫下 3 个树种幼苗生理特性的响应 [J]. 南京林业大学学报·自然科学版, 35(5):11-15.]
ZHOU L, CHENG P, YU GH, et al, 2010. Colonization ofBacillussubtilisStrain TR21 in banana plant and rhizosphere [J]. Chin Agric Sin, 26(19): 392-396. [周林, 程萍, 喻国辉, 等, 2010. 枯草芽孢杆菌 TR21 在香蕉体内及根际的定殖动态 [J]. 中国农学通报, 26(19): 392-396.]
Resistance physiological indexes of different walnut varieties after infected byFusariumsolani
ZHENG Lei, ZHANG Jing, MA Wen-Jian, PENG YAN, ZHU Tian-Hui*
(CollegeofForestry,SichuanAgriculturalUniversity, Ya’an 625014, China )
Abstract:Juglans sigllata, a commercial crop, is widely planted in Liangshan prefecture of Southwest China. Liangshan prefecture is a major traditional growing area of J. sigllata and has an unique advantage for walnut industrial development because of its good conditions of soil, solar-thermal and source of water. Currently there are 2.7 hm2 walnut, contributing to an important incomes for farmers. In April 2013, numerous J. sigllata were found infected with the root rot in the Muli County of Liangshan prefecture. Complications include dried leaves, dead brachces, and even death. According to the cultural characteristics, the fungus was primarily identified as Fusarium solani. To analyze the impact of host resistance physiological index of walnut root rot caused by F. solani, in this study, three different walnut varieties including Juglans sigllata, Mianyang walnut and No. 2 of Xinjiang walnut were the samples, and their morbidity situations and six changes of the physiological indexes including MDA, soluble sugar, POD, PPO, SOD and CAT were further detected after inoculated of Fusarium solani respectively. The results showed that the morbidity of Juglans sigllata was up to 100%, and the morbidities of Mianyang walnut and Xinjiang walnut were 23.33% and 16.67%, so it turned out that J. sigllata belonged to highly infected varieties, while the other two were disease-resistant varieties. During the fifty monitoring days, the leaf physiological indexes of the controls showed fluctuated and no obvious difference. But the content of soluble sugar of the experimental group droped rapidly over time, and the content of MDA and POD activities performanced rising trends overall, for SOD and PPO activities, it rose firstly and then droped. Moreover, the differences among the five Indexes of the study were significant while it was irregular to CAT activity. The correlation analysis indicated that the contents of soluble sugar and MDA, the activities of SOD, POD and PPO could be used as the standards to evaluate the resistance abilities of different walnut varieties. This paper provides important references to the study on mechanism of walnut root rot and improvement of resistance abilities.
Key words:root rot, Fusarium solani, walnut, resistance physiological index
DOI:10.11931/guihaia.gxzw201409035
收稿日期:2014-09-16修回日期:2014-10-08
基金项目:国家科技基础条件平台项目(2005DK21207-13)[Supported by the National Science and Technology Basic Platform of China(2005DK21207-13)]。
作者简介:郑磊(1985-),男,河南濮阳人,博士研究生,从事林木病理学研究,(E-mail)xiaoshitou4632@163.com。 *通讯作者:朱天辉,教授,博导,主要从事林木病理学研究,(E-mail)zhuth1227@126.com。
中图分类号:Q945,S763.11
文献标识码:A
文章编号:1000-3142(2016)06-0651-07
郑磊,张静,麻文建,等. 腐皮镰刀菌对不同品种核桃抗性生理指标的影响 [J]. 广西植物, 2016, 36(6):651-657
ZHENG L,ZHANG J, MA WJ,et al. Resistance physiological indexes of different walnut varieties after infected byFusariumsolani[J]. Guihaia, 2016, 36(6):651-657
