葡萄愈伤组织中白藜芦醇含量的影响因素
2016-07-25钟英英黄禧擎凌秋萍罗钰沁罗
钟英英++黄禧擎++凌秋萍++罗钰沁+罗思成++梁琼锋
摘要:以葡萄的叶片、叶柄及茎段诱导的愈伤组织为试验材料,考察紫外线照射、硝酸银处理和杂菌污染对其愈伤组织中白藜芦醇含量的影响。结果表明:经硝酸银处理的愈伤组织中白藜芦醇含量随处理浓度的提高呈现先增加后减少的变化趋势,在浓度为10 mg/L时,白藜芦醇含量达到最大;经紫外线照射的愈伤组织中白藜芦醇含量随照射时间的延长先增加后减少,茎段与叶片经紫外线照射3 min后白藜芦醇的含量最高,而叶柄经紫外处理5 min后白藜芦醇的含量最高。染菌的愈伤组织中白藜芦醇含量也明显高于对照。因此,在所试验的范围内提高葡萄愈伤组织中白藜芦醇含量,硝酸银的适宜浓度为10 mg/L,紫外线照射时间为3~5 min,另外杂菌感染也有助于葡萄愈伤组织中白藜芦醇含量的提高。
关键词:葡萄;愈伤组织;白藜芦醇;硝酸银;紫外线辐照
中图分类号: S663.101文献标志码: A文章编号:1002-1302(2016)06-0406-02
收稿日期:2015-04-20
基金项目:国家级大学生创新创业计划;广西壮族自治区大学生创新创业计划。
作者简介:钟英英(1979—),女,广西柳州人,硕士,讲师,主要从事天然产物提取及利用方面的研究。Tel:(0772)2687033;E-mail:mininetzhkitty@126.com。白藜芦醇是最先在葡萄属植物中发现的一种抗逆性物质,是植物体在恶劣环境下或遇到病原微生物侵害时自身分泌的一种抗毒素。目前,可提取白藜芦醇的原料主要来自葡萄、虎杖、桑树、花生等植物,在葡萄属植物中含量最高,由于其具有抗氧化、抗癌、保护心血管等作用而备受关注[1-2]。目前白藜芦醇的提取主要依靠葡萄皮、虎杖等[2-3],要满足白藜芦醇日益增长的市场需要,需要消耗大量的原料,对环境及野生资源的破坏很大。而利用植物细胞培养生产次生代谢产物具有成本低、周期短、不破坏自然资源、不受季节限制等优势,为白藜芦醇生产提供了新途径。本试验研究AgNO3和紫外光照对葡萄愈伤组织白藜芦醇积累的影响,以期找到从葡萄愈伤组织中提取白藜芦醇的最佳条件,为葡萄愈伤组织中白藜芦醇的大规模生产和产业化开发提供理论依据。
1材料与方法
1.1材料
试验用的葡萄叶柄、茎段和叶片等材料取自当地葡萄园;白藜芦醇对照品购于四川成都曼斯特生物科技公司;MS培养基、NAA、6-BA等均购自浙江临安木木生物有限公司。
1.2方法
1.2.1葡萄愈伤组织的培养选取无病害葡萄叶柄、叶片和茎段,用低浓度的洗衣粉浸泡30 min,在无菌超净台下,用75%乙醇消毒30 s,用1% NaClO3 浸泡1~2 min,再用无菌蒸馏水冲洗数次;将叶片剪成约0.5 cm×0.5 cm的片段,叶柄、茎段则切成0.3~0.5 cm长的小段,接种于MS培养基(含 2 mg/L NAA+0.3 mg/L 6-BA,pH值为5.8)中,(26±1) ℃进行暗培养,每个月继代培养1次。
1.2.2不同浓度的AgNO3处理将继代培养的愈伤组织分别转移到质量浓度为0、1、10、30 mg/L AgNO3的继代培养基MS(2 mg/L NAA+0.3 mg/L 6-BA,pH值5.8)中,每个浓度3个重复,(26±1) ℃继续进行暗培养30 d备用。
1.2.3紫外光处理将继代培养的愈伤组织在紫外灯下分别照射0、1、3、5、10、15 min,每个处理3个重复,照射后继续在(26±1) ℃暗培养30 d备用。
1.2.4染菌处理将继代培养的愈伤组织转移至有培养基的广口瓶后敞开20 min,然后继续盖上,(26±1) ℃暗培养30 d备用。同时,用正常培养的愈伤组织作对照,处理和对照均进行9次重复。
1.2.5白藜芦醇含量的测定(1)白藜芦醇标准曲线的制作。精确称取2.0 mg白藜芦醇对照品,用甲醇在10 mL容量瓶中混匀,定容得到0.2 mg/mL标准溶液,再将其稀释至质量浓度分别为2、4、6、8、10、12、14、16 ug/mL的溶液。以浓度为0作空白,用紫外可见分光光度计在306 nm处分别测出各浓度的吸光度,以吸光度为纵坐标、浓度为横坐标作标准曲线及回归方程。
(2)白藜芦醇提取及含量计算。将愈伤组织烘至恒质量,研磨至粉后,精确称取2.000 g,转移至50 mL圆底烧瓶中,以料液比为1 g ∶ 20 mL加入70%甲醇,60 ℃恒温回流提取2 h。之后将所得溶液进行真空抽滤,洗涤2次,合并洗涤液和滤液,记录体积,取2 mL样品加70%甲醇至10 mL,用紫外可见分光光度计在306 nm处分别测出各提取液的吸光度,按照下式计算白藜芦醇的含量(mg/g):
白藜芦醇含量=C×V×D/(103×m)。
式中:C为查标准曲线样品液吸光度对应的白藜芦醇的浓度,μg/mL;V为样品溶液的体积,mL;m为样品称取的质量,g;D为样品溶液稀释倍数。
1.2.6统计学分析不同组织来源的愈伤组织中白藜芦醇含量的单向方差分析以及染菌与对照样本的独立样本t检验,均用SPSS 20.0进行分析。
2结果与分析
2.1标准曲线
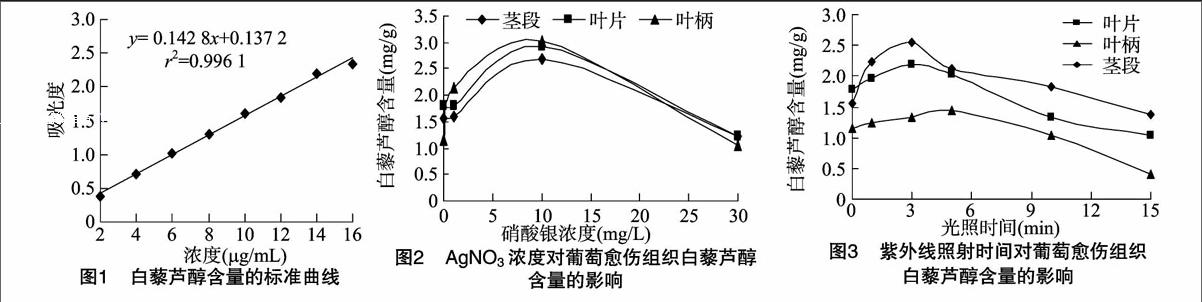
由“1.2.5”节中标准曲线制作方法,得到回归方程为y=0.142 8x+0.137 2,r2=0.996 1,表明白藜芦醇浓度在2~16 μg/mL 间呈线性关系(图1)。
2.2AgNO3浓度对葡萄愈伤组织白藜芦醇含量的影响
由图2可知,随AgNO3浓度的提高,白藜芦醇含量呈先上升后又逐渐下降的趋势,这与张真等的研究结果[4]类似。当AgNO3浓度为10 mg/L时,白藜芦醇含量达最大,此时茎段、叶片和叶柄诱导的愈伤组织中白藜芦醇含量分别为2669、2.926、3.011 mg/g,均明显高于未处理的 1.562、1786、1.159 mg/g;但随着AgNO3浓度的升高,白藜芦醇含量开始下降,当AgNO3浓度达到30 mg/L时,茎段、叶片和叶柄诱导的愈伤组织中白藜芦醇含量分别下降至 1.230、1238、1063 mg/g。因此,浓度低于10 mg/L的AgNO3能够促进白藜芦醇的生成,而浓度超过10 mg/L的AgNO3则会抑制其积累。
白藜芦醇是植物在恶劣环境下或遇到病原微生物侵害时自身产生的一种抗逆性物质。低浓度银离子存在时,植物体可能为了消除银离子的伤害,从而刺激生物体合成更多的抗逆性物质[5]。当硝酸银浓度过高时,则可能会使细胞受到毒害,抑制白藜芦醇的生成。其中的原因可能是离体植物细胞会产生并积累乙烯,Ag+通过竞争性结合细胞膜上的乙烯受体蛋白,抑制乙烯的活性,继而抑制愈伤组织形成[6]。另外,重金属胁迫可能导致活性氧自由基在植物细胞内增多,其强氧化性对许多生物功能分子造成破坏,从而使细胞的生长受到影响[4]。
2.3紫外线照射对葡萄愈伤组织白藜芦醇含量的影响
如图3所示,随着紫外线照射时间的延长,葡萄不同组织诱导的愈伤组织中白藜芦醇含量呈现先上升随后又逐渐下降的趋势。经紫外光辐射3~5 min的愈伤组织中,白藜芦醇含量较高。其中,茎段和叶片诱导的愈伤组织经辐照3 min后白藜芦醇的含量最高,达到2.543、2.180 mg/g,分别为对照组(茎段1.562 mg/g,叶片1.786 mg/g)的1.63、1.22倍;叶柄诱导的愈伤组织则在辐照5 min处理组中的白藜芦醇含量最高(1.446 mg/g),为对照组(1.159 mg/g)的1.25倍。但当辐照时间超过15 min时,葡萄愈伤组织中的白藜芦醇含量均低于对照,茎段、叶片、叶柄来源的愈伤组织中白藜芦醇含量分别比对照下降了11.7%、41.8%、11.3%,叶片诱导的愈伤组织受到的影响最大。
白藜芦醇为芪类次生代谢物,芪合酶(stilbene synthase, STS)是白藜芦醇生物合成过程中的关键酶[6-7]。Fritzemeier等发现,紫外光照射可显著提高葡萄叶片的STS 活性,与白藜芦醇生物合成相关的另外2种酶(苯丙氨酸解氨酶和肉桂酸-4-羟化酶)也同时被诱导[8]。Bruno等也研究发现,北美沙地葡萄品种(Vitis rupestris)在紫外诱导2 h后,STS mRNA持续高水平表达,白藜芦醇含量也急剧增加[9]。本研究结果表明,少于5 min的紫外光照射可提高葡萄愈伤组织中的白藜芦醇含量。然而,紫外光辐射也是一种环境胁迫因子,过度照射可能会导致细胞损伤并影响白藜芦醇等代谢物的生成。
2.4染菌对白藜芦醇含量的影响
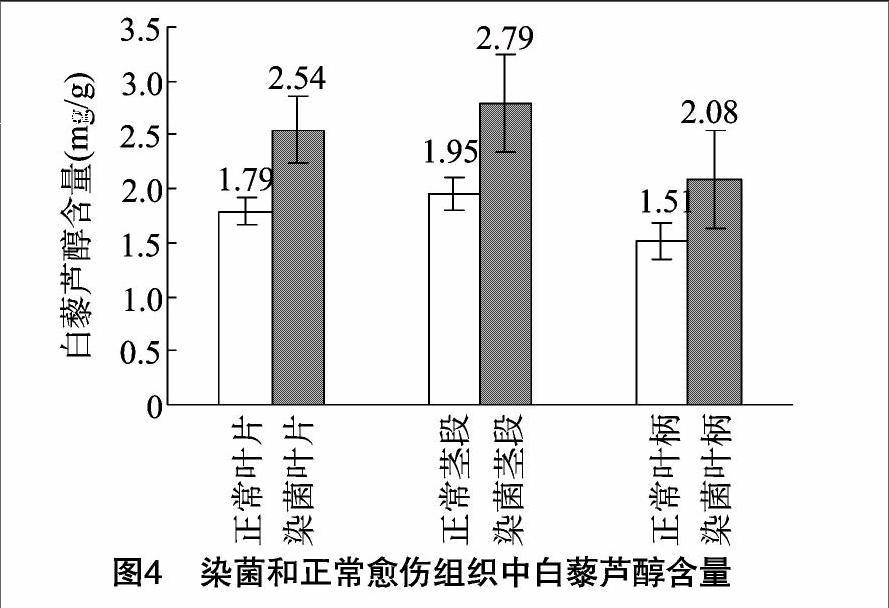
从图4可以看出,正常的愈伤组织中,茎段来源的白藜芦醇含量最高(9次重复均值达到1.95 mg/g),其次为叶片愈伤组织(1.79 mg/g),含量最低的为叶柄愈伤组织(1.51 mg/g),但是不同组织之间的白藜芦醇含量没有显著差异(P>005)。染菌处理后,无论是叶片、叶柄还是茎段来源的愈伤组织中白藜芦醇含量均显著高于对照(叶片P=0007、叶柄P=0.001、茎段P=0.009)。这可能是由于杂菌污染可以作为一种胁迫,可以引发植物细胞产生防御性应答反应,诱导相关基因的表达,从而激活特定代谢途径,促使葡萄离体细胞中白藜芦醇的积累。已有研究表明,健康葡萄叶片中白藜芦醇含量大大低于染病的叶片,感染的程度越大叶片中白藜芦醇含量相对越高[10]。另外,文涛等发现真菌诱导可以提高虎杖愈伤组织中的白藜芦醇含量[11]。本研究结果表明,染菌可以显著提高愈伤组织生成白藜芦醇的量,不同重复得到的结果差别偏大可能跟愈伤组织受到感染程度不同有关。
3结论
葡萄愈伤组织中白藜芦醇的含量随着AgNO3浓度的增加呈现先上升随后又逐渐下降的趋势,当其浓度为10 mg/L时,白藜芦醇含量最高;而在浓度超过30 mg/L时,白藜芦醇积累
受到抑制。葡萄愈伤组织中白藜芦醇含量随着紫外线照射时间的延长呈现先上升随后又逐渐下降的趋势。其中,光照 3 min 后茎段与叶片来源的愈伤组织白藜芦醇含量最高,光照 5 min 后叶柄白藜芦醇含量最高。但紫外光照超过 15 min,愈伤组织中的白藜芦醇积累则会受到抑制。外植体的差异也会造成愈伤组织中白藜芦醇含量不同,其中含量从高到低依次为叶片>茎段>叶柄,但无显著差异。染菌处理可以显著提高愈伤组织中白藜芦醇的含量。
参考文献:
[1]郭景南,刘崇怀,潘兴,等. 葡萄属植物白藜芦醇研究进展[J]. 果树学报,2002,19(3):199-204.
[2]张贵娟,杨涛,罗非君,等. 白藜芦醇的提取与检测方法研究进展[J]. 食品与机械,2013,29(2):234-237.
[3]韩晶晶,刘炜,毕玉平. 白藜芦醇的研究进展[J]. 生物工程学报,2008,24(11):1851-1859.
[4]张真,李胜,刘媛,等. 硝酸银对葡萄愈伤组织生长及其白藜芦醇含量的影响[J]. 甘肃农业大学学报,2008,43(5):59-62.
[5]区炳庆,何丽烂. 香蕉组培苗POD、PPO及SOD活性对银胁迫的反应[J]. 广西植物,2003,23(1):93-95,89.
[6]Akiyama T,Shibuya M,Liu H M,et al. p-Coumaroyltriacetic acid synthase,a new homologue of chalcone synthase,from Hydrangea macrophylla var. thunbergii[J]. European Journal of Biochemistry/FEBS,1999,263(3):834-839.
[7]Tropf S,Karcher B,Schrodre G,et al. Reaction mechanisms of homodimeric plant polyketidesynthases(stilbene and chalcone synthase)[J]. Journal of Biological Chemistry,1995,270(14):7922-7928.
[8]Fritzemeier K H,Kindl H. Coordinate induction by UV light of stilbene synthase,phenylalanine ammonia-lyase and cinnamate 4-hydroxylase in leaves of vitaceae[J]. Planta,1981,151(1):48-52.
[9]Borie B,Jeandet P,Parize A,et al. Resveratrol and stilbene synthase mRNA production in grapevine leaves treated with biotic and abiotic phytoalexin elicitors[J]. American Journal of Enology and Viticulture,2004,55(1):60-64.
[10]Bavaresco L,Petegolli D,Cantu E,et al. Elicitation and accumulation of stilbene phytoalexins in grapevine berries infected by Botrytis cinerea[J]. Vitis,1997,36(2):77-83.
[11]文涛,曾杨,喻晓,等. 真菌诱导子对虎杖愈伤组织中白藜芦醇合成的影响[J]. 核农学报,2008,22(4):435-438,419.
